Method Article
高盐饮食条件下盐敏感大鼠肠道微生物细胞外囊泡的分离和差异表征
* 这些作者具有相同的贡献
摘要
该方案描述了使用密度梯度离心法从喂食 HSD 的盐敏感大鼠中分离肠道微生物 EV。通过纳米颗粒示踪、TEM、LPS/BCA 测定和 16S rRNA 测序对 EVs 进行表征,以分析其大小、形态、组成和微生物群来源。
摘要
高盐摄入量是高血压的主要危险因素,其潜在机制可能与肠道微生物群分泌的细胞外囊泡 (EV) 密切相关。这些由肠道微生物群产生的 EV 携带各种生物活性成分,这些成分可能在高盐饮食 (HSD) 诱导的高血压发展中起关键作用。为了研究这种机制,我们开发了一种基于密度梯度离心的高效提取方法,以从喂食 HSD 的盐敏感大鼠的肠道微生物群中分离 EV。通过粒径分析、透射电子显微镜 (TEM) 和脂多糖 (LPS) 检测,我们确定了肠道菌群 EVs 的梯度分布并实现了精确提取。此外,采用 16S rRNA 基因测序分析正常组和 HSD 组之间 EVs 的来源和组成差异,揭示高盐摄入量对肠道菌群 EVs 遗传特征的影响。这项研究为盐诱导高血压的肠道微生物群机制提供了有价值的工具和科学见解,并为预防和治疗相关疾病提供了新的视角。
引言
肠道微生物群,也称为肠道微生物群或肠道微生态学,是位于生物胃肠道中的数万种微生物的复合体,在维持人类健康中起着至关重要的作用1。近年来,随着进一步的研究,发现肠道微生物群可以产生细胞外囊泡 (EV)2。EV 是细胞释放的小囊泡,在细胞中携带各种分子,例如蛋白质、核酸和脂质 3,4。它们可以与其他微生物5、肠上皮细胞,甚至远处组织和器官6 相互作用,从而影响人体的健康 7,8。这些肠道微生物群产生的 EV 与饮食之间存在紧密联系9。
肠道微生物群产生的 EV 可能是高盐饮食 (HSD) 影响身体健康的重要因素。HSD 不仅直接破坏肠道菌群的平衡10,导致有益菌(如乳酸菌)的数量显着减少11,而且还促进有害菌(如拟杆菌等)的增殖12. 这种不平衡会降低肠道屏障功能并增加肠道炎症的风险。此外,HSD 还通过改变肠道微生物群的代谢活动13 进一步影响肠道中的酸碱平衡和营养吸收,例如减少具有多种生理功能的短链脂肪酸14,15 的产生。
这些变化不仅影响肠道健康,还可能间接调节 EV 的产生和释放,并改变 EV 的成分和功能。高盐环境可能会影响肠道细胞的正常生理功能,包括 EVs 的释放和运输,从而干扰 EVs 在细胞间信息传递和免疫调节中的作用。同时,肠道炎症可能促进多种具有特殊功能的EV16,并通过肠器官轴等方式扩散到全身17,18,这与高血压19,20、心血管21和脑血管疾病22,23、肥胖24,25、糖尿病26的发生发展密切相关和其他慢性疾病。
因此,本研究的总体目标是开发一种高效可靠的方法,从喂食 HSD 的盐敏感大鼠的肠道微生物群中提取 EV,并系统研究它们的物理特性、组成和功能。由于高盐饮食后血压显着升高的特点,选择盐敏感大鼠,通过构建高效的提取方法揭示 HSD 对肠道菌群 EV 的影响。该方法基于密度梯度离心,并结合了各种动态鉴定技术,如粒度检测、LPS/BCA 测量、透射电子显微镜和蛋白质组学分析。该方案旨在揭示 HSD 对肠道微生物群 EV 的影响及其在心血管疾病中的机制。该方法具有高效、重现性和广泛的适用性,不仅为探索肠道菌群 EVs 在盐诱导高血压中的机制提供了重要工具,也为制定基于 EVs 的疾病干预策略奠定了理论基础。通过这项研究,我们希望为预防和治疗心血管疾病(如高血压)开辟新的途径27,28。
研究方案
本动物实验研究符合相关伦理准则和国际标准。涉及动物的研究得到了成都中医药大学实验动物福利和伦理委员会(机构:成都中医药大学;方案编号:2018-21)的批准。
1. 动物准备和饮食制度
- 通过在 50% ± 10% 湿度下饲养,使 6 周龄雄性 Dahl 盐敏感大鼠适应,体重 180-200 克;12 小时/12 小时光照循环;在无特定病原体的条件下,20.0 ± 2.0 °C 持续 1 周。
- 随后,将大鼠平均分成两组 (n = 6)。为每组提供持续 6 周的不同饮食:含 0.5% 氯化钠的正常盐饮食 (NSD) 和含 8% 氯化钠的 HSD,这在已发表的研究中常用 29,30,31。在整个研究过程中,小鼠可以无限制地获得食物和水。
2. 监测血压
注意:尾袖体积描记法用作血压测量的非侵入性方法,当从尾血容量测量血压时,使用体积压力记录 (VPR)。
- 将大鼠单独放在装有锯末的小笼子中,在大约 37 °C 下加热 10 分钟,然后放置在带有可调节鼻子和门的定制啮齿动物约束装置中,以便动物进入。将大鼠放在加热垫上,俯卧位,以保持体温在 37 °C。
- 将 VPR 传感器连接到尾部底部,并设置至少 10 个适应周期以稳定 BP28。
- 将充气袖带填充在尾根上,并将体积描记传感器(或光电传感器)放在下方。缓慢充气至收缩压以上(通常为 200 mmHg),然后缓慢释放。仪器自动检测脉搏波消失(收缩压)和恢复(舒张压)的压力值。连续测量 3-5 次,取平均值。
- 训练所有大鼠适应约束程序,并在上午 9 点左右在安静的实验室中进行这项研究,以尽量减少昼夜节律变化的影响。
- 在牺牲前每隔一天测量一次收缩压 (SBP) 和舒张压 (DBP)。根据 SBP 和 DBP 估计平均动脉压 (MAP)
映射 = (SBP + 2 DBP)/3
3. EV 的提取
- 样本采集
- 将无菌棉签浸入 75% 酒精中,然后用它来刺激大鼠的肛门。刺激旨在促进肠道蠕动和放松肛门括约肌,从而促进排便。排出粪便后,使用无菌镊子将它们收集到适当大小的无菌容器中,并立即将它们储存在 -80 °C。
- 样品制备
- 用勺子将 5 g 粪便转移到预先称重的 50 mL 离心管中。向试管中加入 50 mL 预热的 37 °C 无内毒素 PBS(最大样品浓度 10%)并旋转 30 分钟。将高速离心机冷却至 4 °C。
- 对称放置样品后,以 8,000 x g 离心 15 分钟,使离心机平衡。离心后,吸出上清液并将其转移到新的无菌离心管中。
- 再次以 8,000 x g 离心 15 分钟。吸出上清液并将其用于进一步分析。
- 粗提物制备
- 使用无菌的 0.22 μm 过滤器装置。将过滤器装置放在冰上并牢牢握住真空泵。将获得的上清液转移到过滤器的顶部。打开真空泵以收集过滤后的样品。
- 将滤液转移至离心过滤器 (10 kDa, 15 mL) 中,在 4 °C、3,000 x g 下离心 30 分钟,并将样品浓缩至至少 1400 μL。
- 收集浓缩的样品,必要时使用预冷的无内毒素 PBS 将其稀释至 1400 μL。稀释后立即将样品放在冰上。
注意:粗提取物可以立即使用或在 -80 °C 下储存数月。
- 电动汽车的分离
- 如下所述准备梯度缓冲液 A 和梯度缓冲液 B。提前一天准备缓冲液,因为化合物需要几个小时才能完全溶解。制备的缓冲液可在 4 °C 下储存 6 个月。
- 梯度缓冲液 A 的制备:通过磁力混合器搅拌,将 0.25 M 蔗糖、6 mM EDTA 和 60 mM Tris 溶解在 800 mL 无内毒素的水中,并使用盐酸将 pH 值调节至 7.4。用无内毒素的水稀释至 1 L。使用 0.22 μm 瓶顶过滤器过滤缓冲液。
- 梯度缓冲液 B 的制备:通过磁力混合器搅拌,将 0.25 M 蔗糖、1 mM EDTA 和 10 mM Tris 溶解在 800 mL 无内毒素的水中,用盐酸将 pH 值调节至 7.4。用无内毒素的水稀释至 1 L。使用 0.22 μm 瓶顶过滤器过滤缓冲液。
- 混合 1 体积的梯度缓冲液 A 和 5 体积的密度梯度培养基(培养基为 60% 碘克沙醇溶液)以制备工作溶液。
- 碘克沙醇溶液(10%、20%、40%)的制备:要制备 10% 碘克沙醇溶液,请混合 1 个单位的工作溶液和 4 个单位缓冲液 B;对于 20% 碘克沙醇溶液,混合 2 个单位的工作溶液和 3 个单位的缓冲液 B;对于 40% 碘克沙醇溶液,混合 4 个单位的工作溶液和 1 个单位的缓冲液 B。准备每种溶液新鲜并储存在冰上。
注意:应为每次实验准备新鲜的工作溶液,并且可以准备额外 10% 体积的溶液以解决实验误差。 - 将步骤 3.3.3 中制备的溶液与 7 mL 密度梯度培养基混合,制成 50% 碘克沙醇溶液。
- 为了制备密度梯度,将台盼蓝溶液添加到 40% 溶液和 10% (wt/vol) 碘克沙醇溶液中,以在不同层之间提供清晰的轮廓。
- 将 8 mL 50% 碘克沙醇溶液转移到薄壁聚丙烯离心管的底部。将试管倾斜 70°,将 8 mL 40% 碘克沙醇溶液转移到液体表面。加入 8 mL 20% 碘克沙醇溶液,然后加入 7 mL 10% 碘克沙醇溶液,最后加入 2 mL 无内毒素 PBS。
注意:准备密度梯度需要练习。密度梯度的质量对实验结果有很大影响。在添加过程中的不同步骤之间不要将试管直立放置,因为这会对密度梯度的质量产生负面影响。 - 提前预冷离心机,并将制备好的密度梯度放入超速离心机中。开始输入参数,参数值:100,000 x g,20 h,10 °C。
- 对于手动梯度密度分离,从系统表面中心缓慢吸取 2 mL 溶液,总共含有 34 mL 液体。每 2 mL 是一个梯度,因此将密度梯度溶液分为 17 个梯度。
- 使用移液管将密度分数转移到无菌样品管中,并立即将它们放在冰上。用拇指和食指夹住离心管,确保其保持直立。
- 如下所述准备梯度缓冲液 A 和梯度缓冲液 B。提前一天准备缓冲液,因为化合物需要几个小时才能完全溶解。制备的缓冲液可在 4 °C 下储存 6 个月。
- 电动汽车的回收
- 使用全自动 EVs 提取系统,通过超滤芯片上的双耦合超声振荡系统施加负压振荡,通过纳米孔去除样品中的核酸和蛋白质杂质并拦截 EV,从而富集和纯化 EV。
- 去除步骤 3.4.7 中的滤液,并将其添加到超滤芯片中。
- 根据仪器说明作仪器,收集过滤后的滤液,即富含外泌体的溶液。主要过程如图 1 所示。
- 使用全自动 EVs 提取系统,通过超滤芯片上的双耦合超声振荡系统施加负压振荡,通过纳米孔去除样品中的核酸和蛋白质杂质并拦截 EV,从而富集和纯化 EV。
4. 电动汽车识别
- 粒度和浓度检测
- 使用基于电阻脉冲传感 (RPS) 的纳米库仑计数器评估尺寸分布和 zeta 电位。为本实验选择测量范围为 60-200 nm 的纳米孔芯片。此外,使用纳米库计数器评估 EV 的粒度分布和 zeta 电位。
- 取适量 EVs 溶液,稀释成 (1/10, 1/100, 1/1000, 1/10000)。
- 将不同稀释的 EV 溶液放在仪器上进行测试。
- 选择稳定性较好的稀释倍数并再次测试,以获得更准确的数据。
- 使用基于电阻脉冲传感 (RPS) 的纳米库仑计数器评估尺寸分布和 zeta 电位。为本实验选择测量范围为 60-200 nm 的纳米孔芯片。此外,使用纳米库计数器评估 EV 的粒度分布和 zeta 电位。
- LPS 和 BCA 检测
- BCA 检测:使用 RIPA 缓冲液裂解 EV,然后分离蛋白质。使用 BCA 蛋白质浓度测定试剂盒测定 EV 的蛋白质含量。
- LPS 检测:使用内毒素检测试剂盒,根据试剂盒步骤添加样品、内毒素检测器和显色剂。测量 545 nm 处的吸光度,并根据标准曲线计算外部囊泡的 LPS 表达。
- TEM 评估:对于阴性染色和 TEM 分析,将样品涂在涂有连续碳膜的发光铜格栅上,并用 0.75% 甲酸铀酰染色。对于冷冻电镜,将 EV 吸收到具有亲水表面的 300 目 EM 碳网格中,并在液氮中冷冻。使用冷冻透射电镜观察和分析网格,并以 22,000 倍放大倍数记录图像32。
- 蛋白质表征:使用 RIPA 缓冲液裂解 EV,然后分离蛋白质。使用 BCA 蛋白检测试剂盒测定蛋白质浓度,通过 SDS-PAGE 从每个样品中分离等量的蛋白质,并在电泳后用考马斯蓝染料溶液染色以可视化蛋白质谱33,34。
- S 测序和分析:使用粪便 DNA 提取试剂盒从粪便样本中提取基因组 DNA。通过琼脂糖凝胶电泳和分光光度计评估 DNA 的完整性和浓度。用通用引物扩增 16S rRNA 基因的 V3 - V4 区域,纯化 PCR 产物,定量,并在 Illumina 平台上进行测序。使用 QIIME2 管道35 执行数据分析。
- 使用 DADA2 对扩增子序列变体 (ASV) 进行分类,并使用 VSEARCH 算法与 Silva 数据库进行匹配。使用 α-Diversity 分析来评估样品中的物种丰富度和多样性,主要使用 Shannon 指数和 Chao1 指数等指数。β多样性分析比较样品之间的微生物群落组成,通常通过主坐标分析 (PCoA) 进行可视化。使用差异分析方法,例如线性判别分析效应大小 (LEfSe) 和火山图分析,以识别条件显著不同的微生物分类群或组间微生物分类群。
结果
以不同的馏分测定 EV 浓度(图 2A)。实验结果表明,EV 的浓度在一系列密度梯度溶液中表现出典型的正态分布模式(图 2B)。具体来说,在馏分 9 中,EV 的浓度达到最高点 (3.85 x 109),表明 EV 的主要分布分数可能是 936。
为了测定蛋白质含量,使用 BCA 试剂盒评估不同组分中的蛋白质含量(图 2C)。在该方法中,馏分 9 中的蛋白质含量为 0.417 μg/μL,这进一步证明了 EV 的分布。由于 LPS 是革兰氏阴性菌37,38 的独特成分,因此还使用内毒素检测试剂盒来确定 LPS 的表达(图 2D),以评估 EV 在不同组分中的分布。实验结果表明,在馏分 9 和 10 中,LPS 表达显著高于其他馏分 (馏分 9 的吸光度 = 0.8086,馏分 10 = 0.8515),其分布呈正态分布,证明 EVs 主要分布在馏分 9 中。在从不同级分分离的 EV 的 SDS-PAGE 凝胶电泳中也观察到组分 9 中蛋白质的含量相对较高(图 2E)。
本研究使用透射电子显微镜 (TEM; 图 2F)。通过 TEM 的高分辨率成像,它能够清楚地可视化 EV 的形态结构,具有圆形膜状结构,这对于理解 EV 的生物学至关重要。
测定大鼠 NSD 和 HSD 饲养 2 个月后大鼠血压变化。我们可以看到 HSD 组的 SBP (图 3A) 、 DBP (图 3B) 和 MBP (图 3C) 显著升高,表明本研究的高血压模型构建成功。
在本研究中,在不同组中检测 EVs 的浓度(图 3D),结果显示 HSD 组的 EV 浓度显著高于 NSD 组大鼠。这表明 HSD 会影响 EV 的水平,这可能是由于 EV 起源的肠道微生物群组成发生变化。
然后在这项研究中测量 EV 的粒径。测量结果表明,EV 的粒径主要在 60 nm 左右(图 3E),HSD 组的粒径略低于 NSD 组。测量数据为评估 EV 的尺寸分布和均匀性提供了重要信息,有助于后续的实验设计和应用开发。
然后,在这项研究中,检查了 HSD 组和 NSD 组中 EVs 的 LPS 表达量(图 3F)。结果显示,HSD 组 EVs 对 LPS 的表达也显著高于 NSD 组。这可能是由于外囊泡衍生的肠道微生物群中革兰氏阴性菌的增加,或者由于 HSD 组的 EV 浓度高于 NSD 组。
为了进一步支持 HSD 和 NSD 组 EV 之间的差异,本研究调查了衍生的肠道菌群,并对 NSD 和 HSD 组的 EV 样本进行了 16S rRNA 测序,以进一步阐明 HSD 对小鼠肠道菌群中 EV 的影响。
α-多样性分析显示,HSD 组肠道微生物群的多样性显着降低,Shannon 和 ACE 指数均下降(图 4A)。β -基于 PCoA 的多样性分析(图 4B)在 ASV 水平区分了各组之间的微生物表型。高盐干预部分逆转了肠道菌群的表型变化,并发现两组之间外部囊泡衍生的肠道微生物群的组成存在显着差异 (p = 0.001)。
在过滤掉低丰度细菌并标准化数据后,分类注释确定了样品中不同范围的微生物群落。外囊泡衍生的肠道菌群主要由变形菌门 (93.19%) 、厚壁菌门 (4.57%) 和拟杆菌门 (1.19%;图 4C)。HSD 组显着增加了厚壁菌门外囊泡的丰度 (图 4D)。在属水平上,结果表明 Nevskia 和 Acinetobacter 等属在 NSD 组中更丰富,而 Delftia、Burkholderia_Ca 和 Clostridium_sen 在 HSD 组中更丰富(图 4E)。此外,本研究还使用热图来显示 HSD 组和 NSD 组之间肠道微生物群 EV 的差异(图 4F)。高盐干预后,一些细菌 Delftia 和 Burkholderia_Ca 的丰度显着增加,Nevskia 和 Acinetobacter 显着减少(图 4G)。综上所述,高盐干预显著改变了肠道菌群衍生的 EVs 产生的差异,主要是因为它改变了其亲本细菌的分布,主要特征是多样性降低、平衡结构发生变化和不同细菌丰度的变化。
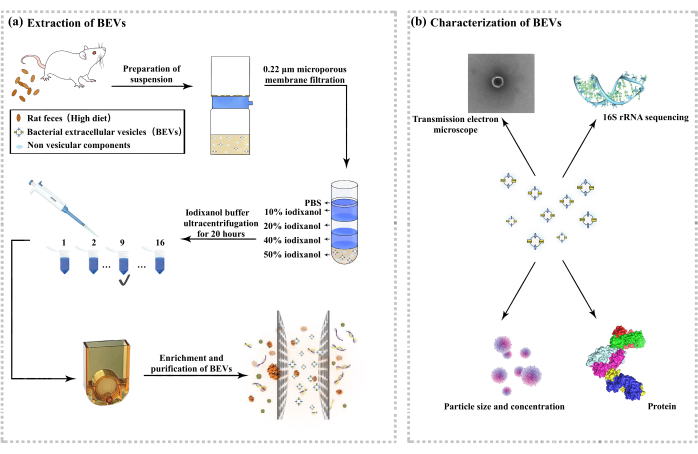
图 1:肠道微生物来源的外囊泡的提取和表征。 (A) 外囊泡提取的流程图。(B) 外囊泡的表征。 请单击此处查看此图的较大版本。
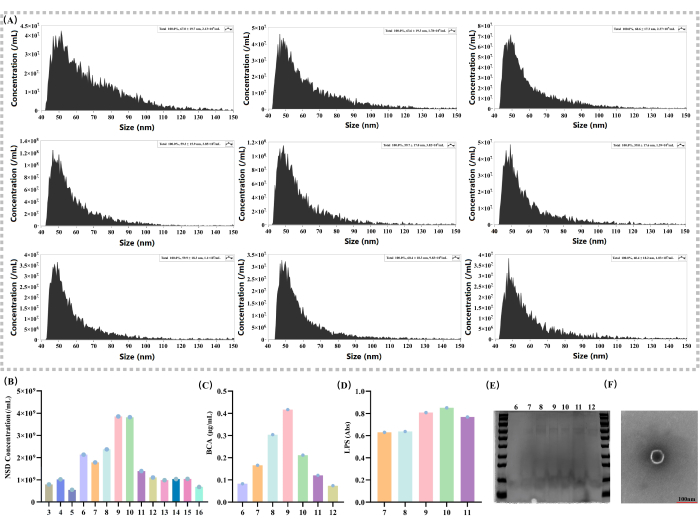
图 2:EV 的基本表征和局部密度梯度的分析。 (A) 不同密度梯度下的囊泡外浓度和粒径测量 (nm;颗粒/mL)。(B) 通过密度梯度 3 - 16 (颗粒/mL) 比较溶液外部囊泡浓度。(C) 使用 BCA 试剂盒在密度梯度 6-12 上测定溶液蛋白含量 (μg/mL)。(D) 使用内毒素检测试剂盒 (Abs) 通过密度梯度 7-11 测量溶液 LPS 表达。(E) 对密度梯度为 6 - 12 的溶液进行 SDS-PAGE 凝胶电泳,并用考马斯亮蓝染色。(F) TEM:比例尺为 100 nm;单个囊泡如图所示。 请单击此处查看此图的较大版本。
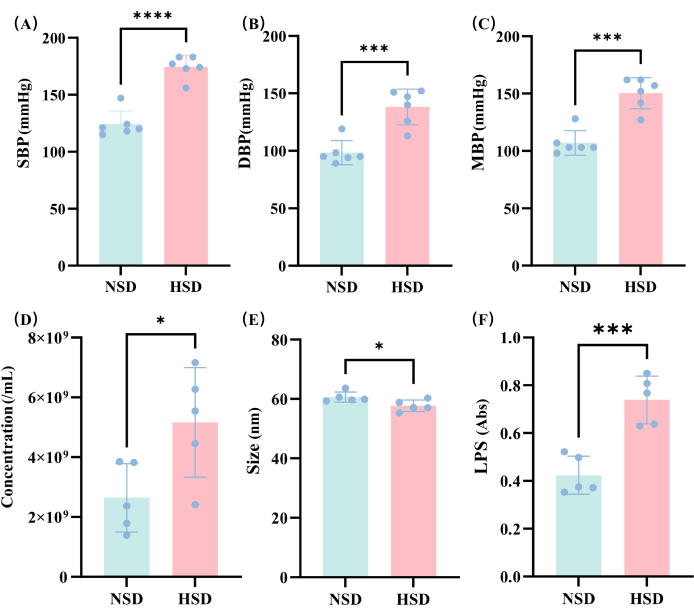
图 3:不同饮食下血压和 EV 变化的分析。 (A) 小型杠杆计划;(B) DBP;(C) MBP;(D) HSD 和 NSD 组外部囊泡浓度的比较;(E) HSD 和 NSD 组外囊泡大小的比较。(F) 通过分光光度法测定 NSD 和 HSD 样品中的 LPS。*p < 0.05,** p < 0.01,*** p < 0.001,NS 表示无显著性,t 检验。 请单击此处查看此图的较大版本。

图 4:不同饮食下 16s rRNA 检测的分析。 (A) α多样性分析;(B) 主坐标分析;(C) 门水平肠道微生物群的丰度;(D) 门水平细菌的变化;(E) LEfSe 结果;(F) 基于差异菌属的聚类热图分析;(G) 属水平细菌的变化。*p < 0.05,** p < 0.01,*** p < 0.001,NS 表示无显著性,t 检验。 请单击此处查看此图的较大版本。
讨论
在这项研究中,我们专注于 HSD 盐敏感大鼠的肠道微生物群 EV,并取得了一系列关键成就。首先,成功构建了一种基于密度梯度离心的高效提取方法,从 HSD 上的盐敏感大鼠肠道微生物群中分离 EV,并通过细致、标准化的动物实验作和样品处理过程分离了大多数非 EV 成分。密度梯度离心法的 EVs 提取方法高效且重现性好,优于常规超速离心法,能更好地保留 EVs 的完整性和功能性,保证样品质量和研究可行性。
其次,通过各种动态技术对 EVs 进行全面鉴定:粒径和浓度检测表明 EVs 具有特定的粒度分布;LPS 和 BCA 测量量化 EV 的蛋白质含量和 LPS 表达;TEM 清楚地显示了 EV 的形态结构;和蛋白质特性定义了蛋白质谱。这些鉴定结果全面揭示了 EVs 的物理和生化特性,为后续研究提供了可靠的数据支持。
此外,16S rRNA 基因测序技术通过深入分析正常和 HSD EVs 的来源和组成之间的差异,以及α多样性分析和β多样性分析表明,高盐摄入量显著影响肠道微生物 EVs 的遗传特性,包括微生物群落结构、物种丰富度和多样性,从而更全面地解决高盐饮食对肠道微生物群 EVs 的影响, 为机理研究提供多层次的证据。
尽管该方法在外泌体回收率和完整性方面比传统的超速离心方法具有一些优势,但仍存在一些局限性,例如样品需求量高和难以区分宿主和微生物群落来源。然而,与现有方法相比,密度梯度离心在维持外泌体的功能完整性方面具有独特的优势,为进一步研究高盐饮食通过肠道菌群影响宿主血压的机制提供了可靠的技术支持。此外,对于实验中遇到的梯度分层不清楚,我们还通过延长离心时间或更换更高性能的转子进行了改进。
未来,我们可以进一步探索肠道微生物群 EV 在高盐饮食诱导的高血压中的机制,尤其是它与免疫系统的相互作用,例如促炎 T 细胞39,40;或使用植物衍生产品干预肠道微生物群 EV41,42,进一步干预疾病并探索它们在调节宿主代谢和免疫反应中的作用。
综上所述,本研究不仅为探究盐诱导肠道菌群高血压的机制提供了重要工具,通过盐敏感大鼠模型,加深了对 HSD、肠道菌群和 EVs 之间关系的理解,也为高血压等心血管疾病的防治开辟了一条新途径,为饮食-微生物-宿主相互作用的研究提供了独特的视角。
披露声明
作者声明,他们没有已知的竞争性经济利益或个人关系,这些利益或个人关系似乎可能会影响本文报告的工作。
致谢
这项工作得到了国家自然科学基金 (82205240)、四川省自然科学基金 (2025ZNSFSC1836) 和四川省骨科医院临床基础项目 (PY202414) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| Essential Supplies | |||
| Centrifugal Filter (10nkDa 2 mL) | Millipore | UFC903096 | |
| Centrifuge Tude(50 mL) | BKMAN | 20220404 | |
| Centrifuge Tudes | BECKMAN COULTER | Z30815SCA | |
| Vacuum Filtration System | Biosharp | 24902581 | |
| Reagents | |||
| Chromogenic LAL Endotoxin Assay Kit | Beyotime | 022124240705 | |
| Coomassie Blue Fast Staining Solution | Beyotime | Z972241010 | |
| EDTA | Damas-beta | P3117308 | |
| Enhanced BCA Protein Assay Kit | Beyotime | A006241112 | |
| Ethanol | KESH | ||
| HCl | |||
| OptiPrep (60% wt/vol, iodixanol) | Serumwerk | 00124 | |
| PBS | Labshark | 130114005 | |
| phosphotungstic acid | RUIXIN | ||
| Sucrose | Damas-beta | P1917057 | |
| Tris (VWR) | Damas-beta | P3061764 | |
| Trypan blue staining solution (0.4%) | Beyotime | BD07242904 | |
| Equipment | |||
| Absorbance Microplate Reader | SpectraMax | ABP01690 | |
| Biomicroscope | Motic | BA210Digital | |
| Desk centrifuge | Cence | CHT210R | |
| Desktop high-speed micro centrifuge | DLAB | D3024 | |
| Fixed Angle Aluminum Rotor + 500 mL Centrifugal Cup | Cence | ||
| High precision electronic balance | SKR | BN-200 | |
| Laminar flow cabinet | Nantong Hunan Scientific Instrument Co., Ltd. | SW-CJ-2FDS | |
| SW 32.1 Ti Swing bucket turn+ SW 32.1 Ti Rotor bucket | BECKMAN COULTER | ||
| Transmission electron microscope | JEOL | JEM-1400FLASH | |
| Tube rotator | |||
| Ultracentrifuge | BECKMAN COULTER | Optima XE-100 | |
| Ultra-pure water system | ULPHW | UPR-II-15TNZ | |
| Water-Cieculation Multifunction Vacuum Pump | Qiang Qiang | SHZ-D(III) |
参考文献
- Thursby, E., Juge, N. Introduction to the human gut microbiota. Biochem J. 474 (11), 1823-1836 (2017).
- Aschtgen, M. S., et al. Rotation of Vibrio fischeri Flagella Produces Outer Membrane Vesicles That Induce Host Development. J Bacteriol. 198 (16), 2156-2165 (2016).
- Gurung, S., Perocheau, D., Touramanidou, L., Baruteau, J. The exosome journey: from biogenesis to uptake and intracellular signalling. Cell Comm Signal. 19 (1), 47(2021).
- Avila-Calderón, E. D., et al. Outer Membrane Vesicles of Gram-Negative Bacteria: An Outlook on Biogenesis. Front Microbiol. 12, 557902(2021).
- Melo-Marques, I., Cardoso, S. M., Empadinhas, N. Bacterial extracellular vesicles at the interface of gut microbiota and immunity. Gut Microbes. 16 (1), 2396494(2024).
- Kim, N. Y., et al. Effect of gut microbiota-derived metabolites and extracellular vesicles on neurodegenerative disease in a gut-brain axis chip. Nano Converg. 11 (1), 7(2024).
- Ahmadi Badi, S., et al. Microbiota-Derived Extracellular Vesicles as New Systemic Regulators. Front Microbiol. 8, 1610(2017).
- Barathan, M., Ng, S. L., Lokanathan, Y., Ng, M. H., Law, J. X. The Profound Influence of Gut Microbiome and Extracellular Vesicles on Animal Health and Disease. Int J Mol Sci. 25 (7), 4024(2024).
- Maukonen, J., Saarela, M. Human gut microbiota: does diet matter. Proc Nutri Soc. 74 (1), 23-36 (2015).
- Bier, A., et al. A High Salt Diet Modulates the Gut Microbiota and Short Chain Fatty Acids Production in a Salt-Sensitive Hypertension Rat Model. Nutrients. 10 (9), 1154(2018).
- Aghamohammad, S., et al. Anti-inflammatory and immunomodulatory effects of Lactobacillus spp. as a preservative and therapeutic agent for IBD control. Immun Inflamm Dis. 10 (6), e635(2022).
- Dong, Z., et al. The Effects of High-Salt Gastric Intake on the Composition of the Intestinal Microbiota in Wistar Rats. Med Sci Monit. 26, e922160(2020).
- Yan, X., et al. Intestinal Flora Modulates Blood Pressure by Regulating the Synthesis of Intestinal-Derived Corticosterone in High Salt-Induced Hypertension. Circ Res. 126 (7), 839-853 (2020).
- Wang, X., Lang, F., Liu, D. High-Salt Diet and Intestinal Microbiota: Influence on Cardiovascular Disease and Inflammatory Bowel Disease. Biology. 13 (9), 674(2024).
- Qi, L., et al. Microbiome-metabolome analysis insight into the effects of high-salt diet on hemorheological functions in SD rats. Front Nutri. 11, 1408778(2024).
- Wu, Q., et al. Insights into the unique roles of extracellular vesicles for gut health modulation: Mechanisms, challenges, and perspectives. Curr Res Microb Sci. 7, 100301(2024).
- Zhang, H., et al. Effects of bacterial extracellular vesicles derived from oral and gastrointestinal pathogens on systemic diseases. Microbiol Res. 285, 127788(2024).
- Wang, H. X., Wang, Y. P. Gut Microbiota-brain Axis. Chinese Med J. 129 (19), 2373-2380 (2016).
- Huang, S., et al. A cross-tissue transcriptome association study identifies key genes in essential hypertension. Front Genet. 14, 1114174(2023).
- Gao, H., et al. Microbial DNA Enrichment Promotes Adrenomedullary Inflammation, Catecholamine Secretion, and Hypertension in Obese Mice. J Am Heart Assoc. 11 (4), e024561(2022).
- Chen, P. Gut Microbiota and Pathogenesis of Organ Injury. , Springer. Singapore. (2020).
- Xie, N., et al. hPSCs-derived brain organoids for disease modeling, toxicity testing and drug evaluation. Exp Neurol. 385, 115110(2024).
- Liu, N., et al. The underlying mechanisms of DNA methylation in high salt memory in hypertensive vascular disease. Sci Rep. 14 (1), 925(2024).
- Li, M., et al. Wheat β-glucan reduces obesity and hyperlipidemia in mice with high-fat and high-salt diet by regulating intestinal flora. Int J Biol Macromol. 288, 138754(2024).
- Kerem, G., et al. Small intestinal microbiota composition altered in obesity-T2DM mice with high salt fed. Sci Rep. 13 (1), 8256(2023).
- Díez-Sainz, E., Milagro, F. I., Riezu-Boj, J. I., Lorente-Cebrián, S. Effects of gut microbiota-derived extracellular vesicles on obesity and diabetes and their potential modulation through diet. J Physiol Biochem. 78 (2), 485-499 (2022).
- Wu, S., et al. Liuzijue training improves hypertension and modulates gut microbiota profile. Front Cardiovasc Med. 10, 1075084(2023).
- Qi, L. M., et al. Salvia miltiorrhiza bunge extract improves the Th17/Treg imbalance and modulates gut microbiota of hypertensive rats induced by high-salt diet. J Funct Foods. 117, 106211(2024).
- Wilck, N., et al. Salt-responsive gut commensal modulates T(H)17 axis and disease. Nature. 551 (7682), 585-589 (2017).
- Jiang, X., et al. Intestinal Gastrin/CCKBR (Cholecystokinin B Receptor) Ameliorates Salt-Sensitive Hypertension by Inhibiting Intestinal Na(+)/H(+) Exchanger 3 Activity Through a PKC (Protein Kinase C)-Mediated NHERF1 and NHERF2 Pathway. Hypertension. 79 (8), 1668-1679 (2022).
- Zheng, T., et al. Hypertension of liver-yang hyperactivity syndrome induced by a high salt diet by altering components of the gut microbiota associated with the glutamate/GABA-glutamine cycle. Front Nutr. 9, 964273(2022).
- Mulligan, S. K., et al. Multiplexed TEM Specimen Preparation and Analysis of Plasmonic Nanoparticles. Microsc Microanal. 21 (4), 1017-1025 (2015).
- Olson, B. Assays for Determination of Protein Concentration. Curr Protoc Pharmacol. 73, A.3a.1-a.3a.32 (2016).
- Matsumoto, H., Haniu, H., Komori, N. Determination of Protein Molecular Weights on SDS-PAGE. Methods Mol Biol. 1855, 101-105 (2019).
- Sanschagrin, S., Yergeau, E. Next-generation Sequencing of 16S Ribosomal RNA Gene Amplicons. J Vis Exp. (90), e51709(2014).
- Tulkens, J., De Wever, O., Hendrix, A. Analyzing bacterial extracellular vesicles in human body fluids by orthogonal biophysical separation and biochemical characterization. Nat Protoc. 15 (1), 40-67 (2020).
- Ruhal, R., Kataria, R. Biofilm patterns in gram-positive and gram-negative bacteria. Microbiol Res. 251, 126829(2021).
- Maldonado, R. F., Sá-Correia, I., Valvano, M. A. Lipopolysaccharide modification in Gram-negative bacteria during chronic infection. FEMS Microbio Rev. 40 (4), 480-493 (2016).
- Honda, K., Littman, D. R. The microbiota in adaptive immune homeostasis and disease. Nature. 535 (7610), 75-84 (2016).
- Guzik, T. J., et al. Role of the T cell in the genesis of angiotensin II induced hypertension and vascular dysfunction. J Exp Med. 204 (10), 2449-2460 (2007).
- Huang, J., et al. Extracellular vesicles as a novel mediator of interkingdom communication. Cytokine Growth Factor Rev. 73, 173-184 (2023).
- Li, W., et al. Alleviation of colitis by honeysuckle MIR2911 via direct regulation of gut microbiota. J Control Release. 376, 123-137 (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。