Method Article
Идентификация и классификация позиционно-специфичных вариантов миссенс-субъединицы рецептора ГАМКА по их роли в пирамидальных нейронах гиппокампа
В этой статье
Резюме
Это исследование представляет многоуровневую структуру, охватывающую от ДНК до функции белка и нейронного поведения. В нем представлен новый подход к исследованию предсказанных патогенных мутаций в субъединице рецептораГАМК А , предполагая, что эпилептогенные мутации и проксимальные мутации, прогнозируемые как патогенные, могут оказывать аналогичное воздействие на модель пирамидального нейрона CA1.
Аннотация
Понимание эффектов функционально неизвестных вариантов в генах, связанных с эпилепсией, имеет решающее значение для выяснения патофизиологии заболевания и разработки персонализированной терапии. С помощью многоуровневой структуры, охватывающей от последовательности ДНК до функции белка и поведения нейронов, мы описываем новый подход к прогнозированию и исследованию патогенных мутаций, предполагая, что эпилептогенные мутации в субъединице рецептора ГАМКА и близлежащих предсказанных мутациях могут оказывать аналогичное воздействие на модель пирамидального нейрона CA1. Изучая характерные взаимосвязи между предсказанными патогенными мутациями и проксимальными эпилептогенными мутациями, исследование направлено на оценку эффектов прогнозируемых мутаций на основе влияния эпилептогенных мутаций на моделирование пирамидальных нейронов гиппокампа.
Методология начинается со сбора генетических данных γ2-субъединицы рецептора ГАМКА , за которым следует очистка и форматирование данных в R с использованием пользовательского скрипта. Далее будут применены ансамблевые предикторы для идентификации и приоритизации патогенных миссенс-вариантов субъединицы γ2 . Будет проиллюстрировано картирование конкретного патогенного варианта (предсказанного) на субъединичные структурные домены, общие для эпилептогенных мутаций, с молекулярным моделированием их эффектов и рассмотрением эволюционного сохранения. Затем будет проведен мета-анализ и нормализация параметров, а затем корреляционный анализ для выявления любых значимых взаимосвязей между прогнозируемыми мутациями и проксимальными эпилептогенными мутациями. С помощью нейронного симулятора на основе Python будет описана многокомпонентная модель нейронов на основе проводимости, отражающая влияние мутантов дикого типа и эпилептогенов. Для грубой оценки влияния прогнозируемых патогенных вариантов на нейронный ответ будет рассмотрено моделирование нейронных реакций, генерируемых эпилептогенным подтипом рецептора ГАМКА . Насколько нам известно, это первый протокол, в котором исследуется многоуровневая структура для оценки влияния вариантов рецептора ГАМКА на поведение нейронов, что имеет решающее значение для исследований эпилепсии. Этот протокол может служить основой для усиления прогнозирования клеточных фенотипов, вызванных потенциально патогенными вариантами рецепторов ГАМКА , ассоциированных с эпилепсией.
Введение
Почти для всех заболеваний человека генетическая изменчивость играет значительную роль в индивидуальной восприимчивости. Таким образом, понимание того, как вариации последовательностей связаны с риском заболевания, предлагает ценный способ выявить ключевые процессы, участвующие в развитии заболевания, и определить новые подходы к профилактике и лечению1. Это также относится к нарушениям развития нервной системы, которые относятся к числу наиболее распространенных хронических заболеваний в педиатрической первичной медико-санитарной помощи2. Такие состояния, как расстройство аутистического спектра, умственная отсталость и эпилепсия, иллюстрируют, как генетическая изменчивость существенно влияет на индивидуальную восприимчивость вовремя развития.
Развивающийся мозг более восприимчив к эпилептическим припадкам, чем мозг взрослогочеловека, из-за генетически запрограммированного несоответствия в развитии нервной системы в критическом балансе между возбуждением и торможением. Поскольку ГАМК (гамма-аминомасляная кислота), основной тормозной нейромедиатор в мозге взрослого человека, является возбуждающим во время эмбрионального и раннего постнатального развития, это не благоприятно сказывается на стабильности, необходимой для предотвращения судорог в молодом мозге. Это временное состояние, вызванное отсутствием достаточной экспрессии котранспортеров K-Cl5, может способствовать повышенному риску судорожной активности в присутствии дисфункциональных рецепторов ГАМКА. Рецепторы ГАМК А опосредуют возбуждающее и ингибирующее действие ГАМК в зависимости от внутриклеточной концентрации Cl- ion6. Таким образом, по мере созревания мозга мутации в генах, кодирующих рецептор ГАМКА, а также в других ионных каналах, искажают возбудимость, а мутации в генах, участвующих в нейронном метаболизме, передаче сигналов в клеткахи образовании синапсов, могут вызывать такие состояния, как детская абсансная эпилепсия.
Клинические вмешательства все чаще используют генетический анализ для повышения точности лечения нарушений развития нервной системы2. Генетическое тестирование при детской эпилепсии представляет собой потенциальные мишени для подходов точной медицины9, подчеркивая важность генетических вариантов при принятии решений о лечении. Кроме того, ~25% пациентов с эпилепсией с мутациями de novo получают генетические диагнозы, которые определяют потенциальные мишени для точной медицины, что подчеркивает значительную ценность генетических вариантовпри принятии решений о лечении. Этому способствовали достижения в области технологий секвенирования нового поколения, такие как целевые генные панели, полноэкзомное секвенирование и полногеномное секвенирование, которые значительно ускорили генетические открытия. Тем не менее, растущее число открытий новых генов сопряжено с проблемой, когда в результате появляется вариант неизвестного значения (VUS), классификация, которая отражает противоречивые данные или недостаточную информацию о молекулярной роли варианта в патогенезе заболевания. Варианты, классифицируемые как ВУС, относятся к одной категории в рамках пятиуровневой системы классификации вариантов, предложенной Американским колледжем медицинской генетики и геномики (ACMG) и Ассоциацией молекулярной патологии (AMP)12.
Решение проблемы функционально неизвестных генетических вариантов требует усилий в двух ключевых измерениях: клинической практике и исследованиях. С клинической точки зрения, неопределенность, связанная с ВУС, может осложнить ведение пациента и принятие решений13. С точки зрения научных исследований, выявление патогенных вариантов среди растущего числа вариантов с неопределенной значимостью и определение их роли в патофизиологии заболевания и фенотипических эффектах имеют решающее значение1. Один из идеальных сценариев должен включать в себя точное прогнозирование молекулярных, нейронных и сетевых эффектов всех функционально нехарактерных вариантов, тем самым минимизируя ресурсы, время и усилия, необходимые для лабораторных исследований. Эти аспекты подчеркивают важность точной классификации генетических вариантов для точной диагностики генетической эпилепсии, поддержки персонализированного лечения и облегчения обнаружения потенциальных фармакологических мишеней. Современные прогностические инструменты 14,15,16,17 являются относительно точными, но, как правило, обеспечивают только бинарную классификацию (патогенные и доброкачественные) и не имеют специфического для заболевания понимания молекулярной патофизиологии, фенотипических последствий и лежащих в их основе механизмов. Сосредоточившись на неизвестных миссенс-вариантах отдельных генов, кодирующих субъединицу рецептораГАМК А, в данной статье представлена структура, направленная на совершенствование руководства исследованиями путем включения контекстуальных факторов вариантов, таких как молекулярные, эволюционные и структурные аспекты, а также моделирование нейронной патологии, полученное на основе биофизических данных in vitro мутаций, ассоциированных с эпилепсией. Наша методология направлена на идентификацию неизвестных патогенных вариантов γ2-субъединицы рецептора ГАМКА, ключевой субъединицы, участвующей в патофизиологии эпилепсии 18,19,20. За этим следует исследование позиционно-специфического соответствия этих предсказанных вариантов с мутациями, связанными с эпилепсией, характеризующимися структурными и электрофизиологическими данными. Эти данные затем используются для оценки вариационного влияния на модель пирамидального нейрона гиппокампа, экспрессирующего подтип рецептора ГАМКА, состоящий из γ2, α1 и β3 субъединиц (рецепторы γ2-ГАМКА), ответственного за быстрое синаптическое торможение6. Важно отметить, что рецепторы ГАМКА собираются из большого пула субъединиц (α1-α6, β1-β3, γ1-γ3, δ, Ε, θ, π и ρ1-ρ3) и в зависимости от состава субъединиц рецепторыГАМК А различаются по своей модуляции, биофизическим характеристикам, а также по региональным, клеточным и субклеточным паттернам экспрессии в сочетании со специфическими функциями 6,21,22,23, 24,25. Таким образом, в настоящем исследовании основное внимание уделяется только γ2-ГАМКА рецепторам или γ2-содержащим ГАМКА рецепторам.
Субъединицы рецептора ГАМКА состоят из характерных структурных особенностей – длинного N-концевого внеклеточного домена (ECD), четырех трансмембранных охватывающих доменов (TM1 – TM4), внутриклеточного линкера, соединяющего TM1 и TM2, внеклеточного линкера, соединяющего TM2 и TM3, большой внутриклеточной петли между TM3 и TM4 (петля TM3-TM4) и короткого внеклеточного C конца 6,26, 27. Предполагается, что рецептор ГАМКА функционирует по сложному механизму «блокировки и вытягивания», при котором связывание с ГАМК блокирует β и α субъединицы, заставляя их притягивать внеклеточные домены (ECD) субъединиц, вращая их против часовой стрелки27. Это движение изгибает трансмембранные домены (TMD), тем самым открывая ионный канал27. Таким образом, активность канала, по-видимому, координируется вместе со структурными кассетами внутри рецепторов ГАМКА. Оказывается, что мутации при эпилепсии вызывают дисфункцию в активности каналов из-за искажения этих структурных кассет28. Следовательно, наше исследование основано на идее о том, что предсказанные патогенные варианты в непосредственной близости от функционально идентифицированных эпилептогенных мутаций в специфических структурных кассетах субъединиц рецептора ГАМКА могут демонстрировать аналогичные паттерны электрофизиологических или биофизических искажений в функции канала, как это наблюдается в случаях этих эпилептогенных мутаций. В то время как присутствие эпилептогенных структурных кассет в субъединицах28 рецептора ГАМКА косвенно подтверждает эту идею, наше исследование демонстрирует сложность и проблему корреляции биофизических параметров эпилептогенных мутаций с параметрами прогнозируемых патогенных мутаций. Чтобы выявить эти сложные взаимосвязи, наша концепция имеет важное значение, поскольку она подчеркивает многоуровневый подход, начиная от ДНК и заканчивая функцией белка и нейронным поведением, критически важным для исследований эпилепсии. Этот подход объединяет вычислительную генетику с молекулярным моделированием и нейронным моделированием, а также подчеркивает важность дополнительных методов, таких как машинное обучение, обученное на больших наборах данных, которые могут зафиксировать влияние мутаций на структуру канала, активность и возбудимость нейронов. Кроме того, моделирование активности эпилептогенного γ2-ГАМКрецептора А на модели пирамидального нейрона гиппокампа позволяет воспроизводить in vitro клеточный фенотип, связанный с каналопатией рецептора ГАМКА, и демонстрировать измененные ответы одного нейрона в центре дисфункции сети.
протокол
1. Прогнозирование in silico патогенных вариантов
- Сбор данных о вариантах
- Используя базу данныхClinVar 29, выполните поиск вариантов неопределенной значимости (VUS) в кодирующей области интересующего гена через веб-сайт: https://www.ncbi.nlm.nih.gov/clinvar/. Введите символ гена (например, GABRG2) в строку поиска и отфильтруйте результаты, чтобы включить только желаемые типы вариантов, такие как однонуклеотидные, миссенс-варианты с неопределенной значимостью. Загрузите и сохраните данные в формате data.xlxs (Дополнительный файл 4: Дополнительная таблица S1). Запишите дату загрузки данных.
ПРИМЕЧАНИЕ: В настоящем протоколе будет проанализирована человеческая γ2-субъединица рецептора ГАМКА, а именно субъединица гамма-аминомасляной кислоты гамма-2 (GABRG2) Homo sapiens гамма-аминомасляной кислоты типа А, вариант транскрипта 1, мРНК (NCBI Ref. seq.: NM_198904.4), также известная как γ2L. Важно записывать референсный транскрипт интересующего гена, а также другие соответствующие идентификаторы в различных базах данных (UniProt, ENSEMBL, PDB), поскольку для разных методов вычисления могут потребоваться разные идентификаторы (Дополнительный файл 4: Дополнительная таблица S2). В случае, если база данных или вычислительный инструмент не распознает номера версий идентификаторов последовательности, попробуйте использовать идентификатор как с номером версии (NM_198904.4), так и без номера версии (NM_198904). - Справочная информация о белке
- В https://www.ncbi.nlm.nih.gov/ базы данных NCBI выберите Nucleotide в опциях поиска и введите NCBI Ref. seq. ID интересующего гена (NM_198904.4). Затем, прокрутив вниз в правой колонке, нажмите на «Белок » в категории «Связанная информация », чтобы найти белок (NP_944494.1), закодированный в транскрипте NM_198904.4. Используя информацию, приведенную для белка NP_944494.1, запишите последовательности конкретных областей в виде таблицы (Дополнительный файл 4: Дополнительная таблица S3).
Примечание: Важно определить предварительную известную информацию о положении последовательностей функционально и структурно критических областей, мотивов или остатков, таких как белковые домены, сайты фосфорилирования, сайты связывания лигандов и интерфейсы молекулярных взаимодействий. Это может быть достигнуто путем объединения баз данных (NCBI, ENSEMBL, UniProt...) и поиска литературы.
- В https://www.ncbi.nlm.nih.gov/ базы данных NCBI выберите Nucleotide в опциях поиска и введите NCBI Ref. seq. ID интересующего гена (NM_198904.4). Затем, прокрутив вниз в правой колонке, нажмите на «Белок » в категории «Связанная информация », чтобы найти белок (NP_944494.1), закодированный в транскрипте NM_198904.4. Используя информацию, приведенную для белка NP_944494.1, запишите последовательности конкретных областей в виде таблицы (Дополнительный файл 4: Дополнительная таблица S3).
- Используя базу данныхClinVar 29, выполните поиск вариантов неопределенной значимости (VUS) в кодирующей области интересующего гена через веб-сайт: https://www.ncbi.nlm.nih.gov/clinvar/. Введите символ гена (например, GABRG2) в строку поиска и отфильтруйте результаты, чтобы включить только желаемые типы вариантов, такие как однонуклеотидные, миссенс-варианты с неопределенной значимостью. Загрузите и сохраните данные в формате data.xlxs (Дополнительный файл 4: Дополнительная таблица S1). Запишите дату загрузки данных.
- Организация данных о вариантах
- Организуйте данные в соответствии с входными требованиями для выбранных предикторов. Убедитесь, что формат извлекаемых данных организован в соответствии с требованиями сервера dbNSFP http://database.liulab.science/dbNSFP. Для этого удалите ненужные столбцы из файла data.xlsx (Supplementary File 4: Supplementary Table S1 from step 1.1.1), оставив только следующие столбцы в указанном порядке:
"GRCh38Хромосома", "GRCh38Расположение", "Название", "Изменение белка". - Сохраните файл под новым именем: "data1.xlsx" (Дополнительная таблица S4). Отформатируйте файл data1.xlsx в R, выполнив код (Дополнительный файл 1: Data_GABAA. R), который сохранит отформатированные данные как data1_output.xlsx (Дополнительный файл 4: Дополнительная таблица S5) в рабочем каталоге, относящемся к проекту R.
ПРИМЕЧАНИЕ: Для разных вычислительных методов требуются разные типы и форматы данных. Сбор и организация данных в соответствии с определенными требованиями к формату, даже для дюжины вариантов, может быть подвержена ошибкам и отнимать много времени, поэтому этот шаг важен, если пул вариантов не состоит всего из нескольких вариантов. В этом случае может быть возможна ручная организация данных.
- Организуйте данные в соответствии с входными требованиями для выбранных предикторов. Убедитесь, что формат извлекаемых данных организован в соответствии с требованиями сервера dbNSFP http://database.liulab.science/dbNSFP. Для этого удалите ненужные столбцы из файла data.xlsx (Supplementary File 4: Supplementary Table S1 from step 1.1.1), оставив только следующие столбцы в указанном порядке:
- Прогнозирование патогенности
- Перенесите содержимое файла data1_output.xlsx в академическую версию сервера dbNSFP30,31, доступ к которому осуществляется через http://database.liulab.science/dbNSFP. Для этого скопируйте/вставьте или напрямую загрузите файл в формате .txt.
- Перед отправкой убедитесь, что на сервере предварительно выбраны и подтверждены следующие параметры: HG38 (сборка генома), ClinPred32 и BayesDEL33 . В течение нескольких минут сервер сгенерирует результаты.
Примечание: В настоящем протоколе два ансамблевых предиктора, а именно BayesDEL33 и ClinPred32, были выбраны за высокую точность34 и практичность. Тем не менее, можно выбрать и другие предикторы, такие как AlphaMissense, который доступен в базе данных dbNSFP30,31. Выбор инструментов in silico зависит от нескольких факторов, в том числе от создания достаточного количества вычислительных доказательств для мощногопрогнозирования. Для этой цели могут служить ансамблевые предикторы, интегрирующие анализ нескольких прогностических алгоритмов. - Скачайте выходной файл (в формате .txt) и сохраните его как data2.xlsx (Дополнительный файл 4: Дополнительная таблица S6).
- Установите фильтры в data2.xlsx (Дополнительный файл 4: Дополнительная таблица S6), нажав на опцию фильтра в меню, и определите варианты консенсуса в обоих столбцах путем фильтрации по D. Это даст список наиболее патогенных вариантов; сохраните его (см. вкладку «Консенсус » в Дополнительной таблице S6 [ Дополнительный файл 4]).
- Выбор варианта
- Среди консенсусных патогенетических прогнозов определите варианты в непосредственной близости эпилептогенных мутаций, полученных из литературы. Убедитесь, что последние обладают структурными и биофизическими параметрами, подходящими для моделирования нейронов.
Примечание: Этот этап является исследовательским и также связан с изучением интересующего белка с точки зрения его структурных, физико-химических и биофизических параметров. В настоящем исследовании эти данные были получены от Brünger et al.35 и Guo et al.36 в дополнение к обзору мутаций, связанных с эпилепсией. Кроме того, в качестве альтернативы, оценка AlphaMissense37 была получена из базы данных dbNSFP 30,31 с повторением шага 1.3 (Дополнительный файл 4: Дополнительная таблица S7). Более подробная информация приведена в разделах протокола 2.1.1 и 2.1.2 и в Результатах (см. раздел «Варианты кластеризации по структурным и биофизическим параметрам»). - Для базовой визуализации используйте серверы Protter38 (https://wlab.ethz.ch/protter/start/) и HOPE39 (https://www3.cmbi.umcn.nl/hope/) для изучения вариантов на предыдущем шаге в контексте выбранных мутаций гена GABRG2 : P302L40 и K328M (или K289M41, если исключить сигнальный пептид с 39 остатками).
ПРИМЕЧАНИЕ: Из-за огромной сложности структурная оценка эффектов вариантов должна проводиться на нескольких уровнях анализа. Такие инструменты, как Protter38 , позволят четко визуализировать варианты в контексте топологических особенностей белка, а удобные для пользователя серверы, такие как HOPE39 , дадут представление об эффекте вариантов с помощью молекулярного моделирования. Кроме того, всесторонний обзор литературы об интересующем белке имеет решающее значение для выявления и интеграции информации о мутациях, связанных с эпилепсией. - Анализ эволюционного сохранения и структурных представлений
- Open Jalview 42,43,44, программа с открытым исходным кодом для редактирования, визуализации и анализа белков.
- Импорт последовательностей для выравнивания. Нажмите на «Файл» в верхнем меню | Выборка последовательностей; выберите базу данных в диалоговом окне (например, UniProt); нажмите на вкладку «Получить идентификаторы»; и, как описано в диалоговом окне, введите идентификаторы присоединения UniProt интересующего гена (GABRG2) человека и других видов позвоночных: P18507, P22723, Q6PW52, A0A2I3TKX0, F1RR72, A0A8I3MDZ2, A0A8M1P4D6. Нажмите OK.
ПРИМЕЧАНИЕ: Регистрационные номера UniProt белков, кодируемых GABRG2 , следующие: P18507 (P18507-2) для Homo sapiens, P22723 для Mus musculus, A0A2I3TKX0 для Pan troglodytes, F1RR72 для Sus scrofa, A0A8I3MDZ2 для Canis familiaris и A0A8M1P4D6 для Danio rerio. - В зависимости от интересующего гена некоторые последовательности могут быть не аннотированы; поэтому выполните поиск BLAST, чтобы определить релевантную информацию и потенциальные гомологи для лучшего понимания контекста. В этом случае загрузите белковые последовательности в формате FASTA с помощью опции текстового поля «Добавить последовательности/От» в меню «Файл », чтобы создать несколько выравниваний последовательностей нужных последовательностей.
- После загрузки выравнивания наблюдайте за последовательностями, отображаемыми для многократного сравнения последовательностей. Каждая строка представляет последовательность, а каждый столбец представляет позицию в выравнивании. Чтобы определить наилучший метод юстировки, используйте разные подходы; Например, нажмите на Web services в меню Sequence и выберите опцию Run T-Coffee with preset , которая обеспечивает оптимальное выравнивание.
- Щелкните правой кнопкой мыши по последовательности P18507 Homo sapiens (референсная последовательность в данном исследовании) и установите ее в качестве референсной последовательности. Выберите «Формат» в верхнем меню и нажмите « Обтекание » для визуализации полного выравнивания на экране. В том же меню «Формат» нажмите на шкалу выше , чтобы улучшить визуализацию конкретных номеров остатков. Чтобы еще больше улучшить визуализацию, настройте цветовые схемы, перейдя в раздел «Цвет » и выбрав различные параметры (например, «Цвет куста», «Химическое свойство»); При необходимости измените размер шрифта.
- Нажмите « Рассчитать » в строке меню и выберите «Авторасчет консенсуса », чтобы выделить сохраненные регионы.
- Сосредоточьтесь на положении вариантов, представляющих интерес, выявленных на этапе прогнозирования in silico , и изучите конкретные позиции вариантов. Аннотируйте определенные остатки, щелкнув по ним правой кнопкой мыши и выбрав «Добавить аннотацию». Напишите этикетку (например, идентификатор варианта) с соответствующим цветовым кодом и сохраните.
ПРИМЕЧАНИЕ: В настоящем анализе P302L (фиолетовый) и A303T (красный) были выбраны для визуализации их в множественной последовательности вместе со структурными данными (см. следующий раздел).
- Трехмерная реконструкция полного белка с указанием выбранных консервативных остатков
- В файле, полученном на предыдущем шаге, щелкните правой кнопкой мыши по эталонной последовательности (GABRG2 человек) и выберите 3D-данные структуры.
- Определите соответствующие структурные данные (7QNE, цепочка C)26 в раскрывающемся меню и выберите « Открыть новый вид структуры» с помощью Jmol.
ПРИМЕЧАНИЕ: Это позволит включать остатки, выбранные в ходе множественного выравнивания последовательностей, в структурные данные с помощью Jmol, средства просмотра 3D-химических структур с открытым исходным кодом на основе Java.
- Среди консенсусных патогенетических прогнозов определите варианты в непосредственной близости эпилептогенных мутаций, полученных из литературы. Убедитесь, что последние обладают структурными и биофизическими параметрами, подходящими для моделирования нейронов.
2. Подбор параметров и биофизическое моделирование
- Вариантно-специфичный метаанализ и нормализация параметров
- Обзор современной литературы для сбора идентифицированных вариантов субъединиц с электрофизиологической проводимостью канала передачи данных (gGABAA), временем дезактивации (τдеактивация), временем нарастания (τнарастания) и максимальной амплитудой тока (Imax). Укажите состав субъединиц, тип ячейки и измерения дикого типа для каждого случая. Соответствующим образом обозначьте варианты и их контроль (например, известные для вариантов с идентифицированными биофизическими характеристиками и известные контрольные для измерений дикого типа для каждого варианта).
- Получение баллов патогенности AlphaMissense для вариантов с идентифицированными биофизическими характеристиками.
ПРИМЕЧАНИЕ: Для получения более подробной информации см. раздел протокола 1.3. - Создайте фрейм данных с субъединицей и положением аминокислот для каждого варианта, исходными и измененными аминокислотами, оценкой патогенности и биофизическими параметрами, полученными из литературы. Чтобы избежать экспериментальных расхождений, нормализуйте биофизические параметры для идентифицированных вариантов как x-кратные изменения при измерениях дикого типа.
- Сравнительный вариантный анализ по структурно-функциональным характеристикам
- Организация прогнозируемых вариантов на фрейме данных; соответствующим образом пометить (например, спрогнозировано для вариантов без доступной литературы по их биофизическим характеристикам).
- Классифицируйте варианты по их расположению в аминокислотной последовательности и третичной структуре. Добавьте параметры структурной классификации (например, локализацию в альфа-спиралях, спиралях, бета-листах, внеклеточных, внутриклеточных или трансмембранных доменах, выстилание пор, связывание агонистов, белок-белковые взаимодействия) в кадр данных и предоставьте информацию для каждого варианта в отношении их аминокислотного положения.
- Классифицируйте варианты по их расстоянию до центра мембраны и оси пор. Добавьте расстояние до оси пор и расстояние до параметров центра мембраны на кадре данных.
- Анализ корреляции между структурными и биофизическими параметрами по известным вариантам. По возможности оцените прогнозируемые варианты относительно полученных корреляций.
- Построение моделей синапсов и нейронов
- Используйте Brian245, нейронный симулятор с открытым исходным кодом, разработанный на Python для моделирования и симуляции спайковых нейронных сетей, для создания многокомпонентной биофизической модели ГАМКергического синапса на пирамидальном нейроне гиппокампа, основанном на многокомпонентной проводимости.
- Спроектируйте модель на основе проводимости, определив кинетику стробирования ионных каналов, пассивные и активные параметры, а также постсинаптическую проводимость. Определите модель, основанную на проводимости, как показано в дополнительном файле 2, в котором описаны уравнения, используемые в модели.
- Емкость мембраны (Cm) установить равной 1 мкФ/см2 и внутриклеточное сопротивление (Ra) равной 200 Ω см.
- Используйте модифицированные проводимости типа Ходжкина-Хаксли для пирамидных нейронов гиппокампа39 с gL= 0,0003 См/см2, gK= 0,036 См/см2, EL = -76,5 мВ, ENa = 50 мВ, EK = -90 мВ.
- Отрегулируйте распределение плотности каналов NaV по gNa как 0,05 См/см2 для сомы, 0,5 См/см2 для начального сегмента аксона (AIS) и узла Ранвье (NR) и 0,005 См/см2 для дендритов. Установите gK и gNa как 0 в миелинизированных сегментах.
- Постройте кинетику стробирования ионного канала для NaV и KV , как описано в дополнительном файле 2.
- Введите синаптические токи (Isyn) как сумму всех глутаматергических и ГАМКергических синапсов в одном отсеке. Включите в глутаматергический ток (IGLU) как быстрый ток, опосредованный рецептором AMPA (IAMPA), так и медленный ток, опосредованный рецептором NMDA (INMDA). Включайте только быстрый ток, опосредованный рецепторомГАМК А, в ГАМКергический ток (IГАМК). Предположим, что при каждом пресинаптическом всплеске в синапс выделяется постоянное количество глутамата; Таким образом, активация рецепторов зависит от времени спайка (sAMPA и sNMDA), а общая проводимость рецепторов (gAMPA и gNMDA) отражает количество глутамата, которое высвобождается каждым событием.
- Используйте синаптическую модель, как описано в Дополнительном файле 2.
ПРИМЕЧАНИЕ: Подробное объяснение уравнений см. в дополнительном файле 2 , описывающем уравнения, используемые в модели.
- Получить экспериментально измеренный диаметр сомы и нейритов, а также длину каждого нейритного отсека и характер ветвления из предыдущей литературы46,47. Сведите реальную морфологию нейронов к многокомпартментной модели, разделив клетку на несколько компартментов, что точно сохранит основную ветвящуюся структуру и поддерживает двустороннюю симметрию.
- Установите морфологические (длина и диаметр сегмента; т.е. d_soma: 30 мкм; l_AH: 5 мкм; d_AH_i: 1,5 мкм; d_AH_f: 1,3 мкм; l_AIS: 40 мкм; d_axon: 1 мкм; l_myseg: 100 мкм; l_NR: 2 мкм; l_AxTer: 4 мкм; d_AxTer: 2 мкм; l_approx: 100 мкм; l_apmed: 100 мкм; l_apdis: 200 мкм; d_approx_i: 4 мкм; d_approx_f: 3 мкм; d_apmed : 2 мкм; d_apdis: 2 мкм; l_apLM: 70 мкм; d_apLM: 2 мкм; l_nAcDbasal: 400 μм; d_nAcDbasal: 1,4 мкм; l_nAcDbasal_stem: 20 мкм; d_nAcDbasal_stem: 1,5 мкм) и биофизические параметры (как указано в разделе 2.3.2) для каждого компартмента модели пирамидального нейрона 46,47, как также подробно описано в скрипте Python (Дополнительный файл 3: GABAAvar.py).
- Определите биофизические параметры для модели ГАМКергического синапса путем оценки контрольных измерений дикого типа, полученных на шаге 2.1.1.
- Проектирование топологии модели нейрона и присвоение морфологических и биофизических параметров, что включает в себя уточнение пространственного расположения и взаимосвязей компартментов, на основе ранее полученной морфологической и ветвящейся информации. Назначьте соответствующие морфологические (например, длина и диаметр сегмента) и биофизические параметры (раздел 2.3.2) каждому отсеку модели, как указано в дополнительном файле 3: GABAAvar.py.
- Построение синапсов и инжекция тока
- Создайте пресинаптическую активность с помощью SpikeGeneratorGroup (класс из библиотеки Brian2), как указано в "GABAAvar.py" (дополнительный файл 3). Подключите генератор спайков к целевому отсеку модельного нейрона с помощью класса Synapses для моделирования синаптических связей.
- Установите устойчивый постоянный ток (Iinj) равным 0,85 нА и поместите его в сому, чтобы имитировать подпороговую активность, вызванную базовой нагрузкой ионного тока в данный момент времени, как описано в дополнительном файле 3: GABAAvar.py.
- Чтобы создать записывающие мониторы, записывайте трассировки напряжения из целевых отсеков с помощью StateMonitor.
- Постройте и запустите сеть.
- Постройте сеть с помощью модели нейрона, подключений и мониторов с помощью функции «Сеть».
- Установите временной шаг моделирования с помощью defaultclock.dt (например, 0,01 мс).
- Запустите моделирование в сети с помощью network.run(T*ms), где в примере T установлено как 1 000 мс.
- Исследование влияния миссенс-мутаций рецептора ГАМКА
- Определите влияние каждой миссенс-мутации на кинетику канала с помощью биофизических параметров, собранных на шаге 2.1.1.
- Запустите стимуляцию, изменив эти параметры, и постройте график результатов с помощью "matplotlib.pyplot", как указано в "GABAAvar.py" (Дополнительный файл 3).
- Тестирование комбинаций параметров для анализа изменений в схемах стрельбы и скоростях. Построение графика результатов для сравнения.
Результаты
В этом исследовании используется многоуровневый подход для прогнозирования и характеристики патогенных вариантов в γ2-субъединице рецептора ГАМКА , ключевого компонента патофизиологии эпилепсии. Благодаря использованию прогностических моделей, молекулярного моделирования, эволюционного сохранения, структурного исследования, корреляционного анализа и нейронного моделирования этот подход улучшает классификацию вариантов, что имеет большое значение для исследований эпилепсии и, возможно, для клинического использования. Общее резюме методологии представлено на рисунке 1.
Сравнительная оценка двух соседних мутаций γ2-субъединицы
Основываясь на нашем предположении о том, что прогнозируемые патогенные мутации, примыкающие к эпилептогенным мутациям в субъединицах рецептораГАМК А , могут оказывать аналогичное электрофизиологическое воздействие на функцию канала и поведение нейронов, мы сначала провели краткое исследование взаимосвязи между хорошо известной эпилептогенной мутацией и проксимальной предсказанной мутацией γ2-субъединицы.
Среди вариантов, прогнозируемых как патогенные (Дополнительная таблица S6), в качестве примера выбран A303T (rs1581439874, ClinVar Accession: VCV000663033.6). В дополнение к прогнозированию с помощью ансамблевых моделей, патогенность A303T была подтверждена баллами AlphaMissense (Дополнительный файл 4: Дополнительная таблица S7). A303T находится во втором трансмембранном домене субъединицы γ2 рецептора ГАМКА и расположен рядом с эпилептогенной мутацией P302L40, как показано на рисунке 2. По результатам молекулярного моделирования, замены γ2P302L и γ2A303T привели к образованию аминокислот с более крупными боковыми цепями, как показано на рисунке 3. Оба остатка мутантного и дикого типа являются неполярными при мутации γ2P302L, в то время как у γ2A303T мутантный остаток имеет полярную боковую цепь, а остаток дикого типа имеет неполярную боковую цепь. Как P302, так и Ala303 расположены в интерфейсе взаимодействия субъединиц с субъединицей β3 (наблюдается в 7QNB и 7QNA соответственно). Как P302, так и Ala303 имеют сопоставимую площадь поверхности, доступной для растворителей (SASA). Кроме того, оба остатка на 100% сохраняются на протяжении эволюции позвоночных (Рисунок 4, верхняя панель). Они оба расположены в непосредственной близости от второй трансмембранной области (домена TM2) γ2-субъединицы, как показано желтым цветом на трехмерной реконструкции белка рецептора GABAA (7QNE26, где A303, показанный красным цветом, является первым остатком в этом домене (рис. 4). Основываясь на этих сопоставимых особенностях и используя модель пирамидального нейрона, моделирование проксимальных эпилептогенных мутаций (мутаций), таких как мутация γ2 субъединицы P302L40 , может быть использовано для предварительной характеристики влияния прогнозируемого варианта (γ2A303T) на нейронный ответ. На следующем этапе мы расширили наш анализ на более широкий набор вариантов в субъединицах рецептора ГАМКА .
Варианты кластеризации по структурным и биофизическим параметрам
После сравнительной оценки двух смежных мутаций в предыдущем разделе мы применили систематический подход для оценки возможности выявления общих молекулярных особенностей среди вариантов. Этот этап был направлен на изучение того, возникают ли последовательные закономерности в структурных, физико-химических и биофизических особенностях аминокислот и вариантов, тем самым обеспечивая дальнейшую поддержку нашей первоначальной гипотезы.
Структура данных, использованная в данном исследовании, и ссылки приведены в Дополнительном файле 4: Дополнительная таблица S840, 48,49,50,51,52,53,54,55,56,57,58,59,60, 61,62,63, Дополнительная таблицаS936 и Дополнительная таблицаS1035. Кроме того, корреляции между структурными и биофизическими параметрами были определены для каждой субъединицы и для всех вариантов без различия субъединиц (Дополнительный файл 4: Дополнительная таблица S11, Дополнительная таблица S12, Дополнительная таблица S13, Дополнительная таблица S14 и Дополнительная таблица S15). Информация о структурных параметрах (локализация на альфа-спиралях, спиралях, бета-листах; внеклеточных, внутриклеточных или трансмембранных доменах; выстилка пор, связывание агонистов/аллостериков и белок-белковые взаимодействия) была получена из работы Brünger et al.35. Биофизические параметры были получены в результате электрофизиологических исследований на 293 клетках эмбриональной почки человека (HEK). Значения нормализовались с помощью соответствующих констант времени активации рецептора дикого типа (τr) и времени деактивации (τd).
Поскольку наше исследование основано на идее о том, что варианты аминокислот, примыкающие к функционально идентифицированным мутациям в субъединицах рецептора ГАМКА или находящиеся рядом с ними, могут демонстрировать схожие паттерны электрофизиологических изменений в функции каналов, как это наблюдается в случаях этих мутаций, мы изучили возможность взаимосвязи между структурными, физико-химическими и биофизическими параметрами. Расположение вариантов по отношению к их удалению от центра мембраны и оси пор приведено на рисунках 5 и 6. В этом контексте мы также использовали баллы (Дополнительный файл 4: Дополнительная таблица S7) AlphaMissense37; работает на основе высокоточной модели прогнозирования структуры белка AlphaFold264, которая может использовать основную аминокислотную последовательность в качестве входных данных. AlphaMissense может дать ключ к пониманию структурных аспектов замен одиночных аминокислот. Распределение баллов AlphaMissense для известных (черный) и прогнозируемых (красный) вариантов в зависимости от положения варианта (положение аминокислоты, расстояние до центра мембраны и расстояние до оси пор) субъединиц рецептора ГАМКА (субъединицы α1, β3, γ2, кодируемые генами GABRA1, GABRB3, GABRG2 соответственно) представлено на рисунке 7.
На рисунке 7A-C показано распределение оценки AlphaMissense по аминокислотным позициям, на рисунке 7D-F показано распределение оценки AlphaMissense на нормализованном расстоянии от оси пор, а на рисунке 7G-I показано распределение оценки AlphaMissense по расстоянию от центра мембраны. Корреляционный анализ, представленный на рисунке 7, показал сложность установления базовой взаимосвязи через структурные свойства для прогнозирования исхода для вновь выявленных вариантов. Варианты субъединицы b2 (кодируемые геном GABRB2) были включены в разделы кластеризации и корреляции, чтобы иметь возможность провести более широкий анализ. Тем не менее, в биофизические модели были включены только варианты α1-субъединицы, кодируемой GABRA1 (рис. 7A,D,G), β3-субъединицы, кодируемой GABRB3 (рис. 7B,E,H), и γ2-субъединицы, кодируемой GABRBG2 (рис. 7C,F,I), поскольку модель фокусируется на функции пирамидального нейрона гиппокампа и α1β3γ2-комбинации ГАМКА Субъединицы рецепторов являются наиболее распространенной комбинацией в гиппокампе65. Аналогичным образом, любые варианты α1, β3 или γ2, для которых кинетика канала не изучалась в рецепторе α1β3γ2ГАМК А, также были исключены из моделирования. В настоящем анализе наблюдалась слабая корреляция (Дополнительный рисунок S1 и Дополнительный рисунок S2) между показателями AlphaMissense и биофизическими параметрами (нормализованное время активации и деактивации), полученными в результате эффектов мутаций рецептораГАМК А (Дополнительный файл 4 и Дополнительная таблица S8). Это говорит о том, что мутации, прогнозируемые как патогенные (на основе оценок AlphaMissense), также могут привести к измеримым, потенциально разрушительным изменениям в кинетике рецепторов (например, во времени активации и деактивации). Тем не менее, отсутствие корреляции между позиционными корреляциями на рисунке 7 затрудняет использование оценок AlphaMissense для нашего предположения, которое основано на идее о том, что соседние аминокислоты будут иметь аналогичные последствия для биофизических характеристик.
Распределения нормированного расстояния до оси пор в зависимости от кинетики активации и дезактивации известных вариантов показаны на рисунках 8 и 9. Существует слабая корреляция для γ2-субъединицы (рис. 8C), что позволяет предположить, что наша гипотеза, основанная на предположении, что соседние аминокислоты будут иметь сходные последствия, может быть верна в некоторых областях, в частности, в непосредственной близости от поровой области рецепторного канала, домена TM2. Эта область примыкает к нашей эталонной эпилептогенной мутации (рис. 2 и рис. 4; γ2P302), что делает ее относительно хорошим кандидатом для нейронного моделирования. Исходя из этого, можно сделать грубую оценку эффектов смежных предсказанных мутаций, таких как γ2A303T (Рисунок 2 и Рисунок 4). Наши результаты, представленные здесь, учитывают только измерения на α1β3γ2; Таким образом, варианты, оцененные в нашей модели, были ограничены вариантами, приведенными в Дополнительном файле 4:Дополнительная таблица S16.
Влияние мутаций на опосредованное рецептором ГАМК А ингибирование возбуждения пирамидальных нейронов CA1
Влияние мутаций на ингибирование, опосредованное рецептором ГАМКА, продемонстрировано на модели пирамидального нейрона CA1, основанной на многокомпонентной проводимости. Влияние миссенс-вариантов рецептора ГАМКА на функцию пирамидального нейрона гиппокампа может быть изучено с помощью ГАМКергического шунтирования апикальных входов к нейрону из проекций пирамидных нейронов CA3 и энторинальной коры (EC) III. Другими словами, одним из способов моделирования активности рецепторов ГАМКА является принятие контекста, в котором моделирование представляет собой реалистичные предположения о физиологическом значении рецепторов, таких как торможение шунтирования, один из механизмов ГАМКергического ингибирования. Пирамидальные нейроны гиппокампа CA1, как правило, в их апикальных дендритах, имеют рецепторы GABAA в этих зонах, на которые нацелены проекции от нейронов CA3 и EC III. Таким образом, такое расположение подходит для моделирования. Этот исследовательский вопрос требует проектирования ввода с различными задержками и интенсивностью. Таким образом, три различных глутаматергических синапса (GluS1/2/3) были размещены на дистальных апикальных, медиальных апикальных и базальных дендритах, как показано на рисунке 10, и они были активированы последовательно. Для оценки влияния синаптических входов амплитуда постоянного тока должна оставаться ниже минимального порога запуска спайка (Iinj < Imin). Модель пирамидального нейрона с рецептором дикого типа или мутантным рецептором ГАМКА была инициирована инжекцией постоянного тока 0,85 нА в сому. Затем ГАМКергический синапс был помещен в сому. Пресинаптическая активность, имитируемая генератором спайков, была инициирована сначала в дистальном апикальном дендрите. Синаптические входы на медиальных апикальных и базальных дендритах были задержаны на 25 мс и 50 мс соответственно. ГАМКергический синапс активировался с задержкой 40 мс. Интенсивность ГАМКергического ингибирования была отрегулирована таким образом, чтобы ингибировалась вся цепочка спайков, за исключением первого спайка. Затем влияние вариантов исследуется в этих условиях путем варьированияроста τ,деактивации τ и gГАМК А.
Параметры для рецепторов дикого типа и мутантных рецепторов были получены из коллекции, описанной в пункте 2.1.1 протокола, специально для рецепторов, состоящих из α1β3γ2, который является наиболее распространенным составом субъединиц в пирамидальных нейронах гиппокампа65. Распределение параметров приведено в Дополнительном файле 4: Дополнительная таблица S16.
Мутация каждой субъединицы была протестирована на одиночных, двойных и тройных глутаматергических синапсов. При простом подходе влияние мутаций можно оценить по частоте срабатывания и характеру. Средние значенияΔt ISI и стандартное отклонение также могут быть оценены для дальнейшей оценки изменений в картине возбуждения, где ΔtISI представляет собой изменение межспайкового интервала. Результаты для каждого случая представлены в виде скоростей срабатывания и ΔtISI (среднее и стандартное отклонение) в Дополнительном файле 4: Дополнительной таблице S17 и дополнительном рисунке S3. Скачковые цепи и кривые напряжения для вариантов, которые изменили схемы возбуждения, приведены на рисунках 11, 12 и 13.
При активации одиночного (GluS1) и тройного (GluS1-2-3) глутаматергического синапса мутации, изменяющие реакцию нейронов, были только β3мутациями N110D и γ2K328M. В случае однократного глутаматергического входа β3N110D приводил к нарушению торможения, и паттерн возбуждения был заблокирован на цепочке глутаматергических шипов после4-го пресинаптического спайка с небольшой задержкой (рис. 11). γ2K328M также нарушил торможение, хотя и только в районе5-го пресинаптического спайка, и внес большую задержку постсинаптического спайка по сравнению с β3N110D (рис. 11). В случае активации GluS1-2-3 (рис. 13) ответ был сходным между мутациями β3N110D и γ2K328M. Оба мутанта показали паттерн срабатывания, при котором почти все накопленные пресинаптические шипы были обнаружены и вызвали ответную реакцию. В обоих случаях нейронные модели активировались парой спайков в ответ на пресинаптическую активность.
Двойная активация глутаматергического синапса дала отличные результаты по сравнению с двумя другими настройками (рис. 12). В этом случае две мутации на субъединице b3 рецептора ГАМКА (β3N110D и β3T288N) и две мутации на субъединице γ2 рецептора ГАМКА (γ2P302L и γ2K328M) нарушили ингибирование ГАМК. Нейронная модель с мутантом γ2P302L сработала почти синхронно с GluS2, что, скорее всего, было отсроченным ответом на GluS1 с примерно такой же задержкой пресинаптических спайков между GluS1-2. Мутация β3T288N привела к аналогичному результату, при этом различие второго шипа все еще синхронизировано с GluS2. Модель нейрона с мутантом N110D β3реагировала почти на все накопленные глутаматергические входы, за исключением первых двух пресинаптических шипов GluS1/2, которые были введены с более коротким ΔtISI. Схема срабатывания γ2K328M снова была такой же, как у β3N110D, с отсутствием второго и третьего пресинаптических шипов.
Эти результаты демонстрируют различные эффекты мутаций b3-субъединицы (кодируемой геном GABRB3) и γ2-субъединицы (кодируемой GABRG2) на активность пирамидальных нейронов гиппокампа. Интересно, что мутации β3L170R, β3A305V, β3E180G, β3D120N, β3Y302C иγ 2R82Q не привели к каким-либо изменениям в нейронной активности. Наиболее серьезное нарушение при ингибировании было у β3N110D и γ2K328M, оба из которых имели значительно более низкуюдеактивацию τ и более высокийподъем τ. Наш предварительный анализ также показал, что измененияуровня τ или gГАМК А сами по себе недостаточны для ослабления торможения (данные не показаны). Можно утверждать, что мутации, которые приводят к значительному снижениюдеактивации τ вместе с повышением уровня τ, приводят к более значительному ухудшению ГАМКергического торможения.
В случае, когда все возбуждающие входы должны быть подавлены, любая мутация, приводящая к возбуждению, приведет к аномальным и неспецифическим нейронным реакциям, которые могут быть преувеличены в нейронной цепи, состоящей из нейронов с одинаковыми мутациями. Баланс возбуждения/торможения в нейронной сети может быть значительно затронут возникающей в результате нарушением тормозной обратной связи, которая является важнейшим компонентом любой сетевой активности.
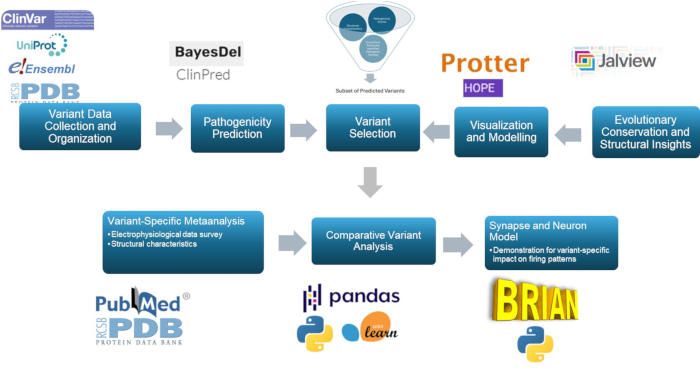
Рисунок 1: Обзор прогнозирования и анализа эффектов вариантов для клинических и исследовательских целей, с особым акцентом на анализ in silico и моделирование нейронных реакций. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
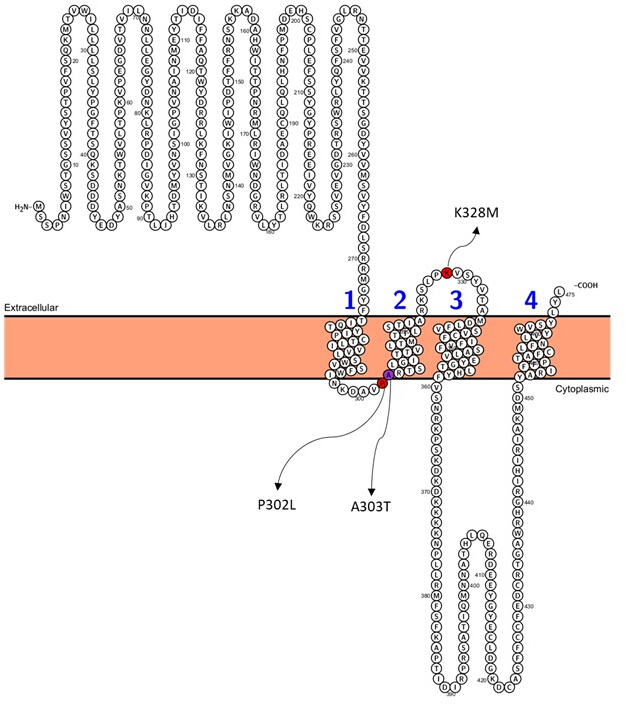
Рисунок 2: Положение γ2A303T и мутации отдельных пациентов;γ2P302L и γ2K328L используются для нейронного моделирования. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
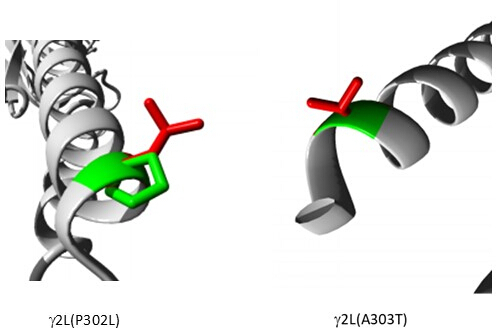
Рисунок 3: Сравнительное моделирование мутации пациента γ2P302L и соседнего варианта γ2L(A303T), прогнозируемого как патогенный. В обеих моделях зеленый цвет представляет дикий тип, а красный — мутантные остатки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
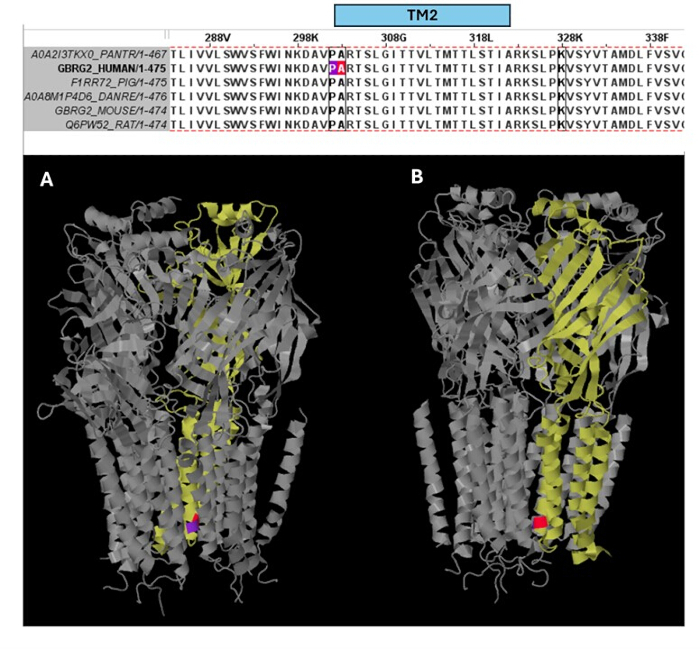
Рисунок 4: Множественное выравнивание последовательностей и структурное понимание. На верхней панели показано эволюционное сохранение остатков в положении мутации пациента (P302L) (фиолетовый) на краю TM2 и патогенного варианта A303T (красный цвет) в начале TM2 γ2 субъединицы. На нижней панели показана визуализация этих консервативных остатков в (A) трехмерной структуре рецептора ГАМКA (7QNE), где субъединица γ2 (цепочка C в 7QNE) показана желтым цветом и под разными углами (A, B). Сокращение: TM2 = второй трансмембранный домен. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
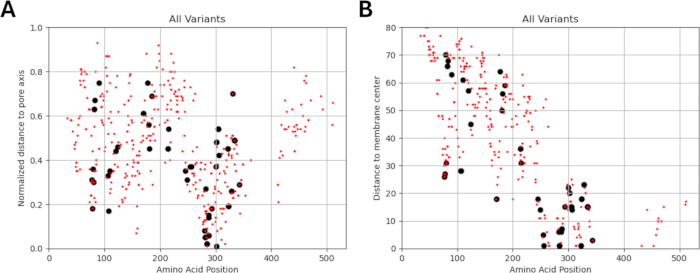
Рисунок 5: Локализация всех включенных вариантов. Показано расположение известных (черный) и прогнозируемых (красный) вариантов относительно их (А) нормированного расстояния от оси пор и (В) расстояния от центра мембраны. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
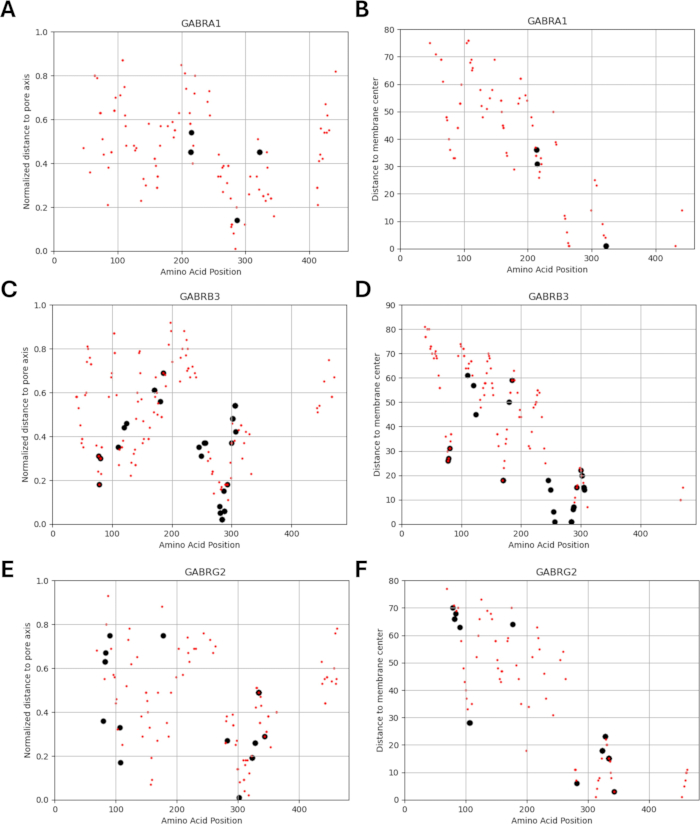
Рисунок 6: Локализация вариантов для каждой субъединицы. Показано расположение известных (черный) и прогнозируемых (красный) вариантов относительно их нормированного расстояния (A, C, E) от оси пор и расстояния (B, D, F) от центра мембраны. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
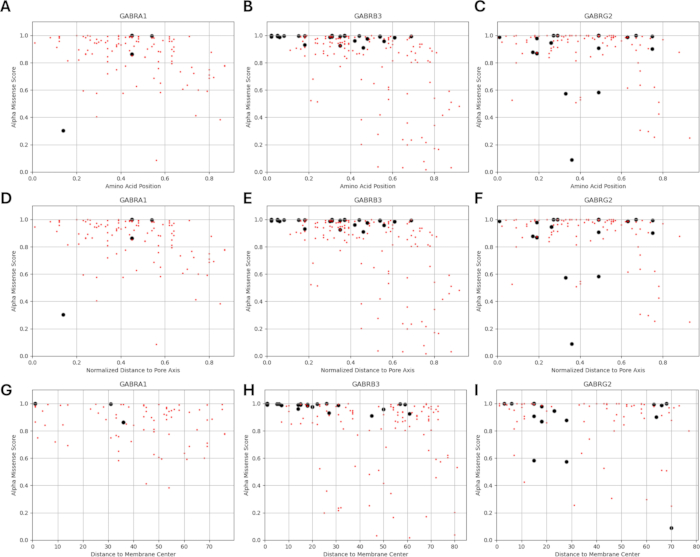
Рисунок 7: Распределение оценки AlphaMissense по местоположению варианта. (А-С) Распределение баллов AlphaMissense по положению аминокислот, нормализованное расстояние (D-F) от оси пор и расстояние (G-I) от центра мембраны приведены для известных (черный) и прогнозируемых (красный) вариантов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
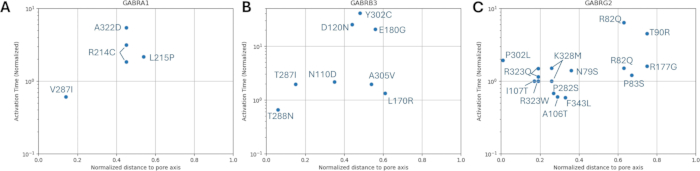
Рисунок 8: Нормализованное время активации рецепторов ГАМКА с мутациями в субъединице α1 (GABRA1), субъединице β3 (GABRB3) и субъединице γ2 (GABRG2). Отображены экспериментально полученные константы времени активации относительно нормированного расстояния от оси пор для каждой мутации на субъединицах (A) α1, (B) β3 и (C) γ2. Значения нормализовались с учетом соответствующего времени активации рецептора дикого типа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
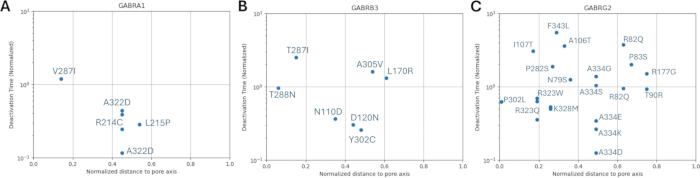
Рисунок 9: Нормализованное время деактивации рецепторов ГАМКА с мутациями в субъединице α1 (GABRA1) рецептора ГАМК А, β3 (GABRB3) субъединице рецептора ГАМКА и субъединице γ2 (GABRG2). Отображены экспериментально полученные константы времени дезактивации по отношению к нормированному расстоянию от оси пор для каждой мутации на субъединицах (A) α1, (B) β3 и (C) γ2. Значения нормализовались с учетом соответствующего времени деактивации рецептора дикого типа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 10: Модель пирамидального нейрона CA1. Модельный нейрон состоит из: (1) сомы, (2) апикального дендрита с проксимальным, медиальным и дистальным компартментами, заканчивающегося двумя ветвями в lamina molecularis, (3) двух симметрично составленных базальных дендритов, которые разветвляются на две секции после короткого базального стебля дендрита, и (4) аксона, который начинается с конического бугорка аксона, за которым следует цилиндрический начальный сегмент аксона, миелинизированные сегменты и узлы Ранвье, заканчивающиеся сферическим окончанием аксона. Зелеными треугольниками обозначено расположение глутаматергических синапсов, а красным треугольником обозначен ГАМКергический синапс, расположенный в соме. Масштабная линейка = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
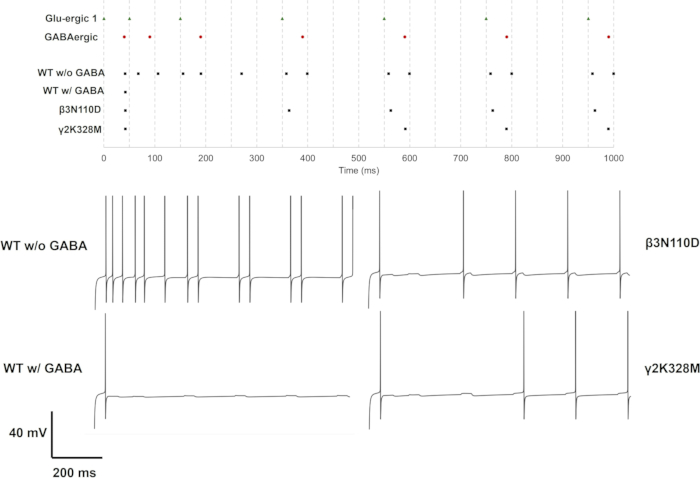
Рисунок 11: Схема обжига только с активностью GluS1. Спайковые тренировки для пресинаптических нейронов (GluS1 (зеленый треугольник) и GABergic (красный круг)) и постсинаптических нейронов с рецепторами дикого типа или мутантными ГАМКА (черный квадрат) приведены на верхней панели. Индивидуальные трассы напряжения для нейронов с рецептором ГАМК А дикого типа с ГАМКА или без него, а также для нейронов с мутантными ГАМКА рецепторами с ГАМКергическим торможением отображаются на нижних панелях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 12: Схема обжига только с активностью GluS1 и GluS2. Спайковые тренировки для пресинаптических нейронов (GluS1/2 (зеленый треугольник) и ГАМКергический (красный круг)) и постсинаптических нейронов с рецепторами дикого типа или мутантными ГАМКА (черный квадрат) приведены на верхней панели. Индивидуальные трассы напряжения для нейронов с рецептором ГАМК А дикого типа с ГАМКА или без него, а также для нейронов с мутантными ГАМКА рецепторами с ГАМКергическим торможением отображаются на нижних панелях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
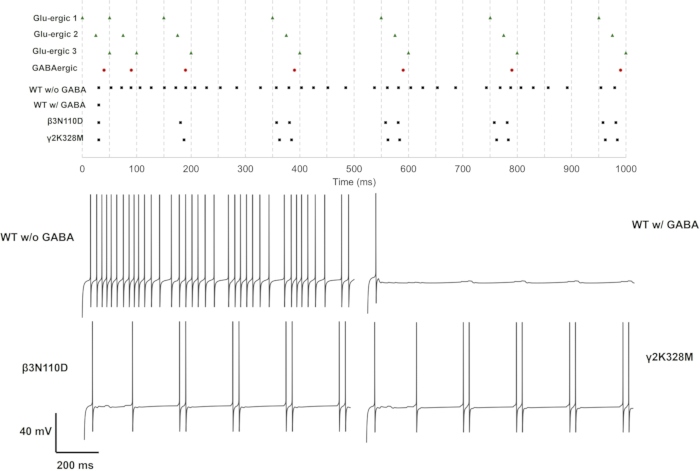
Рисунок 13: Схема обжига только с активностью GluS1, GluS2 и GluS3. Спайковые линии для пресинаптических нейронов (GluS1/2/3 (зеленый треугольник) и ГАМКергический (красный круг) и постсинаптических нейронов с рецепторами дикого типа или мутантными ГАМКА (черный квадрат) приведены на верхней панели. Индивидуальные трассы напряжения для нейронов с рецептором ГАМК А дикого типа с ГАМКА или без него, а также для нейронов с мутантными ГАМКА рецепторами с ГАМКергическим торможением отображаются на нижних панелях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный рисунок S1: Распределение баллов AlphaMissense и биофизических параметров (нормализованное время деактивации; Нормализованный τd) мутаций субъединицы рецептора ГАМКА , отобранных в настоящем исследовании. Также см. Дополнительный файл 4: Дополнительная таблица 8. Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
Дополнительный рисунок S2: Распределение баллов AlphaMissense и биофизических параметров (нормализованное время активации; Нормализованный τr) мутаций субъединицы рецептораГАМК А , отобранных в настоящем исследовании. Также см. Дополнительный файл 4: Дополнительная таблица 8. Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
Дополнительный рисунок S3: Межспайковые интервалы для нейронного ответа с рецепторами дикого типа и мутантными рецепторами ГАМКА . Самый верхний график показывает межспайковые временные интервалы для одиночного глутаматергического входа. На среднем графике показаны два, а на самом нижнем — три глутаматергических синапса, активных одновременно. Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
Дополнительный файл 1: Файл "Data_GABAA. R", требуется для запуска в R для форматирования данных. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 2: Уравнения, используемые при проектировании модели на основе проводимости. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 3: GABAAvar.py требуется для запуска в Brian2 для Neural Simulation. Файл содержит коды на языке Python для модели многокомпонентного нейрона на основе Brian2 (функция: CA1_Pyr), уравнения для нейронов и синаптических моделей на основе проводимости (функция: model_eqns, syn_eqns) и начальные параметры (функции: biophys_param, morpho_param, syn_param). Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 4: Zip-папка, содержащая все дополнительные таблицы. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительная таблица S1: Миссенс-варианты неизвестного значения в гене GABRG2 , загруженные из ClinVar в виде файла .txt и впоследствии сохраненные как "data.xlxs". Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S2: Идентификаторы последовательностей, использованных в исследовании, референсный транскрипт интересующего гена (NCBI Ref. seq.) и другие соответствующие идентификаторы в различных базах данных). Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S3: Положение структурных и функциональных областей. Положения специфических областей белка γ2 субъединицы (NCBI Reference Sequence: NP_944494.1), кодируемых референсным транскриптом (NM_198904.4) Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S4: Содержимое файла "data1.xlxs", который представляет данные ClinVar GABRG2 , включающий только столбцы: "GRCh38Chromosome", "GRCh38Location", "Name", "Protein change". Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S5: Содержимое файла "data1_output.xlsx", содержащего требуемое форматирование миссенс-вариантов данных GABRG2 , которые должны быть загружены на сервер dbNSFP для прогнозирования вариационных эффектов. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S6: Содержимое файла "data2.xlsx", содержащего выходные данные сервера dbNSFP для прогнозирования эффекта вариаций для неизвестных миссенс-вариантов GABRG2. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S7: Оценка AlphaMissense для вариантов субъединиц рецептора ГАМКА . Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S8: Биофизические характеристики вариантов. Значения биофизических параметров были получены из предыдущих исследований с электрофизиологическими экспериментами. Варианты обозначаются типом "S" (замещение), в то время как параметры рецептора дикого типа указываются для каждой замены и обозначаются буквой "C" (контроль). τd : постоянная времени деактивации, POpen : вероятность открытия, gGABA — проводимость рецептора, Imax — максимальный ток, τr — постоянная времени активации. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S9: Физико-химические характеристики вариантов. Ранее идентифицированные варианты с биофизическими параметрами обозначаются типом «S» (замещение), а прогнозируемые варианты – «P». H: Изменение гидрофобности, VSC: Изменение объема боковой цепи, P1: Изменение полярности, P2: Изменение поляризации, SASA: Изменение поверхности, доступной растворителю, NCISC: Изменение индекса чистого заряда. Значения получены для каждой исходной аминокислоты и варианта из Guo et al.36 , и изменение каждого параметра оценивается как данное. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S10: Структурные характеристики вариантов. Ранее идентифицированные варианты с биофизическими параметрами обозначаются типом «S» (замещение), а прогнозируемые варианты — «P». Локализация варианта в домене обозначается как 1, в противном случае 0. Все значения взяты из Brünger et al.35. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S11: Корреляции структурных и биофизических параметров для всех известных вариантов. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S12: Структурные, физико-химические и биофизические корреляции параметров для известных вариантов GABRA1 . Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S13: Структурные, физико-химические и биофизические корреляции параметров для известных вариантов GABRB2 . Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S14: Структурные, физико-химические и биофизические корреляции параметров для известных вариантов GABRB3 . Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S15: Структурные, физико-химические и биофизические корреляции параметров для известных вариантов GABRG2 . Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S16: Биофизические параметры рецепторов дикого типа и мутантных α1β3γ2 ГАМКА. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительная таблица S17: Частота возбуждения и межспайковые интервалы в ответ на одинарные, двойные или тройные глутаматергические синапсы с рецепторами дикого типа и мутантными ГАМКА . Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Применяя комбинацию вычислительной генетики, молекулярного моделирования и нейронного моделирования, подход, представленный в этой статье, может улучшить классификацию вариантов рецептора ГАМКА, предлагая ценные идеи как для исследований эпилепсии, так и для клинического применения. Представлен всесторонний анализ для идентификации и приоритизации прогнозируемых патогенных мутаций, который расширен в рамки, которые потенциально устраняют разрыв между влиянием вариантов на белок и клеточный фенотип. Оценка влияния эпилептогенной активности рецептора ГАМКА на моделирование пирамидального нейрона гиппокампа позволяет воспроизвести in vitro фенотип, связанный с дисфункцией рецептора ГАМКА, и продемонстрировать изменение ответа одного нейрона в корне дисфункции сети. На основе этих симуляций нейронных реакций, генерируемых эпилептогенными мутациями, была изучена грубая оценка функциональных эффектов структурно проксимальных предсказанных мутаций. Прогнозы влияния предсказанных мутаций на кинетику канала требуют тщательного анализа с известными наборами вариантов. Сравнительный анализ, подобный представленному в данной статье, и моделирование нейронной активности дают критически важную информацию для дальнейшего создания и совершенствования прогностических моделей, фокусирующихся на вариативном влиянии на функцию белка и нейронную патологию. Кроме того, наша методология может быть использована для отбора и приоритизации наиболее патогенных вариантов среди неизвестных вариантов для изучения эффектов вариантов, связанных с нарушениями развития нервной системы, связанными с рецептором ГАМКА. Например, субъединицы рецепторов, помеченные флуоресцентными зондами 66,67,68,69,70 и несущие предсказанные мутации, могут экспрессироваться in vitro для изучения их транспорта, экспрессии клеточной поверхности и нейрофизиологии. Кроме того, животные модели, такие как C. elegans, могут быть рассмотрены для подтверждения эффектов предсказанных мутаций. Например, редактирование гена CRISPR-Cas9 было использовано для создания делеции unc-49, рецептора GABAA C. elegans, тем самым генерируя гомозиготные мутации, связанные с эпилепсией, в unc-49 или субъединицах человеческого рецептора GABAA 71.
В целом, классификация вариантов выигрывает от использования нескольких уровней вычислительных доказательств, как это рекомендовано в ACMG-AMP12. Такой подход повышает надежность классификации вариантов за счет интеграции различных прогностических инструментов и источников данных, что в конечном итоге повышает точность клинических оценок и улучшает общий процесс принятия решений в геномной диагностике. В нашей методологии использование ансамблевых предикторов, которые объединяют прогнозы нескольких инструментов, тем самым удовлетворяя потребность в нескольких линиях вычислительных доказательств и устраняя необходимость использования разных инструментов по отдельности, является преимуществом. Этот подход также решает проблему обработки разрозненных выходных данных от отдельных инструментов, тем самым оптимизируя процесс прогнозирования и повышая эффективность. Тем не менее, нет никаких гарантий в отношении прогностической точности геноцентричного или вариантно-специфического анализа. Это приводит к выводу о том, что геноцентрические или специфичные для вариантов прогнозы должны выполняться в конкретных условиях, скорректированных на конкретные контексты и цели 15,72,73,74. Для клинических вмешательств это потребовало бы оценки прогностической точности инструментов in silico для конкретного гена или подмножества генов в контексте данного заболевания, часто синдивидуальной оптимизацией. Однако оценка прогностической точности часто ограничена отсутствием достаточного количества вариантов, что может повлиять на достоверность оценки точности.
В литературе доступны различные инструменты, точность которых проверена и подтверждена в наборах данных14. Однако эти результаты точности, основанные на больших наборах данных, не обязательно отражаются на прогнозировании нескольких неизвестных вариантов для данного гена. В этом контексте накопленная литература предполагает, что ансамблевые предикторы, которые компилируют и вычисляют результаты отдельных предикторов, как известно, работают лучше, чем согласованность отдельных предикторов 33,76,77,78, и, таким образом, в настоящем исследовании мы решили использовать ансамблевые предикторы, а именно BayesDEL 33 и ClinPred32, специально из-за их превосходной производительности 32. 34 BayesDEL был сравнительно оценен на 4094 миссенс-варианта в клинически значимых генах, включая гены, кодирующие трансмембранные белки, такие как потенциал-зависимый альфа-субъединица 5 натриевого канала (SCN5A), и показал превосходную производительность33. В нашем протоколе прогнозирования вариантов эффектов в качестве первого шага мы рассмотрели консенсус двух ансамблевых предикторов (BayesDEL и ClinPred). AlphaMissense37, модель глубокого обучения, разработанная Google DeepMind, является расширением AlphaFold 64,79, таким образом, используя возможности высокоточного прогнозирования структуры белка. Когда мы сравнили первоначальные результаты прогнозирования ансамблевых моделей (BayesDEL и ClinPred, как описано в нашем протоколе на шаге 1.3) с результатами AlphaMissense, прогнозы частично согласовывались друг с другом (Дополнительный файл 4: Дополнительная таблица S15) и не полностью совпадали с предсказаниями ансамблевых моделей (BayesDEL и ClinPred), которые достигли консенсуса патогенных или связанных с болезнями. показаны в виде розовых строк (Дополнительный файл 4: Дополнительная таблица S15). Тем не менее, неизвестные варианты (L81F, A303T и V329F) рядом с мутациями GABRG2 R82Q, P302L и K328M, которые мы использовали в нашей нейронной модели и которые были предсказаны как патогенные как ClinPred и BayesDEL, также были предсказаны как патогенные AlphaMissense, как показано желтым выделением (Дополнительный файл 4: Дополнительная таблица S15).
Поскольку AlphaMissense29 использует предсказание последовательности и структурного контекста, в нашем исследовании мы также хотели увидеть, существует ли какая-либо связь между оценками AlphaMissense и местами мутации рецептора ГАМКА , основанными на их расстоянии от центра мембраны и оси пор. Наша гипотеза основана на идее о том, что функциональное воздействие вариантов аминокислот, прилегающих или проксимальных к функционально идентифицированным мутациям субъединиц рецептора ГАМКА , может демонстрировать сходные паттерны физико-химических изменений функции канала, наблюдаемые в случаях мутаций. Корреляция между позициями мутации субъединицы рецептораГАМК А и оценками AlphaMissense поможет нам определить пригодную для использования связь для построения основы для нашей гипотезы, позволяющей предсказывать функциональные последствия новых миссенс-вариантов в субъединицах рецептора ГАМКА . Тем не менее, баллы AlphaMissense не предсказывали изменения этих биофизических параметров (рис. 7). Важно отметить, что ограниченный размер выборки в нашем анализе затрудняет получение окончательных выводов. Тем не менее, наш анализ показал, что показатели AlphaMissense не коррелируют со структурными параметрами рецепторов ГАМКА . Отсутствие четкой позиционной корреляции (например, между позициями мутаций и оценками AlphaMissense) ставит под сомнение обоснованность нашего предположения. Если бы соседние остатки действительно имели аналогичные эффекты, мы ожидали бы увидеть более четкую корреляцию. Поскольку это не так, это ослабляет возможность использовать оценки AlphaMissense в качестве надежного инструмента для проверки нашего предположения.
Интересно, что в нашем исследовании мы обнаружили слабую корреляцию между расстоянием от варианта до оси пор и нормализованным временем активации канала для мутантов гена GABRG2 . Таким образом, наше предварительное предположение о том, что соседние аминокислоты будут иметь аналогичные последствия, может быть справедливым в некоторых областях канала, таких как области в порах или в ключевых участках, участвующих в гейтировании, но может быть не столь однозначным в других областях. Небольшой набор данных ограничивает возможность разглядеть эту изменчивость, но будущие данные или более детальный структурный анализ могут помочь уточнить этот аспект нашей гипотезы. Моделирование молекулярной динамики80 может служить мощным дополнительным подходом к дальнейшему исследованию этих предварительных результатов, особенно в контексте сравнительной оценки двух смежных мутаций γ2-субъединицы, а именно эпилептогенной мутации γ2P302L40 и проксимальной предсказанной мутации γ2A303T (rs1581439874), выполненной в нашем исследовании. В будущем этот подход может позволить более точно оценить влияние неизвестного варианта на клеточный фенотип, особенно при интеграции с нейронным моделированием, представленным в нашем исследовании.
Кроме того, будет интересно изучить, могут ли структурные и физико-химические свойства субъединиц рецептораГАМК А вместе с другими особенностями быть использованы для обучения мощных моделей машинного обучения для функционального прогнозирования новых эффектов вариантов на канал, нейрон, сеть и фенотип заболевания. С появлением подходов к автоматизированному машинному обучению мы достигли точки, когда врачи и ученые могут также разрабатывать свои собственные модели в более демократичнойсреде. Таким образом, интеграция этих технологий в клиническую практику потенциально может оптимизировать процесс, сделав персонализированную медицину более доступной и снизив зависимость от узкоспециализированных знаний для анализа функциональных вариантов. В этом контексте наш подход дает представление о структурной и функциональной динамике рецептора, потенциально помогая в будущих исследованиях для функционального прогнозирования вариационного эффекта.
Несмотря на достигнутый в настоящее время прогресс в прогнозировании структуры белка и прорыв, представленный AlphaFold64, точное прогнозирование влияния мутаций и функции белка остается сложной задачей из-за отсутствия данных, необходимых для обучения модели79. Для прогнозирования вариационного эффекта AlphaMissense демонстрирует более высокую производительность по сравнению с подмножеством прогностических моделей, но ансамблевые предикторы BayesDEL25 и ClinPred24, которые использовались в нашем исследовании, не были включены в это сравнение29. Важно отметить, что в нашем исследовании инструменты in silico BayesDEL, ClinPred и AlphaMissense использовались для разных целей. Ансамблевые предикторы, BayesDEL и ClinPred, в основном использовались для прогнозирования патогенности, в то время как AlphaMissense был специально использован для изучения взаимосвязи между его оценками и известными данными о влиянии мутаций в γ2-субъединице. В частности, наша гипотеза предполагает, что прогнозируемые патогенные варианты, особенно те, которые расположены рядом или рядом с функционально идентифицированными мутациями в субъединицах рецептораГАМК А , будут демонстрировать биофизические параметры, аналогичные тем, которые наблюдаются при функционально охарактеризованных мутациях. Чтобы исследовать это, мы выбрали AlphaMissense из-за того, что он работает на основе высокоточной модели AlphaFold264 , которая использует базовую пептидную последовательность для прогнозирования последствий замен одной аминокислоты.
Следовательно, основным ограничением нашего исследования в первую очередь является ограниченная доступность экспериментальных данных. Например, наша нейронная модель основана на экспрессии данных, полученных из комбинации α1β3γ2 субъединиц рецепторов ГАМКА , что по своей сути ограничивает мутации, изучаемые в литературе, субъединицами, экспрессируемыми как часть этой специфической комбинации рецепторов. Кроме того, мы полагались на электрофизиологические данные, полученные исключительно из экспрессии этих субъединиц в клетках HEK, что еще больше сужает объем доступных данных в литературе. Использование нами нейронного моделирования для оценки эффектов неизвестных вариантов предполагает, что неизвестные варианты (прогнозируемые как патогенные в нашем рабочем процессе), расположенные в непосредственной близости от известных мутаций, будут демонстрировать аналогичные паттерны в параметрах кинетики канала или физико-химических свойствах эффектов мутаций, описанных в литературе. Это предположение в сочетании с потребностью в электрофизиологических данных для специфических рецепторных сборок в клетках HEK293 сокращает объем экспериментальных данных, доступных для моделирования. В результате этих ограничений имеющиеся данные позволили нам смоделировать лишь ограниченное число вариантов в α1β3γ2 субъединицах. Тем не менее, обучение нейронной модели для различных сборок субъединиц, таких как комбинации субъединиц α1β2γ2, α1β2δ или комбинации субъединиц α4β3δ, которые имеют специфичные для субъединиц клеточные, цепные и сетевые значения, вероятно, покажет более широкую применимость к различным типам эпилепсии и нарушениям развития нервной системы. В будущем, с увеличением доступных электрофизиологических данных и исследованиями, сосредоточенными на мутациях в четко определенных рецепторных сборках и конкретных типах клеток, может стать возможным повысить обобщаемость и точность нашего подхода.
Модели нейронов, основанные на многокомпонентной проводимости, являются мощным инструментом для прогнозирования функциональной значимости рецепторных вариантов ответа одного нейрона. Этот инструмент обеспечивает гибкое определение как клеточных/синаптических параметров, так и их расположения для проверки любого конкретного вопроса. Простые генераторы спайков, используемые в этом протоколе, могут быть заменены другими моделями нейронов для изучения активности микросхем. Критический шаг протокола также является самым ограничивающим: определение любого варианта рецептора с точки зрения измененной кинетики канала. Требуемая информация в идеале должна быть получена в результате электрофизиологических исследований с пластырем; Тем не менее, вычислительный анализ аминокислотных замен с прогнозируемой клинической значимостью и сравнения с известными заменами также могут дать некоторое понимание. Наше исследование и описанный протокол включают использование моделирования нейронной активности не в качестве прогностического инструмента, а скорее в качестве инструмента для изучения эффектов мутаций для поддержки более широкого взгляда на последствия измененных биофизических характеристик рецептора ГАМКА на активность одного нейрона. Зависимость от экспериментальных данных в нейронном моделировании является важным ограничением нашего подхода, который может выиграть от передового молекулярного моделирования для преодоления разрыва между структурой и функцией.
В нашем протоколе определенные шаги должны быть критически оценены. Во-первых, выбор прогностической модели, используемой в первой части нашего протокола, может иметь решающее значение. Выбор инструментов in silico зависит от нескольких факторов, в том числе от создания достаточного количества вычислительных доказательств для мощногопрогноза. Ансамблевые предикторы, интегрирующие анализ нескольких прогностических алгоритмов, лучше соответствуют данной рекомендации, поэтому предпочтительнее по сравнению с отдельными предикторами. Существуют различные предикторы, и их точность обычно проверяется на больших наборах данных, что не обязательно гарантирует точность прогностической модели, используемой для неизвестных вариантов эффектов, расположенных в конкретном гене. Это компенсируется использованием двух ансамблевых моделей, которые собирают и вычисляют результаты прогнозирования от нескольких предикторов. Кроме того, пороговые значения прогностических моделей могут быть скорректированы для повышения специфичности, если цель состоит в первую очередь в выявлении наиболее патогенных вариантов. Установление соответствующих пороговых значений важно для обеспечения баланса между чувствительностью и специфичностью и обеспечения точной классификации вариантов. В нашем исследовании мы использовали пороговые значения по умолчанию. В частности, мы не изменили пороговое значение в пользу выявления вариантов, которые с большей вероятностью могут быть патогенными, поскольку это уменьшило бы объем вариантов, подлежащих изучению на нескольких уровнях нашего анализа, как описано в нашем рабочем процессе. Также важно отметить, что при выборе структурных данных для трехмерной реконструкции интересующего белка возникает необходимость в предварительном обзоре структурных данных в литературе. Структурное изучение рецепторов ГАМКА в последнее время набрало обороты благодаря тщательным структурным исследованиям, в которых сообщается о трехмерной структуре различных рецепторных сборок в различных условиях 26,27,82,83,84,85. Учитывая доступность этих данных, в нашем исследовании мы сосредоточились на экспериментально определенных структурах для реконструкции структурных данных. Тем не менее, предсказание AlphaFold64 может быть предпочтительным для анализа других белков, которым не хватает таких экспериментально определенных данных. Для получения структурных данных, полученных в результате экспериментальных исследований, важно обратить внимание на нумерацию аминокислот. Нумерация аминокислот PDB может отличаться от нумерации UniProt, поскольку первая может не включать сигнальный пептид, который удаляется во время созревания белка. Кроме того, химерные белки, экспрессируемые в экспериментальной системе, могут вызывать расхождения. В этом случае попарное выравнивание интересующей последовательности с последовательностью, полученной из структурных данных, поможет сохранить согласованность. В литературе структурные данные белка γ2 субъединицы основаны на различных методах, в том числе экспериментальных, таких как электронная микроскопия (ЭМ) и метод высокоточного прогнозирования AlphaFold. Если экспериментальный метод не покрывает желаемую последовательность полностью с высоким разрешением, можно использовать предсказания AlphaFold. В настоящем исследовании была выбрана структура 7QNE26, так как она соответствует криогенной электронно-микроскопической структуре полноразмерного синаптического рецептора человека α1β3γ2 ГАМКА. Это в точности представляет собой комбинацию полноразмерных субъединиц, которая была в центре внимания настоящего исследования.
Кроме того, для сравнительного анализа следует отдавать предпочтение использованию нормализованных параметров кинетики канала, так как значения этих параметров могут варьироваться в зависимости от состава рецепторной субъединицы и экспериментальных условий. Например,подъем τ идеактивация τ должны быть определены по x-кратным изменениям относительно контрольных значений дикого типа. На этапе протокола 2.5 для небольшого числа известных вариантов может быть предпочтительным параметрический или категориальный корреляционный анализ и определение значений rho и p. В идеале ожидается, что такие методы, как анализ главных компонент, дадут более точные соотношения, но потребуют большего количества выборок.
Среда моделирования может быть изменена. В этом исследовании предпочтение было отдано Brian2 по следующим причинам: класс пространственных нейронов в Brian2 предоставляет ценный инструмент для моделирования нейронной активности. Брайан2 имеет значительное преимущество в использовании дифференциальных уравнений для описания непрерывной динамики и обновления операторов для дискретных событий, вместо того, чтобы полагаться на предопределенные модели «черного ящика», и это приводит к превосходной читаемости и адаптивности кода, поскольку каждый аспект модели может быть явно определен в одном скрипте Python, при этом уравнения модели изложены в математической нотациии используется лишь небольшое количество специфичного для Брайана словаря.. Поскольку модель описана в явном виде, все характеристики задокументированы и могут быть найдены в основном файле описания симуляции, что устраняет необходимость в ранее использовавшихся моделях «черного ящика», как упоминалось в исследованиях Stimberg et al.45,86.
В современной модели нейрона используются модифицированные проводимоститипа Ходжкина-Хаксли 46 с Na+, K+ и током утечки. Эта модель, основанная на проводимости, может быть дополнительно расширена за счет включения нескольких других типов каналов, таких как каналы Ca2+ . Для моделей синапсов важно отметить, что эти параметры должны быть получены для конкретных составов субъединиц, и должны оцениваться только варианты с параметрами, измеренными с помощью этих составов. В этом исследовании была выбрана композиция рецептора α1β3γ2; поэтому были включены только варианты α1, β3 или γ2 с параметрами кинетики канала, измеренными на рецепторе α1β3γ2 ГАМКА .
Оценка клеточной биофизики включает в себя сегментацию клетки на несколько цилиндрических компартментов, каждый из которых потенциально обладает различными характеристиками проводимости. Несмотря на неровности в дендритах нейрона, их можно рассматривать как локально однородные нити. Такие модели помогают понять сложную структуру и функционирование клеток. При проектировании модели основное внимание уделяется упрощенной версии фактической морфологии, которая может отражать эти особенности.
Расположение и физико-химические характеристики измененной аминокислоты определяют влияние на кинетику канала. Например, аминокислотная замена, приводящая к образованию аминокислоты с большей боковой цепью, приведет к снижению проводимости канала, если это изменение происходит на аминокислоте, выстилающей поры канала. Подстановки также могут повлиять на открытие/закрытие канала. Для простоты в этой модели кинетика связывания ГАМК сведена только к соотношению доступных рецепторов; Тем не менее, более детальные модели могут быть разработаны с учетом этого взаимодействия для изучения возможного влияния замен, которые изменяют аффинность связывания лигандов.
В заключение следует отметить, что в настоящем исследовании используются вычислительные методы для прогнозирования патогенных вариантов в субъединицах рецептораГАМК А и качественной оценки возможного клеточного фенотипа на основе моделирования мутаций, ассоциированных с эпилепсией, в модели пирамидального нейрона гиппокампа. Насколько нам известно, это первый протокол, в котором исследуется совместное применение вычислительной генетики, молекулярного моделирования и нейронного моделирования для оценки того, как генетические варианты могут способствовать дисфункции рецептора ГАМКА на нескольких уровнях сложности, от ДНК до функции белка и нейронного поведения. Этот протокол может стать основой для улучшения оценки потенциально вредных вариантов и связанной с ними нервной патологии при эпилепсии. Кроме того, он может быть использован для изучения других каналопатий, что дает важное представление о механизме, лежащем в основе соответствующих расстройств развития нервной системы и сетей. Исходя из этого, путем включения структурных и физико-химических оценок рецептора ГАМКА для изучения функционального влияния вариантов и их интеграции в кинетику канала рецептора ГАМКА , в будущем может быть разработан более точный анализ.
Раскрытие информации
Все авторы заявляют, что у них нет конфликта интересов, связанного с данной работой.
Благодарности
Мы благодарим Чаглу Коджу за помощь в построении модельного нейрона.
Материалы
| Name | Company | Catalog Number | Comments |
| Brian2 | Sorbonne Université, INSERM, CNRS, Institut de la Vision, France; Imperial College London, United Kingdom | 2.8.0.4 | Stimberg et al., 2019 (https://pypi.org/project/Brian2/ ) |
| dbNSFP server | Genos Bioinformatics LLC, USA | v3.0 | Liu et al., 2020 (http://database.liulab.science/dbNSFP) (https://sites.google.com/site/jpopgen/dbNSFP) |
| HOPE | Centre for Molecular and Biomolecular Informatics CMBI, Radboud University, Netherlands | 1.1.1 | Venselaar et al., 2010 (https://www3.cmbi.umcn.nl/hope/) |
| Jalview | University of Dundee, UK | JV2 | Waterhouse et al., 2009 (https://www.jalview.org/) |
| Jupyter Notebook | Project Jupyter, USA | https://jupyter.org/install | |
| Phyton | Python Software Foundation, USA | 3.13 | https://www.python.org/downloads/ |
| Protter | ETH Zurich, Switzerland | Version 1.0 | Omasits, et al., 2014 (https://wlab.ethz.ch/protter/start/) |
| R | The R Foundation for Statistical Computing, USA | R version 4.3.2 | https://www.r-project.org/ |
| RStudio | Posit software, PBC, USA | RStudio 2023.12.1+402 "Ocean Storm" Release | https://posit.co/downloads/ |
Ссылки
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены