Method Article
Открытие гематоэнцефалического барьера с помощью фокусированного ультразвука для воздействия на структуры головного мозга и оценки хемогенетической нейромодуляции
В этой статье
Резюме
Этот протокол определяет шаги, необходимые для доставки гена через фокусированное ультразвуковое открытие гематоэнцефалического барьера (ГЭБ), оценку результирующей экспрессии генов и измерение нейромодуляционной активности хемогенетических рецепторов с помощью гистологических тестов.
Аннотация
Акустически направленная хемогенетика (ATAC) позволяет осуществлять неинвазивный контроль над определенными нейронными цепями. ATAC достигает такого контроля за счет комбинации индуцированного гематоэнцефалического барьера (FUS-BBBO), индуцированного фокусированным ультразвуком (FUS-BBBO), доставки генов с помощью аденоассоциированных вирусных векторов (AAV) и активации клеточной сигнализации с помощью инженерных, хемогенетических, белковых рецепторов и их родственных лигандов. С помощью ATAC можно трансдуцировать как большие, так и маленькие участки мозга с точностью до миллиметра с помощью одного неинвазивного ультразвукового приложения. Эта трансдукция в дальнейшем может обеспечить длительную, неинвазивную, безаппаратную нейромодуляцию у свободно движущихся животных с помощью лекарственного препарата. Поскольку FUS-BBBO, AAV и хемогенетика использовались на нескольких животных, ATAC также должен быть масштабируемым для использования на других видах животных. Эта статья расширяет ранее опубликованный протокол и описывает, как оптимизировать доставку генов с помощью FUS-BBBO в небольшие участки мозга под контролем МРТ, но без необходимости использования сложного МРТ-совместимого устройства FUS. Протокол также описывает конструкцию компонентов наведения и удержания мыши, которые могут быть напечатаны на 3D-принтере в любой лаборатории и могут быть легко модифицированы для различных видов или специального оборудования. Для обеспечения воспроизводимости протокол подробно описывает, как микропузырьки, AAV и венепункция использовались при разработке ATAC. Наконец, приведен пример данных, которыми можно руководствоваться при проведении предварительных исследований с использованием ATAC.
Введение
Использование технологий нейромодуляции, специфичных для конкретных цепей, таких как оптогенетика1,2 и хемогенетика 3,4,5, продвинуло наше понимание психических состояний как расстройств нейрональной цепи. Нейронные цепи трудно изучать и еще труднее контролировать при лечении заболеваний головного мозга, потому что они, как правило, определяются конкретными типами клеток, областями мозга, молекулярными сигнальными путями и временем активации. В идеале, как для исследовательских, так и для клинических применений, такой контроль должен осуществляться неинвазивно, но достижение как точной, так и неинвазивной нейромодуляции является сложной задачей. Например, в то время как нейроактивные препараты могут достигать мозга неинвазивным путем, им не хватает пространственной специфичности, поскольку они действуют по всему мозгу. С другой стороны, электрическая глубокая стимуляция мозга может контролировать определенные области мозга, но имеет трудности с контролем определенных типов клеток и требует хирургического вмешательстваи установки устройства.
Акустически таргетная хемогенетика7 (ATAC) обеспечивает нейромодуляцию с пространственной, клеточной и временной специфичностью. Он сочетает в себе три метода: сфокусированное ультразвуковое индуцированное открытие гематоэнцефалического барьера (FUS-BBBO) для пространственного таргетирования, использование аденоассоциированных вирусных векторов (AAV) для неинвазивной доставки генов под контролем специфических промоторов клеточного типа и сконструированные хемогенетические рецепторы для селективной модуляции трансфицированных нейронных цепей путем введения лекарств. FUS — это одобренная FDA технология, которая использует способность ультразвука фокусироваться глубоко в тканях, включая мозг человека, с пространственной точностью до миллиметра. При высокой мощности ФУЗ используется для неинвазивной таргетной абляции, включая одобренное FDA лечение эссенциального тремора8. FUS-BBBO сочетает в себе низкоинтенсивный ультразвук с системно вводимыми микропузырьками, которые колеблются в кровеносных сосудах в фокусе ультразвука, что приводит к локализованному, временному (6-24 ч) и обратимому раскрытию ГЭБ9. Это отверстие позволяет доставлять белки9,10, малые молекулы 11 и вирусные векторы7,12,13,14 в мозг без значительного повреждения тканей грызунов 10 и нечеловекообразных приматов 15. В настоящее время продолжаются клинические испытания FUS-BBBO16,17, что указывает на возможное терапевтическое применение этой методики.
Доставка вирусных генов с помощью AAV также быстро продвигается в клиническое использование при заболеваниях ЦНС, а недавние одобрения FDA и регулирующих органов ЕС являются важными вехами. Наконец, хемогенетические рецепторы18, такие как рецепторы, активируемые исключительно дизайнерскими препаратами (DREADDs), широко используются нейробиологами для обеспечения фармакологического контроля над возбуждением нейронов у трансгенных или трансфицированных животных19,20. DREADD — это рецепторы, связанные с G-белком (GPCR), которые были генетически модифицированы для реагирования на синтетические хемогетические молекулы, а не на эндогенные лиганды, так что системное введение этих лигандов увеличивает или снижает возбудимость нейронов, экспрессирующих DREADD. Когда эти три технологии объединены в ATAC, их можно использовать для неинвазивной модуляции выбранных нейронных цепей с пространственной, клеточной и временной точностью.
В этой статье мы расширяем и обновляем ранее опубликованный протокол для FUS-BBBO11 , включив в него методологию точного нацеливания на области мозга с помощью FUS-BBBO у мышей с использованием простого напечатанного на 3D-принтере оборудования для наведения. Мы также показываем применение FUS-BBBO в ATAC. Мы показываем шаги, необходимые для доставки AAV, несущих хемогетические рецепторы, а также для оценки экспрессии генов и нейромодуляции с помощью гистологии. Этот метод особенно применим для воздействия на большие или множественные области мозга для экспрессии генов или нейромодуляции. Например, обширная область коры головного мозга может быть легко трансдуцирована с помощью FUS-BBBO и модулирована с помощью хемогенетики. Тем не менее, доставка генов с помощью альтернативного метода, внутричерепных инъекций, потребует большого количества инвазивных инъекций и краниотомий. FUS-BBBO и его приложение, ATAC, могут быть масштабированы для животных разных размеров, где области мозга больше и труднее поддаются инвазивному воздействию.
протокол
Все эксперименты проводились в соответствии с протоколом, одобренным Комитетом по уходу за животными и их использованию Калифорнийского технологического института, где данные были первоначально получены J.O.S.
1. Дизайн и 3D-печать шлейки животных и оборудования для наведения изображений
- Используйте файлы с веб-сайта лаборатории Шабловского по адресу: https://www.szablowskilab.org/downloads для 3D-печати компонентов.
- Убедитесь, что печатный материал имеет низкую восприимчивость к МРТ, но имеет видимую для МРТ опору. Подробнее об используемых материалах см. в разделе материалы и реактивы.
- Учитывайте деградацию материала при многократном использовании, многократно проверяя материал и наблюдая за местами износа, которые должны быть усилены. Убедитесь, что толщина стенок с печатью составляет не менее 2 мм.
- Используйте высокоточные 3D-принтеры, чтобы повысить точность наведения.
- Противодействуйте гравитации и другим силам, чтобы избежать отклонения пластиковых компонентов, напечатанных на 3D-принтере, поддерживая компоненты по их длине и увеличивая толщину стенок, напечатанных на 3D-принтере, если наблюдается какой-либо изгиб.
- Учитывайте точность по нескольким осям, включая переднюю/заднюю, медиальную/латеральную, дорсальную/вентральную, а также по рысканию, тангажу и наклону.
- Проверьте точность наведения, выполнив FUS-BBBO и зафиксировав отклонение от заданного положения.
- При использовании моторизованных стереотаксических систем оцените влияние динамического движения на эластичность материала, записав процедуру наведения FUS-BBBO на видео, и исправьте любые отклонения, утолщая стенки материала, напечатанного на 3D-принтере.
2. Описание ультразвуковой системы
- Используйте ультразвуковую систему с восьмиэлементным кольцевым решетчатым преобразователем (диаметр = 25 мм, естественная фокусная точка = 20 мм; апертура (F) = 0,8)) и соедините корпус с головкой с дегазированным ультразвуковым гелем, нанеся гель на бритую голову мыши.
ПРИМЕЧАНИЕ: Центральная частота преобразователя, использованного в предыдущем исследовании7, составляла 1,5 МГц, длительность импульса — 10 мс, а частота повторения импульсов — 1 Гц в течение 120 с. Давление калибровалось с помощью волоконно-оптического гидрофона и поддерживалось в пределах 0,36-0,45 МПа. Предположим, что акустическое затухание составляет 18% через череп21 на частоте 1,5 МГц и теменную кость. Диапазон условий, необходимых для безопасного вскрытия ГЭБ и доставки AAV, был подробно описан в другом месте 7,14,22.
3. Подготовка животных
- Обезболить одну мышь с помощью ингаляции изофлурана в дозе 2% с медицинским воздухом. Проверьте глубину анестезии с помощью прикосновения, чтобы убедиться в отсутствии ответа. Затем нанесите офтальмологическую мазь, чтобы предотвратить высыхание роговицы, используя одноразовую стерильную ватную палочку, чтобы предотвратить перекрестное загрязнение тюбика с мазью.
ПРИМЕЧАНИЕ: Типичная процедура FUS-BBBO может длиться от 30 минут до 2 часов, и анестезия должна поддерживаться на протяжении всего времени. - После анестезии мыши промыть чистый катетер гепаринизированным физиологическим раствором (10 ЕД/мл).
ПРИМЕЧАНИЕ: Подходящий катетер для мыши 25-35 г имеет иглу 30 G и трубку PE10. - Затем продезинфицируйте мышиный хвост 70% этиловым тампоном. Поместите катетер хвостовой вены в боковую хвостовую вену и закрепите ее тканевым клеем. Наблюдайте за обратным током крови из хвостовой вены в катетер, чтобы подтвердить его размещение.
- Побрейте голову мыши, а затем используйте крем для депиляции после высыхания тканевого клея, чтобы уменьшить вероятность попадания пузырьков воздуха под ультразвуковой гель во время озвучивания.
- Поместите мышь в каретку для МРТ, напечатанную на 3D-принтере, установив передние зубы на прикусную планку, а головку внутрь носового конуса (рис. 1a).
- Введите до 10 мкл лидокаина подкожно в место контакта с притупленными ушными планками. Затем прикрепите притупленные стержни к черепу и приложите безопасное количество давления, стараясь не оказывать давление на дыхательное горло, так как оно затрудняет дыхание. Понаблюдайте за дыханием в течение 30 с, чтобы убедиться, что животное дышит свободно со скоростью 1/с.
- Подсоедините направляющую к ушным планкам, проверьте дыхание, как показано в шаге 3.6 (рис. 1b), и продолжайте визуально контролировать дыхание на протяжении всей процедуры каждую минуту. Частота дыхания выше 1/с является одним из признаков потери анестезии. Продолжайте контролировать реакцию щипки пальцев каждые 5 минут, когда мыши не находятся в МРТ-сканере или если частота дыхания превышает 1/с.
- Переместите каретку МРТ в держатель МРТ, а затем внутрь отверстия магнита.
ПРИМЕЧАНИЕ: Конструкция аппаратного обеспечения оптимизирована для 72-миллиметровой катушки внутри 7-тонного магнитно-резонансного томографа. - Получите последовательность МРТ, чтобы локализовать мышь в сканере.
- Выберите последовательность 3D-быстрой съемки под низким углом (FLASH), чтобы получить весь мозг, используя следующие параметры, в соответствии с конкретными инструкциями производителя прибора. Время эхо: 3,9 мс, Время повторения: 15 мс, Угол импульса возбуждения: 15°, Размер матрицы: 130 x 130 x 114, Разрешение: 350 x 200 x 200 мкм на воксель, Средние: 1, Время съемки: 3 мин 42 с
- Передача файлов из системы МРТ на компьютер, управляющий системой FUS.
- Откройте последовательность визуализации в программном обеспечении, чтобы выполнить наведение под контролем МРТ, где изображение должно появиться, как показано на рисунке 1c.
4. Наведение на цель под контролем МРТ
ПРИМЕЧАНИЕ: При использовании специально разработанных направляющих для нацеливания нет необходимости помещать ультразвуковой датчик в МРТ, а также нет необходимости делать разрез кожи для выполнения нацеливания путем обнуления стереотаксиса на брегма- и лямбда-линиях. Выполните следующие действия, чтобы выполнить процесс таргетинга.
- Поместите каретку в стереотаксический инструмент. Закрепите его на месте с помощью металлического блока с двусторонним скотчем и прижав каретку к двум опорным стойкам стереотаксического инструмента.
- Передайте изображения МРТ на компьютер с запущенным программным обеспечением FUS, выбрав файлы в диспетчере данных, щелкнув правой кнопкой мыши, чтобы открыть пункты меню, и выбрав «Передать немедленно».
- Откройте программное обеспечение FUS и загрузите изображение, нажав «Открыть последовательность» и загрузив все файлы последовательности изображений.
- Переформатируйте изображение по трем осям, нажав правой кнопкой мыши и «Переформатировать».
- Локализуйте датчик на круговой направляющей наведения (рис. 1c), щелкнув правой кнопкой мыши.
- В сагиттальном виде отрегулируйте вертикальное положение виртуального преобразователя с учетом толщины водяной бани и корпуса преобразователя (в данном случае – 8,2 мм вверх, рис. 1d).
- Укажите область (области), на которую нужно нацелиться, в планировщике траектории и запишите координаты в электронную таблицу (в данном случае – средний мозг, как показано на рисунке 1d).
- Наберите нужную глубину наведения (z-значение в электронной траектории (рис. 2) и запишите координаты в электронную таблицу.
- Нацеливайтесь на каждую из точек, нажимая «Отправить траекторию» и «Выполнить» (рисунок 2).
ПРИМЕЧАНИЕ: Это делается, когда держатель для мыши помещен внутрь двигателей. Тем не менее, такое же наведение может быть достигнуто с высокой точностью на стереотаксическом инструменте. - Чтобы соотнести координаты МРТ со стереотаксической рамкой, поместите установленный на заказ датчик над направляющей для наведения и перемещайте до тех пор, пока каждый из трех болтов наведения (рис. 3, элемент A) не сможет пройти через держатель датчика (рис. 3, элемент B) и направляющую наведения (рис. 3, элемент C). Убедитесь, что болты не находятся под натяжением или наклоном.
- Переместите датчик на 10,56 мм вперед в переднем/заднем направлении, пока он не окажется в том же месте, где на МРТ появляется центр направляющей для наведения.
- Определите расстояние от центра виртуального преобразователя (рис. 3a, элемент A) до целевой области (рис. 3a, элемент B) и переместите преобразователь в эти координаты с помощью стереотаксической системы координат.
- Приступают к приготовлению раствора для инъекций.
5. Приготовление раствора для инъекций
ПРИМЕЧАНИЕ: Микропузырьковые растворы очень чувствительны к давлению. Следовательно, энергичное перемешивание или быстрое введение через тонкие иглы может схлопнуть микропузырьки и снизить эффективность раскрытия ГЭБ. Кроме того, микропузырьки легче воды и могут всплывать в верхнюю часть трубки, катетера или шприца (рис. 4), например, в автоматическом инъекторе. Настоятельно рекомендуется ресуспендировать микропузырьковый раствор непосредственно перед каждой инъекцией.
- Наберите 0,8 мл физиологического раствора с помощью шприца в пробирку объемом 1,5 мл.
- С помощью шприца добавьте 0,1 мл контрастного вещества для МРТ в ту же пробирку объемом 1,5 мл и перемешайте.
- Неактивированный раствор микропузырьков23,24 довести до комнатной температуры.
- Непосредственно перед озвучиванием активируйте микропузырьки в течение 45 секунд в устройстве активации микропузырьков.
- Медленно (в течение ~3 с) извлеките 0,1 мл микропузырьков с помощью туберкулинового шприца объемом 1 мл и иглы 21 г из средней глубины жидкости.
- Добавьте 0,08 мл микропузырьков в раствор контрастного вещества и физиологического раствора, приготовленный на этапе 5.3. Перемешивайте, постукивая рукой в течение 15 с.
- При конечной концентрации AAV 0,5-2 x 10 10 вирусных частиц на грамм массы тела (VP/г) вводят груз для доставки (в данном случае AAV9) через иглу30 G в катетер хвостовой вены, в случае ATAC – AAV, несущие хемогенетические рецепторы, или отрицательный контроль, например, AAV, несущие GFP под тем же промотором.
- Снова перемешайте микропузырьки вручную в течение 15 с, чтобы избежать всплытия (рисунок 4).
- Сразу после этого аспирируйте 200 мкл раствора микропузырьков через шприц без прикрепленной иглы. Отсутствие иглы уменьшит силу сдвига на микропузырьках.
- Переверните шприц и перемешайте, нажимая на поршень вверх и вниз.
- Прикрепите иглу 30 G и, все еще перевернутые, медленно выталкивайте микропузырьки до тех пор, пока на конце иглы не появятся капли.
6. Процедура озвучивания
- Установите параметры для озвучивания: длительность импульса 10 мс, 120 повторов через каждые секунды и давление 0,30-0,45 МПа на череп.
- Снимите направляющую и нанесите дегазированный ультразвуковой гель на голову мыши, следя за тем, чтобы не образовывались пузырьки.
- Опустите излучатель и поместите его прямо на держатель амбушюры, а затем введите координаты в стереотаксические приборы (рис. 5).
- Вводят раствор ААВ (0,5-2 х10, 10 ВП/г).
- Смешайте микропузырьки и раствор контрастного вещества для МРТ в течение 15 с и введите 80 мкл на мышь по 30 г.
- Немедленно примените ультразвук в течение 120 с, нажав «Отправить» и «Выполнить».
- Если целью является более одного участка, переместите датчик на этот участок и отрегулируйте таргетинг по глубине в соответствии с цифрами в электронной таблице из шагов 4.7–4.9. Затем повторите шаги 6.5-6.6 для каждого инсонированного участка.
7. МРТ-оценка вскрытия ГЭБ
ПРИМЕЧАНИЕ: МРТ-оценка вскрытия ГЭБ была подробно описана в другом месте11. Расположение вскрытия ГЭБ может быть визуализировано в виде более светлых участков у мышей, получивших инъекцию Т1-взвешенного Gd-контрастного вещества.
- После проведения ультразвукового исследования запишите последовательность МРТ, как показано в шаге 3.10.
- Извлеките мышь из МРТ-сканера и поместите ее в клетку для восстановления, чтобы можно было восстановиться после анестезии. Ежедневно наблюдайте за мышами на предмет признаков дистресса, потери веса или других гуманных конечных точек. Проконсультируйтесь с ветеринарным персоналом и рекомендациями IACUC, чтобы приступить к любому лечению в случае возникновения непредвиденных нежелательных явлений.
8. Стимуляция DREADD хемогенетическим лигандом
- Выберите хемогенетический рецептор. Для DREADD выберите рецептор hM3Dq для активации нейронов через Gq-сопряженные пути19, рецептор hM4Di для ингибирования нейрональной активности через Gi/o связанные пути20 или рецептор KORD для активации нейронов через Gs-связанные пути с использованием сальвинорин-B-лиганда25.
- Растворите клозапин-n-оксид (CNO) в стерильном физиологическом растворе в концентрации 1 мг/мл. Храните аликвотированный CNO при -20 °C.
- Вводят CNO19 или другой хемогенетический лиганд26,27,28 внутрибрюшинным путем в концентрации 0,3 – 10 мг/кг.
- Если необходимо зарегистрировать влияние CNO на поведение, начинайте регистрировать поведенческую активность в течение 15-45 мин после введения препарата для достижения максимальной активацииDREADDs 19.
- Если требуется анализ активации нейронов, используйте мышей для гистологического исследования через 60-120 минут после инъекции.
- Приступайте к эвтаназии через сердечную перфузию (см. раздел 9).
9. Гистологическая оценка экспрессии генов и хемогенетической активации
ПРИМЕЧАНИЕ: После того, как экспериментальная конечная точка (например, окончание поведенческого исследования, время, необходимое для экспрессии генов) достигнута, очень важно подтвердить местоположение и наличие экспрессии генов.
- После активации хемогенетическим лигандом проводят сердечную перфузию для сохранения тканей.
- Обезболивайте мышь смесью кетамина (100 мг/кг) / ксилазина (10 мг/кг) в стерильном физиологическом растворе через IP-инъекцию. Подтвердите анестезию зажимом пальца ноги и убедитесь, что частота дыхания снижена примерно до 1/с. Обеспечьте тепловую поддержку через грелку до подтверждения эвтаназии.
- Приготовьте 10% нейтральный буферный формалин (NBF) и PBS с 10 единицами гепарина на мл.
ПРИМЕЧАНИЕ: Растворы должны находиться при температуре 4 °C. - Разлейте каждый буфер в отдельные пробирки по 50 мл, соедините и заправьте перистальтический насос, подключенный к катетеру-бабочке 25 G, раствором PBS/гепарина.
- Прикрепите конечности к впитывающей синей подушечке с помощью ленты и убедитесь, что животное находится в положении лежа на подушечке. Продезинфицируйте шерсть, чтобы избежать перекрестного загрязнения периферических органов в случае необходимости их сбора.
- Вскрыть полость брюшины поперечным разрезом, обнажив диафрагму.
- Вскрыть грудную клетку через два надреза хирургическими ножницами по передней/задней оси.
- Обнажите сердце, поместите иглу в левую камеру (правая сторона сердца, если смотреть на лежа на спине) и поместите в катетер-бабочку на шаге 9.1.3.
- Сделайте небольшой разрез в правом желудочке, чтобы обеспечить отток крови.
- Включите перистальтическую помпу, чтобы начать промывание крови PBS/гепарином.
ПРИМЕЧАНИЕ: Если этот этап не будет выполнен должным образом, кровь свернется во время фиксации формалином и препятствует надлежащей перфузии. - После того, как вся кровь будет вымыта и из правого желудочка начнет выходить прозрачный PBS, переключите входное отверстие перистальтического насоса на раствор NBF и начните перфузию в дозе 25 мл на мышь.
- Извлеките мозг, поместите не менее 4 мл NBF и зафиксируйте на 24 часа.
- Срез головного мозга с помощью корональных срезов на вибратоме толщиной 50 мкм.
- Поместите каждую секцию в лунку с 24-луночной пластиной, хранящей срезы по всему мозгу.
- Оцените экспрессию хемогенетических рецепторов, слитых с флуоресцентными белками (например, mCherry или mCitrine), под флуоресцентным микроскопом, чтобы определить участки, показывающие экспрессию, чтобы подтвердить местоположение. Выражение лица, скорее всего, будет тусклым.
- Проводят иммуноокрашивание против флуорофора по следующему протоколу:
- Помещают 3 среза в 0,5 мл раствора, содержащего 10% сыворотку хозяина вторичного антитела, и инкубируют в течение 30 мин.
- Перенесите срезы в раствор первичного антитела в разведении 1:250 – 1:1000, используя 1:500 в качестве отправной точки.
- Инкубируют срезы с первичными антителами в течение ночи при 4 °C в микропланшете, запечатанном парафиновой пленкой.
- Промойте срезы PBS 3 раза по 5 минут за раз.
- Добавить 0,5 мл на лунку раствора вторичных антител в 10% сыворотке.
- Выдерживают 4 ч при комнатной температуре.
- Промойте срезы PBS 3 раза по 5 минут за раз.
- Устанавливайте на предметные стекла с помощью водной монтажной среды, содержащей ядерное пятно (например, DAPI).
- Оцените локализацию и распространение с помощью конфокального микроскопа, выполнив сканирование плитки всего среза.
- Оцените интенсивность экспрессии, измерив интенсивность пикселей флуоресценции в целевых областях мозга и сравните с контролем с внутричерепной инъекцией.
- В качестве альтернативы можно оценить процент положительных нейронов путем подсчета клеток, окрашенных против хемогенетических рецепторов, по сравнению с DAPI-положительными клетками или клеточно-специфическими маркерами.
- Оцените повреждение тканей, выполнив окрашивание гематоксилином на срезе 50 мкм и визуализируя потерю клеток, накопление клеточного мусора и другие признаки грубого повреждения.
- Чтобы оценить специфичность клеточного таргетирования, проводят двойное иммуноокрашивание, как описано ниже, для хемогенетического рецептора и клеточно-специфического маркера. Затем выполните подсчет положительных ячеек, как показано на шаге 9.8.
- Помещают 3 среза в 0,5 мл раствора, содержащего 10% сыворотку хозяина вторичного антитела, и инкубируют в течение 30 мин.
- Переносят срезы в раствор первичного антитела против флуоресцентного маркера хемогенетического рецептора в разведении 1:250 – 1:1,000, используя 1:500 в качестве отправной точки. Добавьте второе первичное антитело от другого вида хозяина, которое нацелено на интересующий клеточный маркер (например, CamkIIa).
- Инкубируют срезы с первичными антителами в течение ночи при 4 °C в микропланшете, запечатанном парафиновой пленкой.
- Промойте срезы PBS 3 раза по 5 минут за раз.
- Добавляют 0,5 мл раствора вторичных антител на лунку в 10% сыворотке крови от вида хозяина обоих вторичных антител.
ПРИМЕЧАНИЕ: Каждое антитело должно иметь отдельный флуорофор и должно быть реактивным против первичных антител на этапе 9.10.2. - Выдерживают 4 ч при комнатной температуре.
- Промойте срезы PBS 3 раза по 5 минут за раз.
- Установите на салазки и зафиксируйте водной монтажной средой, содержащей ядерное пятно.
10. Оценка активации нейронов с помощью иммуноокрашивания на c-Fos
- Выполните окрашивание c-Fos, как указано в пункте 9.5 данного протокола, используя первичное антитело к c-Fos и вторичное антитело с флуоресцентной меткой, отличной от ядерного окрашивателя.
- Подсчитайте процент клеток, которые являются положительными как на c-Fos, так и на ядерное окрашивание в области, на которую нацелен хемогенетический рецептор.
- Проанализируйте процент c-Fos положительных ядер в группе мышей, экспрессирующих хемогетические рецепторы и обработанных хемогенетическим лигандом или контролем транспортных средств, а также в группе мышей дикого типа, получавших хемогенетический лиганд или контроль транспортных средств.
Результаты
Первым этапом выполнения протокола ATAC является нацеливание FUS-BBBO на нужные участки мозга. Например, в соответствии с описанным протоколом, в гиппокамп нацеливался FUS-BBBO, а мышам вводили контрастное вещество и AAV9, несущие DREADD, после чего проводилась FLASH 3D МРТ-последовательность, которая получала изображения мозга мыши. Усиление сигнала Т1 было достигнуто в области гиппокампа (рис. 6) и в других частях мозга (рис. 7). Через несколько недель внутри целевой области мозга экспрессировались DREADD. В то время как многие DREADD соединяются с флуоресцентным репортером (например, mCherry), было обнаружено, что процесс перфузии и фиксации формальдегидом резко снижает флуоресценцию этих белков. Иммуноокрашивание против mCherry или DREADD привело к более надежному выявлению экспрессии (рис. 8), основанному на предыдущем опыте. В предыдущих экспериментах ~85% мышей показали экспрессию после FUS-BBBO7. Простым тестом на достаточный уровень экспрессии DREADD является проверка их функциональности на клеточном уровне. Это можно сделать, например, путем введения хемогенетического лиганда или физиологического раствора, такого как CNO 19, дешлорозапин28 или другие29, и подождать 2 часа перед сердечной перфузией и фиксацией. Затем срезы головного мозга были совместно окрашены на белок c-Fos30, который указывает на повышенную активность нейронов, и на DREADD. Эксперимент считался успешным, если участок мозга, на который были нацелены DREADD, показывал значительно большее количество ядер нейронов, которые являются c-Fos положительными в группе, получавшей хемогенетический лиганд, по сравнению с группой, получавшей физиологический раствор7, или по сравнению с контралатеральным участком, который не подвергался воздействию FUS-BBBO. Следует отметить, что некоторые из этих лигандов могут неспецифически активировать нейроны без экспрессии DREADD. Например, было показано, что CNO метаболизируется в низких уровнях клозапина у мышей, который проникает через ГЭБ и активирует DREADD с высокой активностью27. Тем не менее, было также показано, что он привязывается к неопределенным местам. Как и в любом эксперименте, крайне важно включить все надлежащие средства контроля в хемогенетические исследования31. Одним из возможных способов контроля является введение хемогенетического лиганда мышам дикого типа без процедур, чтобы исключить влияние только препарата на желаемый поведенческий или гистологический анализ. Другим контролем может быть включение четырех групп: DREADD + лиганд, DREADD + носитель, EGFP + лиганд, EGFP + транспортное средство, что будет учитывать любые потенциальные эффекты как доставки генов с помощью FUS-BBBO, так и хемогенетического лиганда.
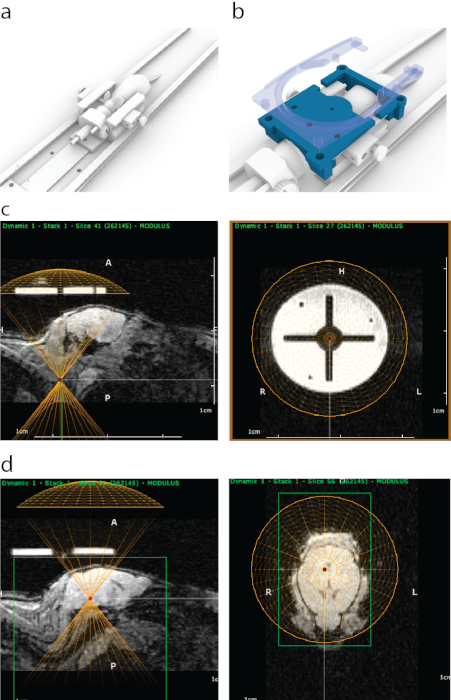
Рисунок 1: Процесс наведения FUS под контролем МРТ в ATAC. (a) Размещение мыши с помощью ушных планок, носового конуса и платформы, которая может быть установлена внутри МРТ-сканера. (b) Напечатанный на 3D-принтере шаблон (синий), который виден на МРТ, был прикреплен к концам рамки ушной планки, а затем закреплен на месте держателем поверхностной катушки МРТ, содержащей четыре защелкивающихся болта (полупрозрачный синий). (c) Внешний вид напечатанного на 3D-принтере шаблона в сагиттальной МРТ (левая панель) с нижней частью виртуального изображения датчика, выровненной (желтый полукруг) с нижней частью проводника. На правой панели показан внешний вид напечатанного на 3D-принтере шаблона на МРТ с корональной проекции. Яркий круг был изготовлен из полиструйного поддерживающего материала, обладающего сильным МРТ-контрастом. Крест был сформирован пластиком. Желтый круг обозначает расположение преобразователя, которое было концентрически выровнено по направляющему внутри стереотаксической рамки. (d) Для воздействия на структуры мозга виртуальный датчик был перемещен в направлении z над мышами, чтобы соответствовать толщине ультразвукового конуса/корпуса. При этом из-за толщины водяной бани преобразователь был перемещен на 8,2 мм выше направляющей для точного наведения. Структуры головного мозга были выбраны с использованием данных МРТ-томографии, а затем их МРТ-координаты записывались и вводились в стереотаксическую машину. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2: Интерфейс используемого программного обеспечения. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
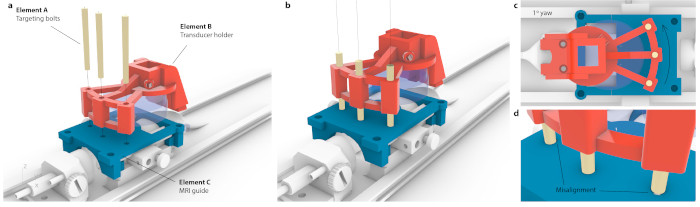
Рисунок 3: Процесс сопоставления координатного пространства МРТ со стереотаксическим прибором. (a) Три отверстия в держателе преобразователя были совмещены с тремя отверстиями в направляющей МРТ, и три конических болта наведения были вставлены, не вызывая изгиба всего узла. (b) В идеале все три болта должны располагаться в центре отверстий. (c) Если есть какая-либо неточность в выравнивании, не все три болта будут подходить, например, в случае небольшого, вероятно, незаметного рыскания 1° только один болт войдет в него, в то время как противоположные болты застрянут в направляющей МРТ. Кроме того, может наблюдаться видимый изгиб всей сборки при проталкивании болтов. (d) Увеличенный вид болтового крепления. Болты должны быть размещены концентрически для лучшей точности. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
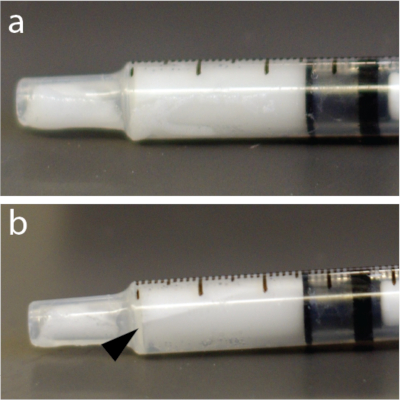
Рисунок 4: Быстрое перераспределение микропузырьков внутри шприца. а) Шприц был сфотографирован через 5 с после смешивания. (b) Через минуту был отчетливо виден слой, показывающий концентрат некоторых пузырьков в верхней части туберкулинового шприца объемом 1 мл. В этом примере, в частности, использовался раствор микропузырьков. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
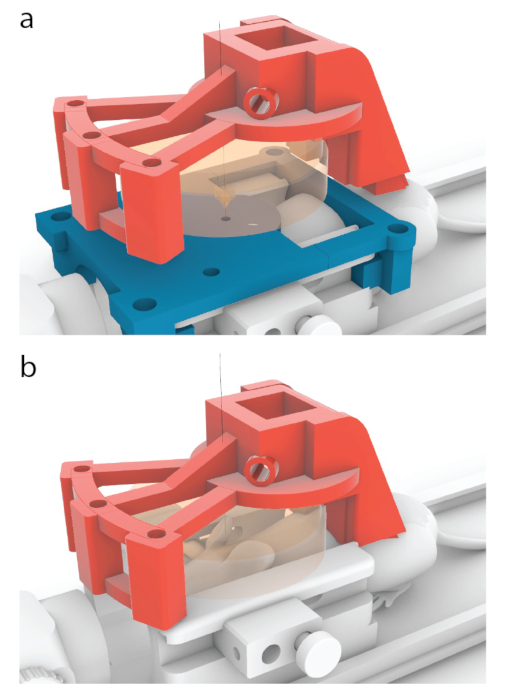
Рисунок 5: Процесс размещения центра датчика над центром проводника МРТ. (a) В моделях, показанных в этой статье, красная несущая была спроектирована таким образом, чтобы перемещаться на 10,56 мм вперед из положения, показанного на рисунке 3b, в положение, показанное здесь. (b) Синий направляющий для МРТ был удален перед ультразвуковой обработкой, и между мышью и датчиком был нанесен ультразвуковой гель (оранжевый) для обеспечения прохождения ультразвука. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
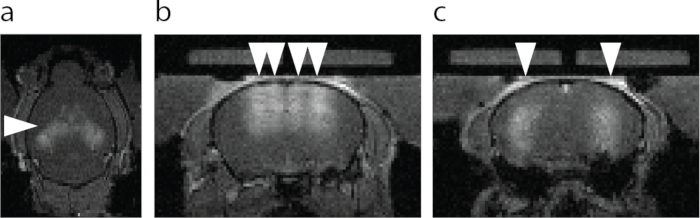
Рисунок 6: МРТ-визуализация отверстия ГЭБ. (a) Осевой вид отверстия BBB. Более яркая область, обозначенная стрелкой, показывает экстравазацию контрастного вещества МРТТ1 . (b) Корональный вид дорсального гиппокампа и коры головного мозга над гиппокампом, направленный на FUS-BBBO (наконечники стрел). (c) Корональная проекция центрального гиппокампа с помощью FUS-BBBO (наконечники стрел). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
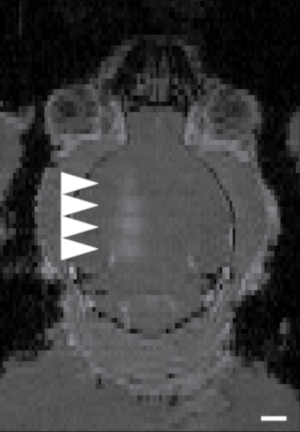
Рисунок 7: Пример нацеливания на 4 участка мозга с использованием трехболтовой системы наведения, описанной в этой статье. На участках со стрелками были выявлены открытые участки ГЭБ с диффузией контрастного вещества для МРТ. Четыре участка были выбраны последовательно, с ~150 секундами между каждым открытием BBB, снизу вверх. Снимок был сделан в течение 2 минут после последнего вскрытия BBB. Масштабная линейка составляет 2 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
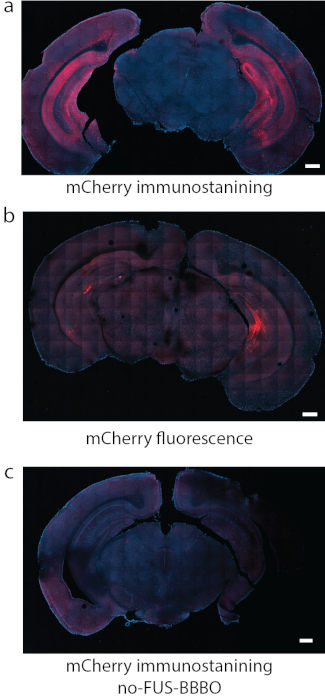
Рисунок 8: Обнаружение экспрессии DREADD. (a) Иммуноокрашивание флуорофора, прикрепленного к DREADD, в данном случае mCherry был надежным методом обнаружения в некоторых исследованиях. (b) В другой репрезентативной секции с DREADD, направленными на гиппокамп с использованием тех же условий, что и на рисунке (a), флуоресценция mCherry сама по себе производила сильный фон и относительно слабый сигнал. (c) В качестве отрицательного контроля использовали мышь, которая получала системную инъекцию AAV, но не подвергалась FUS-BBBO. При иммуноокрашивании mCherry не может быть обнаружена значительная экспрессия. Масштабные линейки составляют 500 мм. (Данные в a, c адаптированы из7 с разрешениями, Copyright 2020 Nature-Springer). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
ATAC требует успешного внедрения нескольких методов для успешной нейромодуляции конкретных нейронных цепей, включая точное нацеливание под контролем МРТ, FUS-BBBO и гистологическую оценку экспрессии генов. Компоненты, пригодные для 3D-печати, были разработаны для упрощения нацеливания на небольшие структуры мозга с помощью FUS-BBBO под визуальным контролем.
Проведение фокусированного ультразвука под контролем МРТ (МРТФУЗ) сопряжено с рядом проблем. Во-первых, типичная катушка МРТ имеет ограниченное пространство, которое предназначено только для размещения образца, а не ультразвукового оборудования. Большие отверстия МРТ увеличивают стоимость оборудования и снижают качество изображения, так как сигнал связан с коэффициентом заполнения катушки32. Следовательно, любое оборудование FUS, размещенное поверх изображения животного в МРТ, поставит под угрозу качество изображения. Во-вторых, разработка устройств, совместимых с МРТ, сложна и дорога. Материалы, совместимые с МРТ, должны быть диамагнитными, иметь низкую склонность к созданию вихревых токов при радиочастотном облучении и иметь низкую магнитную восприимчивость в сильных магнитных полях. В любом проводящем материале создание вихревых токов или его магнитная восприимчивость также отрицательно сказываются на качестве изображения. Наконец, доступные МРТ-совместимые материалы имеют более низкие модули Юнга и долговечность, чем металлы, обычно используемые в производстве аппаратов точного наведения, например, стереотаксических рамок. Двигатели, используемые для регулировки положения, должны быть совместимы с МРТ и располагаться за пределами отверстия МРТ из-за их размера. Эти двигатели должны быть подключены на расстоянии от датчика внутри отверстия МРТ с использованием материалов, совместимых с МРТ. Проблемы пластиковой деформации, отсутствие достаточного пространства внутри канала ствола для реализации компонентов прочного размера и недостаточное пространство для изменения положения прицеливания по всему мозгу повлияли на точность прицеливания в предыдущих работах.
Для решения этих проблем было принято решение о проведении визуализации в МРТ и введении FUS-BBBO вне сканера. Чтобы обеспечить МРТ-наведение, мышей поместили внутрь напечатанного на 3D-принтере фиксатора, который имел видимую для МРТ направляющую, которую можно было использовать для локализации структур мозга мыши как в МРТ, так и в пространстве координат стереотаксиса. Поскольку и череп мыши, и направляющая для наведения надежно прикреплены к держателям ушных планок (рис. 1, а, б), руководство по наведению может быть использовано для корреляции пространственных координат в изображении МРТ и обнуления стереотаксических инструментов. Фиксатор не имеет движущихся частей и не содержит датчика, что позволило сделать его прочным и достаточно маленьким для размещения внутри МРТ, а также устранило помехи сигнала от электроники датчика. Пространство внутри направляющей по наведению было выдолблено, так как на МРТ видна напечатанная на 3D-принтере опора для некоторых материалов (рис. 1c). Отверстия в сборке были введены для обеспечения калибровки стереотаксиса (рис. 3). Ультразвуковой преобразователь был прикреплен к электрододержателю стереотаксиса, и наведение осуществлялось, как описано в разделе 4 (рис. 1d). Преобразователь должен поддерживаться по всей длине корпусом ушных планок, предотвращая любое отклонение от плоскости уровня. Наведение в дорсо-вентральном направлении может быть достигнуто с помощью фазовых сдвигов в кольцевой решетке.
Практическая точность наведения определяется ультразвуковой фокусировкой и затуханием черепа. Процедура FUS-BBBO была подробно описана на крысах11 и была реализована на ряде других модельных организмов 23,33,34 и на людях 16,17. Зависимость между размером фокуса ультразвука обратно пропорциональна частоте, где более высокие частоты могут привести к более точной подаче. Однако затухание черепа увеличивается с частотами35, что может привести к нагреву черепа и повреждению кортикальных областей. Точная стратегия таргетинга будет зависеть от участка мозга. Участки, где в ткани мозга помещается половина максимального давления во всю ширину, позволяют предсказуемо и безопасно открывать ГЭБ во многих структурах мозга, таких как полосатое тело, средний мозг и гиппокамп. Области, расположенные вблизи основания мозга, представляют особую проблему у мышей. Мозг мыши имеет размеры примерно 8-10 мм в дорсо-вентральном направлении, что сопоставимо с половиной максимального размера многих коммерчески доступных датчиков. Следовательно, нацеливание на нижнюю часть черепа может привести к отражению ультразвука от костей и воздуха, присутствующего в ушных каналах, во рту или трахее, что может привести к непредсказуемым картинам высокого и низкого давления36. Некоторые из этих давлений могут пересекать порог инерционной кавитации, который, как было показано, вызывает кровотечение и повреждение тканей37. Для нацеливания на области, расположенные вблизи основания черепа, может быть предпочтительнее использовать интерсекциональный ATAC7, где интерсекционная генетика38 используется для ограничения экспрессии генов меньшей областью, чем та, на которую нацелен пучок FUS. В опубликованном примере интерсекционального ATAC трансгенное животное, экспрессирующее фермент редактирования генов (Cre38) в дофаминергических клетках, было направлено ультразвуком в подсекцию области, содержащей дофаминергические клетки. Наконец, ФУЗИ может воздействовать на кортикальные области, но дифракция и отражение ультразвука могут приводить к неравномерным профилям давления. Этот протокол не охватывает нацеливание на области коры головного мозга, так как он будет сильно зависеть от используемого вида; тем не менее, было обнаружено некоторое нацеливание на кору головного мозга над гиппокампом 7 (например, рис.7), что указывает на то, что, по крайней мере, у мышей, это возможно.
Выбор хемогенетического активатора и дозировка будут зависеть от конкретных потребностей эксперимента. В ряде исследований, в том числе в одном из исследований авторов7, не было выявлено значимого неспецифического ответа39,40, в то время как более высокие дозы (например, 10 мг/кг) могут вызывать побочные эффекты, по крайней мере, в некоторых случаях41. Однако, как и во всех поведенческих экспериментах, надлежащий контроль31 имеет важное значение из-за потенциальной нецелевой активности CNO и его метаболитов42. Такой контроль может включать введение CNO и физиологического раствора животным, экспрессирующим DREADD, и введение CNO животным дикого типа, или, в некоторых конкретных случаях, сравнение ипси- и контралатеральных участков мозга, которые, соответственно, экспрессируют и не экспрессируют хемогенетические рецепторы. Кроме того, недавние исследования выявили ряд новых агонистов DREADD с улучшенной специфичностью28,29,43. Другие хемогенетические рецепторы 5,25,44 также могут быть использованы в сочетании с процедурой ATAC.
Гистологическая оценка экспрессии генов необходима посмертно для каждого животного. Небольшая часть животных демонстрирует плохую экспрессию генов после FUS-BBBO7. Кроме того, необходимо показать пространственную точность и специфичность экспрессии генов, так как возможно неправильное нацеливание. Следует отметить, что некоторые ААВ могут демонстрировать ретроградную или антероградную способность к отслеживанию45 и могут вызывать трансфекцию вдали от участка, на который направлено ультразвуковое исследование, несмотря на точное ультразвуковое наведение. Если экспрессируемый хемогенетический рецептор сливается с флуорофором или совместно экспрессирует его, визуализации флуорофора в срезах ткани может быть достаточно для оценки локализации и интенсивности экспрессии. Тем не менее, многие флуоресцентные белки повреждаются в процессе фиксации тканей, и иммуноокрашивание для белка mCherry, которое часто используется с DREADD, дало лучший сигнал в предыдущих исследованиях7. Наконец, из-за плотности нейронов в определенных частях мозга (например, в слое зернистых клеток в гиппокампе), использование ядерно-локализованных флуорофоров, экспрессируемых при IRES, в отличие от слияний, для подсчета клеток может быть полезным, поскольку ядра могут быть легко сегментированы и окрашены ядерными красителями, такими как DAPI или TO-PRO-3. Для оценки нейромодуляции с помощью окрашивания c-Fos необходимо выполнить ядерное контрокрашивание и подсчет положительных ядер c-Fos, а не какого-либо флуоресцентного сигнала. В некоторых случаях клеточный мусор может проявлять флуоресценцию и искажать измерения положительных клеток.
Ограничения доставки лекарств и генов с помощью FUS-BBBO включают более низкое разрешение, чем при инвазивных внутричерепных инъекциях, и необходимость введения большего количества инъекционных препаратов или вирусных векторов. Кроме того, в то время как прямая инъекция в мозг приводит к исключительной доставке в место инъекции, FUS-BBBO использует внутривенный путь, что приводит к возможной доставке в периферические ткани. К ограничениям использования хемогенетики для нейромодуляции относится медленная временная шкала, которая может быть неадекватна некоторым поведенческим протоколам, требующим быстрых изменений интенсивности нейромодуляции.
Раскрытие информации
Отсутствие конфликта интересов.
Благодарности
Это исследование было поддержано Фондом мозга и поведения, NARSAD Young Investigator Award. Несколько компонентов, напечатанных на 3D-принтере, были первоначально разработаны Фабьеном Рабюссо (Fabien Rabusseau) (Image Guided Therapy, Франция). Автор благодарит Джона Хита (John Heath) и Маргарет Свифт (Margaret Swift) за техническую помощь в подготовке рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 21-gauge needles (BD) | Fisher Scientific | 14826C | |
| 25-gauge butterfly catheter | Harvard Bioscience | 725966 | |
| 30-gauge needles (BD) | Fisher Scientific | 14826F | |
| Absorbent blue pad | Office Depot | 902406 | |
| Anti-c-Fos antibody | Santa Cruz Biotechnology | SC-253-G | |
| Anti-mCherry antibody | Thermofisher | PA534974 | |
| Bruker Biospec 70/30 | Bruker | custom | includes the RF coils |
| Clozapine-n-oxide | Tocris | 4936 | |
| Custom designed 3D printed mouse harnesses and MRIgFUS targeting components | ImageGuidedTherapy, Szablowski lab | custom | download from szablowskilab.org/downloads |
| Custom MRIgFUS machine | ImageGuidedTherapy | N/A | |
| Definity microbubbles | Lantheus | DE4 | |
| Degassed aquasonic/ultrasound gel | Fisher Scientific | 5067714 | |
| Depilation crème | Nair | n/a | |
| Eight-element annular array transducer | Imasonic Inc. | custom | |
| Ethanol Pads/Alcohol Swabs (70%) (BD) | Office Depot | 599893 | |
| Heparin | Sigma-Aldrich | H3149-25KU | |
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Ketamine | Patterson Veterinary | 07-890-8598 | |
| Neutral buffered formalin (10%) | Sigma-Aldrich | HT501128-4L | |
| Optical fiber hydrophone | Precision Acoustics | ||
| PE10 tubing | Fisher Scientific | NC1513314 | |
| Peristaltic pump | |||
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | 524650-1EA | |
| Prohance contrast agent | Bracco | 0270-1111-04 | |
| Saline | Fisher Scientific | NC9054335 | |
| Secondary antibody, Donkey-anti goat | ThermoFisher | A-11055 | |
| Secondary antibody, Donkey-anti rabbit | ThermoFisher | 84546 | |
| Surgical scissors (straight) | Fisher Scientific | 17467480 | |
| ThermoGuide Software | ImageGuidedTherapy | ||
| Tissue glue (Gluture) | Fisher Scientific | NC9855218 | |
| Tuberculin Syringe (1 mL) (BD) | Fisher Scientific | 14823434 | |
| VeroClear 3D printable material | Stratasys | RGD810 | |
| Vialmix microbubble activation device | Lantheus | VMIX | |
| Vibrating microtome | Compresstome | VF-300 | |
| Xylazine | Sigma-Aldrich | X1251-1G |
Ссылки
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
- Zhang, F., Wang, L. -. P., Boyden, E. S., Deisseroth, K. Channelrhodopsin-2 and optical control of excitable cells. Nature Methods. 3, 785-792 (2006).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences. 104, 5163-5168 (2007).
- Lerchner, W., et al. Reversible silencing of neuronal excitability in behaving mice by a genetically targeted, ivermectin-gated Cl- channel. Neuron. 54, 35-49 (2007).
- Magnus, C. J., et al. Chemical and genetic engineering of selective ion channel-ligand interactions. Science. 333, 1292-1296 (2011).
- Deeb, W., et al. Proceedings of the fourth annual deep brain stimulation think tank: a review of emerging issues and technologies. Frontiers in Integrative Neuroscience. 10, 38 (2016).
- Szablowski, J. O., Lee-Gosselin, A., Lue, B., Malounda, D., Shapiro, M. G. Acoustically targeted chemogenetics for the non-invasive control of neural circuits. Nature Biomedical Engineering. 2, 475-484 (2018).
- Elias, W. J., et al. A pilot study of focused ultrasound thalamotomy for essential tremor. New England Journal of Medicine. 369, 640-648 (2013).
- Burgess, A., Hynynen, K. Noninvasive and targeted drug delivery to the brain using focused ultrasound. ACS Chemical Neuroscience. 4, 519-526 (2013).
- Kinoshita, M., McDannold, N., Jolesz, F. A., Hynynen, K. Noninvasive localized delivery of Herceptin to the mouse brain by MRI-guided focused ultrasound-induced blood-brain barrier disruption. Proceedings of the National Academy of Sciences U. S. A. 103, 11719-11723 (2006).
- Samiotaki, G., Acosta, C., Wang, S., Konofagou, E. E. Enhanced delivery and bioactivity of the neurturin neurotrophic factor through focused ultrasound-mediated blood-brain barrier opening in vivo. Journal of Cerebral Blood Flow & Metabolism. 35, 611-622 (2015).
- O'Reilly, M. A., Waspe, A. C., Chopra, R., Hynynen, K. MRI-guided disruption of the blood-brain barrier using transcranial focused ultrasound in a rat model. Journal of Visualized Experiments. (61), e3555 (2012).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human gene Therapy. 23, 1144-1155 (2012).
- Hsu, P. -. H., et al. Noninvasive and targeted gene delivery into the brain using microbubble-facilitated focused ultrasound. PloS One. 8, 58682 (2013).
- Wang, S., Olumolade, O. O., Sun, T., Samiotaki, G., Konofagou, E. E. Noninvasive, neuron-specific gene therapy can be facilitated by focused ultrasound and recombinant adeno-associated virus. Gene Therapy. 22, 104 (2015).
- Downs, M. E., et al. Long-Term Safety of Repeated Blood-Brain Barrier Opening via Focused Ultrasound with Microbubbles in Non-Human Primates Performing a Cognitive Task. PLoS One. 10, 0125911 (2015).
- Lipsman, N., et al. Blood-brain barrier opening in Alzheimer's disease using MR-guided focused ultrasound. Nature Communications. 9, 2336 (2018).
- Carpentier, A., et al. Clinical trial of blood-brain barrier disruption by pulsed ultrasound. Science Translational Medicine. 8, 343 (2016).
- Sternson, S. M., Roth, B. L. Chemogenetic Tools to Interrogate Brain Functions. Annual Reviews Neurosciences. 37, 387-407 (2014).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63, 27-39 (2009).
- Zhu, H., et al. Chemogenetic inactivation of ventral hippocampal glutamatergic neurons disrupts consolidation of contextual fear memory. Neuropsychopharmacology. 39, 1880-1892 (2014).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound in Medicine & Biology. 33, 95-104 (2007).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human Gene Therapy. 23, 1144-1155 (2012).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-646 (2001).
- Yang, F. -. Y., Fu, W. -. M., Chen, W. -. S., Yeh, W. -. L., Lin, W. -. L. Quantitative evaluation of the use of microbubbles with transcranial focused ultrasound on blood-brain-barrier disruption. Ultrasonics Sonochemistry. 15, 636-643 (2008).
- Vardy, E., et al. A New DREADD Facilitates the Multiplexed Chemogenetic Interrogation of Behavior. Neuron. 86, 936-946 (2015).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Sciences. 1, 61-72 (2018).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Nagai, Y., et al. Deschloroclozapine: a potent and selective chemogenetic actuator enables rapid neuronal and behavioral modulations in mice and monkeys. bioRxiv. , 854513 (2019).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Science. 1, 61-72 (2018).
- Bullitt, E. Expression of c-fos-like protein as a marker for neuronal activity following noxious stimulation in the rat. Journal of Comparative Neurology. 296, 517-530 (1990).
- Mahler, S. V., Aston-Jones, G. CNO Evil? Considerations for the use of DREADDs in behavioral neuroscience. Neuropsychopharmacology. 43, 934 (2018).
- Gruber, B., Froeling, M., Leiner, T., Klomp, D. W. J. RF coils: A practical guide for nonphysicists. Journal of Magnetic Resonance Imaging. 48, 590-604 (2018).
- Treat, L. H., McDannold, N., Vykhodtseva, N., Hynynen, K. Transcranial MRI-guided focused ultrasound-induced blood-brain barrier opening in rats. IEEE. 2, 998-1000 (2004).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Feasibility of transcranial, localized drug-delivery in the brain of Alzheimer's-model mice using focused ultrasound. IEEE. 2, 988-991 (2005).
- Cobbold, R. S. . Foundations of Biomedical ultrasound. , (2006).
- Younan, Y., et al. Influence of the pressure field distribution in transcranial ultrasonic neurostimulation. Medical Physics. 40, 082902 (2013).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Physics in Medicine and Biology. 51, 793-807 (2006).
- Branda, C. S., Dymecki, S. M. Talking about a Revolution: The Impact of Site-Specific Recombinases on Genetic Analyses in Mice. Developmental Cell. 6, 7-28 (2004).
- Jendryka, M., et al. Pharmacokinetic and pharmacodynamic actions of clozapine-N-oxide, clozapine, and compound 21 in DREADD-based chemogenetics in mice. Scientific Reports. 9, 4522 (2019).
- Manvich, D. F., et al. The DREADD agonist clozapine N-oxide (CNO) is reverse-metabolized to clozapine and produces clozapine-like interoceptive stimulus effects in rats and mice. Scientific Reports. 8, 3840 (2018).
- Martinez, V. K., et al. Off-Target Effects of Clozapine-N-Oxide on the Chemosensory Reflex Are Masked by High Stress Levels. Frontiers in Physiology. 10, 521 (2019).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Bonaventura, J., et al. High-potency ligands for DREADD imaging and activation in rodents and monkeys. Nature Communications. 10, 1-12 (2019).
- Roth, B. L. DREADDs for Neuroscientists. Neuron. 89, 683-694 (2016).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of Transduction Efficiency, Tropism and Axonal Transport of AAV Serotypes 1, 2, 5, 6, 8 and 9 in the Mouse Brain. PLoS One. 8, 76310 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены