Method Article
Apertura de la barrera hematoencefálica inducida por ultrasonido focalizado para dirigirse a las estructuras cerebrales y evaluar la neuromodulación quimiogenética
En este artículo
Resumen
Este protocolo delinea los pasos necesarios para la administración de genes a través de la apertura de la barrera hematoencefálica (BBB) por ultrasonido focalizado, la evaluación de la expresión génica resultante y la medición de la actividad de neuromodulación de los receptores quimiogenéticos a través de pruebas histológicas.
Resumen
La quimiogenética acústicamente dirigida (ATAC) permite el control no invasivo de circuitos neuronales específicos. ATAC logra dicho control a través de una combinación de apertura de la barrera hematoencefálica inducida por ultrasonido focalizado (FUS) (FUS-BBBO), la administración de genes con vectores virales adenoasociados (AAV) y la activación de la señalización celular con receptores de proteínas quimiogenéticos y sus ligandos afines. Con ATAC, es posible transducir regiones cerebrales grandes y pequeñas con precisión milimétrica utilizando una sola aplicación de ultrasonido no invasivo. Esta transducción puede permitir posteriormente una neuromodulación a largo plazo, no invasiva y sin dispositivos en animales que se mueven libremente utilizando un fármaco. Dado que FUS-BBBO, AAV y quimiogenética se han utilizado en múltiples animales, ATAC también debería ser escalable para su uso en otras especies animales. Este artículo amplía un protocolo publicado anteriormente y describe cómo optimizar la entrega de genes con FUS-BBBO a pequeñas regiones del cerebro con guía por resonancia magnética, pero sin necesidad de un complicado dispositivo FUS compatible con resonancia magnética. El protocolo, también, describe el diseño de los componentes de orientación y restricción de ratones que pueden ser impresos en 3D por cualquier laboratorio y pueden ser fácilmente modificados para diferentes especies o equipos personalizados. Para ayudar a la reproducibilidad, el protocolo describe en detalle cómo se utilizaron las microburbujas, los AAV y la venopunción en el desarrollo de ATAC. Finalmente, se muestran datos de ejemplo para guiar las investigaciones preliminares de los estudios que utilizan ATAC.
Introducción
El uso de tecnologías de neuromodulación específicas de circuitos, como la optogenética1,2 y la quimiogenética 3,4,5, ha avanzado en nuestra comprensión de las afecciones psiquiátricas como trastornos del circuito neuronal. Los circuitos neuronales son difíciles de estudiar y aún más difíciles de controlar en el tratamiento de trastornos cerebrales porque generalmente se definen por tipos específicos de células, regiones cerebrales, vías de señalización molecular y tiempo de activación. Idealmente, tanto para la investigación como para las aplicaciones clínicas, dicho control se ejercería de forma no invasiva, pero lograr una neuromodulación precisa y no invasiva es un desafío. Por ejemplo, aunque los fármacos neuroactivos pueden llegar al cerebro de forma no invasiva, carecen de especificidad espacial al actuar en todo el cerebro. Por otro lado, la estimulación eléctrica cerebral profunda puede controlar regiones cerebrales específicas, pero tiene dificultades para controlar tipos específicos de células y requiere cirugíay colocación de dispositivos.
La quimiogenética acústicamente dirigida7 (ATAC) proporciona neuromodulación con especificidad espacial, de tipo celular y temporal. Combina tres técnicas: la apertura de la barrera hematoencefálica inducida por ultrasonido focalizado (FUS-BBBO) para la orientación espacial, el uso de vectores virales adenoasociados (AAV) para administrar genes de forma no invasiva bajo el control de promotores específicos del tipo de célula y receptores quimiogenéticos diseñados para modular los circuitos neuronales transfectados de forma selectiva mediante la administración de fármacos. FUS es una tecnología aprobada por la FDA que aprovecha la capacidad del ultrasonido para enfocarse profundamente dentro de los tejidos, incluido el cerebro humano, con precisión espacial milimétrica. A alta potencia, el FUS se utiliza para la ablación dirigida no invasiva, incluido un tratamiento aprobado por la FDA para el temblor esencial8. FUS-BBBO combina ultrasonidos de baja intensidad con microburbujas administradas sistémicamente, que oscilan en los vasos sanguíneos en el foco de ultrasonido, lo que resulta en una apertura localizada, temporal (6-24 h) y reversible de la BHE9. Esta apertura permite la entrega de proteínas9,10, moléculas pequeñas 11 y vectores virales7,12,13,14 al cerebro sin daño tisular significativo en roedores 10 y primates no humanos 15. Se están llevando a cabo ensayos clínicos para FUS-BBBO16,17, lo que indica posibles aplicaciones terapéuticas de esta técnica.
La administración de genes virales mediante AAV también está avanzando rápidamente hacia el uso clínico para los trastornos del SNC, con las recientes aprobaciones regulatorias de la FDA y la UE como hitos importantes. Por último, los receptores quimiogenéticos18, como los Receptores de Diseño Activados Exclusivamente por Fármacos de Diseño (DREADDs), son ampliamente utilizados por los neurocientíficos para proporcionar control farmacológico sobre la excitación neuronal en animales transgénicos o transfectados 19,20. Los DREADDs son receptores acoplados a proteínas G (GPCRs) que han sido modificados genéticamente para responder a moléculas quimiogenéticas sintéticas en lugar de ligandos endógenos, de modo que la administración sistémica de estos ligandos aumenta o reduce la excitabilidad de las neuronas que expresan DREADD. Cuando estas tres tecnologías se combinan en ATAC, se pueden utilizar para la modulación no invasiva de circuitos neuronales seleccionados con precisión espacial, de tipo celular y temporal.
Aquí, ampliamos y actualizamos un protocolo previamente publicado para FUS-BBBO11 mediante la inclusión de una metodología para la orientación precisa de las regiones cerebrales con FUS-BBBO en ratones utilizando un equipo de orientación simple impreso en 3D. También mostramos una aplicación de FUS-BBBO a ATAC. Mostramos los pasos necesarios para la administración de AAVs portadores de receptores quimiogenéticos, y la evaluación de la expresión génica y la neuromodulación por histología. Esta técnica es particularmente aplicable para apuntar a regiones cerebrales grandes o múltiples para la expresión génica o la neuromodulación. Por ejemplo, un área amplia de una corteza puede ser fácilmente transducida con FUS-BBBO y modulada usando quimiogenética. Sin embargo, la administración de genes con una técnica alternativa, las inyecciones intracraneales, requeriría un gran número de inyecciones invasivas y craneotomías. FUS-BBBO y su aplicación, ATAC, se pueden escalar a animales de diferentes tamaños, donde las regiones del cerebro son más grandes y más difíciles de atacar de forma invasiva.
Protocolo
Todos los experimentos se llevaron a cabo bajo un protocolo aprobado por el Comité Institucional de Cuidado y Uso de Animales del Instituto de Tecnología de California, donde los datos fueron obtenidos originalmente por J.O.S.
1. Diseño e impresión 3D de arneses para animales y hardware de guía de imágenes
- Utilice los archivos del sitio web del laboratorio Szablowski en: https://www.szablowskilab.org/downloads para la impresión 3D de los componentes.
- Asegúrese de que el material de impresión tenga una baja susceptibilidad en la RMN, pero que tenga un soporte visible para la RMN. Consulte los detalles de los materiales utilizados en la sección de materiales y reactivos.
- Tenga en cuenta la degradación del material con múltiples usos probando el material repetidamente y observando los sitios de desgaste que deben reforzarse. Asegúrese de que las paredes impresas tengan al menos 2 mm de grosor.
- Utilice impresoras 3D de alta precisión para mejorar la precisión de la orientación.
- Contrarreste la gravedad y otras fuerzas para evitar la desviación de los componentes de plástico impresos en 3D apoyando los componentes a lo largo de su longitud y aumentando el grosor de las paredes impresas en 3D si se observa alguna flexión.
- Tenga en cuenta la precisión en múltiples ejes, incluidos anterior/posterior, medial/lateral, dorsal/ventral, así como guiñada, cabeceo e inclinación.
- Pruebe la precisión de la orientación realizando FUS-BBBO y registrando la desviación de la posición objetivo.
- Si utiliza sistemas estereotáxicos motorizados, evalúe los efectos del movimiento dinámico en la elasticidad del material grabando el procedimiento de orientación FUS-BBBO en vídeo y corrija cualquier desviación engrosando las paredes del material impreso en 3D.
2. Descripción del sistema de ultrasonido
- Utilice un sistema de ultrasonido con un transductor anular de ocho elementos (diámetro = 25 mm, punto focal natural = 20 mm; apertura (F) = 0,8)) y acople la carcasa a la cabeza con gel de ultrasonido desgasificado aplicando gel a la cabeza del ratón afeitado.
NOTA: La frecuencia central de un transductor utilizado en un estudio previo7 fue de 1,5 MHz, la duración del pulso fue de 10 ms y la frecuencia de repetición del pulso fue de 1 Hz durante 120 s. Las presiones se calibraron con hidrófono de fibra óptica y se mantuvieron entre 0,36-0,45 MPa. Supongamos una atenuación acústica del 18% a través del cráneo21 para 1,5 MHz y el hueso parietal. La gama de condiciones apropiadas para una apertura segura de BBB y la administración de AAV se han descrito en detalle en otra parte 7,14,22.
3. Preparación animal
- Anestesiar un ratón mediante inhalación de isoflurano al 2% con aire de grado médico. Verifique la profundidad de la anestesia con un pellizco táctil para confirmar la falta de respuesta. Luego, aplique un ungüento oftálmico para evitar que la córnea se seque usando un hisopo estéril de un solo uso para evitar la contaminación cruzada del tubo de ungüento.
NOTA: El procedimiento típico de FUS-BBBO puede oscilar entre 30 minutos y 2 horas, y la anestesia debe mantenerse durante todo el proceso. - Después de anestesiar al ratón, lavar un catéter limpio con solución salina heparinizada (10 U/ml).
NOTA: Un catéter apropiado para un ratón de 25-35 g tiene una aguja de 30 g y un tubo de PE10. - Posteriormente, desinfecte la cola del ratón con una almohadilla de etanol al 70%. Coloque el catéter de la vena de la cola en una vena lateral de la cola y asegúrelo con un pegamento para tejidos. Observe un reflujo de sangre desde la vena de la cola hacia el catéter para confirmar su colocación.
- Afeita la cabeza del ratón y luego usa crema depilatoria después de que el pegamento tisular se haya secado para reducir la posibilidad de que las burbujas de aire queden atrapadas bajo el gel ultrasónico durante la insonación.
- Coloque el ratón en un carro de resonancia magnética impreso en 3D, montando los dientes frontales en una barra de mordida y la cabeza dentro de una nariz (Figura 1a).
- Inyecte hasta 10 μL de lidocaína por vía subcutánea en el sitio que entra en contacto con las barras de las orejas desafiladas. Luego, asegure las barras desafiladas al cráneo y aplique cantidades seguras de presión, teniendo cuidado de no aplicar presión a la tráquea, ya que impide la respiración. Observe la respiración durante 30 s para confirmar que el animal respira libremente a un ritmo de 1/s.
- Conecte la guía de orientación a las barras de los oídos, verifique la respiración como en el paso 3.6 (Figura 1b) y continúe monitoreando visualmente la respiración durante todo el procedimiento cada minuto. Una frecuencia respiratoria elevada por encima de 1/s es una de las indicaciones de pérdida de anestesia. Continúe monitoreando la respuesta de pellizco de los dedos de los pies cada 5 minutos cuando los ratones no estén en el escáner de resonancia magnética o si la frecuencia respiratoria se eleva por encima de 1/s.
- Transfiera el carro de resonancia magnética a un soporte de resonancia magnética y luego dentro del orificio de un imán.
NOTA: El diseño del hardware está optimizado para una bobina de 72 mm dentro de una resonancia magnética 7T. - Adquiera una secuencia de resonancia magnética para localizar el ratón en el escáner.
- Seleccione la secuencia de disparo rápido de ángulo bajo (FLASH) en 3D para adquirir la totalidad del cerebro, utilizando los siguientes parámetros, de acuerdo con las instrucciones específicas del fabricante del instrumento. Tiempo de eco: 3,9 ms, Tiempo de repetición: 15 ms, Ángulo de pulso de excitación: 15°, Tamaño de la matriz: 130 x 130 x 114, Resolución: 350 x 200 x 200 μm por vóxel, Promedios: 1, Tiempo de adquisición: 3 min 42s
- Transfiera archivos desde el sistema de resonancia magnética a una computadora que controle el sistema FUS.
- Abra la secuencia de imágenes en el software para realizar la orientación guiada por RMN, donde debería aparecer la imagen como se muestra en la Figura 1c.
4. Focalización guiada por resonancia magnética
NOTA: Con el uso de guías de focalización diseñadas a medida, no es necesario colocar un transductor de ultrasonido dentro de una resonancia magnética, ni es necesario incidir la piel para realizar la focalización mediante la reducción a cero de la estereotasa en las líneas bregma y lambda. Siga los pasos que se indican a continuación para realizar el proceso de segmentación.
- Coloque el carro dentro de un instrumento estereotáxico. Asegúrelo en su lugar con un bloque de metal con una cinta adhesiva de doble cara y presionando el carro contra dos postes de soporte del instrumento estereotáxico.
- Transfiera imágenes de resonancia magnética a una computadora con un software de guía FUS en ejecución seleccionando archivos en el administrador de datos, haciendo clic con el botón derecho para abrir las opciones del menú y seleccionando 'Transferir inmediatamente'.
- Abra el software de guía FUS y cargue la imagen haciendo clic en 'Abrir secuencia' y cargando todos los archivos de la secuencia de imágenes.
- Vuelva a formatear la imagen a tres ejes presionando el botón derecho y 'Reformatar'.
- Localice el transductor en la guía de orientación circular (Figura 1c) haciendo clic con el botón derecho.
- En la vista sagital, ajuste la posición vertical de un transductor virtual para tener en cuenta el grosor del baño de agua y la carcasa del transductor (en este caso, 8,2 mm hacia arriba, Figura 1d).
- Señale las áreas a las que se dirigirá en el planificador de trayectorias y anote las coordenadas en una hoja de cálculo (en este caso, el mesencéfalo, como en la Figura 1d).
- Marque la profundidad deseada de la orientación (valor z en la trayectoria electrónica (Figura 2) y anote las coordenadas en una hoja de cálculo.
- Apunte a cada uno de los puntos presionando 'Enviar trayectoria' y 'Ejecutar' (Figura 2).
NOTA: Esto se hace cuando se coloca un soporte para mouse dentro de los motores. Sin embargo, se puede lograr la misma orientación con alta precisión en un instrumento estereotáxico. - Para correlacionar las coordenadas de una resonancia magnética con el marco estereotáxico, coloque el transductor montado a medida sobre una guía de orientación y traslación hasta que cada uno de los tres pernos de orientación (Figura 3, elemento A) pueda pasar tanto por el soporte del transductor (Figura 3, elemento B) como por la guía de orientación (Figura 3, elemento C). Asegúrese de que los pernos no estén bajo tensión o inclinación.
- Traslade el transductor 10,56 mm hacia adelante en dirección anterior/posterior hasta que se encuentre en el mismo lugar donde aparece el centro de una guía de orientación en una resonancia magnética.
- Determine la distancia desde el centro del transductor virtual (Figura 3a, elemento A) hasta la región de destino (Figura 3a, elemento B) y mueva el transductor a estas coordenadas utilizando el marco estereotáxico.
- Proceda a la preparación de la solución inyectable.
5. Preparación de la solución inyectable
NOTA: Las soluciones de microburbujas son muy sensibles a la presión. En consecuencia, la mezcla vigorosa o la inyección rápida a través de agujas finas pueden colapsar las microburbujas y reducir la eficacia de la apertura de la BBB. Además, las microburbujas son más livianas que el agua y pueden flotar hasta la parte superior de un tubo, catéter o jeringa (Figura 4), por ejemplo, en un inyector automático. Se recomienda encarecidamente volver a suspender la solución de microburbujas inmediatamente antes de cada inyección.
- Extraer 0,8 ml de solución salina con una jeringa en un tubo de 1,5 ml.
- Con una jeringa, agregue 0.1 ml de agente de contraste para resonancia magnética en el mismo tubo de 1.5 ml y mezcle.
- Lleve la solución de microburbujas23,24 no activadas a temperatura ambiente.
- Justo antes de la insonación, active las microburbujas durante 45 s en un dispositivo de activación de microburbujas.
- Retire lentamente (más de ~ 3 s) 0,1 ml de microburbujas con una jeringa de tuberculina de 1 ml y una aguja de 21 g de la profundidad media de un líquido.
- Añadir 0,08 ml de microburbujas a la solución de contrastante y solución salina preparada en el paso 5.3. Mezclar dando golpecitos con la mano durante 15 s.
- Con una concentración final de AAVs de 0,5-2 x10 10 partículas virales por gramo de peso corporal (VP/g), inyectar la carga para su entrega (en este caso AAV9) a través de una aguja de 30 G en el catéter de la vena de cola, en el caso de ATAC – AAVs portadores de receptores quimiogenéticos, o un control negativo, como AAVs portadores de GFP bajo el mismo promotor.
- Mezcle las microburbujas a mano durante 15 s nuevamente para evitar la flotación (Figura 4).
- Inmediatamente después, aspire 200 μL de la solución de microburbujas a través de una jeringa sin aguja colocada. La falta de una aguja reducirá las fuerzas de cizallamiento en las microburbujas.
- Invierta la jeringa y mezcle presionando el émbolo hacia arriba y hacia abajo.
- Coloque la aguja de 30 G y, mientras aún está invertida, empuje lentamente las microburbujas hasta que aparezcan gotas en el extremo de una aguja.
6. Procedimiento de insonación
- Ajuste los parámetros para la insonación: duración del pulso de 10 ms, 120 repeticiones, cada s, y presión de 0,30-0,45 MPa en el cráneo.
- Retire la guía de orientación y aplique gel de ultrasonido desgasificado en la cabeza del ratón, asegurándose de que no se formen burbujas.
- Baje el transductor y colóquelo directamente en el soporte de la barra de la oreja, y marque las coordenadas en los instrumentos estereotáxicos (Figura 5).
- Inyectar la solución de AAV (0,5-2 x 1010 VP/g).
- Mezclar las microburbujas y la solución de contraste para RMN durante 15 s e inyectar 80 μL por ratón de 30 g.
- Aplique inmediatamente ultrasonido durante 120 s pulsando 'Enviar' y 'Ejecutar'.
- Si se dirige a más de un sitio, mueva el transductor a ese sitio y ajuste la orientación de profundidad siguiendo los números de la hoja de cálculo de los pasos 4.7-4.9. A continuación, repita los pasos 6.5-6.6 para cada sitio insonado.
7. Evaluación por resonancia magnética de la apertura de la BHE
NOTA: La evaluación por RMN de la abertura de la BHE se ha descrito en detalle en otra parte11. La ubicación de la apertura de la BHE se puede visualizar como áreas más brillantes en ratones que recibieron una inyección de un agente de contraste Gd ponderado en T1.
- Después de la aplicación de ultrasonido, registre una secuencia de resonancia magnética como en el paso 3.10.
- Retire el ratón del escáner de resonancia magnética y colóquelo en una jaula de recuperación para permitir la recuperación de la anestesia. Monitoree a los ratones diariamente para detectar signos de angustia, pérdida de peso u otros criterios de valoración humanitarios. Consulte al personal veterinario y a las guías institucionales de la IACUC para proceder con cualquier tratamiento en caso de que ocurran eventos adversos inesperados.
8. Estimulación DREADD con un ligando quimiogenético
- Escoge un receptor quimiogenético. Para los DREADD, elija el receptor hM3Dq para la activación neuronal a través de las vías acopladas a Gq19, el receptor hM4Di para la inhibición de la actividad neuronal a través de las vías acopladas Gi/o20, o el receptor KORD para la activación de las neuronas a través de las vías acopladas a Gs utilizando el ligando25 de Salvinorin-B.
- Disolver el n-óxido de clozapina (CNO) en solución salina estéril a una concentración de 1 mg/ml. Almacenar el CNO alícuota a -20 °C.
- Administrar CNO 19, u otro ligando quimiogenético26,27,28, por vía intraperitoneal a concentraciones entre 0,3 –10 mg/kg.
- Si se van a registrar los efectos de la CNO sobre el comportamiento, se debe comenzar a registrar la actividad conductual dentro de los 15-45 minutos posteriores a la administración del fármaco para lograr la máxima activación de los DREADDs19.
- Si se desea un análisis de la activación neuronal, utilice ratones para la evaluación histológica después de 60-120 minutos después de la inyección.
- Proceder a la eutanasia mediante perfusión cardíaca (ver sección 9).
9. Evaluación histológica de la expresión génica y la activación quimiogenética
NOTA: Una vez que se alcanza el criterio de valoración experimental (p. ej., fin del estudio conductual, tiempo necesario para la expresión génica), es fundamental confirmar la ubicación y la presencia de la expresión génica.
- Después de la activación con un ligando quimiogenético, realizar la perfusión cardíaca para preservar los tejidos.
- Anestesiar al ratón con una mezcla de ketamina (100 mg/kg) / xilacina (10 mg/kg) en solución salina estéril mediante una inyección IP. Confirme la anestesia con un pellizco en el dedo del pie y asegúrese de que la frecuencia respiratoria se haya reducido a aproximadamente 1/s. Proporcionar soporte térmico a través de la almohadilla térmica hasta la confirmación de la eutanasia.
- Prepare formalina tamponada neutra (NBF) al 10% y PBS con 10 unidades de heparina por ml.
NOTA: Las soluciones deben estar a 4 °C. - Vierta cada tampón en tubos separados de 50 ml y conéctelos y cebe una bomba peristáltica conectada a un catéter de mariposa de 25 G con solución de PBS/heparina.
- Sujete las extremidades a una almohadilla azul absorbente con cinta adhesiva y asegúrese de que el animal esté en posición supina sobre la almohadilla. Desinfectar el pelaje para evitar la contaminación cruzada de los órganos periféricos en caso de que sea necesario recogerlos.
- Abrir la cavidad peritoneal mediante una incisión transversal, exponiendo el diafragma.
- Abra la caja torácica a través de dos cortes de tijeras quirúrgicas a lo largo del eje anterior / posterior.
- Exponga el corazón y coloque la aguja en una cavidad izquierda (lado derecho del corazón visto en decúbito supino) y colóquela en el catéter de mariposa en el paso 9.1.3.
- Haga una pequeña incisión en el ventrículo derecho para permitir la salida de la sangre.
- Encienda la bomba peristáltica para comenzar a eliminar la sangre con PBS/heparina.
NOTA: Si este paso no se realiza adecuadamente, la sangre se coagulará durante la fijación con formol e impedirá la perfusión adecuada. - Después de que se haya eliminado toda la sangre y comience a salir PBS claro del ventrículo derecho, cambie la entrada de una bomba peristáltica a una solución NBF y comience la perfusión durante 25 ml por ratón.
- Extraer el cerebro, colocar en al menos 4 mL de NBF y posfijar durante 24 h.
- Seccionar el cerebro usando secciones coronales en un vibrátomo usando un espesor de sección de 50 μm.
- Coloque cada sección en un pocillo de una placa de 24 pocillos que almacene las secciones en todo el cerebro.
- Evaluar la expresión de los receptores quimiogenéticos fusionados a proteínas fluorescentes (p. ej., mCherry o mCitrine), bajo un microscopio fluorescente para identificar las secciones que muestran expresión y confirmar la ubicación. Es probable que la expresión sea tenue.
- Realice la inmunotinción contra el fluoróforo utilizando el siguiente protocolo:
- Colocar 3 secciones en 0,5 ml de solución que contenga un 10% de suero de un huésped de un anticuerpo secundario e incubar durante 30 min.
- Transfiera las secciones a una solución de un anticuerpo primario con una dilución de 1:250 a 1:1.000, utilizando 1:500 como punto de partida.
- Incubar las secciones con el anticuerpo primario durante la noche a 4 °C en una microplaca sellada con una película de parafina.
- Lave las secciones con PBS, 3 veces durante 5 minutos a la vez.
- Añadir 0,5 ml por pocillo de la solución de anticuerpos secundarios en suero al 10%.
- Incubar durante 4 h a temperatura ambiente.
- Lave las secciones con PBS, 3 veces durante 5 minutos a la vez.
- Móntelo en portaobjetos con un medio de montaje acuoso que contenga una tinción nuclear (p. ej., DAPI).
- Evalúe la localización y la propagación con un microscopio confocal realizando un escaneo de mosaico de una sección completa.
- Evalúe la intensidad de la expresión midiendo la intensidad de los píxeles de fluorescencia en regiones cerebrales específicas y compárelo con un control inyectado intracranealmente.
- Alternativamente, evalúe el porcentaje de neuronas positivas contando las células teñidas contra receptores quimiogenéticos, en comparación con las células DAPI positivas o marcadores específicos de la célula.
- Evalúe el daño tisular realizando tinción con hematoxilina en una sección de 50 μm y la obtención de imágenes para detectar la pérdida de células, la acumulación de restos celulares y otros signos de daño grave.
- Para evaluar la especificidad de la diana celular, realice una inmunotinción doble como se describe a continuación para el receptor quimiogenético y un marcador específico de la célula. A continuación, realice recuentos de células positivas como en el paso 9.8.
- Colocar 3 secciones en 0,5 ml de una solución que contenga un 10% de suero de un huésped de un anticuerpo secundario e incubar durante 30 min.
- Transfiera las secciones a una solución de un anticuerpo primario contra un marcador fluorescente de un receptor quimiogenético con una dilución de 1:250 a 1:1.000, utilizando 1:500 como punto de partida. Agregue un segundo anticuerpo primario de una especie huésped diferente que se dirija contra un marcador de interés específico de la célula (por ejemplo, CamkIIa).
- Incubar las secciones con el anticuerpo primario durante la noche a 4 °C en una microplaca sellada con una película de parafina.
- Lave las secciones con PBS, 3 veces durante 5 minutos a la vez.
- Añadir 0,5 ml por pocillo de solución de anticuerpos secundarios en suero al 10% de la especie huésped de ambos anticuerpos secundarios.
NOTA: Cada anticuerpo debe tener un fluoróforo distinto y debe ser reactivo contra los anticuerpos primarios en el paso 9.10.2. - Incubar durante 4 h a temperatura ambiente.
- Lave las secciones con PBS, 3 veces durante 5 minutos a la vez.
- Móntelo en portaobjetos y fíjelo con un medio de montaje acuoso que contenga una tinción nuclear.
10. Evaluar la activación neuronal con inmunotinción para c-Fos
- Realice la tinción de c-Fos como en el punto 9.5 de este protocolo utilizando un anticuerpo primario de c-Fos y un anticuerpo secundario con una etiqueta fluorescente distinta de la tinción nuclear.
- Cuente el porcentaje de células que son positivas tanto para c-Fos como para tinción nuclear en el área objetivo de un receptor quimiogenético.
- Analizar el porcentaje de núcleos positivos de c-Fos en un grupo de ratones que expresan receptores quimiogenéticos y tratados con un ligando quimiogenético o control de vehículo y en un grupo de ratones de tipo salvaje que son tratados con un ligando quimiogenético o un control de vehículo.
Resultados
El primer paso para realizar el protocolo ATAC es dirigir el FUS-BBBO a las regiones cerebrales deseadas. Por ejemplo, siguiendo el protocolo descrito, el hipocampo se atacó con FUS-BBBO, y se inyectó en los ratones un agente de contraste y AAV9 portador de DREADD, seguido de una secuencia de resonancia magnética 3D FLASH que adquiere imágenes del cerebro del ratón. Se logró una mejora de la señal T1 en la región del hipocampo (Figura 6) y en otras partes del cerebro (Figura 7). Después de varias semanas, los DREADDs se expresaron dentro de la región del cerebro objetivo. Si bien muchos DREADD se fusionan con un indicador fluorescente (por ejemplo, mCherry), se descubrió que el proceso de perfusión y fijación con formaldehído reduce drásticamente la fluorescencia de estas proteínas. La inmunotinción contra mCherry o el DREADD condujo a una detección más fiable de la expresión (Figura 8) basada en la experiencia previa. En experimentos anteriores, ~85% de los ratones mostraron expresión siguiendo FUS-BBBO7. Una prueba sencilla para determinar los niveles suficientes de expresión de los DREADD es comprobar su funcionalidad a nivel celular. Se puede hacer, por ejemplo, proporcionando un ligando quimiogenético o un control salino, como CNO 19, descloroclozapina28 u otros29, y esperando 2 horas antes de una perfusión y fijación cardíaca. A continuación, las secciones cerebrales se inmunodescribieron conjuntamente para la proteína c-Fos30, que indica una mayor actividad de las neuronas, y para DREADD. El experimento se consideró exitoso si el sitio del cerebro atacado con DREADDs mostró un número significativamente mayor de núcleos neuronales que son c-Fos positivos en el grupo que recibió un ligando quimiogenético en comparación con el grupo que recibió solución salina7 o en comparación con un sitio contralateral que no fue sometido a FUS-BBBO. Cabe destacar que existe la posibilidad de que algunos de estos ligandos activen neuronas de forma no específica sin expresión de DREADDs. Por ejemplo, se ha demostrado que el CNO se metaboliza en niveles bajos de clozapina en ratones, que atraviesa la barrera hematoencefálica y activa los DREADD con alta potencia27. Sin embargo, también se demostró que se unía a ubicaciones no específicas. Como en todos los experimentos, es fundamental incluir todos los controles adecuados en los estudios quimiogenéticos31. Un posible control es la administración del ligando quimiogenético a ratones de tipo salvaje, sin procedimientos, para excluir los efectos del fármaco solo en el ensayo conductual o histológico deseado. Otro control podría ser la inclusión de cuatro grupos: ligando DREADD +, DREADD + vehículo, EGFP + ligando, EGFP + vehículo, que tendrán en cuenta cualquier efecto potencial tanto de la entrega génica con FUS-BBBO como del ligando quimiogenético.
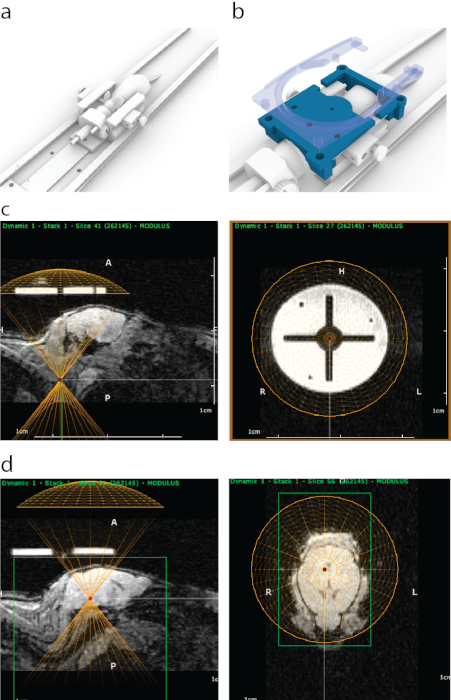
Figura 1: El proceso de focalización guiada por resonancia magnética de la FUS en ATAC. (a) Colocación del ratón con barras en las orejas, un cono en la nariz y una plataforma que pueda caber dentro de un escáner de resonancia magnética. (b) Una guía impresa en 3D (azul) que es visible en la resonancia magnética se fijó a los extremos del marco de la barra de la oreja y luego se aseguró en su lugar con un soporte de una bobina de resonancia magnética de superficie que contiene cuatro pernos a presión (azul semitransparente). (c) Apariencia de la guía impresa en 3D en la resonancia magnética sagital (panel izquierdo), con una parte inferior de la representación virtual de un transductor alineada (semicírculo amarillo) con la parte inferior de la guía. El panel derecho muestra la apariencia de la guía impresa en 3D en la resonancia magnética desde la vista coronal. El círculo brillante estaba hecho de un material de soporte de polijet que tiene un fuerte contraste de resonancia magnética. La cruz se formó con plástico. Un círculo amarillo representa la ubicación del transductor que se alineó concéntricamente con la guía dentro de un marco estereotáxico. (d) Para apuntar a las estructuras cerebrales, se movió un transductor virtual en dirección z por encima de los ratones para que conotara el grosor de un cono / carcasa de ultrasonido. En este caso, debido al grosor del baño de agua, el transductor se movió 8,2 mm por encima de la guía para apuntar con precisión. Las estructuras cerebrales se seleccionaron utilizando datos de imágenes de resonancia magnética, y sus coordenadas de resonancia magnética se escribieron y se introdujeron en la máquina estereotáxica. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Interfaz del software utilizado. Haga clic aquí para ver una versión más grande de esta figura.
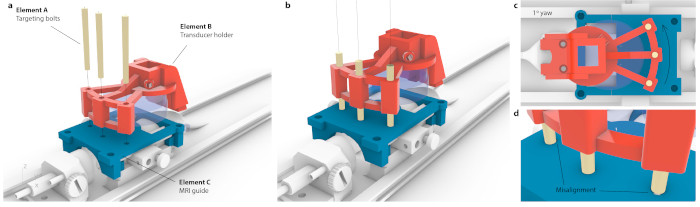
Figura 3: Proceso de coincidencia del espacio de coordenadas de la RM con el instrumento estereotáxico. (a) Se alinearon tres orificios dentro de un soporte de transductor con tres orificios dentro de la guía de resonancia magnética, y se insertaron tres pernos de orientación cónicos sin causar flexión en todo el conjunto. (b) Idealmente, los tres pernos se ubicarían en el centro de los agujeros. (c) Si hay alguna imprecisión en la alineación, no encajarían los tres pernos, por ejemplo, en caso de guiñada pequeña y probablemente imperceptible de 1°, solo encajaría un perno mientras que los pernos opuestos se atascarían en la guía de resonancia magnética. Alternativamente, podría haber una flexión visible de todo el conjunto a medida que se forzaran los pernos. d) Ampliación de la vista del ajuste de los pernos. Los pernos deben colocarse concéntricamente para obtener la mejor precisión. Haga clic aquí para ver una versión más grande de esta figura.
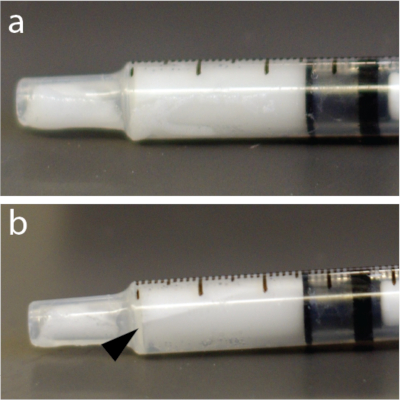
Figura 4: Redistribución rápida de microburbujas dentro de la jeringa. (a) La jeringa fue fotografiada 5 s después de la mezcla. (b) Un minuto después, había una capa claramente visible que mostraba algunas de las burbujas concentradas cerca de la parte superior de la jeringa de tuberculina de 1 mL. En este ejemplo, en particular, se utilizó una solución de microburbujas. Haga clic aquí para ver una versión más grande de esta figura.
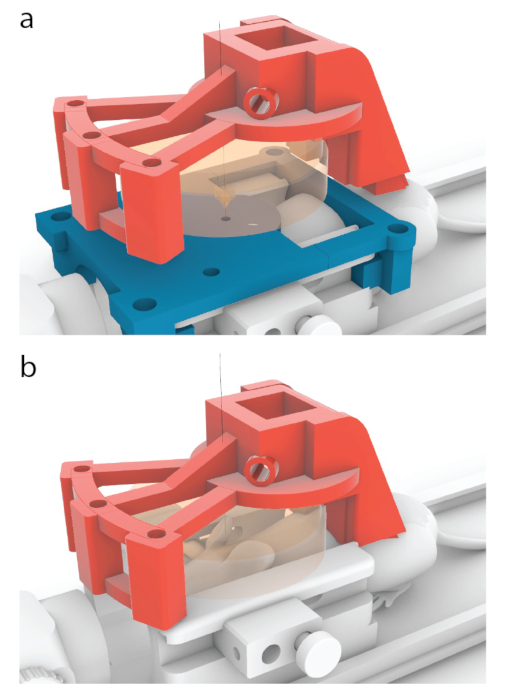
Figura 5: Proceso de colocación del centro de un transductor sobre el centro de una guía de resonancia magnética. (a) En los modelos que se muestran en este documento, el portador rojo ha sido diseñado para moverse 10,56 mm hacia adelante desde la posición que se muestra en la Figura 3b, a la que se muestra aquí. (b) Se retiró la guía azul de RM antes de la sonicación y se aplicó un gel de ultrasonido entre el ratón y el transductor (naranja) para asegurar el paso de la ecografía. Haga clic aquí para ver una versión más grande de esta figura.
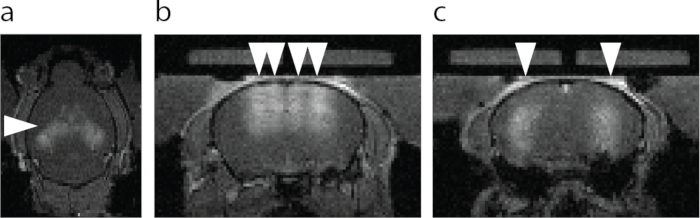
Figura 6: Visualización por resonancia magnética de la abertura de la BHE. (a) Vista axial de la abertura de la BBB. El área más brillante designada con una punta de flecha muestra la extravasación de un agente de contraste T1 de RMN. (b) Vista coronal del hipocampo dorsal y la corteza por encima del hipocampo apuntado con FUS-BBBO (puntas de flecha). (c) Vista coronal del hipocampo central apuntado con FUS-BBBO (puntas de flecha). Haga clic aquí para ver una versión más grande de esta figura.
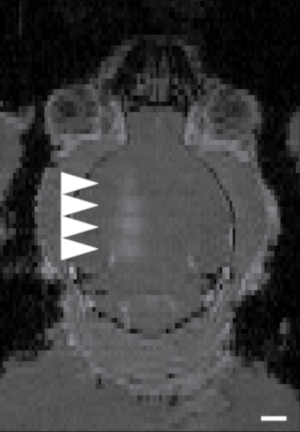
Figura 7: Ejemplo de focalización de 4 sitios cerebrales utilizando el sistema de focalización de tres pernos descrito en este artículo. Las áreas con puntas de flecha mostraron sitios abiertos de BHE con difusión de un agente de contraste para RMN. Los cuatro sitios fueron atacados en sucesión, con ~150 s entre cada abertura BBB, de abajo hacia arriba. La imagen fue tomada dentro de los 2 minutos posteriores a la última apertura de BBB. La barra de escala es de 2 mm. Haga clic aquí para ver una versión más grande de esta figura.
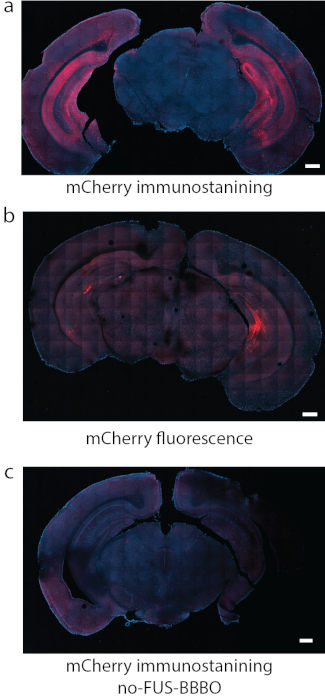
Figura 8: Detección de la expresión TEDR. (a) La inmunotinción para el fluoróforo unido a los DREADDs, en este caso mCherry fue un método fiable de detección en algunos estudios. (b) En otra sección representativa con DREADDs dirigidos al hipocampo utilizando las mismas condiciones que en (a), la fluorescencia de mCherry por sí sola produjo un fondo fuerte y una señal relativamente débil. (c) Como control negativo, se utilizó un ratón que recibió una inyección sistémica de AAV, pero que no se sometió a FUS-BBBO. No se puede encontrar una expresión significativa mediante la inmunotinción de mCherry. Las barras de escala son de 500 mm. (Datos en a, c adaptados de7 con permisos, Copyright 2020 Nature-Springer). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
ATAC requiere la implementación exitosa de varias técnicas para la neuromodulación exitosa de circuitos neuronales específicos, incluida la orientación precisa guiada por resonancia magnética, FUS-BBBO y la evaluación histológica de la expresión génica. Se desarrollaron componentes imprimibles en 3D para simplificar la focalización de pequeñas estructuras cerebrales con FUS-BBBO guiado por imágenes.
La administración de ultrasonido focalizado guiado por resonancia magnética (MRIgFUS, por sus siglas en inglés) plantea una serie de desafíos. En primer lugar, la bobina de resonancia magnética típica tiene un espacio limitado que está diseñado para acomodar solo una muestra y no el hardware de ultrasonido. Los orificios más grandes de las resonancias magnéticas aumentan el costo del equipo y disminuyen la calidad de la imagen, ya que la señal está relacionada con el factor de llenado de una bobina32. En consecuencia, cualquier hardware FUS colocado en la parte superior de una imagen animal en la resonancia magnética comprometerá la calidad de la imagen. En segundo lugar, el diseño de dispositivos compatibles con la resonancia magnética es difícil y costoso. Los materiales compatibles con la resonancia magnética deben ser diamagnéticos, tener una baja propensión a crear corrientes de Foucault durante la irradiación de radiofrecuencia y tener una baja susceptibilidad magnética en campos magnéticos altos. En cualquier material conductor, la creación de corrientes de Foucault o su susceptibilidad magnética también afectará negativamente a la calidad de la imagen. Por último, los materiales disponibles compatibles con la resonancia magnética tienen módulos de Young y durabilidad más bajos que los metales que se utilizan normalmente en la producción de máquinas de puntería precisa, por ejemplo, monturas estereotáxicas. Los motores utilizados para los ajustes de posición deben ser compatibles con la RMN y colocarse fuera del orificio de la RMN debido a su tamaño. Estos motores deben conectarse a distancia al transductor dentro de un orificio de resonancia magnética utilizando materiales compatibles con resonancia magnética. Los problemas de deformación del plástico, la falta de espacio suficiente dentro del orificio para implementar componentes de tamaño robusto y el espacio insuficiente para cambiar las posiciones de puntería en todo el cerebro han afectado a la precisión de la puntería en trabajos anteriores.
Para resolver estos problemas, se tomó la decisión de realizar imágenes en la RM y la administración de FUS-BBBO fuera del escáner. Para permitir la guía por resonancia magnética, los ratones se colocaron dentro de una restricción impresa en 3D que tenía una guía de orientación visible por resonancia magnética que podría usarse para localizar las estructuras cerebrales del ratón tanto en la resonancia magnética como en el espacio de coordenadas estereotasis. Dado que tanto el cráneo del ratón como la guía de orientación están firmemente sujetos a los soportes de la barra de la oreja (Figura 1 a, b), se puede utilizar una guía de orientación para correlacionar las coordenadas espaciales dentro de la imagen de resonancia magnética y poner a cero los instrumentos estereotáxicos. La restricción no tiene partes móviles y no contiene un transductor, lo que nos permitió hacerla robusta y lo suficientemente pequeña como para caber dentro de una resonancia magnética y eliminó la interferencia de la señal de la electrónica del transductor. El espacio dentro de la guía de orientación se ha vaciado, ya que el soporte impreso en 3D para algunos materiales es visible en la resonancia magnética (Figura 1c). Se introdujeron orificios en el conjunto para permitir la calibración estereográfica (Figura 3). El transductor de ultrasonido se conectó a un portaelectrodos de una estereotasa y la focalización se realizó como se describe en la sección 4 (Figura 1d). El transductor debe estar soportado a lo largo de su longitud por la carcasa de las barras de los oídos, evitando cualquier desviación del plano de nivel. La focalización en la dirección dorso-ventral se puede lograr utilizando desplazamientos de fase en una matriz anular.
La precisión práctica de la orientación está determinada por el enfoque ultrasónico y la atenuación del cráneo. El procedimiento FUS-BBBO se ha descrito en detalle para ratas 11 y se ha implementado en otros organismos modelo23,33,34 y en humanos 16,17. La relación entre el tamaño del foco de ultrasonido es inversamente proporcional a la frecuencia, donde las frecuencias más altas pueden dar lugar a una entrega más precisa. Sin embargo, la atenuación del cráneo aumenta con frecuencias35, lo que puede provocar calentamiento del cráneo y daños en las áreas corticales. La estrategia de focalización exacta dependerá del sitio del cerebro. Los sitios donde una presión media máxima de ancho completo encaja dentro del tejido cerebral permiten una apertura predecible y segura de la BHE en muchas estructuras cerebrales, como el cuerpo estriado, el mesencéfalo y el hipocampo. Las regiones cercanas a la base del cerebro plantean un desafío específico en ratones. El cerebro del ratón mide aproximadamente 8-10 mm en dirección dorso-ventral, lo que es comparable a la mitad del tamaño máximo de ancho completo de muchos transductores disponibles comercialmente. En consecuencia, apuntar a la parte inferior del cráneo puede conducir a la reflexión ultrasónica de los huesos y el aire presente en los canales auditivos, la boca o la tráquea, lo que puede conducir a patrones impredecibles de presiones altas y bajas36. Algunas de estas presiones pueden cruzar un umbral de cavitación inercial que se ha demostrado que causa hemorragias y daño tisular37. Para dirigirse a las regiones que se encuentran cerca de la base del cráneo, puede ser preferible utilizar el ATAC7 interseccional, donde la genética interseccional38 se utiliza para restringir la expresión génica a un área más pequeña que la que se dirige con el haz FUS. En el ejemplo publicado de ATAC interseccional, un animal transgénico que expresa una enzima de edición genética (Cre38) en células dopaminérgicas ha sido atacado con ultrasonido en la subsección de la región que contiene células dopaminérgicas. Por último, las regiones corticales pueden ser atacadas con FUS, pero la difracción y la reflexión de los ultrasonidos pueden producirse, lo que da lugar a perfiles de presión desiguales. Este protocolo no cubre la focalización de regiones corticales, ya que dependerá en gran medida de la especie utilizada; sin embargo, se ha observado cierta orientación de la corteza por encima del hipocampo 7 (por ejemplo, Figura 7), lo que indica que, al menos en ratones, es posible.
La elección de un activador quimiogenético y la dosificación dependerán de las necesidades experimentales específicas. Varios estudios, incluido uno de los estudios de los autores7, no mostraron una respuesta inespecífica significativa39,40, mientras que dosis más altas (p. ej., 10 mg/kg) pueden producir efectos secundarios, al menos en algunos casos41. Sin embargo, al igual que con todos los experimentos conductuales, los controles adecuados31 son esenciales debido a la posible actividad fuera del objetivo de CNO y sus metabolitos42. Dichos controles podrían incluir la administración de controles de CNO y solución salina a animales que expresen DREADD y la administración de CNO a animales de tipo salvaje o, en algunos casos específicos, una comparación de sitios ipsi y contralaterales del cerebro que expresan y no expresan receptores quimiogenéticos, respectivamente. Además, investigaciones recientes revelaron una serie de nuevos agonistas de DREADD con especificidad mejorada28,29,43. Otros receptores quimiogenéticos 5,25,44 también se pueden utilizar junto con el procedimiento ATAC.
La evaluación histológica de la expresión génica es necesaria post mortem para cada animal. Una pequeña fracción de los animales muestra una expresión génica deficiente después de FUS-BBBO7. Además, es necesario demostrar la precisión espacial y la especificidad de la expresión génica, ya que es posible que se dirijan mal. Cabe destacar que algunos AAV pueden mostrar una capacidad de rastreo retrógrada o anterógrada45 y pueden causar transfección lejos del sitio objetivo con ultrasonido a pesar de la precisión de la orientación del ultrasonido. Si el receptor quimiogenético expresado se fusiona con un fluoróforo o lo coexpresa, las imágenes del fluoróforo en secciones de tejido pueden ser suficientes para evaluar la localización y la intensidad de la expresión. Sin embargo, muchas proteínas fluorescentes son dañadas por el proceso de fijación tisular, y la inmunotinción para la proteína mCherry que se usa con frecuencia con DREADDs produjo una mejor señal en estudios previos7. Por último, debido a la densidad de neuronas en ciertas partes del cerebro (por ejemplo, la capa de células granulares en el hipocampo), el uso de fluoróforos localizados nuclearmente expresados en IRES, en lugar de fusiones, para realizar recuentos celulares puede ser beneficioso, ya que los núcleos pueden segmentarse fácilmente y contrateñirse con tinciones nucleares, como DAPI o TO-PRO-3. Para evaluar la neuromodulación mediante tinción de c-Fos, es imprescindible realizar la contratinción nuclear y contar los núcleos positivos de c-Fos, en lugar de cualquier señal de fluorescencia. En algunos casos, los desechos celulares pueden mostrar fluorescencia y confundir las mediciones de las células positivas.
Las limitaciones de la administración de fármacos y genes con FUS-BBBO incluyen una resolución más baja que la administración con inyecciones intracraneales invasivas y la necesidad de mayores cantidades de fármacos inyectados o vectores virales. Además, mientras que una inyección directa en el cerebro da como resultado una administración exclusiva en un sitio inyectado, FUS-BBBO utiliza una vía intravenosa que da como resultado una posible administración a los tejidos periféricos. Las limitaciones del uso de la quimiogenética para la neuromodulación incluyen una escala de tiempo lenta, que puede ser inadecuada para algunos protocolos conductuales que requieren cambios rápidos en la intensidad de la neuromodulación.
Divulgaciones
Sin conflicto de intereses.
Agradecimientos
Esta investigación fue apoyada por la Fundación Cerebro y Comportamiento, Premio NARSAD al Investigador Joven. Varios componentes impresos en 3D fueron diseñados originalmente por Fabien Rabusseau (Terapia Guiada por Imágenes, Francia). El autor agradece a John Heath (Caltech) y Margaret Swift (Caltech) por su ayuda técnica en la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 21-gauge needles (BD) | Fisher Scientific | 14826C | |
| 25-gauge butterfly catheter | Harvard Bioscience | 725966 | |
| 30-gauge needles (BD) | Fisher Scientific | 14826F | |
| Absorbent blue pad | Office Depot | 902406 | |
| Anti-c-Fos antibody | Santa Cruz Biotechnology | SC-253-G | |
| Anti-mCherry antibody | Thermofisher | PA534974 | |
| Bruker Biospec 70/30 | Bruker | custom | includes the RF coils |
| Clozapine-n-oxide | Tocris | 4936 | |
| Custom designed 3D printed mouse harnesses and MRIgFUS targeting components | ImageGuidedTherapy, Szablowski lab | custom | download from szablowskilab.org/downloads |
| Custom MRIgFUS machine | ImageGuidedTherapy | N/A | |
| Definity microbubbles | Lantheus | DE4 | |
| Degassed aquasonic/ultrasound gel | Fisher Scientific | 5067714 | |
| Depilation crème | Nair | n/a | |
| Eight-element annular array transducer | Imasonic Inc. | custom | |
| Ethanol Pads/Alcohol Swabs (70%) (BD) | Office Depot | 599893 | |
| Heparin | Sigma-Aldrich | H3149-25KU | |
| Isoflurane | Patterson Veterinary | 07-893-1389 | |
| Ketamine | Patterson Veterinary | 07-890-8598 | |
| Neutral buffered formalin (10%) | Sigma-Aldrich | HT501128-4L | |
| Optical fiber hydrophone | Precision Acoustics | ||
| PE10 tubing | Fisher Scientific | NC1513314 | |
| Peristaltic pump | |||
| Phosphate-buffered saline (PBS) | Sigma-Aldrich | 524650-1EA | |
| Prohance contrast agent | Bracco | 0270-1111-04 | |
| Saline | Fisher Scientific | NC9054335 | |
| Secondary antibody, Donkey-anti goat | ThermoFisher | A-11055 | |
| Secondary antibody, Donkey-anti rabbit | ThermoFisher | 84546 | |
| Surgical scissors (straight) | Fisher Scientific | 17467480 | |
| ThermoGuide Software | ImageGuidedTherapy | ||
| Tissue glue (Gluture) | Fisher Scientific | NC9855218 | |
| Tuberculin Syringe (1 mL) (BD) | Fisher Scientific | 14823434 | |
| VeroClear 3D printable material | Stratasys | RGD810 | |
| Vialmix microbubble activation device | Lantheus | VMIX | |
| Vibrating microtome | Compresstome | VF-300 | |
| Xylazine | Sigma-Aldrich | X1251-1G |
Referencias
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
- Zhang, F., Wang, L. -P., Boyden, E. S., Deisseroth, K. Channelrhodopsin-2 and optical control of excitable cells. Nature Methods. 3, 785-792 (2006).
- Armbruster, B. N., Li, X., Pausch, M. H., Herlitze, S., Roth, B. L. Evolving the lock to fit the key to create a family of G protein-coupled receptors potently activated by an inert ligand. Proceedings of the National Academy of Sciences. 104, 5163-5168 (2007).
- Lerchner, W., et al. Reversible silencing of neuronal excitability in behaving mice by a genetically targeted, ivermectin-gated Cl- channel. Neuron. 54, 35-49 (2007).
- Magnus, C. J., et al. Chemical and genetic engineering of selective ion channel-ligand interactions. Science. 333, 1292-1296 (2011).
- Deeb, W., et al. Proceedings of the fourth annual deep brain stimulation think tank: a review of emerging issues and technologies. Frontiers in Integrative Neuroscience. 10, 38(2016).
- Szablowski, J. O., Lee-Gosselin, A., Lue, B., Malounda, D., Shapiro, M. G. Acoustically targeted chemogenetics for the non-invasive control of neural circuits. Nature Biomedical Engineering. 2, 475-484 (2018).
- Elias, W. J., et al. A pilot study of focused ultrasound thalamotomy for essential tremor. New England Journal of Medicine. 369, 640-648 (2013).
- Burgess, A., Hynynen, K. Noninvasive and targeted drug delivery to the brain using focused ultrasound. ACS Chemical Neuroscience. 4, 519-526 (2013).
- Kinoshita, M., McDannold, N., Jolesz, F. A., Hynynen, K. Noninvasive localized delivery of Herceptin to the mouse brain by MRI-guided focused ultrasound-induced blood-brain barrier disruption. Proceedings of the National Academy of Sciences U. S. A. 103, 11719-11723 (2006).
- Samiotaki, G., Acosta, C., Wang, S., Konofagou, E. E. Enhanced delivery and bioactivity of the neurturin neurotrophic factor through focused ultrasound-mediated blood-brain barrier opening in vivo. Journal of Cerebral Blood Flow & Metabolism. 35, 611-622 (2015).
- O'Reilly, M. A., Waspe, A. C., Chopra, R., Hynynen, K. MRI-guided disruption of the blood-brain barrier using transcranial focused ultrasound in a rat model. Journal of Visualized Experiments. (61), e3555(2012).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human gene Therapy. 23, 1144-1155 (2012).
- Hsu, P. -H., et al. Noninvasive and targeted gene delivery into the brain using microbubble-facilitated focused ultrasound. PloS One. 8, 58682(2013).
- Wang, S., Olumolade, O. O., Sun, T., Samiotaki, G., Konofagou, E. E. Noninvasive, neuron-specific gene therapy can be facilitated by focused ultrasound and recombinant adeno-associated virus. Gene Therapy. 22, 104(2015).
- Downs, M. E., et al. Long-Term Safety of Repeated Blood-Brain Barrier Opening via Focused Ultrasound with Microbubbles in Non-Human Primates Performing a Cognitive Task. PLoS One. 10, 0125911(2015).
- Lipsman, N., et al. Blood-brain barrier opening in Alzheimer's disease using MR-guided focused ultrasound. Nature Communications. 9, 2336(2018).
- Carpentier, A., et al. Clinical trial of blood-brain barrier disruption by pulsed ultrasound. Science Translational Medicine. 8, 343(2016).
- Sternson, S. M., Roth, B. L. Chemogenetic Tools to Interrogate Brain Functions. Annual Reviews Neurosciences. 37, 387-407 (2014).
- Alexander, G. M., et al. Remote control of neuronal activity in transgenic mice expressing evolved G protein-coupled receptors. Neuron. 63, 27-39 (2009).
- Zhu, H., et al. Chemogenetic inactivation of ventral hippocampal glutamatergic neurons disrupts consolidation of contextual fear memory. Neuropsychopharmacology. 39, 1880-1892 (2014).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Noninvasive, transcranial and localized opening of the blood-brain barrier using focused ultrasound in mice. Ultrasound in Medicine & Biology. 33, 95-104 (2007).
- Thévenot, E., et al. Targeted delivery of self-complementary adeno-associated virus serotype 9 to the brain, using magnetic resonance imaging-guided focused ultrasound. Human Gene Therapy. 23, 1144-1155 (2012).
- Hynynen, K., McDannold, N., Vykhodtseva, N., Jolesz, F. A. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits. Radiology. 220, 640-646 (2001).
- Yang, F. -Y., Fu, W. -M., Chen, W. -S., Yeh, W. -L., Lin, W. -L. Quantitative evaluation of the use of microbubbles with transcranial focused ultrasound on blood-brain-barrier disruption. Ultrasonics Sonochemistry. 15, 636-643 (2008).
- Vardy, E., et al. A New DREADD Facilitates the Multiplexed Chemogenetic Interrogation of Behavior. Neuron. 86, 936-946 (2015).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Sciences. 1, 61-72 (2018).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Nagai, Y., et al. Deschloroclozapine: a potent and selective chemogenetic actuator enables rapid neuronal and behavioral modulations in mice and monkeys. bioRxiv. , 854513(2019).
- Thompson, K. J., et al. DREADD Agonist 21 Is an Effective Agonist for Muscarinic-Based DREADDs in Vitro and in Vivo. ACS Pharmacology and Translational Science. 1, 61-72 (2018).
- Bullitt, E. Expression of c-fos-like protein as a marker for neuronal activity following noxious stimulation in the rat. Journal of Comparative Neurology. 296, 517-530 (1990).
- Mahler, S. V., Aston-Jones, G. CNO Evil? Considerations for the use of DREADDs in behavioral neuroscience. Neuropsychopharmacology. 43, 934(2018).
- Gruber, B., Froeling, M., Leiner, T., Klomp, D. W. J. RF coils: A practical guide for nonphysicists. Journal of Magnetic Resonance Imaging. 48, 590-604 (2018).
- Treat, L. H., McDannold, N., Vykhodtseva, N., Hynynen, K. Transcranial MRI-guided focused ultrasound-induced blood-brain barrier opening in rats. IEEE. 2, 998-1000 (2004).
- Choi, J. J., Pernot, M., Small, S. A., Konofagou, E. E. Feasibility of transcranial, localized drug-delivery in the brain of Alzheimer's-model mice using focused ultrasound. IEEE. 2, 988-991 (2005).
- Cobbold, R. S. Foundations of Biomedical ultrasound. , Oxford university press. (2006).
- Younan, Y., et al. Influence of the pressure field distribution in transcranial ultrasonic neurostimulation. Medical Physics. 40, 082902(2013).
- McDannold, N., Vykhodtseva, N., Hynynen, K. Targeted disruption of the blood-brain barrier with focused ultrasound: association with cavitation activity. Physics in Medicine and Biology. 51, 793-807 (2006).
- Branda, C. S., Dymecki, S. M. Talking about a Revolution: The Impact of Site-Specific Recombinases on Genetic Analyses in Mice. Developmental Cell. 6, 7-28 (2004).
- Jendryka, M., et al. Pharmacokinetic and pharmacodynamic actions of clozapine-N-oxide, clozapine, and compound 21 in DREADD-based chemogenetics in mice. Scientific Reports. 9, 4522(2019).
- Manvich, D. F., et al. The DREADD agonist clozapine N-oxide (CNO) is reverse-metabolized to clozapine and produces clozapine-like interoceptive stimulus effects in rats and mice. Scientific Reports. 8, 3840(2018).
- Martinez, V. K., et al. Off-Target Effects of Clozapine-N-Oxide on the Chemosensory Reflex Are Masked by High Stress Levels. Frontiers in Physiology. 10, 521(2019).
- Gomez, J. L., et al. Chemogenetics revealed: DREADD occupancy and activation via converted clozapine. Science. 357, 503-507 (2017).
- Bonaventura, J., et al. High-potency ligands for DREADD imaging and activation in rodents and monkeys. Nature Communications. 10, 1-12 (2019).
- Roth, B. L. DREADDs for Neuroscientists. Neuron. 89, 683-694 (2016).
- Aschauer, D. F., Kreuz, S., Rumpel, S. Analysis of Transduction Efficiency, Tropism and Axonal Transport of AAV Serotypes 1, 2, 5, 6, 8 and 9 in the Mouse Brain. PLoS One. 8, 76310(2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados