16.7 : Расчеты титрования: слабая кислота - слабое основание
Расчет pH для титрационной растворов: Слабая кислота/сильная основание
Для титрования 25.00 мл 0.100 M CH3CO2H с 0.100 M NaOH реакция может быть представлена как:

PH титровального раствор после добавления различных объемов титранта NaOH можно рассчитать следующим образом:
(A) Начальный pH рассчитывается для уксусной кислоты раствор при обычном подходе К ЛЬДУ:
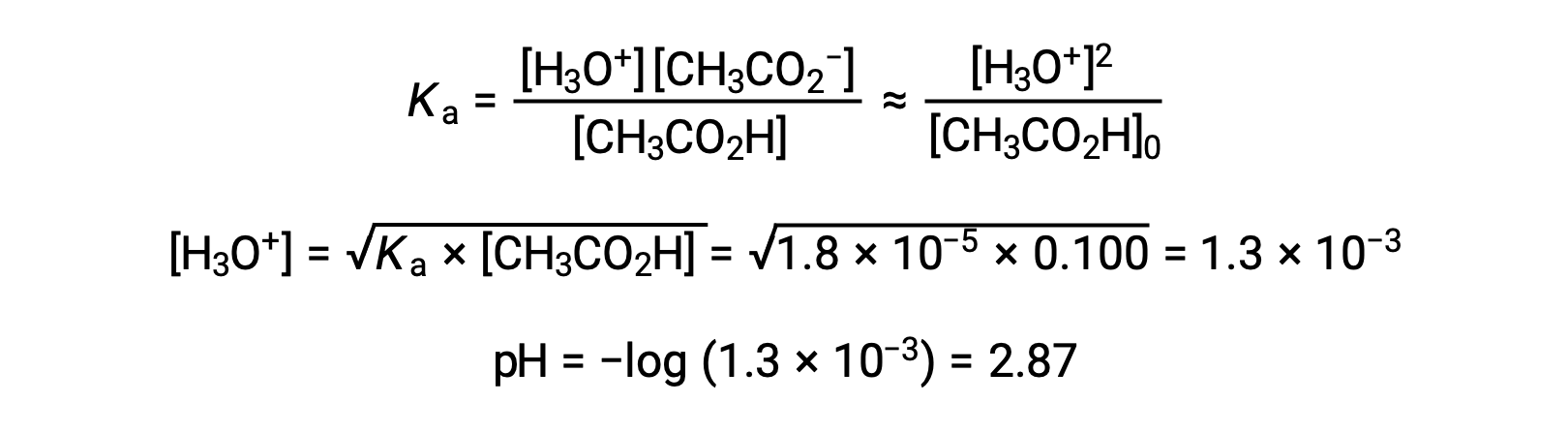
B) кислота и титрант являются как монопротическими, так и растворами образца и титранта в равной степени концентрированы; таким образом, этот объем титранта представляет собой точку эквивалентности. В отличие от сильнокислотного примера, реакционная смесь в данном случае содержит слабый конъюгатный основание (ацетатный ион). PH раствор рассчитывается с учетом ионизации ацетата основание, которая присутствует в концентрации
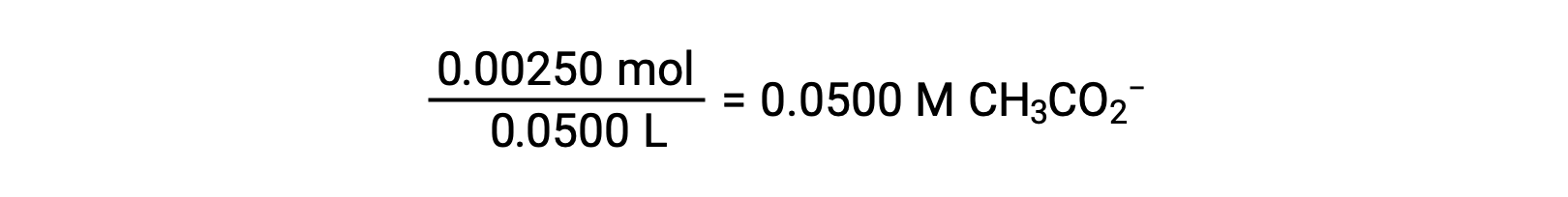
Ионизация ацетата основание представлена уравнением

Если предположить, что x << 0.0500, pH можно рассчитать с помощью обычного ЛЕДОВОГО подхода:
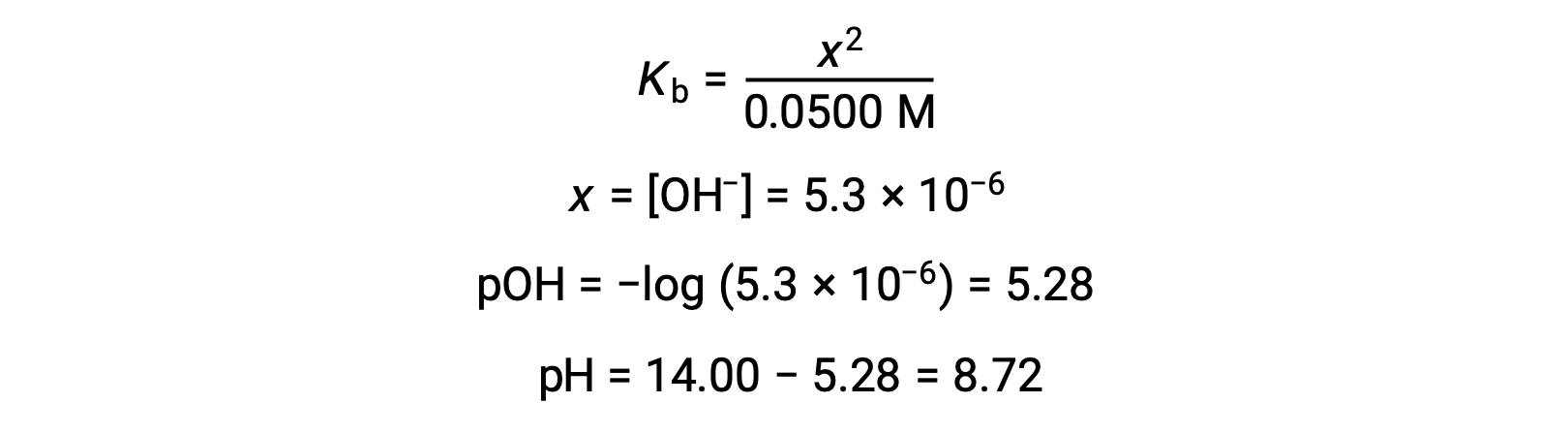
Обратите внимание, что pH в точке эквивалентности этого титрования значительно превышает 7, как ожидалось при титровании слабой кислоты с сильным основание.
(c) объем титранта = 12.50 мл. Этот объем представляет собой половину стехиометрического количества титранта, поэтому половина уксусной кислоты была нейтрализована, чтобы получить эквивалентное количество ацетатного иона. Таким образом, концентрации этих сопряженных партнеров кислотно-основная равны. Удобный подход к вычислениям рН — это использование уравнения Хендерсона-Хасселбалча:

(PH = pKa в точке полуэквивалентности при титровании слабой кислоты)
(d) объем титранта = 37.50 мл. Этот объем представляет собой стехиометрический избыток титранта, а также реакцию раствор, содержащую титровальный продукт, ацетатный ион и избыток сильного титранта. В таких решениях рН раствор определяется в первую очередь количеством избыточного сильного основание:

Этот текст адаптирован из Openstax, Химия 2е изд., раздел 14.7: Титраки кислотно-основная.
Из главы 16:

Now Playing
16.7 : Расчеты титрования: слабая кислота - слабое основание
Кислотно-основное равновесие и равновесие растворимости
43.7K Просмотры

16.1 : Общий ионный эффект
Кислотно-основное равновесие и равновесие растворимости
40.9K Просмотры

16.2 : Буферы
Кислотно-основное равновесие и равновесие растворимости
163.3K Просмотры

16.3 : Уравнение Хендерсона-Хассельбаха
Кислотно-основное равновесие и равновесие растворимости
68.0K Просмотры

16.4 : Расчет изменений pH в буферном растворе
Кислотно-основное равновесие и равновесие растворимости
52.5K Просмотры

16.5 : Эффективность буфера
Кислотно-основное равновесие и равновесие растворимости
48.4K Просмотры

16.6 : Расчеты титрования: сильная кислота - сильное основание
Кислотно-основное равновесие и равновесие растворимости
28.9K Просмотры

16.8 : Индикаторы
Кислотно-основное равновесие и равновесие растворимости
47.7K Просмотры

16.9 : Титрование полипротонной кислоты
Кислотно-основное равновесие и равновесие растворимости
95.6K Просмотры

16.10 : Равновесия растворимости
Кислотно-основное равновесие и равновесие растворимости
51.9K Просмотры

16.11 : Факторы, влияющие на растворимость
Кислотно-основное равновесие и равновесие растворимости
32.9K Просмотры

16.12 : Образование сложных ионов.
Кислотно-основное равновесие и равновесие растворимости
23.1K Просмотры

16.13 : Осаждение ионов
Кислотно-основное равновесие и равновесие растворимости
27.5K Просмотры

16.14 : Качественный анализ
Кислотно-основное равновесие и равновесие растворимости
20.3K Просмотры

16.15 : Кривые кислотно-основного титрования
Кислотно-основное равновесие и равновесие растворимости
126.2K Просмотры
Авторские права © 2025 MyJoVE Corporation. Все права защищены