Method Article
Modelo de injeção minimamente invasiva de cisterna magna para estudos de metástase leptomeníngea em camundongos
Neste Artigo
Resumo
O protocolo descreve um método para injetar células tumorais através da via de punção percutânea na cisterna magna que induz metástase leptomeníngea em camundongos, reduzindo o trauma e a carga tumoral extracraniana.
Resumo
A metástase leptomeníngea (LM), a disseminação de células cancerígenas para as leptomeninges cheias de líquido cefalorraquidiano (LCR), é uma complicação rara, mas devastadora, de tumores sólidos avançados. Pacientes com LM geralmente têm um prognóstico desfavorável, com sobrevida medida em semanas a meses. O desenvolvimento de modelos in vivo que reproduzam com precisão as complexidades da LM é essencial para entender seus mecanismos celulares e patológicos e avaliar possíveis terapias. Os modelos de LM murino são normalmente criados por meio de injeção intracardíaca, de artéria carótida ou cisterna magna de células tumorais. No entanto, as injeções intracardíacas ou carotídeas geralmente resultam em carga substancial de tumores extracranianos e cerebrais, complicando a imagem bioluminescente e levando à mortalidade não relacionada à LM. Enquanto isso, a injeção convencional de cisterna magna requer procedimentos invasivos, como incisão na pele e dissecção muscular, tornando-a traumática e intensiva em recursos. Aqui, descrevemos um procedimento minimamente invasivo para injeção de células tumorais no espaço leptomeníngeo através da cisterna magna sem a necessidade de uma incisão na pele. Essa abordagem reduz a formação de tumores extracranianos, minimiza o trauma cirúrgico e reduz o tempo e os cuidados pós-operatórios necessários em comparação com outros métodos cirúrgicos. É importante ressaltar que induz consistentemente LM com infiltração mínima do parênquima cerebral, conforme confirmado por microscopia de dois fótons e análise histológica. Essa abordagem simplificada oferece um modelo eficiente e confiável para estudar a LM em pesquisas pré-clínicas.
Introdução
A doença metastática continua sendo o maior desafio para pacientes com cânceres avançados. A metástase leptomeníngea (LM) refere-se à disseminação de células cancerígenas para a pia-máter, aracnóide e subaracnóidea A ML de tumores sólidos está se tornando cada vez mais comum em câncer de pulmão (9%-25%), câncer de mama (5%-20%) e melanoma (6%-18%)1,2, em grande parte devido à maior sobrevida e melhores técnicas diagnósticas. As células cancerígenas podem invadir o espaço leptomeníngeo por várias rotas, incluindo 1) invasão direta através de estruturas periféricas, como dura-máter, osso e nervos; 2) disseminação hematogênica pelo sistema venoso; e 3) entrada pela circulação arterial, onde as células cancerígenas deslizam através dos vasos fenestrados para o plexo coróide e, posteriormente, para os ventrículos cheios de líquido cefalorraquidiano 3,4,5. As células tumorais que entram no espaço leptomeníngeo encontram vários desafios, incluindo privação de fatores de crescimento, intermediários metabólicos limitados e condições hipóxicas6. No entanto, devido à falta de ferramentas e técnicas apropriadas, como as células tumorais navegam por essas vias e superam condições inóspitas para colonizar o espaço leptomeníngeo é pouco compreendido. Apesar dos avanços nas terapias multimodais, incluindo radioterapia, tratamento sistêmico e terapia de injeção intratecal, o prognóstico para pacientes com LM permanece ruim, com sobrevida variando tipicamente de 2 a 4 meses 3,7,8,9. Assim, há uma necessidade urgente de uma compreensão mais profunda da biologia da metástase leptomeníngea para melhorar os tratamentos atuais e desenvolver novas terapias direcionadas. Conseguir isso requer o desenvolvimento de modelos in vivo que recapitulam as características complexas do LM.
Ao contrário das metástases em órgãos como fígado, osso e cérebro, a LM geralmente se desenvolve anos após o diagnóstico do tumor primário 10,11,12. Da mesma forma, em modelos de camundongos com metástase espontânea, a LM é rara devido à sua baixa incidência e ao fato de que os camundongos normalmente sucumbem a metástases em outros locais. Modelos experimentais de ML murina podem ser criados por meio de vários métodos, incluindo artéria intracardíaca, intracarótida ou, alternativamente, injeção direta na cisterna magna ou nos ventrículos cerebrais. Embora a injeção intracardíaca de células cancerígenas seja amplamente utilizada9, muitas vezes resulta em uma carga tumoral extracraniana significativa, causando mortalidade não relacionada à LM. Abordagens alternativas, como a injeção de células tumorais através da artéria carótida13,14, requerem amplos recursos especializados e resultam em grandes incisões cirúrgicas, que são traumáticas. Além disso, esse método também leva principalmente à metástase dentro dos próprios tecidos cerebrais, em vez de leptomeninges, e é demorado e ineficiente para estabelecer modelos de LM15. A injeção na cisterna magna permite a entrega direta de células tumorais ao espaço leptomeníngeo. Vários estudos têm utilizado essa abordagem para investigar os mecanismos da ML e avaliar novos tratamentos 6,16,17.
Neste manuscrito, apresentamos um protocolo conveniente de injeção transcisterna magna envolvendo uma punção percutânea direta para gerar de forma rápida e estável uma quantidade maior de camundongos com LM. Este método contorna a barreira cérebro-sangue e, portanto, permite o xenoenxerto eficiente de células tumorais no espaço leptomeninges. Também reduz significativamente o trauma cirúrgico e o tempo do procedimento, ao mesmo tempo em que induz LM de forma confiável em camundongos. Confirmamos a ocorrência de ML com infiltração mínima no parênquima cerebral, verificada por microscopia de dois fótons e análise histológica. Portanto, o modelo resultante replica fielmente o complexo microambiente da LM, fornecendo uma ferramenta valiosa para estudar mecanismos celulares e patológicos associados a doenças e avaliar possíveis terapias.
Protocolo
Todos os procedimentos em animais neste manuscrito foram revisados e aprovados pelo Comitê de Revisão de Bem-Estar e Ética em Animais de Laboratório (ZJU20230155). Camundongos C57BL/6J e NSG foram obtidos e alojados em condições livres de patógenos específicos no ZJU Laboratory Animal Center. Este protocolo usa a linha celular de câncer de pulmão murino, carcinoma de pulmão de Lewis (LLC1) e a linha celular de câncer de pulmão humano, A549, ambas marcadas com GFP e luciferase de vaga-lume. Ambas as linhagens celulares são gentilmente cedidas pelo Dr. Xiang H. F. Zhang (Baylor College of Medicine, EUA)18. Aqui, usamos células LLC1 como exemplo. O procedimento para a injeção de células A549 é quase idêntico, exceto que 6 x 104 células A549 foram injetadas em camundongos NSG.
1. Preparação de células cancerígenas para injeção
- Cultura de 1,0 x 106 células LLC1 em DMEM suplementado com 10% de soro fetal bovino (FBS) e 0,1 mg/mL de penicilina-estreptomicina a 37 °C em uma incubadora de 5% de CO2 . Quando as células atingirem 70%-90% de confluência, tripsinize-as por 1 min usando 2 mL de solução de tripsina/EDTA a 0,25%. Centrifugue as células a 300 x g por 3 min, lave-as 2x com PBS gelado e ressuspenda-as em 1 mL de solução salina tamponada com fosfato (PBS).
- Avaliar a concentração de células viáveis usando uma solução de Azul de Trypan e um hemocitômetro19. Certifique-se de que a viabilidade celular seja superior a 90%, com a maioria das células sendo únicas. Ajuste a concentração da célula para 2 x 106 células / mL em PBS gelado.
- Alíquota de 50 μL da suspensão celular em tubos de microcentrífuga separados para evitar pipetagem repetida.
- Mantenha as suspensões celulares congeladas até que estejam prontas para a injeção. Injete 10 μL de células LLC1 marcadas com GFP-luciferase por camundongo neste protocolo, correspondendo a 2 x 104 células por camundongo.
NOTA: Ajuste o número de células conforme necessário com base na cinética metastática das linhas celulares injetadas.
2. Preparação de ratos
NOTA: Neste estudo, foram utilizados camundongos C57BL/6J machos, com idades entre 6 e 8 semanas.
- Autoclave todos os instrumentos cirúrgicos e luvas embalados com campos cirúrgicos. Higienize a bancada e o equipamento não cirúrgico com etanol a 75% e, em seguida, cubra a área de trabalho com cortinas à prova d'água.
- Prepare uma gaiola limpa para animais e uma almofada de aquecimento para recuperação pós-procedimento.
- Anestesiar o camundongo injetando subcutaneamente tribromoetanol a 2% (200 mg/kg). Verifique a profundidade da anestesia usando um teste de pinça antes de prosseguir. Aplique pomada oftálmica estéril para proteger os olhos de danos à córnea assim que o camundongo estiver anestesiado.
- Raspe o pelo da região occipital posterior com uma tesoura, seguido da aplicação de cremes depilatórios para remover completamente o pelo na mesma região.
- Posicione o mouse de bruços com o pescoço colocado sobre um tubo de centrífuga de 15 mL. Prenda a cabeça e a região lombar com fita adesiva e palpe o espaço entre o occipital e a vértebra C1 com o dedo indicador (Figura 1).
- Desinfete a região occipital posterior por meio de três rodadas de limpeza com cotonetes estéreis embebidos em etanol a 75%, seguidos de esfoliação cirúrgica betadine. Cubra as partes não estéreis do animal com uma cortina estéril.
3. Injeção de cisterna magna
NOTA: Técnicas assépticas são necessárias para as etapas a seguir, incluindo o uso de equipamentos de proteção individual e luvas estéreis.
- Pipete suavemente a suspensão celular e aspire 10 μL para injeção com uma seringa de insulina 31G de 8 mm.
- Palpe a área entre o occipital e C1 do camundongo com o dedo indicador para localizar o local preciso da punção na margem mediana inferior do crânio occipital posterior. Marque este site, se necessário.
- Insira a agulha em um ângulo de 45°-50° na cisterna magna através do local de punção identificado, avançando até uma profundidade de 4 mm. Uma sensação distinta de avanço indica que a agulha entrou com sucesso na cisterna magna.
- Se o local da punção for difícil de localizar, faça uma pequena incisão de 3-5 mm no nível da orelha para expor a linha média posterior. Se for necessária uma incisão cirúrgica, administre Meloxicam (5 mg/kg/dia) e Buprenorfina (0,1 mg/kg) por via subcutânea 1 h antes da cirurgia.
- Injete lentamente a suspensão celular avançando o êmbolo da seringa, mantendo a seringa firme com a mão colocada sobre a mesa.
- Após a inoculação, segure a seringa no lugar por mais 10 s para permitir que a pressão intracraniana se equilibre. Em seguida, retire a agulha e pressione o local da punção com um cotonete estéril por 1-2 min.
4. Cuidados pós-injeção
- Transfira os animais para gaiolas limpas em uma almofada de aquecimento e monitore-os de perto até que estejam totalmente recuperados.
- Caso seja feita uma incisão, feche a ferida com cola de tecido e clipes. Administre analgésicos adicionais por 2-3 dias após a cirurgia para controlar a dor e ajudar na recuperação.
- Monitore os camundongos de perto por 7 dias após o procedimento e verifique diariamente as atividades físicas dos animais e a aparência ao redor do local da injeção.
5. Avaliação do crescimento do tumor leptomeníngeo
- Imagem de bioluminescência
- Anestesiar o camundongo e administrar D-luciferina (150 μg/g) na veia retroorbital. Coloque os camundongos na câmara de imagem, posicionando-os em um cone de nariz designado no coletor de anestesia. Use defletores de luz entre os animais para minimizar a interferência do sinal.
- Fotografe os animais imediatamente usando o sistema IVIS com o tempo de exposição entre 0,5 s e 2 min6. Confirme a inoculação bem-sucedida de células tumorais no espaço leptomeníngeo por um sinal bioluminescente dispersivo na cabeça e na medula espinhal (Figura 2A).
- Monitore a progressão da LM por imagem de bioluminescência a cada 4 dias. Ajuste os intervalos de imagem com base na cinética de crescimento do tumor.
- Análise histológica
- Anestesie os camundongos quando eles estiverem significativamente menos ativos ou tiverem perdido 20% do peso corporal e corte a pele e as costelas para expor a cavidade torácica. Insira cuidadosamente uma cânula de ponta romba no ventrículo esquerdo e avance a cânula para a aorta ascendente. Perfunda o animal com 20 mL de PBS através da cânula lentamente.
- Use uma tesoura para remover a cabeça e faça uma incisão no couro cabeludo na linha média para expor o crânio. Extirpar os tecidos moles circundantes. Corte ao longo da crista orbital, insira uma tesoura no forame magno e avance cuidadosamente ao longo da superfície interna do crânio com pressão para cima para evitar danos aos tecidos.
- Remova os ossos cranianos e, em seguida, extraia suavemente o cérebro. Fixe o cérebro em paraformaldeído a 4% a 4 ° C por 24 h e, em seguida, equilibre-o em solução de sacarose PBS a 15% por 24 h, seguida por solução de sacarose PBS a 30% por mais 24 h a 4 ° C.
- Coloque o tecido em um criomold preenchido com composto de temperatura de corte ideal (OCT) e armazene-o em gelo seco por 30 min20.
- Corte o cérebro embebido em OCT em seções de 10 μm de espessura usando um criostato. Armazenar as secções num congelador a -80 °C até nova aplicação.
- Realize a coloração de hematoxilina/eosina (H&E) nas lâminas cerebrais21. A presença de células tumorais na borda do cérebro indica que a metástase ocorre exclusivamente no espaço leptomeníngeo (Figura 3 e Tabela 1).
- Microscopia de dois fótons
- Anestesiar os ratos com LM. Remova o couro cabeludo que cobre a superfície dorsal do crânio com fórceps e tesoura. Use uma lâmina de bisturi para remover o periósteo fino da superfície do crânio.
- Afine o crânio com uma broca abrasiva até que os vasos piais sejam visíveis através do crânio afinado. Estabilize a área de observação da cabeça do mouse com uma antena triangular presa por adesivo de tecido22,23.
- Administrar 0,025 mL de TRITC-dextrano a 5% (p/v) em uma veia infraorbital para marcar os vasos sanguíneos22.
- Realizar microscopia de dois fótons através das janelas de imagem e reconstruir o espaço leptomeníngeo (Figura 4). Detectar o osso por fluorescência de segundo harmônico a 450 nm de emissão com excitação de 900 nm24. Visualize células tumorais marcadas com GFP e vasos marcados com dextrana coletando sinais de fluorescência em emissões de 507 nm e 572 nm com excitação de 900 nm e 1000 nm, respectivamente.
- Microscópio de fluorescência estéreo
- Remova o cérebro do camundongo e coloque-o sob um estereomicroscópio. Visualize células marcadas com GFP usando um conjunto de filtros específicos para GFP (Figura 5).
Resultados
A Figura 1 ilustra a colocação do camundongo para injeção e o local da punção nas vistas lateral e frontal. A Figura 2 mostra imagens representativas de bioluminescência in vivo de animais testados para gerar LM por meio de diferentes abordagens. Células LLC1 marcadas com luciferase GFP foram injetadas nos animais por diferentes rotas, seguidas de imagens bioluminescentes. Conforme mostrado na Figura 2A, 10 dias após a injeção intra-cisterna magna, o sinal bioluminescente estava presente no cérebro do camundongo e distribuído ao longo da medula espinhal, indicando enxerto bem-sucedido de células tumorais no espaço leptomeníngeo. Em contraste, as injeções intracarotídeas de células tumorais geraram predominantemente metástases parenquimatosas cerebrais sem envolvimento significativo em leptomeninges 21 dias após a injeção (Figura 2B). Para o método de injeção intracardíaca, a imagem de bioluminescência da posição supina mostra que a maioria das metástases cresce em órgãos extracranianos (esquerda), e as imagens da visão prona confirmaram que nenhum dos três camundongos desenvolveu LM (direita; Figura 2C). A mesma distribuição de células tumorais foi observada 10 dias após a injeção de cisterna magna de 6 x 104 (10 μL) células A549 marcadas com GFP-luciferase em camundongos NSG (Figura 2D), sugerindo que tal abordagem gera LM de forma robusta em diferentes cepas de camundongos com diferentes linhagens celulares.
A Figura 3 mostra imagens representativas da coloração histológica e imunofluorescente dos tecidos cerebrais após 14 dias de injeção de células tumorais através da cisterna magna. A coloração de hematoxilina-eosina (H&E) mostra a maioria das áreas tumorais localizadas no espaço leptomeníngeo (Figura 3A). A Figura 3B mostra que a maioria das células tumorais marcadas com GFP estava agrupada nas meninges e ventrículos, enquanto as células tumorais na região do parênquima são principalmente células únicas. A Figura 4 apresenta imagens representativas de dois fótons do espaço leptomeníngeo de um camundongo com LM. O osso craniano (azul) foi detectado coletando a segunda fluorescência harmônica a 450 nm de emissão com excitação de 900 nm24. A vasculatura (vermelha) foi marcada por TRITC-dextrana (70 kDa). Células tumorais marcadas com GFP (verde) foram encontradas entre o osso craniano (azul) e o parênquima cerebral, especificamente na região leptomeníngea. A Figura 5 mostra a presença de células tumorais marcadas com GFP na superfície do cérebro, visualizadas usando um microscópio de fluorescência estéreo. A Tabela 1 apresenta a comparação entre os três métodos.
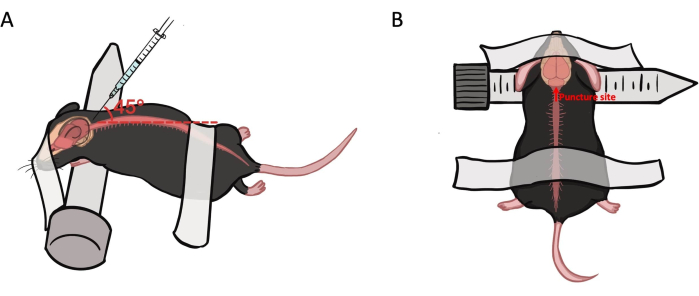
Figura 1: Preparo do animal e local de punção para injeção intracisterna magna. (A) O camundongo é colocado em decúbito ventral, com o pescoço envolto em um tubo de centrífuga de 15 mL. A cabeça e a parte inferior das costas são presas com fita adesiva. A agulha é inserida em um ângulo de 45°-50° na cisterna magna na margem inferior mediana. (B) A agulha é inserida na margem inferior mediana do crânio occipital posterior. Clique aqui para ver uma versão maior desta figura.
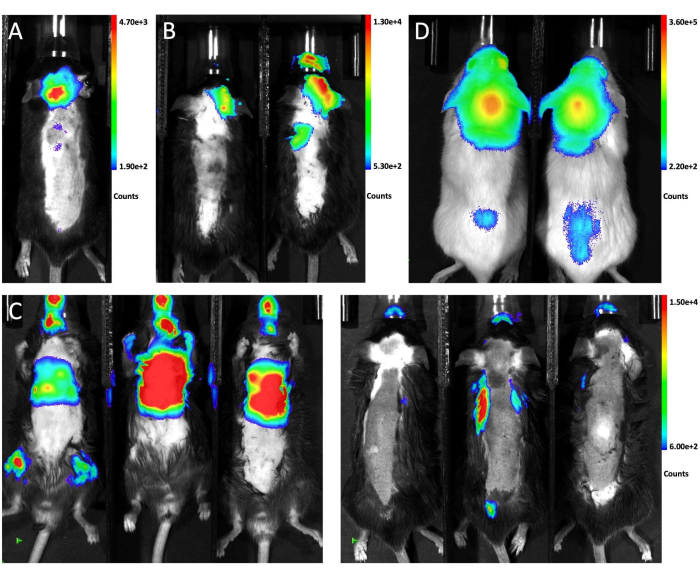
Figura 2: Imagens representativas de bioluminescência in vivo de camundongos recebendo diferentes métodos de injeção. (UMA)O sinal de bioluminescência in vivo de todo o animal após injeção intra-cisterna magna de células LLC1. (B) A imagem de bioluminescência in vivo dos camundongos após injeção intra-carotídea de células LLC1. (C) O sinal de bioluminescência in vivo dos camundongos após injeção intracardíaca de células LLC1. O lado esquerdo mostra a visão supina e o lado direito mostra a vista prona. (D) A imagem de bioluminescência de camundongos NSG após a injeção de células A549 através da cisterna magna.a Clique aqui para ver uma versão maior desta figura.
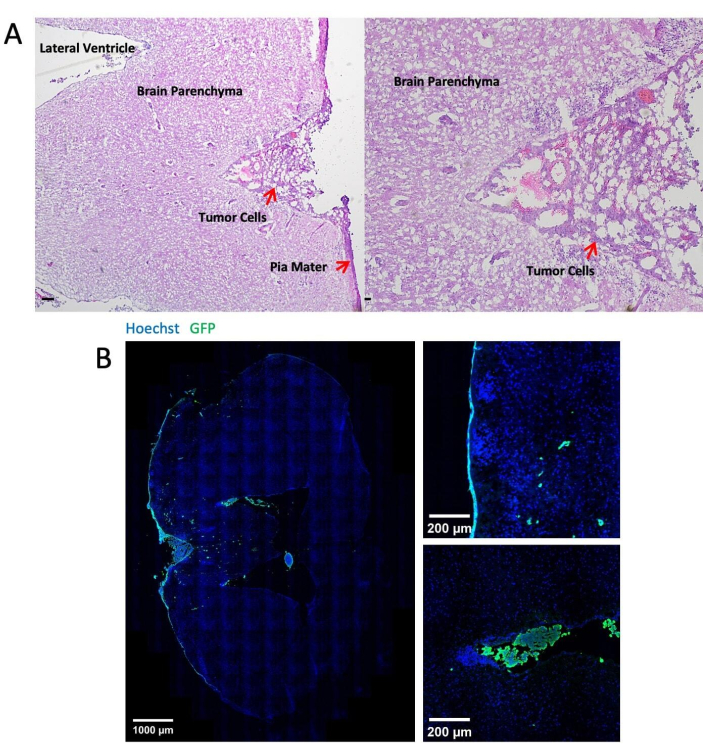
Figura 3: Imagens representativas da coloração histológica e imunofluorescente. (A) A coloração H & E representativa mostra células LLC1 depositadas principalmente na superfície das meninges e nos ventrículos. Barra de escala = 25 μm. (B) Imagens de coloração imunofluorescente do cérebro portador de tumor LLC1. Clique aqui para ver uma versão maior desta figura.
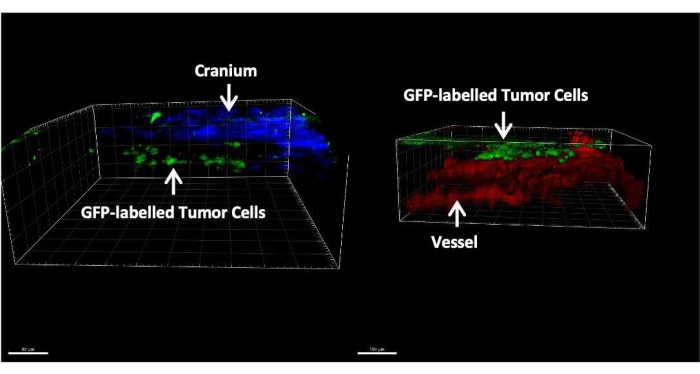
Figura 4: Imagens representativas de dois fótons de um camundongo com LM. As células tumorais marcadas com GFP (verde) são encontradas exclusivamente entre o crânio (azul) e o parênquima cerebral (vermelho). Clique aqui para ver uma versão maior desta figura.
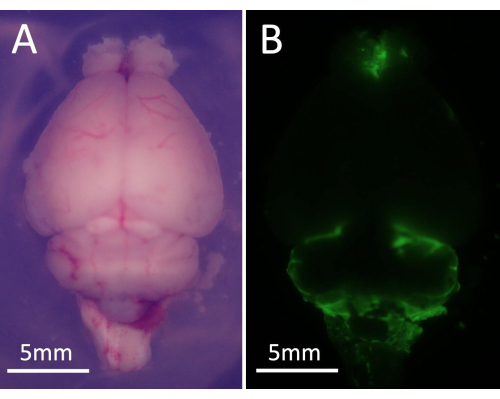
Figura 5: Imagens representativas do microscópio de fluorescência estéreo. (A) Campo visual global do cérebro de camundongo sob microscópio. (B) Células tumorais marcadas com GFP foram apresentadas na superfície do cérebro, que emitem fluorescência verde. Clique aqui para ver uma versão maior desta figura.
| Duração do procedimento/min | Incidência de LM observada 14 dias após a injeção | Taxa de tumor extracraniano | Taxa de grandes tumores do parênquima cerebral | |
| Injeção magna intra-cisterna | ~5 | 100% (15/15) | 0 (0/15) | 0 (0/15) |
| Injeção intracarotídea | ~ 20 | 0 (0/15) | 100% (15/15) | 100% (15/15) |
| Injeção intracardíaca | ~5 | 0 (0/3) | 100% (3/3) | 0(0/3) |
Tabela 1: Comparação de três métodos de injeção diferentes em termos de duração da operação, incidência de metástase leptomeníngea, tumores extracranianos e taxa de grandes tumores parenquimatosos cerebrais.
Discussão
LM é uma condição agressiva e fatal. Uma vez que as células tumorais metastatizam para o espaço preenchido pelo líquido cefalorraquidiano, elas se disseminam rapidamente por todo o sistema nervoso central25. Essas células se instalam e invadem o cérebro, a medula espinhal, os nervos cranianos e espinhais, levando a uma rápida deterioração neurológica e eventual morte17. Para entender melhor os mecanismos fisiopatológicos subjacentes e avaliar possíveis estratégias terapêuticas, é crucial desenvolver um modelo in vivo eficiente que recapitule o processo metastático e o microambiente circundante na metástase leptomeníngea.
Um relato anterior mostrou que a ML pode ser induzida em modelos murinos pela injeção direta de células tumorais no hemisfério cerebelar direito15. No entanto, essa abordagem muitas vezes não produz metástases na região subfrontal ou na medula espinhal distal em alguns indivíduos. Um estudo recente demonstrou que tumores derivados de células cancerígenas de pulmão de pequenas células mutadas, quando implantados por via subcutânea, podem se espalhar espontaneamente para o espaço leptomeníngeo após um período prolongado de latência14. Após a expansão in vitro de células tumorais da LM espontânea, os autores estabeleceram com sucesso uma sublinhagem celular capaz de desenvolver LM com infiltração mínima do parênquima cerebral por meio de injeção intra-carotídea. Embora esse procedimento capture o curso natural da disseminação metastática para o espaço leptomeníngeo, é ineficiente e demorado, pois a maioria dos camundongos morre de metástases em outros órgãos antes que a ML possa se desenvolver completamente. Além disso, essa abordagem requer uma microcirurgia sofisticada, o que impõe um trauma considerável ao sujeito26. Alternativamente, a injeção direta de células tumorais na cisterna magna resultou em extenso envolvimento leptomeníngeo, que se assemelha muito à condição observada em pacientes com LM15. No entanto, alguns métodos de injeção intracisternal requerem dissecção de pele e músculo, resultando em trauma significativo e aumento do risco de infecção intracraniana, o que pode alterar as características fisiopatológicas da ML.
Aqui, descrevemos um método minimamente invasivo para injetar células tumorais na cisterna magna por meio de uma via de punção percutânea. Em contraste com outras abordagens cirúrgicas, as injeções percutâneas evitam etapas invasivas, como a incisão na pele, minimizando assim o risco de infecção. Com posicionamento preciso, o procedimento pode ser concluído em apenas alguns minutos, reduzindo significativamente o tempo de cuidados operatórios e pós-operatórios. Além disso, a injeção direta de células tumorais na cisterna magna melhora o enxerto de células tumorais dentro do espaço leptomeníngeo e reduz a incidência de colonização de órgãos extracranianos (Tabela 1).
Há algumas considerações críticas e informações de solução de problemas para o protocolo. Embora esperemos que o procedimento atual reduza a necessidade de pessoal altamente qualificado e simplifique todo o processo, ainda é fundamental que o operador identifique com precisão o local da punção. Os operadores devem estar familiarizados com a anatomia do camundongo, particularmente a fossa craniana posterior e a região cervical, para garantir um posicionamento preciso. Se a agulha encontrar uma superfície óssea durante a inserção, o local da punção pode ser muito alto e deve ser ajustado para baixo adequadamente. Para garantir injeções bem-sucedidas, posicionamos e prendemos os animais acima de um tubo de centrífuga de 15 mL para expor totalmente o local da injeção. Também descobrimos que a seringa de insulina 31G, 8 mm tem um desempenho melhor do que a seringa Hamilton convencional para perfurar a cisterna magna. Isso provavelmente ocorre porque a agulha da seringa de Hamilton é menos eficaz em penetrar em camadas espessas de tecido e fornece menos controle durante a inserção. A profundidade (4 mm) e o ângulo (45°-50°) da inserção da agulha são cruciais. A profundidade excessiva pode levar ao crescimento do tumor no tronco encefálico, enquanto a profundidade insuficiente pode resultar em tumores subcutâneos. Assim, para minimizar o risco de morte acidental por um aumento súbito da pressão intracraniana, a injeção deve ser realizada o mais lentamente possível.
No entanto, este protocolo não é isento de limitações. Ao contrário dos métodos tradicionais, o procedimento descrito depende do posicionamento preciso do animal e do feedback sensacional do operador, o que introduz um grau de variabilidade. Com um controle cuidadoso da profundidade de injeção e prática repetida, uma alta taxa de sucesso pode ser alcançada. Outra grande desvantagem do procedimento atual é que ele ignora as etapas iniciais da cascata metastática e, portanto, não é capaz de recapitular todo o curso da LM em pacientes. No geral, o procedimento apresentado é tecnicamente simples e altamente eficiente para estabelecer modelos de LM murinos, representando uma valiosa plataforma pré-clínica para estudos relacionados à LM.
Divulgações
Os autores declaram não haver conflito de interesses.
Agradecimentos
Os autores agradecem aos membros do laboratório Zhang por suas valiosas discussões e assistência ao longo deste estudo. W.Z. é apoiado pelos Fundos de Pesquisa Fundamental para as Universidades Provinciais de Zhejiang (2023QZJH60), o Programa de Fundo de Ciência para Jovens Acadêmicos Distintos da Fundação Nacional de Ciências Naturais da China (588020-X42306/041) e o fundo inicial do Instituto de Ciências da Vida da Universidade de Zhejiang.
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5ml Eppendorf tubes | Biosharp | BS-15-M-S | |
| 15ml centrifuge tube | LABSELECT | CT-002-15A | |
| 31G x 8mm insulin syringe(0.3ml) | Promisemed | / | |
| Abrasive drill | GLOBALEBIO | GEGZ-AM1 | |
| Animal heat mat | woggee | / | |
| Cryomold | Supin | SP-AB-7 x 7 x 5 | |
| Depilatory creams | Nair | 1.00023E+11 | |
| D-Luciferin | Gold Biology | LUCK-1G | |
| DMEM | Gibco | C11995500CP | |
| FBS | Gibco | 10270-106 | |
| IVIS Spectrum | Caliper | / | |
| Optimal Cutting Temperature | Sakura | 4583-1 | |
| Paraformaldehyde | SCR | 80096618 | |
| PBS | Servicebio | G4202-500ML | |
| Pen/Strep Amphotericin B | Gibco | 15140122 | |
| Shaver | Hipidog | 2103CGMJ3373-GQ22N526 | |
| Stereo fluorescence microscope | Olympus | / | |
| Straight forceps | Beyotime | FS019 | Need to be autoclaved |
| Surgical scissors | Beyotime | FS001 | Need to be autoclaved |
| Triangular mouse fixation head piece | Transcend vivoscope | TVS-FDM-027 | |
| Tribromoethanol | Macklin | C14432922 | |
| TRITC-dextran, MW 70000 | MedChemExpress | HY-158082C | |
| Trypsin/EDTA solution | Gibco | 25200056 | |
| Two-photon laser scanning microscopy | Olympus | / | |
| Vetbond Tissue Adhesives | 3M | 1469SB |
Referências
- Wilcox, J. A., et al. Leptomeningeal metastases from solid tumors: A Society for Neuro-Oncology and American Society of Clinical Oncology consensus review on clinical management and future directions. Neuro Oncol. 26 (10), 1781-1804 (2024).
- Wasserstrom, W. R., Glass, J. P., Posner, J. B. Diagnosis and treatment of leptomeningeal metastases from solid tumors: experience with 90 patients. Cancer. 49 (4), 759-772 (1982).
- Remsik, J., Boire, A. The path to leptomeningeal metastasis. Nat Rev Cancer. 24 (7), 448-460 (2024).
- Kokkoris, C. P. Leptomeningeal carcinomatosis. How does cancer reach the pia-arachnoid. Cancer. 51 (1), 154-160 (1983).
- Remsik, J., et al. Leptomeningeal metastatic cells adopt two phenotypic states. Cancer Rep. 5 (4), e1236(2022).
- Chi, Y., et al. Cancer cells deploy lipocalin-2 to collect limiting iron in leptomeningeal metastasis. Science. 369 (6501), 276-282 (2020).
- Yin, K., et al. A molecular graded prognostic assessment (molGPA) model specific for estimating survival in lung cancer patients with leptomeningeal metastases. Lung Cancer. 131, 134-138 (2019).
- Li, Y. S., et al. Leptomeningeal Metastases in Patients with NSCLC with EGFR Mutations. J Thorac Oncol. 11 (11), 1962-1969 (2016).
- Li, Y. S., et al. Unique genetic profiles from cerebrospinal fluid cell-free DNA in leptomeningeal metastases of EGFR-mutant non-small-cell lung cancer: a new medium of liquid biopsy. Ann Oncol. 29 (4), 945-952 (2018).
- Posner, J. B., Chernik, N. L. Intracranial metastases from systemic cancer. Adv Neurol. 19, 579-592 (1978).
- Kuiper, J. L., et al. Treatment and survival of patients with EGFR-mutated non-small cell lung cancer and leptomeningeal metastasis: A retrospective cohort analysis. Lung Cancer. 89 (3), 255-261 (2015).
- Tsukada, Y., Fouad, A., Pickren, J. W., Lane, W. W. Central nervous system metastasis from breast carcinoma. Autopsy study. Cancer. 52 (12), 2349-2354 (1983).
- Singh, M., Bakhshinyan, D., Venugopal, C., Singh, S. K. Preclinical Modeling and Therapeutic Avenues for Cancer Metastasis to the Central Nervous System. Front Oncol. 7, 220(2017).
- Shi, M. X., et al. PROTAC EZH2 degrader-1 overcomes the resistance of podophyllotoxin derivatives in refractory small cell lung cancer with leptomeningeal metastasis. BMC Cancer. 24 (1), 504(2024).
- Choi, S. A., et al. In vivo bioluminescence imaging for leptomeningeal dissemination of medulloblastoma in mouse models. BMC Cancer. 16 (1), 723(2016).
- Zhao, J., et al. Dura immunity configures leptomeningeal metastasis immunosuppression for cerebrospinal fluid barrier invasion. Nat Cancer. 5 (12), 1940-1961 (2024).
- Boire, A., et al. Complement Component 3 Adapts the Cerebrospinal Fluid for Leptomeningeal Metastasis. Cell. 168 (6), 1101-1113.e13 (2017).
- Zhang, W., et al. Metastasis Initiation Is Coupled with Bone Remodeling through Osteogenic Differentiation of NG2+ Cells. Cancer Discov. 13 (2), 474-495 (2023).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods Mol Biol. 740, 7-12 (2011).
- Green, T. R. F., Ortiz, J. B., Harrison, J. L., Lifshitz, J., Rowe, R. K. Simultaneous Cryosectioning of Multiple Rodent Brains. J Vis Exp. (139), e58513(2018).
- Feldman, A. T., Wolfe, D. Tissue Processing and Hematoxylin and Eosin Staining. Methods Mol Biol. 1180, 31-43 (2014).
- Shih, A. Y., Mateo, C., Drew, P. J., Tsai, P. S., Kleinfeld, D. A polished and reinforced thinned-skull window for long-term imaging of the mouse brain. J Vis Exp. (61), e3742(2012).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32 (7), 1277-1309 (2012).
- Drew, P. J., et al. Chronic optical access through a polished and reinforced thinned skull. Nat Methods. 7 (12), 981-984 (2010).
- Wilcox, J. A., Li, M. J., Boire, A. A. Leptomeningeal Metastases: New Opportunities in the Modern Era. Neurotherapeutics. 19 (6), 1782-1798 (2022).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid Cancer Cell Injection to Produce Mouse Models of Brain Metastasis. J Vis Exp. (120), e55085(2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados