Method Article
キメラ抗原受容体T細胞を単一細胞レベルで評価するための液滴ベースの細胞毒性アッセイ
要約
ここでは、1つのT細胞とがん標的細胞を内包したダブルエマルジョン液滴を作製し、細胞死を1細胞レベルで調べる方法について述べる。この方法により、大規模なT細胞集団内の細胞傷害性分子と標的細胞のアポトーシスの両方を二重に定量できます。
要約
キメラ抗原受容体(CAR)T細胞治療などのT細胞ベースの治療法の細胞毒性の可能性の評価は、その有効性を評価するのに役立ち、臨床応用の前提条件です。しかし、従来の細胞毒性アッセイはバルクアッセイとして実施され、CAR-T細胞集団の機能的不均一性に関する詳細な情報は提供されません。この研究では、シングルエフェクターCAR-T細胞とシングルターゲット細胞の大規模な共カプセル化を可能にするダブルエマルジョンドロップレットベースの方法を説明すると同時に、T細胞由来の細胞傷害性エフェクター分子と標的細胞の細胞死の両方の二重定量を可能にします。このプロトコルは、CD19特異的CAR T細胞の生成と精製の方法、続いてCD19+ 細胞株JeKo-1との液滴中での共カプセル化、および細胞傷害性エフェクター分子の分泌(グランザイムB)および細胞死(ヨウ化プロピジウム、PIを使用)を視覚化するための試薬を概説しています。私たちは、シングルCAR-Tを含む液滴と標的細胞を、ダブルエマルジョン液滴を生成するための市販のマイクロ流体デバイスを用いて作製する方法を示します。さらに、標準的なフローサイトメトリー装置を使用して、液滴中のCAR-T細胞の機能的多様性をアッセイする方法の例を提供します。最後に、CD19特異的CAR-T細胞の死滅の時間的動態と不均一性について簡単に説明します。この方法は、CAR-T細胞の攻撃後の細胞死に焦点を当てていますが、他の種類のT細胞、細胞傷害性免疫細胞、サイトカイン分泌などのエフェクター細胞機能を調べることにも適応できます。
概要
キメラ抗原受容体(CAR)T細胞療法は、急速に拡大している細胞がん免疫療法の分野であり、さまざまな形態の白血病、リンパ腫1、多発性骨髄腫2に対して有効であることが証明されています。CAR-T細胞は、B細胞、形質細胞、およびそれらの悪性対応物に発現するCD19やB細胞成熟抗原(BCMA)などの表面タンパク質に選択的に結合できる合成抗原受容体を用いてT細胞を改変することによって作製されます。近年のCAR設計の進歩により、複数のインプットシグナルに依存して複数の抗原3を同時に標的化したり、特定のタンパク質アイソフォーム4などの腫瘍関連抗原のみに結合したりすることが可能になりました。さらに、いくつかのCARは現在、非血液がんの標的に対して試験されています5。
細胞毒性アッセイは、臨床製品がリリースされる前のCAR開発と品質管理の両方に不可欠です6,7,8。しかし、現在のほとんどのアッセイは、がん細胞株に過剰に添加されたエフェクターCAR-T細胞のバルク集団に依存しており、これはバイスタンダー効果9による偽陽性の結果につながり、in vitroとin vivoの結果10との間の相関性が乏しい結果をもたらす可能性があります。T細胞の増殖と長期の持続性は、初期活性化イベント11,12中に受信されるシグナルに依存するため、単一細胞レベルでの細胞傷害性イベントを詳しく調べることは非常に興味深い。
バルク法の限界に対処するために、フローサイトメトリー13、14、15、16、17およびイメージングベースのアッセイ18を用いて、シングルセルレベルでの細胞毒性研究を実施することができる。しかし、標準的なフローサイトメトリーでは、エフェクター細胞と標的細胞の両方を定量化し、特性評価するためのシングルセル分解能が得られますが、個々のCAR-T細胞の標的細胞に対する特異的な細胞傷害能力を直接決定することはできません。さらに、それぞれのターゲットと相互作用する個々のCAR-T細胞を大量にイメージングすることは、細胞の一貫した運動性のために困難で時間がかかります。これらの課題に対処するために、マイクロウェルアレイ19,20,21、マイクロラフトアレイ22、マイクロチップ23、および液滴マイクロ流体工学24,25,26を使用して、空間的に限られた空間でエフェクタ細胞と標的細胞をペアリングすることに依存するシングルセル解析用の新しいツールが開発されました.これらのツールにより、測定感度が向上し、試薬量を減らしてより少ない細胞で調査することができます。しかし、効率的な細胞ペアリング、解析可能なサンプル数が限られていること、イメージングベースの解析のみに依存していること、さらなる解析のために生存細胞集団を回収することの難しさなど、いくつかの課題が残っています。
ここでは、液滴ベースのマイクロ流体工学への非常に簡素化されたアプローチを可能にする市販のマイクロ流体工学デバイスを利用しています。このデバイスにより、安定性の高いダブルエマルジョン(DE)液滴を用いた高度なシングルセル解析やアッセイが可能になります。マイクロウェルアッセイや従来の液滴マイクロ流体アッセイと比較して、ここで概説するプロトコルは、広範なマイクロフルディクスの専門知識を必要としません。
DE液滴は、水溶液に懸濁された水性コアを備えたオイルシェルで構成された小さな球状のコンパートメントです。水滴には、細胞、細胞セクレトーム、細胞培地、およびアッセイ試薬が含まれ、保持されるため、各コンパートメント内で複雑なアッセイを行うことができます。マイクロ流体デバイスを使用すると、哺乳類の単一細胞または細胞間相互作用アッセイに適した設定容量(約100 pL)でDE液滴が生成され、マイクロ流体工学の専門知識を持たない一般のラボユーザーでも、非常に大量(サンプルあたり約750,000個の液滴)と短時間(8サンプルで約10分)を生成できます。生成された液滴は細胞培地に懸濁することができるため、O2 およびCO2 のトランスシェル拡散と内部の緩衝が可能になると同時に、細胞分泌エフェクター分子などの親水性およびより大きな分子を保持することができます。したがって、検査された細胞は適切にバッファーされ、細胞間相互作用と時間的ダイナミクスを経時的に調べることができます。単一のエマルジョン液滴(例えば、油中水滴)27とは対照的に、DE液滴は、標準的な細胞インキュベーター内で融合または融合しない堅牢な構造である。その安定性と水性外相により、従来のフローサイトメトリーなどの下流解析手順にも適合します。したがって、マイクロ流体デバイスによって生成されたこれらのピコリットル液滴は、細胞機能のハイスループットシングルセル分析に使用でき、従来のバルクアッセイに隠された機能不均一性を解明することができます。
ここでは、DE液滴を利用して、リンパ腫細胞に対するCD19特異的CARの細胞傷害性を調べるプロトコールについて概説します。私たちのプロトコルは、標的殺傷とグランザイムB(GzmB)分泌の単一細胞分析を可能にし、ここで調べたCAR-T細胞の約20%が即時殺傷の可能性を持っていることを明らかにしています。
プロトコル
この研究で使用されたCAR-T細胞は、認定されたバイオセーフティGMOクラス2実験室でCD19scFv-CD28-CD3ζ-tNGFR CARコンストラクトを使用して初代T細胞のレンチウイルス形質導入によって生成され、研究所の基準に従って4日後に機密解除されました。精製されたT細胞は、匿名化された献血から廃棄された余剰材料から抽出されたもので、デンマークの法律により、さらなる倫理的承認が免除されました。
1. CAR-T細胞の作製
注:以下で使用する試薬の名称は、一般名と略称を使用しています。完全な商用名は、 資料の表の括弧内にあります。
- T細胞の活性化、形質導入、増殖
注:CD19 CAR T細胞の安定発現は、ネガティブセレクションT細胞単離キットを使用して新鮮な末梢血単核細胞(PBMC)から単離された初代ヒトT細胞のレンチウイルス形質導入によって達成されました。使用される抗CD19 CARは、FMC63 single-chain-variable fragment (scFv)、CD28 hinge and transmembrane domain、CD28 costimulatory domain、CD3ζ activation domain28 、およびCAR発現細胞29のモニタリングおよび濃縮のための神経成長因子受容体(tNGFR)の短縮型で構成される第2世代のコンストラクトである.トランスファーベクタープラスミドはde novoで合成し、これをpMDLg/pRRE (Addgene plasmid #12251)、pRSV-Rev (Addgene plasmid #12253)、およびpMD2.G (Addgene plasmid #12259)と組み合わせることで第3世代レンチウイルスを作製した30。後の3つのプラスミドは、ディディエ・トロノからの贈り物でした。粗ウイルスをPEGベースの試薬を用いて濃縮し、SUP-T1細胞を形質導入し、標準プロトコル31に従ってフローサイトメトリーによるtNGFRを測定することにより、感染の多様性(MOI)を決定した。- 2 x 106 初代ヒト T 細胞を 12 ウェル培養皿に移し、1 mL の完全 RPMI-1640 培地 (10% 熱不活化ウシ胎児血清、1% ペニシリン/ストレプトマイシン) に 100 単位/mL 組換えヒトインターロイキン-2 (IL-2) を添加した 1 mL のビーズ対細胞比で CD3/CD28 コーティングビーズで刺激します。細胞を37°Cで加湿した5%CO2インキュベーターで24時間インキュベートします。
- 活性化T細胞にレンチウイルス粒子をMOI5〜10で添加します。穏やかに混合し、細胞を72時間インキュベートします。非形質導入(NTD)T細胞をネガティブコントロールとして含めます。
- 形質導入後3日目に、T細胞を1.5mLチューブに回収し、チューブを磁気スタンドに1〜2分間置いて、CD3 / CD28活性化ビーズを除去します。細胞を含む上清を新しい1.5mLチューブに移します。
- 自動セルカウンターを使用して細胞カウントを行い、100 U/mL IL-2を添加した完全なRPMI-1640培地で細胞密度を1 x 106 細胞/mLに調整します。懸濁液中のCAR-T細胞の総数が少なくとも1.5 x 106 (通常は合計で約6 x 106 T細胞)に達するまでT細胞の増殖を続けてから、NGFR濃縮(下記参照)に進みます。
- 細胞数を隔日でモニターし、100ユニット/mLのIL-2を補充した新鮮な培地を添加して濃度を1 x 106 細胞/mLに調整し、増殖中の細胞状態を最適化します。
- CAR発現T細胞の濃縮
- 6 x 106 個以上の形質導入T細胞を15 mLチューブに移し、300 x g で5分間遠心分離します。0.5%ウシ血清アルブミン(BSA)を添加したPBS320 μLに細胞ペレットを再懸濁してPBSAを作製し、40 μLの抗NGFR磁気ビーズを添加します。よく混ぜ合わせ、氷上で15分間インキュベートします。
注:このプロトコルは、約25%の形質導入効率を前提としており、濃縮後に>1.5×106 CAR T細胞が得られます。6 x 106 細胞未満から始めると、CAR-T細胞の回収率が低下する可能性があるため、お勧めしません。 - 1640 μL の PBSA を添加して最終容量を 2 mL にした後、製造元の指示に従って分離カラムを使用して磁気分離を進めます。
- 6 x 106 個以上の形質導入T細胞を15 mLチューブに移し、300 x g で5分間遠心分離します。0.5%ウシ血清アルブミン(BSA)を添加したPBS320 μLに細胞ペレットを再懸濁してPBSAを作製し、40 μLの抗NGFR磁気ビーズを添加します。よく混ぜ合わせ、氷上で15分間インキュベートします。
- フローサイトメトリーによるCAR発現の検出
注:この時点でCAR発現細胞の割合とその生存率を決定し、以下のアッセイを実行する前に適切な細胞を確認することをお勧めします。この時点で、CD4とCD8の比率と記憶表現型も決定できます。代表的なプロットについては、 図 1 を参照してください。- 形質導入培養物と非形質導入培養物の両方から2.5 x 105 T細胞を別々のフローサイトメトリーチューブに移します。細胞を200μLのPBSで2回洗浄し、各洗浄後に300 x g で5分間遠心分離します。
- 抗CD19 CAR FMC63 Idiotype PE、抗CD3 BV480、および抗NGFR FITC抗体を含む抗体ミックスを調製し、それぞれPBSで1:100に希釈します。抗体ミックス50 μLに細胞を再懸濁し、4°Cで20分間インキュベートします。
- 細胞を200μLのPBSで2回洗浄し、各洗浄後に300 x g で5分間遠心分離します。細胞を200 μLのPBSに再懸濁し、フローサイトメトリーを使用して解析します。
2. T細胞と標的細胞を内包する液滴の生成
注:カプセル化する前に、T細胞とJeKo-1細胞を異なる細胞染色で染色して、液滴細胞の内容物をモニターします。細胞をアッセイ試薬でカプセル化し、2〜6時間インキュベートしてから、液滴をフローサイトメーターで分析します( 図2を参照)。
- カプセル化前の細胞の染色
- 2種類の蛍光色素(バイオレット色素と遠赤色色素を使用)のワーキング溶液を調製し、ストック溶液(メーカーの指示に従って調製)をdPBSで1:5,000に希釈します。
- 各ドナーについて、2.5 x 106 CAR T、2.5 x 106 NTD T、および 15 x 106 JeKo-1 細胞を別々の遠心チューブ(15 mL または 50 mL チューブ)に移し、300 x g で 5 分間遠心分離します。この実験では、0.5 x 106 エフェクター細胞を、調製したサンプルごとに1.5 x 106 の標的細胞にカプセル化しました。
注:ここに転写された細胞の数は、各ドナーの各エフェクター細胞タイプを含む4倍のカプセル化サンプルを対象としています。必要なサンプル数に応じて、細胞と試薬の数をスケールダウンします。さらに、サンプルあたりの正確な細胞数は、実験のニーズに応じてスケーリングできます。 - 上清を除去し、紫色蛍光色素の1:5,000作動溶液中のエフェクター細胞ペレットと、遠赤色蛍光色素の1:5,000作動溶液中の標的細胞(JeKo-1)ペレットを再懸濁します。ピペットで細胞を1 x 106 細胞/mL染色溶液の細胞濃度までしっかりと再懸濁します。
- 細胞を37°C加湿CO2 インキュベーターで20分間インキュベートします。細胞を300 x g で5分間遠心分離し、上清を除去し、15 mLの完全RPMI-1640培地に再懸濁して細胞を洗浄します。
- 洗浄を繰り返し、300 x g で5分間遠心分離します。上清を除去し、エフェクター細胞ペレットを225 μLの完全RPMI-1640に再懸濁し、標的細胞ペレットを450 μLの完全RPMI-1640に再懸濁します。
- 30 μLのグラジエント培地をエフェクター細胞懸濁液に、60 μLの同じグラジエント培地を標的細胞懸濁液に加えます。ピペッティングのかなり前に、グラジエント培地ストック溶液を再懸濁してください。
- 20 μg/mL の PI ストック 15 μL をエフェクター細胞懸濁液に、30 μL の PI ストックをターゲット細胞懸濁液に添加します。最終的なPI濃度は、以下にグランザイムB(GzmB)基質を添加した後、最終的に1 μg/mLになります。
- 完全RPMI-1640で1:10希釈のGzmB基質を調製し、このGzmB基質希釈液30μLをエフェクター細胞懸濁液に、60μLを標的細胞懸濁液に加えます。ピペットとよく混ぜます。
注:各エフェクター細胞ペレットに添加した試薬の総容量は300 μL、標的細胞ペレットに添加した試薬の総容量は600 μLになります。これらの溶液中のグラジエント培地濃度は 10%、PI 濃度は 1 μg/mL、GzmB 基質濃度は 1:100 である必要があります。 - CD3、CD4、およびCD8抗体を使用した代替標識
注:場合によっては、標的細胞と共カプセル化する前に、エフェクター細胞をさらに標識することが興味深いかもしれません。ここでは、CD3、CD4、CD8抗体とPBMCを使用したこのタイプの標識の原理実証を示します( 図3を参照)。- 2.0 x 106 PBMCを1.5 mLチューブに移し、細胞を300 x gで5分間スピンダウンします。上清を取り除き、細胞ペレットを0.5% BSAを含む200 μLのdPBSに再懸濁します。内容物を2本の2mLチューブに分けます。
- チューブの1つに5 μLの抗CD3-APCと5 μLの抗CD4-StarBright Violet 760を加えます。20 μL の抗 CD3-FITC と 5 μL の抗 CD8-StarBright Violet 760 をもう一方のチューブに加えます。
- よく混ぜ合わせ、暗所で室温で30分間インキュベートします。1 mLの洗浄バッファーを細胞に加え、300 x g で5分間スピンダウンし、上清を除去し、細胞ペレットを0.5% BSAを含む1 mLのdPBSに再懸濁します。
- 細胞を300 x g で5分間スピンダウンし、上清を取り除き、フェノールレッドを含まない150 μLのRPMIおよび10%グラジエント培地に細胞ペレットを再懸濁します。ステップ 2.2 で説明したように、フェノールレッドを含まない RPMI、細胞用の 33% 安定化溶液、および外側培地として 10% グラジエント培地を使用してカプセル化します。
- 細胞のカプセル化
- カプセル化する前に、カプセル化カートリッジと安定化溶液を室温に予熱します。完全なRPMI-1640培地、細胞用33%安定化溶液、および10%グラジエント培地からなる外部培地のストックを準備します。
- 各カプセル化サンプルについて、混合ターゲットエフェクター細胞を含む細胞サンプル溶液を調製します。よく調製した細胞溶液をピペットで再懸濁し、調製したエフェクター細胞懸濁液65 μLと調製した標的細胞懸濁液65 μLを1.5 mLチューブに混合します(どちらもステップ2.1で調製)。
- 適切なカプセル化を確保するために、カプセル化カートリッジの指定されたウェルに次の順序で試薬をロードすることを直ちに進めてください。調製したカプセル化サンプルごとに1セットのウェルをロードします。
ウェル #A:400μLの外部メディア。
ウェル #D:小さな棚に40μLの外部メディア。
ウェル #C:120 μLのプレミックス溶液とターゲット細胞(JeKo-1)およびエフェクター細胞。ロードする直前にピペットで細胞をしっかりと再懸濁してください。
ウェル #B:250μLのオイル。
注:各カートリッジには、並列にカプセル化するために最大8つのサンプルをロードできます。 - すぐにガスケットのシールを進め、ロードされたカートリッジを傾けたり、振ったり、ぶつけたりしないようにしながら、カートリッジを装置にロードします。ガスケットをカートリッジに慎重に密封します。
- カートリッジをマイクロ流体デバイスに慎重に移し、ユーザーマニュアルに記載されているようにカプセル化を開始します。
- 生成された液滴は、周囲の外部媒体よりも密度が高く、収集井の底に急速に沈殿します(Well #D)。Well #D から沈殿した液滴をオーバーレイ培地に再懸濁し、蓋付きの2 mLの低結合DNAチューブに移すことにより、各液滴産生物(すべての液滴とその周囲の外部培地)を収集します。Well #A の残りの外部メディアと一緒に #D よく洗浄し、残りの液滴を収集します。
- 液滴が採取チューブ内に沈殿したら(約1分)、明視野顕微鏡で液滴の生成を確認します。これを行うには、10 μLのピペットチップにサンプルを充填します:液滴相の表面からの液滴で約1/3、チップをフィルするためのオーバーレイアウターメディウムで約2/3。すぐにサンプルを8チャンバースライドガラスにロードし、4倍および20倍の倍率の明視野顕微鏡で液滴を検査して、細胞の液滴ロードを確認します。
注:この方法で液滴が周囲の媒体のより大きな量で吸引されることが重要です。
- 潜伏
注:液滴は、標準的な加湿37°C、5%CO2インキュベーター内の2mLのDNA低結合チューブでインキュベートできます。これらのチューブは、液滴培養に最適な表面特性を備えているため、使用することをお勧めします。- シリンジ針(23G)で、必要数の2mL低結合DNAチューブの蓋に慎重かつ安全に穴を開けます。これにより、媒体の蒸発を防ぎながら、自由なCO2/O2 拡散が保証されます。
- 各インキュベーションチューブに1 mLの外部培地を加えます。液滴は、適切なバッファリングを確保するために、少なくとも5倍の量の外部培地とインキュベートする必要があります。添加される外部培地の量は、適用される細胞の代謝に応じて増加させることができる。
- オーバーレイ培地で生成された液滴を再懸濁し、各プロダクションを調製したインキュベーションチューブのうち3本(各タイムポイント測定用)に分割します。液滴は重く、沈殿が速いため、各移送の間にストックを再懸濁することが重要です。
注:液滴生成物を分割するインキュベーションチューブの数はさまざまですが、各サンプルに分析に十分なイベントが含まれていることを確認するために、1つの生成物を4つ以下のインキュベーションチューブに分割することをお勧めします。 - 液滴生成後2時間、4時間、または6時間のインキュベーションのために、チューブをインキュベーターに直立させます。
3. 液滴の下流解析
- 顕微鏡
- インキュベーション後、ステップ2.2.7で説明したように、少数の液滴を顕微鏡スライドに移し、適切なレーザーおよびフィルター構成の標準的な蛍光顕微鏡を用いて、明視野顕微鏡および蛍光顕微鏡でそれらを分析します。
注:液滴は明視野顕微鏡で検出できます。紫色に染色されたT細胞はDAPIフィルターで、遠赤色に染色されたJeKo-1細胞はAPCフィルターで、GzmB-FAMシグナルはFITCフィルターで、PIシグナルはPEフィルターで検出できます。最も関心のあるPIシグナルは、初期のアポトーシス細胞は後期アポトーシス細胞よりもピーク発光が低いため、顕微鏡で視覚化するのが難しい場合があります。代表的なデータについては、 図 4 を参照してください。
- インキュベーション後、ステップ2.2.7で説明したように、少数の液滴を顕微鏡スライドに移し、適切なレーザーおよびフィルター構成の標準的な蛍光顕微鏡を用いて、明視野顕微鏡および蛍光顕微鏡でそれらを分析します。
- フローサイトメトリー
- インキュベーション後、各液滴サンプルをオーバーレイ培地に再懸濁し、5 mL FACSチューブに移します。標準的なフローサイトメーターを使用して液滴を解析するには、以下の一般的なガイドラインに従ってください。
- 適切なレーザーとフィルター構成のフローサイトメーターを使用してください。選択した細胞染色パネルとアッセイにより、ここで使用するフローサイトメーターで色補正を行う必要はありません。他の色が適用されている場合や、適用されているフローサイトメーターの構成が異なる場合は、補正が必要になることがあります。
- FSC-Hを閾値トリガーとして使用して、小さなオイルイベントからバックグラウンドノイズを除外します。
- 液滴は重く、FACSチューブの底に沈殿します。SIP が液滴に到達することを確認します。液滴は、取得前に少なくとも5倍の量の外側バッファーに液滴に懸濁する必要があります。
- ドロップレットイベントは高速を使用して取得されます。液滴の分析には強度高さの測定が使用されるため、FSCおよびSSCと検査した蛍光色素の強度高さ(H)信号を記録します。ゲインを調整して、ポジティブなイベントとネガティブなイベントを適切に分離します。
注:FITCチャネルを使用してGzmBシグナルを測定し、Pacific Blueチャネルを使用して紫色に染色されたT細胞を検出し、APCチャネルを使用して遠くの赤く染色されたJeKo-1細胞を検出し、PEチャネルを使用してPIシグナルを検出しました。 - ダウンストリーム解析に十分なイベントを記録します。ここでは、タイムポイントごとに4.5〜8.3 x 103 の共カプセル化液滴を記録しました。
- 液滴取得の各セットの後、標準的な洗浄液とリンス液を使用して、フローサイトメーターをSIPで洗浄します。実験の最後にフローサイトメーターを完全に清掃してください。代表的なデータについては、 図 4 と 図 5 を参照してください。
- インキュベーション後、各液滴サンプルをオーバーレイ培地に再懸濁し、5 mL FACSチューブに移します。標準的なフローサイトメーターを使用して液滴を解析するには、以下の一般的なガイドラインに従ってください。
- データの分析
- 問題の時点でのT細胞のみの液滴集団で決定されたT細胞生存率に正規化されたGzmB陽性T細胞およびJeKo-1細胞の共カプセル化の割合に基づいて、GzmBを分泌するT細胞の割合を計算します。
液滴 T細胞+、Jeko-1+、GzmB+ /(液滴 T細胞+、Jeko-1+- 液滴 死T細胞+、Jeko-1+)
ここで、液滴 死T細胞+、Jeko-1+は、T細胞のみの液滴の死から推定されます:液滴死T細胞+、Jeko-1+ =液滴T細胞+、Jeko-1+ x 液滴 死T細胞+、Jeko-1-/液滴Tcell+、Jeko-1-。 - 標的細胞を死滅させたT細胞の割合を次のように計算します。
細胞傷害性T細胞の割合=(観察された死-背景死)/(100-背景死)
ここで、バックグラウンド死亡は、非殺傷関連死またはカプセル化前に発生した死亡のいずれかに起因する(T細胞+、Jeko-1+)液滴内に存在する死である。 - (T細胞+、Jeko-1-)液滴および(T細胞-、Jeko-1+)液滴の細胞死によるバックグラウンド死を推定します。
バックグラウンド死亡 = (1- (1- DropletsTcell-, Jeko-1+) x (1- DropletsT cell+, Jeko-1-)) x 100
ここで、死亡率は、それぞれT細胞のみの液滴とJeKo-1細胞のみの液滴の%PI陽性液滴として直接測定されます。すべての計算は、サンプリング時間固有の数値で実行されます。
- 問題の時点でのT細胞のみの液滴集団で決定されたT細胞生存率に正規化されたGzmB陽性T細胞およびJeKo-1細胞の共カプセル化の割合に基づいて、GzmBを分泌するT細胞の割合を計算します。
結果
形質導入後、T細胞のCAR発現を、抗CD3抗体および抗NGFR抗体を用いたフローサイトメトリーにより解析しました。その後、抗NGFR磁気ビーズを使用してCAR-T細胞集団を濃縮した結果、両方のドナーで98%を超える純度が得られました(図1A-B)。また、CCR7およびCD45RA抗体を用いた標準的なゲート戦略を用いて、使用した選別CAR細胞のCD4/CD8比と記憶表現型を定量化しました。これらのデータは、使用したCAR-T細胞のCD4/CD8比が0.73であり、細胞は主にナイーブ様記憶表現型であったことを示しています(図1C-E)。
CAR-T細胞とJeKo-1細胞をそれぞれ紫色色素と近赤色色素で染色し、アッセイ試薬GzmB基質とPIとともにDE50液滴にカプセル化しました(図2)。あるいは、抗CD4や抗CD8などの抗体を使用してCAR-T細胞を標識することもでき(図3)、T細胞のより詳細な特性評価が可能になります。各T細胞懸濁液(CAR-TまたはNTD)は、エフェクターでカプセル化する直前にJeKo-1細胞懸濁液と混合しました:標的細胞比1:3(0.5×106T 細胞および1.5×106 JeKo-1)。カプセル化後、各液滴産生(CAR-T細胞+JeKo-1およびNTD+JeKo-1)を、それぞれ2時間、4時間、6時間の3つのインキュベーションチューブに分割しました。細胞を液滴内で37°C、5%CO2 中でインキュベートし、次いで示された時点で顕微鏡法およびフローサイトメトリーにより分析した。
インキュベーションの4時間後にダブルエマルジョン液滴の蛍光顕微鏡法を行いました(図4)。緑色蛍光シグナル(FITC)の強度は、DE50液滴内のCAR-T細胞またはNTDの分泌GzmB活性のレベルを示しています。 図4B は、CAR T細胞とJeKo-1標的細胞が密接に接触している単一のGzmB陽性液滴の位相コントラストおよび蛍光顕微鏡画像を示しています。
次に、DE50液滴をフローサイトメトリーで分析し、初期のGzmB分泌と細胞傷害性細胞殺傷活性を持つCAR-T細胞の割合を定量しました(図5)。JeKo-1標的細胞を遠赤色色素で、エフェクターT細胞をバイオレット色素でインキュベーション前にインキュベーション染色すると、細胞がポアソン分布に基づいて液滴に分布しているため、3つの異なる細胞含有液滴集団の同定が容易になりました。同定された液滴集団は、T細胞のみ、JeKo-1細胞のみ、およびT細胞とJeKo-1細胞を一緒にした液滴です(図5A)。T細胞をJeKo-1細胞と共カプセル化した液滴をゲートし、GzmB活性(図5B)およびPI(図5C)で示される細胞死を示すシグナルについて分析しました。
液滴中の細胞のカプセル化はポアソン分布に従い、4つの異なる液滴集団が得られます(図6A)。 図6B は、自発的なGzmB分泌T細胞の割合を決定することができる液滴の6時間インキュベーション後のすべての液滴集団内のGzmB陽性液滴のレベルを示しています。これらのデータは、CAR T細胞のみがGzmBを分泌するため、この分析法の高い特異性を示しています。
最後に、2時間、4時間、6時間の共インキュベーション後の時点間でのGzmBおよびPIレベルを定量化しました。参考までに、T細胞のみを含む液滴とJeKo-1細胞のみを含む液滴を分析して、各集団におけるバックグラウンド細胞死を調べました(図6C)。バックグラウンド細胞死を使用して、ステップ3.3で説明したように、エフェクター細胞の集団(図7)における生GzmB分泌T細胞および標的細胞死T細胞の割合を決定しました。2人のドナーからのCAR-T細胞は、標的細胞誘導性GzmB分泌と細胞殺傷活性の両方で時間依存的な増加を示しました。ドナー1の生CAR-T細胞の約36%、ドナー2の生CAR-T細胞の約31%が、標的細胞との6時間共カプセル化後にGzmBを分泌しており、NTD制御T細胞と比較して有意に増加していました(図7A)。これに対応して、生きたドナー1の約21%、生きたドナー2のCAR T細胞の約22%が標的細胞を死滅させており、これは正のPIシグナルで示されています(図7B)。GzmBを分泌したCAR-T細胞の割合は、各時点で死滅した標的細胞の割合を上回っており、GzmBを介した細胞毒性の予想される一連のイベントと一致していました。まとめると、これらのデータは、ここで提示された方法により、細胞集団内の個々のT細胞毒性の不均一性の特性評価と、異なる集団間の比較が可能になることを示しています。

図1:NGFRソーティング後の代表的なフローサイトメトリープロット。 (A)約10日間の増殖後、CAR-T細胞をNGFR特異的マイクロビーズおよび磁気選別を用いて選別したところ、CAR-T細胞の集団は>98%のCAR-T細胞であった。(B)ソーティング前後の本研究で使用した2人のドナー由来のCAR-T細胞の定量化。(C)T細胞のCD4/CD8比と記憶表現型を調べるために使用されるゲーティング戦略。(D)使用したT細胞のCD4およびCD8の定量。(E)使用したT細胞の記憶表現型の定量化。略語:CM =セントラルメモリ、EM =エフェクターメモリ、NTD =非形質導入、TEMRA =終末分化型エフェクター細胞。 この図の拡大版を表示するには、ここをクリックしてください。
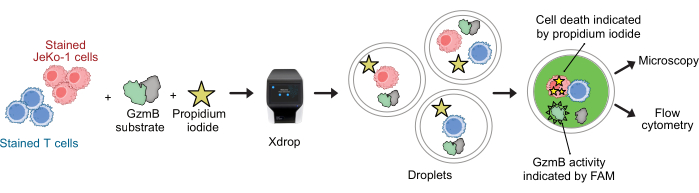
図2:GzmB分泌と細胞毒性を組み合わせたアッセイと液滴中の単一細胞分解能のワークフロー。 DE液滴にカプセル化する前に、ターゲット細胞とエフェクター細胞を紫色細胞染色液と遠赤血球染色液を使用して別々に染色します。マイクロ流体デバイスおよびカプセル化カートリッジを用いて、エフェクター細胞を標的細胞と液滴中に共カプセル化し、細胞培地、PI、およびFAM標識GzmBペプチド基質と共に調製します。アッセイとインキュベーションは液滴内で行われます。分泌されたGzmB活性は、GzmBが基質を切断した後に発生する緑色蛍光の放出によって示されます。細胞死はPIによって示されます。インキュベーション後、DE50液滴を顕微鏡および/またはフローサイトメトリーで分析します。 この図の拡大版を表示するには、ここをクリックしてください。

図3:抗CD3抗体、抗CD4抗体、抗CD8抗体で標識済みの液滴カプセル化PBMCの分析。 (A)抗CD3(APC)および抗CD4(NIR)抗体で事前に標識されたカプセル化されたPBMCを含む液滴の顕微鏡画像。スケールバー = 100 μm. (B) As (A) ですが、代わりに CD3 (FITC) および抗 CD8 (NIR) 標識が付いています。スケールバー = 100 μm. (C) 同じ液滴のフローサイトメトリー解析。 この図の拡大版を表示するには、ここをクリックしてください。
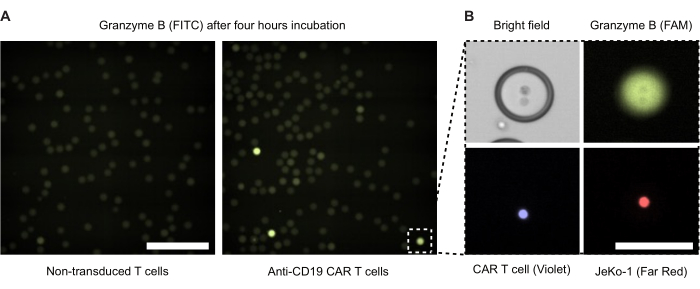
図4:エフェクター細胞と標的細胞を含む液滴の顕微鏡画像。画像は、標準的な37°C、5%CO2 加湿細胞インキュベーターで4時間インキュベートした後に撮影しました。 (A)NTD細胞とJeKo-1細胞をカプセル化した試料(左)またはCAR-T細胞とJeKo-1細胞(右)をFITCチャネルを用いた蛍光顕微鏡でイメージングし、GzmB陽性(緑色)の液滴を検出した試料からの液滴。スケールバー=500μm.(B)位相コントラスト、FITC(GzmB)、APC(JeKo-1細胞)、DAPI(CAR-T細胞)によって画像化された単一の液滴。Scalebar = 100 μm. この図の拡大版を表示するには、ここをクリックしてください。
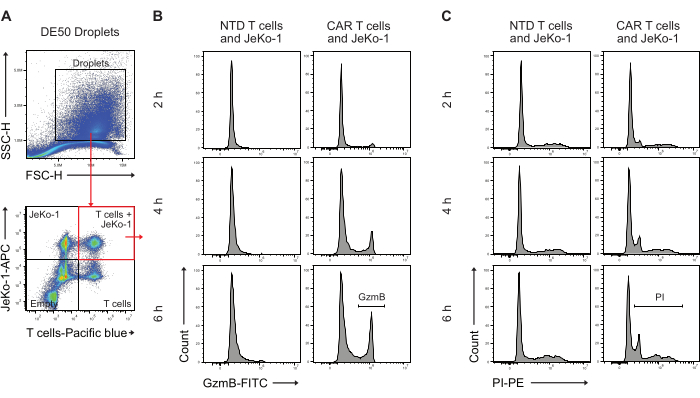
図5:インキュベーション後のフローサイトメトリーによる液滴解析のためのゲーティング戦略 (A)ゲーティングは、液滴を同定するために前方散乱法と側方散乱法によって行われ、続いて液滴を含むゲートを選択しました。ゲートの外側のイベントは、ダブルエマルジョン液滴生成の副産物として生成される油滴を表しています。その後、適用された細胞染色に対応するチャネル内の液滴の蛍光分析により、4つの液滴集団が同定されます:T細胞とJeKo-1細胞の両方を含む液滴(赤い四角);JeKo-1細胞のみの液滴。T細胞のみの液滴。そして空の液滴。(B)NTD細胞とCAR-T細胞間のダブルポジティブ液滴中のGzmBシグナルの代表的なヒストグラム。(C)NTD細胞とCAR-T細胞間のダブルポジティブ液滴中のPIシグナルの代表的なヒストグラム。すべての液滴測定は、強度高さ(H)測定として実行されます。 この図の拡大版を表示するには、ここをクリックしてください。
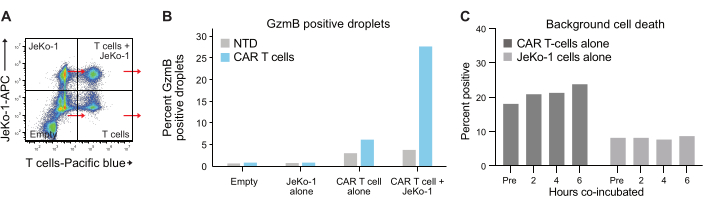
図6:内部統制母集団と参照母集団 (A) 図5A の4つの象限をそれぞれ選択し、それぞれでGzmBとPIを測定した。このタイプの定量化により、T細胞の有効性の最終分析を行う前に、バックグラウンドシグナルを測定して差し引くことができます。(B)4つの液滴集団のそれぞれについて、6時間のインキュベーション後のGzmB陽性液滴の頻度を示すグラフを、ドナー1 CAR Tサンプルからのデータで例示した。(C)バックグラウンド細胞死は、測定された各時点でのJeKo-1のみおよびT細胞のみの制御液滴集団で、ドナー1からのデータを用いて決定されました。バックグラウンド細胞死は、 図7に示され、ステップ3.3で説明した生きたGzmB分泌エフェクター細胞および細胞死エフェクター細胞の頻度を計算するために使用されます。略語: Pre = カプセル化。この図の拡大版を表示するには、ここをクリックしてください。
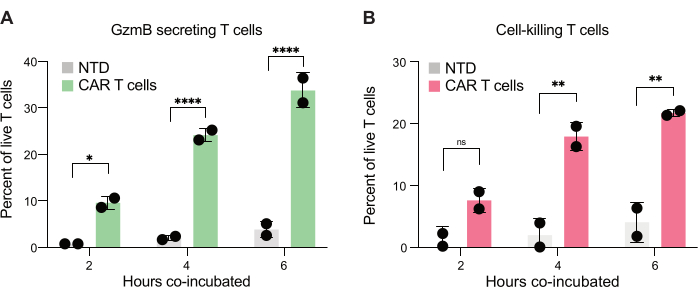
図7:GzmBを分泌し、ダブルポジティブ液滴中のJeKo-1細胞を殺傷するT細胞の定量化。 2人のドナーからゲートされたダブルポジティブ液滴を、液滴中での2時間、4時間、および6時間の共インキュベーション後に調べました。(A)標的細胞に遭遇するT細胞がGzmBを分泌する頻度とNTD T細胞とCAR-T細胞との比較。(B)標的細胞がT細胞に遭遇し、共カプセル化された標的細胞を殺滅する頻度。略語:GzmB =グランザイムB、NTD =非形質導入、PI =ヨウ化プロピジウム。* = P値 < 0.05、** = P値 < 0.005、**** = P値 < 0.0001 (二元配置分散分析)。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここでは、CD19陽性マントル細胞リンパ腫細胞株JeKo-1と共カプセル化した際のCD19-CD28-CD3z CAR T細胞の細胞傷害性を評価するために、市販のマイクロ流体デバイスを使用してT細胞の細胞傷害性をシングルセルレベルで調べる方法を紹介します。
このプロトコルには、いくつかの重要なステップがあります。まず、偽陽性の結果を避けるために、アッセイを行う少なくとも48時間前にT細胞から刺激ビーズを除去することをお勧めします。次に、CARやT細胞受容体などのコンストラクトによるT細胞形質導入の効率は、かなり異なる可能性があります。形質導入したT細胞のその後の精製ステップがなければ、結果の解釈が困難になる可能性があります。ここでは、CAR-T細胞の純粋な集団を使用したため、各時点でCAR-T細胞をキラーまたはノンキラーとして特徴付ける際に、高い確実性が期待できます。あるいは、CARに蛍光タンパク質または遺伝タグをタグ付けして、CAR陽性の細胞を示し、液滴を分析する際にゲーティングすることもできます。タグを使用する場合、選択した蛍光分子は、他のアッセイ蛍光色素からの蛍光発光を妨げてはなりません。例えば、GFPタグを使用すると、ここで実施した実験で適用されたFAM標識GzmB基質に干渉するため、推奨されません。
ここで概説するプロトコルの主な利点は、ドロップレット生成自体が簡素化され、自動化されていることです。ただし、シングルセルのカプセル化を確実にするためには、カートリッジをロードする前に細胞を完全に再懸濁することが重要です。このため、カートリッジをロードする準備をするときは、適切なペースで作業することをお勧めします。GzmB基質を添加する際にも、一部の細胞はGzmBの高分泌物であるため、同様の考慮事項が適用されます。細胞の再懸濁は、小さなカートリッジマイクロ流体チャネルの目詰まりも防ぎます。細胞の適切なカプセル化は、上記のように顕微鏡で簡単に確認できます。
液滴は細胞培地をカプセル化し、細胞から分泌された細胞産物を保持するため、他のサイトカイン、抗体、および化合物を解析することができます。実際、IFN-γやTNF-αなど、現在のプロトコルの変更が必要な他の関連する免疫細胞分泌分子を試験しました。サイトカイン検出のためには、エフェクター細胞表面32上でのELISAサンドイッチの生成など、ここでGzmBについて利用するものとは異なるタイプのアッセイフォーマットを適用することができる。さらに、カルボキシフルオレセインスクシンイミジルエステル(CFSE)など、細胞染色やアッセイの色を変更することができますが、標準的なフローサイトメトリーで行われるように、異なる色の組み合わせでブリードスルーを最小限に抑えるか、またはブリードスルーを行わないことが重要です。
さらに、このプロトコルは、CAR-T細胞の分析に限定されません。また、他のT細胞/標的相互作用やCAR NK細胞などの他の免疫細胞を研究するために拡張することもできます。また、CD4およびCD8 T細胞サブセットを追加の蛍光色素で標識し、より広範な機能的免疫表現型解析を行うなど、より高度な実験も想定できます。実際、ここでは、CD4とCD8が液滴中に検出できることを示しており、したがって、エフェクターT細胞とその細胞毒性能力のさらなる特性評価が可能になります。
このプロトコルを最適化するために、私たちは特に標準的なフローサイトメトリー機器で機能させることを目指しました。液滴フローサイトメトリーは複雑ではありませんが、フローサイトメーターが一定の間隔で適切にすすぎられなかった場合、または各時間間隔でサンプルを分析した後にここで推奨されているように、油が蓄積する可能性があることに気付きました。最適なリンスプロトコルは、個々のフローサイトメーターに固有のものかもしれません。
この方法の大きな利点の1つは、そのハイスループット能力であり、広範な専門知識や高度に専門化された機器を必要とせずに、標的細胞に対する単一細胞エフェクター媒介性の細胞毒性をモニタリングできます。このアッセイは、フローサイトメトリーや顕微鏡などの既存のツールを使用して簡単に行うことができます。ダブルエマルジョン液滴は、セルソーター30,31を用いた選別にも適しており、これにより、特定の機能を有する細胞、例えば、細胞傷害性能を有するCAR-T細胞および細胞毒性能を持たないCAR-T細胞の単離を可能にし、続いてシングルセルトランスクリプトーム分析を行うことができる。
この技術には制限がないわけではありません。一部の細胞株は24時間以上液滴中での培養に耐えられますが、初代細胞は24時間後に生存率が著しく低下する可能性があります。これは、一般的にアッセイの時間的制約を表していますが、現在のアッセイでは、顕著なGzmBおよび細胞死活性が4〜6時間以内に観察されます。これは、小さな液滴コンパートメントがエフェクターと標的細胞の迅速な出会いを保証するためと思われます。同様に、液滴の量が少ないため、分泌されたGzmB切断基質の検出可能なレベルまで濃度が急速に上昇します。この技術のもう一つの制限は、標準的なフローサイトメーターを使用すると、エフェクター細胞による連続死を検出できないことです。しかし、これはイメージフローサイトメーターやイメージサイトメトリー技術で達成できる可能性があり、調査が必要になります。
CD19 CAR T細胞の養子移植は、血液悪性腫瘍患者の治療において顕著な成功を収めています。それにもかかわらず、患者32には大きな反応のばらつきと予測不可能な毒性があり、これは部分的にはCAR-T注入製品内の不均一性によるものかもしれない。その結果、集団内の個々のCAR-T細胞の表現型組成と細胞傷害性能力の解析への関心が高まっています。CAR療法は、自己免疫疾患や他の形態のがんでますますテストされているため、これは特に重要になります。ここで説明するマイクロ流体工学デバイスとプロトコルは、CAR-T細胞やその他の細胞ベースの治療法の不均一性を調べるための堅牢で汎用性の高いアプローチを提供します。
開示事項
著者らは、以下の競合する利益を宣言します:M.B.B.は、ヤンセン、ロシュ、カイト/ギリアドから、本研究とは無関係のコンサルティング謝礼を受け取っています。D.L.P.とP.M.はSamplixの従業員です。
謝辞
著者は、有益な議論と提案をしてくれたCITCOとSamplixのメンバーと従業員に感謝したいと思います。MBBは、ルンドベック財団のEarly-Career Clinician Scientistsフェローシップ(R381-2021-1278)によってサポートされています。この研究は、オーデンセ大学病院からのエリート研究助成金によってサポートされています。さらに、この研究は、欧州イノベーション会議プロジェクト190144395からSamplix ApSへの助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Blocker BSA (BSA) | Thermo Scientific | 37525 | |
| CellTrace Far Red Cell Proliferation Kit (far red fluorescent dye) | Invitrogen | C34564 | |
| CellTrace Violet Cell Proliferation Kit (violet fluorescent dye) | Invitrogen | C34557 | |
| DE Stabilizing Solution (stabilizing solution) | Samplix | REDIVSTABSOL1500 | |
| DPBS (dPBS) | Gibco | 14190-094 | |
| Dulbecco’s PBS (dPBS) | Capricorn Scientific | PBS-1A | |
| Dynabeads Human T-Activator (CD3/CD28 activation beads) | Gibco | 11132D | |
| Fetal Bovine Serum (FBS) | Capricorn Scientific | FBS-HI-12A | |
| Lenti-X Concentrator (PEG-based reagent) | Takara Bio | 631232 | |
| MACSelect LNGFR Microbeads (anti-NGFR magnetic beads) | Miltenyi Biotec | 130-091-330 | |
| OptiPrep density gradient medium (gradient medium) | Stemcell | 7820 | |
| Penicillin-Streptomycin (P/S) | Capricorn Scientific | PS-B | |
| Propidium iodide (PI) | Invitrogen | BMS500PI | |
| Recombinant Human IL-2 (IL-2) | Peprotech | 200-02 | |
| RPMI-1640 with Stable Glutamine (RPMI-1640) | Capricorn Scientific | RPMI-STA | |
| RPMI-1640 without L-Glutamine and phenol red | Gibco | 32404-014 | |
| Xdrop DE oil I (oil) | Samplix | REOILDEC1900 | |
| Xdrop Granzyme B substrate (GzmB substrate) | Samplix | REGRB100 | |
| Zombie-NIR viability dye (viability dye) | BioLegend | 423106 | |
| Plasticware etc. | |||
| 8-chamber glass slide | Chemometec | 942-0003 | |
| Cell culture plate, 12 well | TH Geyer | 7696791 | |
| DNA LoBind tube, 2 mL (DNA tube) | Eppendorf | 30108078 | |
| Eppendorf tube, 1.5 mL (1.5 mL tube) | Eppendorf | 30108051 | |
| Falcon tube, 15 mL (15 mL tube) | TPP | 91015 | |
| Falcon tube, 5 mL (5 mL tube) | Falcon (VWR) | 734-0443 | |
| Green cell suspension flasks for cell incubations (T75 flask) | Sarstedt | 148.19.22 | |
| Green cell suspension plates for cell incubations (96 well plate) | Sarstedt | 148.32.20 | |
| LS Separation Columns (separation column) | Miltenyi Biotec | 130-042-401 | |
| Xdrop DE Gaskets (gaskets) | Samplix | #GADEA100 | |
| Xdrop DE50 Cartridge (encapsulation cartridge) | Samplix | #CADE50A100 | |
| Antibodies | |||
| anti-CCR7 PE-Dazzle 594 | BioLegend | 353236 | |
| anti-CD19 CAR FMC63 Idiotype Antibody, PE | Miltenyi Biotec | 130-127-342 | |
| anti-CD3 APC | Biolegend | 300439 | |
| anti-CD3 BV480 | BD Biosciences | 566105 | |
| anti-CD3 FITC | BD Biosciences | 345763 | |
| anti-CD4 BUV661 | BD Biosciences | 612962 | |
| anti-CD4 StarBright Violet 760 | Bio-Rad | MCA1267SBV760T | |
| anti-CD45RA BUV395 | BD Biosciences | 740298 | |
| anti-CD8 PE-Cy7 | BioLegend | 344712 | |
| anti-CD8 StarBright Violet | Bio-Rad | MCA1226SBV760 | |
| anti-NGFR FITC | BioLegend | 345106 | |
| anti-NGFR PE | BioLegend | 345106 | |
| Cells | |||
| JeKo-1 Mantle-cell lymphoma cell-line (JeKo-1) | ATCC | CRL-3006 | |
| Primary peripheral blood mononuclear cells (PBMCs) | |||
| Equipment | |||
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | A50298 | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| NovoCyte Quanteon Flow Cytometer (flow cytometer) | Agilent | 2010011AA | |
| Xdrop (microfluidics device) | Samplix | IN00110-EU |
参考文献
- Pasqui, D. M., Latorraca, C. D. O. C., Pacheco, R. L., Riera, R. CAR-T cell therapy for patients with hematological malignancies. A systematic review. Eur J Haematol. 109 (6), 601-618 (2022).
- Krejcik, J., et al. Harnessing the immune system to fight multiple myeloma. Cancers. 13 (18), 4546 (2021).
- Tokarew, N., Ogonek, J., Endres, S., von Bergwelt-Baildon, M., Kobold, S. Teaching an old dog new tricks: next-generation CAR T cells. British J Cancer. 120 (1), 26-37 (2019).
- Bogetofte Barnkob, M., Vitting-Seerup, K., Rønn Olsen, L. Target isoforms are an overlooked challenge and opportunity in chimeric antigen receptor cell therapy. Immunother Adv. 2 (1), ltac009 (2022).
- Daei Sorkhabi, A., et al. The current landscape of CAR T-cell therapy for solid tumors: Mechanisms, research progress, challenges, and counterstrategies. Front Immunol. 14, 1113882 (2023).
- . Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/considerations-development-chimeric-antigen-receptor-car-t-cell-products (2024)
- Roddie, C., O'Reilly, M., Dias Alves Pinto, J., Vispute, K., Lowdell, M. Manufacturing chimeric antigen receptor T cells: issues and challenges. Cytotherapy. 21 (3), 327-340 (2019).
- Wang, L., et al. Improvement of in vitro potency assays by a resting step for clinical-grade chimeric antigen receptor engineered T cells. Cytotherapy. 21 (5), 566-578 (2019).
- Burrows, S. R., Fernan, A., Argaet, V., Suhrbier, A. Bystander apoptosis induced by CD8+ cytotoxic T cell (CTL) clones: implications for CTL lytic mechanisms. Int Immunol. 5 (9), 1049-1058 (1993).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. J Clin Invest. 115 (6), 1616-1626 (2005).
- Chen, G. M., et al. Integrative bulk and single-cell profiling of premanufacture T-cell populations reveals factors mediating long-term persistence of CAR T-cell therapy. Cancer Dis. 11 (9), 2186-2199 (2021).
- Frazer, G. L., Gawden-Bone, C. M., Dieckmann, N. M. G., Asano, Y., Griffiths, G. M. Signal strength controls the rate of polarization within CTLs during killing. J Cell Biol. 220 (10), e202104093 (2021).
- Hermans, I. F., et al. The VITAL assay: a versatile fluorometric technique for assessing CTL- and NKT-mediated cytotoxicity against multiple targets in vitro and in vivo. J Immunol Meth. 285 (1), 25-40 (2004).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev Vaccines. 9 (6), 601-616 (2010).
- Piccinini, C., et al. In vitro CAR-T cell killing: validation of the potency assay. Cancer Immunol Immunother CII. 73 (9), 168 (2024).
- Martinez, E. M., et al. High-throughput flow cytometric method for the simultaneous measurement of CAR-T cell characterization and cytotoxicity against solid tumor cell lines. SLAS Disc Adv Life Sci. 23 (7), 603-612 (2018).
- Jedema, I., van der Werff, N. M., Barge, R. M. Y., Willemze, R., Falkenburg, J. H. F. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Liu, L., et al. Cellular and molecular imaging of CAR-T cell-based immunotherapy. Adv Drug Delivery Rev. 203, 115135 (2023).
- Liadi, I., et al. Defining potency of CAR+ T cells: Fast and furious or slow and steady. Oncoimmunology. 8 (10), e1051298 (2019).
- Xhangolli, I., et al. Single-cell analysis of CAR-T cell activation reveals a mixed TH1/TH2 response independent of differentiation. Genom Proteom Bioinfo. 17 (2), 129-139 (2019).
- Zhou, Y., et al. Evaluation of single-cell cytokine secretion and cell-cell interactions with a hierarchical loading microwell chip. Cell Rep. 31 (4), 107574 (2020).
- LaBelle, C. A., Zhang, R. J., Hunsucker, S. A., Armistead, P. M., Allbritton, N. L. Microraft arrays for serial-killer CD19 chimeric antigen receptor T cells and single cell isolation. Cytometry J Int Soc Anal Cytol. 103 (3), 208-220 (2023).
- Hellmann, M. J., et al. Heterogeneously deacetylated chitosans possess an unexpected regular pattern favoring acetylation at every third position. Nat Comm. 15 (1), 6695 (2024).
- Wong, K. U., et al. Assessment of chimeric antigen receptor T cytotoxicity by droplet microfluidics in vitro. Antibody Therapeut. 5 (2), 85-99 (2022).
- Antona, S., Platzman, I., Spatz, J. P. Droplet-based cytotoxicity assay: Implementation of time-efficient screening of antitumor activity of natural killer cells. ACS omega. 5 (38), 24674-24683 (2020).
- Subedi, N., et al. An automated real-time microfluidic platform to probe single NK cell heterogeneity and cytotoxicity on-chip. Sci Rep. 11 (1), 17084 (2021).
- Zhang, Y., et al. Enhanced CRISPR/Cas12a-based quantitative detection of nucleic acids using double emulsion droplets. Biosens Bioelect. 257, 116339 (2024).
- Kochenderfer, J. N., et al. Construction and preclinical evaluation of an anti-CD19 chimeric antigen receptor. J Immunother. 32 (7), 689-702 (2009).
- Michaels, Y. S., et al. Precise tuning of gene expression levels in mammalian cells. Nat Comm. 10 (1), 818 (2019).
- Yuan, Y., et al. Droplet encapsulation improves accuracy of immune cell cytokine capture assays. Lab on a Chip. 20 (8), 1513-1520 (2020).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab on a Chip. 20 (12), 2062-2074 (2020).
- Kirouac, D. C., et al. Deconvolution of clinical variance in CAR-T cell pharmacology and response. Nat Biotechnol. 41 (11), 1606-1617 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved