Method Article
基于液滴的细胞毒性测定,用于在单细胞水平评估嵌合抗原受体 T 细胞
摘要
在这里,我们描述了一种创建封装一个 T 细胞和一个癌症靶细胞的液滴的方法,以检查单细胞水平的细胞杀伤。该方法允许对大量 T 细胞群中的细胞毒性分子和靶细胞凋亡进行双重定量。
摘要
评估基于 T 细胞的疗法(例如嵌合抗原受体 (CAR) T 细胞治疗)的细胞毒潜力有助于评估其疗效,并且是临床应用的先决条件。然而,传统的细胞毒性测定是作为批量测定进行的,不能提供有关 CAR T 细胞群功能异质性的详细信息。在这项研究中,我们描述了一种基于液液滴的方法,该方法允许单效应 CAR T 细胞与单靶细胞的大规模共包络,同时能够对来自 T 细胞的细胞毒性效应分子和靶细胞的细胞死亡进行双重定量。该方案概述了一种生成和纯化 CD19 特异性 CAR T 细胞的方法,然后将其与 CD19 + 细胞系 JeKo-1 共包封在液滴中,以及用于可视化细胞毒性效应分子分泌(颗粒酶 B)和细胞死亡(使用碘化丙啶,PI)的试剂。我们演示了如何使用市售的微流体设备生成含有单个 CAR T 和靶细胞的液滴,以产生液液滴。此外,我们还提供了如何使用标准流式细胞术设备检测液滴中 CAR T 细胞功能多样性的示例。最后,我们简要描述了 CD19 特异性 CAR T 细胞杀伤的时间动力学和异质性。虽然这种方法侧重于 CAR T 细胞攻击后的细胞死亡,但它也适用于检查其他类型的 T 细胞、细胞毒性免疫细胞和效应细胞功能,例如细胞因子分泌。
引言
嵌合抗原受体 (CAR) T 细胞疗法是细胞癌免疫疗法的一个快速扩展领域,已被证明可有效治疗各种形式的白血病、1 型淋巴瘤和多发性骨髓瘤2。CAR T 细胞是通过用合成抗原受体修饰 T 细胞产生的,合成抗原受体可以选择性地结合在 B 细胞、浆细胞及其恶性对应物上表达的表面蛋白,如 CD19 或 B 细胞成熟抗原 (BCMA)。CAR 设计的最新进展使能够同时靶向多种抗原3,依赖于多个输入信号,或仅与肿瘤相关抗原结合,例如特异性蛋白亚型4。此外,目前正在针对非血液系统癌症的靶标测试几种 CAR5。
细胞毒性测定对于临床产品发布前的 CAR 开发和质量控制都是必不可少的 6,7,8。然而,目前的大多数检测都依赖于过量添加到癌细胞系中的大量效应 CAR T 细胞群,这可能会因旁观者效应9 而导致假阳性结果,并导致体外和体内结果之间的相关性差10。由于 T 细胞增殖和长期持久性取决于初始激活事件期间接收到的信号11,12,因此在单细胞水平上仔细检查细胞毒性事件非常有趣。
为了解决批量方法的局限性,可以使用流式细胞术13、14、15、16、17 和基于成像的测定18 进行单细胞水平的细胞毒性研究。然而,尽管标准流式细胞术提供了用于定量和表征效应细胞和靶细胞的单细胞分辨率,但它不能直接确定单个 CAR T 细胞对靶细胞的特异性细胞毒能力。此外,由于细胞的运动一致,对单个 CAR T 细胞与其各自靶标的批量相互作用进行成像具有挑战性且耗时。为了应对这些挑战,已经开发了用于单细胞分析的新型工具,这些工具依赖于使用微孔阵列 19,20,21、微raft 阵列22、微芯片 23 和液滴微流体 24,25,26 在空间受限空间中配对效应细胞和靶细胞.这些工具提供了增强的测量灵敏度,能够使用更少的试剂体积研究更少的细胞。然而,仍然存在一些挑战,包括高效的细胞配对、可分析的样品数量有限、仅依赖基于成像的分析以及难以检索活细胞群以进行进一步分析。
在这里,我们利用了一种市售的微流体设备,该设备允许对基于液滴的微流体进行大规模简化的方法。该设备能够使用高度稳定的液 (DE) 液滴进行高级单细胞分析和测定。与微孔和传统的液滴微流体检测相比,此处概述的方案不需要广泛的微流专业知识。
DE 液滴是由油壳组成的小球形隔室,其水芯悬浮在水溶液中。水性液滴包含并保留细胞、细胞分泌组、细胞培养基和检测试剂,允许在每个隔室内进行复杂的检测。使用微流体设备,产生具有固定体积(约 100 pL)的 DE 液滴,适用于哺乳动物单细胞或细胞间相互作用测定,这些液滴可以由没有微流体专业知识的一般实验室用户在短时间内(每个样品约 750,000 个液滴)产生(8 个样品约 10 分钟)。生成的液滴可以悬浮在细胞培养基中,从而允许 O2 和 CO2 的跨壳扩散和内部缓冲,同时保留亲水性和较大的分子,例如细胞分泌的效应分子。因此,检查的细胞得到了充分的缓冲,可以随着时间的推移检查细胞间相互作用和时间动态。与单个乳液液滴(例如油包水液滴)27 相比,DE 液滴具有坚固的结构,不会在标准细胞培养箱中融合或合并。由于它们的稳定性和水性外相,它们还与下游分析程序(如传统流式细胞术)兼容。因此,微流体装置产生的这些皮升液滴可用于细胞功能的高通量单细胞分析,以阐明传统批量分析中隐藏的功能异质性。
在这里,我们概述了一个利用 DE 液滴来检查 CD19 特异性 CAR 对淋巴瘤细胞的细胞毒潜力的方案。我们的方案允许对靶杀伤和颗粒酶 B (GzmB) 分泌进行单细胞分析,并揭示此处检查的大约 20% 的 CAR T 细胞具有即时杀伤潜力。
研究方案
本研究中使用的 CAR T 细胞是在经过认证的生物安全 GMO 2 类实验室中通过 CD19scFv-CD28-CD3ζ-tNGFR CAR 构建体慢病毒转导原代 T 细胞产生的,并在 4 天后根据研究所标准解密。纯化的 T 细胞来自匿名献血的废弃剩余材料,根据丹麦法律,无需进一步的伦理批准。
1. CAR T 细胞的产生
注:下面使用的试剂名称使用通用名称和缩写名称。完整的商业名称可以在 材料表中的括号中找到。
- T 细胞活化、转导和扩增
注:通过使用阴性选择 T 细胞分离试剂盒对从新鲜外周血单核细胞 (PBMC) 中分离的原代人 T 细胞进行慢病毒转导,实现了 CD19 CAR T 细胞的稳定表达。使用的抗 CD19 CAR 是第二代构建体,由 FMC63 单链可变片段 (scFv)、CD28 铰链和跨膜结构域、CD28 共刺激结构域、CD3ζ 激活结构域28 和神经生长因子受体 (tNGFR) 的截短版本组成,用于监测和富集表达 CAR 的细胞29.从头合成转移载体质粒,并将其与 pMDLg/pRRE(Addgene 质粒 #12251)、pRSV-Rev(Addgene 质粒 #12253)和 pMD2.G(Addgene 质粒 #12259)30 结合制备第三代慢病毒。后三个质粒是 Didier Trono 的礼物。使用基于 PEG 的试剂浓缩粗病毒,通过转导 SUP-T1 细胞并按照标准方案31 通过流式细胞术测量 tNGFR 来确定感染复数 (MOI)。- 将 2 x 106 个原代人 T 细胞转移到 12 孔培养皿中,并在 1 mL 补充有 100 单位/mL 重组人白细胞介素-2 (IL-2) 的完全 RPMI-1640 培养基(10% 热灭活胎牛血清,1% 青霉素/链霉素)中以 1:1 的珠子与细胞比率用 CD3/CD28 包被的珠子刺激它们。将细胞在 37°C 下在加湿的 5% CO2 培养箱中孵育 24 小时。
- 以 5-10 的 MOI 向活化的 T 细胞中加入慢病毒颗粒。轻轻混合并孵育细胞 72 小时。包括未转导 (NTD) T 细胞作为阴性对照。
- 在转导后第 3 天,将 T 细胞收获到 1.5 mL 试管中,并将试管放在磁力架上 1-2 分钟,以去除 CD3/CD28 活化珠。将含有细胞的上清液转移到新的 1.5 mL 试管中。
- 使用自动细胞计数仪进行细胞计数,并在补充有 100 U/mL IL-2 的 RPMI-1640 完全培养基中将细胞密度调节至 1 x 106 个细胞/mL。继续扩增 T 细胞,直到悬浮液中的 CAR T 细胞总数达到至少 1.5 x 106 (通常总共约为 6 x 106 个 T 细胞),然后再进行 NGFR 富集(见下文)。
- 每隔一天监测一次细胞计数,并通过添加补充有 100 单位/mL IL-2 的新鲜培养基将浓度调整为 1 x 106 个细胞/mL,以确保扩增过程中的最佳细胞状态。
- 表达 CAR 的 T 细胞的富集
- 将 6 x 106 个或更多转导的 T 细胞转移到 15 mL 试管中,并以 300 x g 离心 5 分钟。将细胞沉淀重悬于 320 μL 补充有 0.5% 牛血清白蛋白 (BSA) 的 PBS 中,以制备 PBSA,并添加 40 μL 抗 NGFR 磁珠。充分混合并在冰上孵育 15 分钟。
注:该方案假设转导效率约为 25%,富集后产生 >1.5 x 106 个 CAR T 细胞。我们不建议从少于 6 x 10个 6 个细胞开始,因为这可能会导致 CAR T 细胞恢复不良。 - 加入 1640 μL PBSA,使最终体积达到 2 mL,然后根据制造商的说明使用分离柱进行磁性分离。
- 将 6 x 106 个或更多转导的 T 细胞转移到 15 mL 试管中,并以 300 x g 离心 5 分钟。将细胞沉淀重悬于 320 μL 补充有 0.5% 牛血清白蛋白 (BSA) 的 PBS 中,以制备 PBSA,并添加 40 μL 抗 NGFR 磁珠。充分混合并在冰上孵育 15 分钟。
- 通过流式细胞术检测 CAR 表达
注:我们建议此时确定表达 CAR 的细胞的百分比及其活力,以确保在进行以下检测之前获得适当的细胞。此时也可以确定 CD4 和 CD8 比率以及记忆表型。代表性图见 图 1 。- 将 2.5 x 105 T 细胞从转导和未转导的培养物中转移到单独的流式细胞仪管中。用 200 μL PBS 洗涤细胞 2 次,每次洗涤后以 300 x g 离心 5 分钟。
- 制备含有抗 CD19 CAR FMC63 独特型 PE、抗 CD3 BV480 和抗 NGFR FITC 抗体的抗体混合物,每种抗体均在 PBS 中以 1:100 稀释。将细胞重悬于 50 μL 抗体混合物中,并在 4 °C 下孵育 20 分钟。
- 用 200 μL PBS 洗涤细胞 2 次,每次洗涤后以 300 x g 离心 5 分钟。将细胞重悬于 200 μL PBS 中,并使用流式细胞术进行分析。
2. 产生封装 T 细胞和靶细胞的液滴
注:在封装之前,T 细胞和 JeKo-1 细胞用不同的细胞染色剂染色,以监测液滴细胞含量。用测定试剂封装细胞并孵育 2-6 小时,然后在流式细胞仪上分析液滴(参见 图 2)。
- 包封前对细胞进行染色
- 通过在 dPBS 中以 1:5,000 的比例稀释储备溶液(根据制造商的说明制备),制备两种荧光染料(我们使用一种紫色染料和一种远红染料)的工作溶液。
- 对于每个供体,将 2.5 x 106 CAR T、2.5 x 106 NTD T 和 15 x 106 JeKo-1 细胞转移到单独的离心管(15 mL 或 50 mL 管)中,并以 300 x g 离心 5 分钟。在本实验中,每个制备的样品用 1.5 x 106 个靶细胞封装 0.5 x 106 个效应细胞。
注:此处转移的细胞数量适用于每个供体的每种效应细胞类型的 4x 包埋样品。根据所需的样品数量缩小细胞和试剂的数量。此外,每个样品的确切细胞数量可以根据实验需要进行缩放。 - 去除上清液,将效应细胞沉淀重悬于紫色荧光染料的 1:5,000 工作溶液中,将靶细胞 (JeKo-1) 沉淀重悬于远红荧光染料的 1:5,000 工作溶液中。用移液管将细胞充分重悬,并使其细胞浓度为 1 x 106 个细胞/mL 染色液。
- 将细胞在 37 °C 加湿的 CO2 培养箱中孵育 20 分钟。将细胞以 300 x g 离心 5 分钟,去除上清液,然后重悬于 15 mL 完全 RPMI-1640 培养基中以洗涤细胞。
- 重复洗涤并以 300 x g 离心 5 分钟。去除上清液,将效应细胞沉淀重悬于 225 μL 完全 RPMI-1640 中,将靶细胞沉淀重悬于 450 μL 完全 RPMI-1640 中。
- 向效应细胞悬液中加入 30 μL 梯度培养基,向靶细胞悬液中加入 60 μL 相同的梯度培养基。移液前重悬梯度培养基储备液。
- 向效应细胞悬液中加入 15 μL 的 20 μg/mL PI 原液,向目标细胞悬液中加入 30 μL 的 PI 原液。在下面添加颗粒酶 B (GzmB) 底物后,最终 PI 浓度最终为 1 μg/mL。
- 在完全 RPMI-1640 中制备 1:10 稀释的 GzmB 底物,并将 30 μL 的 GzmB 底物稀释液添加到效应细胞悬液中,将 60 μL 的 GzmB 底物稀释液添加到目标细胞悬液中。与移液管充分混合。
注:添加到每个效应细胞沉淀中的试剂总体积现在应为 300 μL,添加到目标细胞沉淀中的试剂总体积应为 600 μL。这些溶液中的梯度培养基浓度应为 10%,PI 浓度为 1 μg/mL,GzmB 底物浓度为 1:100。 - 使用 CD3、CD4 和 CD8 抗体进行替代标记
注意:在某些情况下,在与目标细胞共封装之前进一步标记效应细胞可能很有趣。在这里,我们展示了使用 CD3、CD4 和 CD8 抗体以及 PBMC 进行此类标记的原理验证(参见 图 3)。- 将 2.0 x 106 PBMC 转移到 1.5 mL 试管中,并以 300 x g 的离心速度将细胞离心 5 分钟。去除上清液,将细胞沉淀重悬于 200 μL 含 0.5% BSA 的 dPBS 中。将内容物分成两个 2 mL 试管。
- 向其中一个试管中加入 5 μL 抗 CD3-APC 和 5 μL 抗 CD4-StarBright Violet 760。向另一根试管中加入 20 μL 抗 CD3-FITC 和 5 μL 抗 CD8-StarBright Violet 760。
- 充分混合并在室温下避光孵育 30 分钟。向细胞中加入 1 mL 洗涤缓冲液,以 300 x g 离心 5 分钟,去除上清液,然后将细胞沉淀重悬于 1 mL 含 0.5% BSA 的 dPBS 中。
- 将细胞以 300 x g 离心 5 分钟,去除上清液,然后将细胞沉淀重悬于 150 μL 不含酚红和 10% 梯度培养基的 RPMI 中。如步骤 2.2 中所述,使用不含酚红的 RPMI、33% 细胞稳定溶液和 10% 梯度培养基作为外部培养基进行封装。
- 封装细胞
- 封装前,将封装盒和稳定溶液预热至室温。准备由完全 RPMI-1640 培养基、33% 细胞稳定溶液和 10% 梯度培养基组成的外层培养基储备液。
- 对于每个包埋样品,制备具有混合靶标效应细胞的细胞样品溶液。用移液管重悬制备好的细胞溶液,并在 1.5 mL 试管中混合 65 μL 制备的效应细胞悬液与 65 μL 制备的靶细胞悬液(均在步骤 2.1 中制备)。
- 立即按以下顺序将试剂加载到封装柱的指定孔中,以确保正确封装。为每个制备的包埋样品加载一组孔。
#A 良好:400 μL 外层培养基。
#D:小架子上有 40 μL 外层培养基。
#C 孔:120 μL 与靶细胞 (JeKo-1) 和效应细胞的预混合溶液。上样前用移液管充分重悬细胞。
井 #B:250 μL 油。
注:每个小柱最多可加载 8 个样品,用于并行封装。 - 立即进行垫圈密封并将小柱加载到仪器中,同时避免倾斜、摇晃或碰撞加载的小柱。小心地将垫圈密封到墨盒上。
- 小心地将卡盒转移到微流体装置上,并按照用户手册中的说明开始封装。
- 生成的液滴比周围的外部介质密度更高,会迅速沉积在收集井(#D 井)的底部。通过将 #D 孔中沉淀的液滴重悬于叠加培养基中,并将其转移到带盖的 2 mL 低结合 DNA 管中,收集每个液滴产物(所有液滴及其周围的外部培养基)。用 Well #A 中剩余的外部培养基清洗 Well #D 以收集剩余的液滴。
- 当液滴在收集管中沉淀时(大约需要 1 分钟),通过在明场显微镜中检查它们来验证液滴的产生。为此,请在 10 μL 移液器吸头中加入样品:大约 1/3 用液滴相(白相)表面的液滴填充,大约 2/3 用覆盖的外部介质填充吸头。立即将样品加载到 8 室载玻片上,并通过明场显微镜以 4 倍和 20 倍放大倍率检查液滴,以确认液滴与细胞一起加载。
注意:以这种方式将液滴吸入周围介质的更大体积中非常重要。
- 孵化
注:液滴现在可以在 2 mL DNA 低结合管中,在标准加湿 37 °C、5% CO2 培养箱中孵育。我们建议使用这些试管,因为它们具有最佳的液滴培养表面特性。- 使用注射器针头 (23G),小心、安全地刺穿所需数量的 2 mL 低结合 DNA 管的盖子。这将确保 CO2/O2 的自由扩散,同时防止介质蒸发。
- 向每个孵育管中加入 1 mL 外部培养基。液滴应与至少 5 倍体积的外部培养基一起孵育,以确保适当的缓冲。添加的外部培养基的体积可以根据所施细胞的新陈代谢而增加。
- 重悬叠加培养基中产生的液滴,并将每个产物分装在三个准备好的培养管中(每个时间点测量一个)。液滴很重且沉淀快,因此在每次转移之间重悬储备很重要。
注:用于液滴产生的孵育管的数量可以变化,但我们建议将一次生产分成不超过 4 个孵育管,以确保每个样品都包含足够的事件进行分析。 - 液滴生成后,将试管直立在培养箱中孵育 2 小时、4 小时或 6 小时。
3. 液滴的下游分析
- 显微术
- 孵育后,如步骤 2.2.7 所述将少量液滴转移到显微镜载玻片上,并使用具有适当激光和滤光片配置的标准荧光显微镜通过明场和荧光显微镜对其进行分析。
注意:液滴可以通过明场显微镜检测。紫色染色的 T 细胞可以用 DAPI 滤光片检测,远红染色的 JeKo-1 细胞可以用 APC 滤光片检测,GzmB-FAM 信号可以用 FITC 滤光片检测,PI 信号可以用 PE 滤光片检测。最感兴趣的 PI 信号可能难以通过显微镜观察,因为早期凋亡细胞的峰值发射率低于晚期凋亡细胞。代表性数据见 图 4 。
- 孵育后,如步骤 2.2.7 所述将少量液滴转移到显微镜载玻片上,并使用具有适当激光和滤光片配置的标准荧光显微镜通过明场和荧光显微镜对其进行分析。
- 流式细胞术
- 孵育后,将每个液滴样品重悬于覆盖培养基中,并将其转移到 5 mL FACS 管中。按照下面列出的一般指南,使用标准流式细胞仪分析液滴。
- 使用具有适当激光器和滤光片配置的流式细胞仪。对于选定的细胞染色和检测组合,此处使用的流式细胞仪不需要颜色补偿。如果应用了其他颜色或应用的流式细胞仪的配置不同,则可能需要进行补偿。
- 使用 FSC-H 作为阈值触发器,以排除小型油事件中的背景噪声。
- 液滴很重,会沉淀在 FACS 管的底部。确保 SIP 到达液滴。在采集之前,液滴应悬浮在至少 5 倍体积的液滴外部缓冲液中。
- 使用高速获取 Droplet 事件。记录 FSC 和 SSC 的强度高度 (H) 信号以及检查的荧光团,因为在分析液滴时使用强度高度测量。调整增益以适当分离正负事件。
注:我们使用 FITC 通道测量 GzmB 信号,使用 Pacific Blue 通道检测紫色染色的 T 细胞,使用 APC 通道检测远红染色的 JeKo-1 细胞,使用 PE 通道检测 PI 信号。 - 记录足够的事件以供下游分析。在这里,我们记录了每个时间点 4.5 - 8.3 x 103 的共包埋液滴。
- 在每组液滴采集后,使用标准的清洁和冲洗溶液,通过 SIP 清洗流式细胞仪。实验结束时彻底清洁流式细胞仪。代表性数据见 图 4 和 图 5 。
- 孵育后,将每个液滴样品重悬于覆盖培养基中,并将其转移到 5 mL FACS 管中。按照下面列出的一般指南,使用标准流式细胞仪分析液滴。
- 数据分析
- 根据 GzmB 阳性 T 细胞和 JeKo-1 细胞共包膜的百分比计算分泌 GzmB 的 T 细胞的百分比,该百分比标准化为在相关时间点在仅 T 细胞液滴群中确定的 T 细胞活力,如下所示:
液滴 T 细胞+、Jeko-1+、GzmB+ / (液滴 T 细胞+、Jeko-1+ - 液滴 死亡 T 细胞+、Jeko-1+)
其中液滴 死亡的 T 细胞+,Jeko-1+ 是根据仅含有 T 细胞的液滴中的死亡估计的:液滴死亡的 T 细胞+,Jeko-1+ = 液滴T 细胞+,Jeko-1+ x 液滴 死亡的 T 细胞+,Jeko-1- / 液滴Tcell+,Jeko-1-。 - 按如下方式计算杀死其靶细胞的 T 细胞的百分比:
细胞毒性 T 细胞百分比 = (观察到的死亡 - 背景死亡)/(100 - 背景死亡)
其中,背景死亡是由于非杀伤相关死亡或封装前发生的死亡而导致的 (T 细胞+、Jeko-1+) 液滴内的死亡。 - 估计 (T 细胞 + , Jeko-1 - ) 液滴和 (T 细胞 - ,Jeko-1 + ) 液滴中细胞死亡的背景死亡:
背景死亡 = (1-(1-液滴Tcell-、Jeko-1+ 中的死亡比率) x (1-液滴T 细胞中的死亡比+、Jeko-1-))) x 100
其中死亡率直接测量为仅 T 细胞液滴和仅 JeKo-1 细胞液滴中的 % PI 阳性液滴。所有计算都使用特定于采样时间的数字执行。
- 根据 GzmB 阳性 T 细胞和 JeKo-1 细胞共包膜的百分比计算分泌 GzmB 的 T 细胞的百分比,该百分比标准化为在相关时间点在仅 T 细胞液滴群中确定的 T 细胞活力,如下所示:
结果
转导后,使用抗 CD3 和抗 NGFR 抗体通过流式细胞术分析 T 细胞的 CAR 表达。随后使用抗 NGFR 磁珠富集 CAR T 细胞群,导致两个供体的纯度超过 98%(图 1A-B)。使用利用 CCR7 和 CD45RA 抗体的标准门策略,还对所用分选 CAR 细胞的 CD4/CD8 比率和记忆表型进行了定量。这些数据表明,使用的 CAR T 细胞的 CD4/CD8 比率为 0.73,细胞主要具有幼稚样记忆表型(图 1C-E)。
CAR T 细胞和 JeKo-1 细胞分别用紫色和远红外染料染色,并与检测试剂 GzmB 底物和 PI 一起封装在 DE50 液滴中(图 2)。或者,也可以使用抗 CD4 或抗 CD8 等抗体标记 CAR T 细胞(图 3),从而能够更详细地表征 T 细胞。在封装之前,将每种 T 细胞悬液(CAR T 或 NTD)与 JeKo-1 细胞悬液在效应器中混合:靶细胞比例为 1:3(0.5 x 106 个 T 细胞和 1.5 x 106 个 JeKo-1)。封装后,将每个液滴产生物 (CAR T 细胞 + JeKo-1 和 NTD + JeKo-1) 分成三个孵育管,分别孵育 2 h、4 h 和 6 h。将细胞在 37 °C 和 5% CO2 的液滴内孵育,然后在指定的时间点通过显微镜和流式细胞术进行分析。
孵育 4 小时后,我们对液滴进行了荧光显微镜检查(图 4)。绿色荧光信号 (FITC) 的强度说明了 DE50 液滴内 CAR T 细胞或 NTD 分泌的 GzmB 活性水平。 图 4B 显示了单个 GzmB 阳性液滴的相差和荧光显微镜图像,其中包含一个 CAR T 细胞和一个密切接触的 JeKo-1 靶细胞。
接下来,通过流式细胞术分析 DE50 液滴,以量化具有早期 GzmB 分泌和细胞毒性细胞杀伤活性的 CAR T 细胞的百分比(图 5)。在包封前,用远红外染料对 JeKo-1 靶细胞进行预孵育染色,用紫色染料对效应 T 细胞进行预孵育染色,有助于识别三种不同的含细胞液滴群,因为细胞基于泊松分布分布在液滴中。鉴定的液滴群是单独含有 T 细胞、单独含有 JeKo-1 细胞以及 T 细胞和 JeKo-1 细胞一起出现的液滴(图 5A)。对与 JeKo-1 细胞共封装的液滴进行门控并分析指示 GzmB 活性(图 5B)和细胞死亡的信号,如 PI 所示(图 5C)。
液滴中的细胞包埋遵循泊松分布,并获得四种不同的液滴群(图 6A)。 图 6B 显示了液滴孵育 6 小时后所有液滴群中 GzmB 阳性液滴的水平,从中可以确定自发分泌 GzmB 的 T 细胞的百分比。这些数据表明该方法具有高度特异性,因为只有 CAR T 细胞分泌 GzmB。
最后,我们量化了共孵育 2 小时、 4 小时和 6 小时后跨时间点的 GzmB 和 PI 水平。作为参考,分析仅包含 T 细胞和仅 JeKo-1 细胞的液滴,以检查每个群体中的背景细胞死亡(图 6C)。背景细胞死亡用于确定效应细胞群中分泌 GzmB 的活 T 细胞和靶细胞杀伤 T 细胞的百分比(图 7),如步骤 3.3 所述。来自两个供体的 CAR T 细胞在靶细胞诱导的 GzmB 分泌和细胞杀伤活性方面均表现出时间依赖性增加。来自供体 1 的近 36% 的活 CAR T 细胞和来自供体 2 的 31% 的活 CAR T 细胞在与靶细胞共包封 6 小时后分泌 GzmB,与 NTD 对照 T 细胞相比显着增加(图 7A)。相应地,大约 21% 的活供体 1 和 22% 的活供体 2 CAR T 细胞已经杀死靶细胞,如阳性 PI 信号所示(图 7B)。在每个时间点,分泌 GzmB 的 CAR T 细胞的百分比都超过了被杀死的靶细胞的百分比,这与 GzmB 介导的细胞毒性的预期事件顺序一致。综上所述,这些数据表明,此处介绍的方法允许表征细胞群内单个 T 细胞细胞毒性的异质性以及不同群体之间的比较。

图 1:NGFR 分选后的代表性流式细胞术图。 (A) 扩增大约 10 天后,使用 NGFR 特异性微珠和磁选对 CAR T 细胞进行分选,得到 CAR T 细胞群的 CAR T 细胞>98%。(B) 分选前后来自本研究中使用的两个供体的 CAR T 细胞的定量。(C) 用于检查 CD4/CD8 比率和 T 细胞记忆表型的门控策略。(D) 所用 T 细胞的 CD4 和 CD8 定量。(E) 所用 T 细胞的记忆表型的定量。缩写:CM = 中枢记忆,EM = 效应记忆,NTD = 未转导,TEMRA = 终末分化效应细胞。 请单击此处查看此图的较大版本。
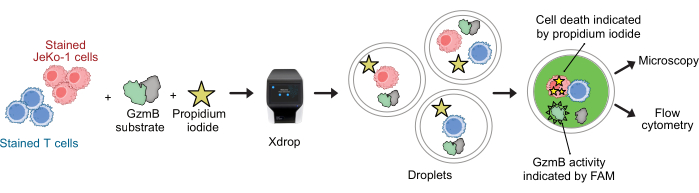
图 2:GzmB 分泌和细胞毒性联合测定的工作流程,液滴中具有单细胞分辨率。 在封装到 DE 液滴中之前,使用紫色和远红细胞染色剂分别对靶细胞和效应细胞进行染色。使用微流体装置和包埋盒,将效应细胞与液滴中的靶细胞以及细胞培养基、PI 和 FAM 标记的 GzmB 肽底物共包埋。检测和孵育在液滴内进行。分泌的 GzmB 活性由 GzmB 裂解底物后产生的绿色荧光表示。细胞死亡由 PI 指示。孵育后,通过显微镜和/或流式细胞术分析 DE50 液滴。 请单击此处查看此图的较大版本。

图 3:分析预先标记了抗 CD3、抗 CD4 和抗 CD8 抗体的液滴封装的 PBMC。 (A) 带有预先标记有抗 CD3 (APC) 和抗 CD4 (NIR) 抗体的封装 PBMC 的液滴的显微镜图像。比例尺 = 100 μm。(B) 与 (A) 相同,但使用 CD3 (FITC) 和抗 CD8 (NIR) 标记。比例尺 = 100 μm。(C) 相同液滴的流式细胞术分析。 请单击此处查看此图的较大版本。
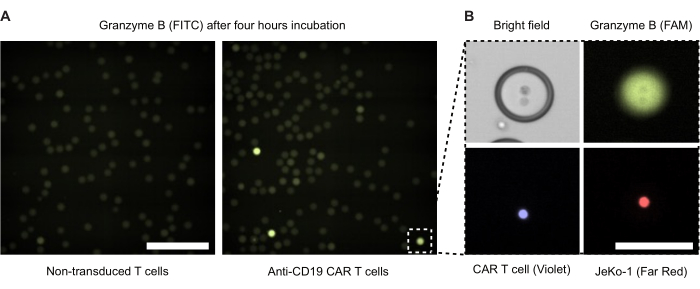
图 4:带有效应细胞和靶细胞的液滴的显微镜图像。在标准 37 °C、5% CO2 加湿细胞培养箱中孵育 4 小时后拍摄图像。 (A) 来自带有包膜 NTD 和 JeKo-1 细胞(左)或 CAR T 细胞和 JeKo-1 细胞(右)的样品中的液滴,使用 FITC 通道通过荧光显微镜成像以检测 GzmB 阳性(绿色)液滴。比例尺 = 500 μm。(B) 通过相差、FITC (GzmB)、APC (JeKo-1 细胞) 和 DAPI(CAR T 细胞)成像的单个液滴。比例尺 = 100 μm。 请单击此处查看此图的较大版本。
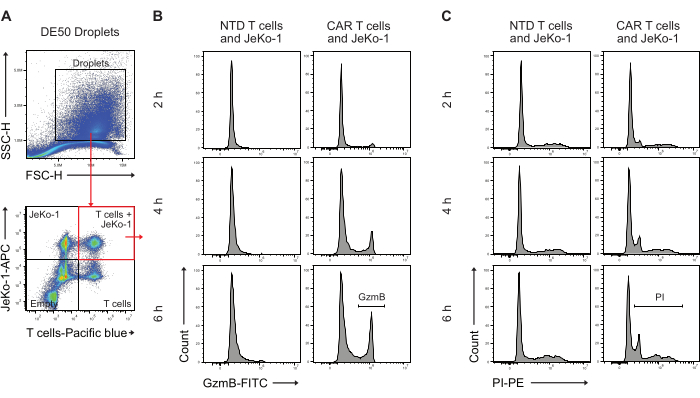
图 5:孵育后通过流式细胞术分析液滴的设门策略。 (A) 通过前向和侧向散射进行设门以识别液滴,然后选择包含液滴的门。闸门外的事件表示作为液滴生产副产品产生的油滴。随后对与所应用的细胞染色剂相对应的通道中的液滴进行荧光分析,可识别出四种液滴群:同时包含 T 细胞和 JeKo-1 细胞的液滴(红色方块);仅具有 JeKo-1 细胞的液滴;仅带有 T 细胞的液滴;和空液滴。(B) 跨时间点以及 NTD 和 CAR T 细胞之间双阳性液滴中 GzmB 信号的代表性直方图。(C) 跨时间点以及 NTD 和 CAR T 细胞之间双阳性液滴中 PI 信号的代表性直方图。所有液滴测量均作为强度高度 (H) 测量进行。 请单击此处查看此图的较大版本。
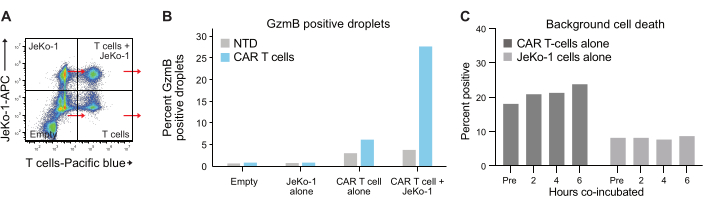
图 6:内对照和参考群体。 (A) 选择 图 5A 中的四个象限中的每一个,并在每个象限中测量 GzmB 和 PI。这种类型的定量允许在对 T 细胞功效进行最终分析之前测量和减去背景信号。(B) 图表显示了四个液滴群中每个液滴群在孵育 6 小时后 GzmB 阳性液滴的频率,以来自供体 1 CAR T 样品的数据为例。(C) 使用来自供体 1 的数据,在每个测量时间点确定仅 JeKo-1 和仅 T 细胞对照液滴群的背景细胞死亡。背景细胞死亡用于计算活 GzmB 分泌和细胞杀伤效应细胞的频率, 如图 7 所示,并在步骤 3.3 中解释。缩写: Pre = 封装。请单击此处查看此图的较大版本。
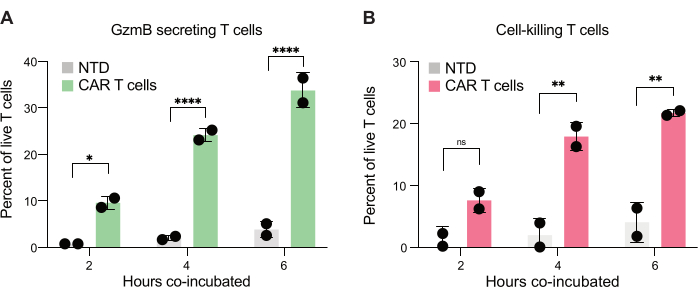
图 7:能够分泌 GzmB 并杀死双阳性液滴中 JeKo-1 细胞的 T 细胞的定量。 在液滴中共孵育 2 小时、 4 小时和 6 小时后,检查来自两个供体的双阳性液滴。(A) 分泌 GzmB 的靶细胞遭遇 T 细胞的频率以及 NTD T 细胞和 CAR T 细胞之间的比较。(B) 遇到靶细胞的 T 细胞杀死共包膜靶细胞的频率。缩写:GzmB = 颗粒酶 B,NTD = 未转导,PI = 碘化丙啶。* = P 值< 0.05,** = P 值< 0.005,**** = P 值< 0.0001(通过双向方差分析)。 请单击此处查看此图的较大版本。
讨论
在这里,我们提出了一种使用易于使用的市售微流体装置在单细胞水平上检查 T 细胞的细胞毒潜力的方法,以评估 CD19-CD28-CD3z CAR T 细胞在与 CD19 阳性套细胞淋巴瘤细胞系 JeKo-1 共包封时的细胞毒潜力。
该协议有几个关键步骤。首先,我们建议在进行任何检测前至少 48 小时从 T 细胞中去除刺激珠,以避免假阳性结果。其次,CAR 或 T 细胞受体等构建体的 T 细胞转导效率可能会有很大差异。如果不对转导的 T 细胞进行后续纯化步骤,结果可能难以解释。在这里,使用了纯 CAR T 细胞群,因此在每个时间点将 CAR T 细胞表征为杀伤基因或非杀伤基因时,可以预期具有高度的确定性。或者,可以用荧光蛋白或遗传标签标记 CAR 来指示 CAR 阳性的细胞,然后在分析液滴时进行门控。如果使用标记,则所选荧光分子不应干扰任何其他检测荧光团的荧光发射。例如,使用 GFP 标记会干扰在此处进行的实验中应用的 FAM 标记的 GzmB 底物,因此不建议使用。
此处概述的方案的一个主要优点是液滴生成本身得到简化和自动化。然而,为了确保单细胞封装,细胞在卡盒加载前彻底重悬非常重要。因此,建议在准备装入磁带时以合理的速度工作。添加 GzmB 底物时,类似的考虑也适用,因为一些细胞是 GzmB 的高分泌者。细胞的重悬还将防止小盒微流体通道堵塞。如上所述,通过显微镜很容易检查细胞的正确封装。
由于液滴封装了细胞培养基并保留了细胞分泌的细胞产物,因此可以分析其他细胞因子、抗体和化合物。事实上,我们已经测试了其他相关的免疫细胞分泌分子,例如 IFN-γ 和 TNF-α,这些分子需要修改当前方案。对于细胞因子检测,可以应用与我们在此处用于 GzmB 的不同类型的检测形式,例如在效应细胞表面生成 ELISA 夹心32。此外,可以更改细胞染色剂和检测颜色,例如羧基荧光素琥珀酰亚胺酯 (CFSE),但重要的是要确保不同颜色组合的渗漏最小或没有渗漏,就像在标准流式细胞术中所做的那样。
此外,该方案不仅限于分析 CAR T 细胞。它还可以扩展到研究其他 T 细胞/靶标相互作用或其他免疫细胞,例如 CAR NK 细胞。还可以设想更高级的实验,例如用额外的荧光团标记 CD4 和 CD8 T 细胞亚群,以执行更广泛的功能性免疫表型分析。事实上,我们在这里表明可以在液滴中检测到 CD4 和 CD8,从而能够进一步表征效应 T 细胞及其细胞毒能力。
优化该方案,我们专门针对它在标准流式细胞术仪器上工作。虽然液滴流式细胞术并不复杂,但我们注意到,如果流式细胞仪没有按特定时间间隔正确冲洗,或者没有按照此处的建议在每个时间间隔分析样品后正确冲洗,则可能会发生油积聚。最佳冲洗方案可能特定于每个单独的流式细胞仪。
该方法的显著优势之一是其高通量能力,无需广泛的专业知识或高度专业化的设备即可监测单细胞效应子介导的针对靶细胞的细胞毒性。可以使用现有工具(如流式细胞术或显微镜)轻松完成检测。化液滴也适用于使用细胞分选仪30,31 进行分选,这可以分离具有特定功能的细胞,例如,具有和没有细胞毒性潜力的 CAR T 细胞,然后进行单细胞转录组分析。
该技术并非没有限制。虽然一些细胞系可以耐受在液滴中培养 24 小时及更长时间,但原代细胞在 24 小时后可能具有显著降低的活力。这代表了一般测定的时间限制,但对于当前的测定,可以在 4-6 小时内观察到明显的 GzmB 和细胞杀伤活性,这可能是因为小液滴室确保了效应器和靶细胞的快速相遇。同样,小液滴体积将确保分泌的 GzmB 裂解底物的浓度快速积累至可检测水平。该技术的另一个局限性是,当使用标准流式细胞仪时,无法检测到效应细胞的连续杀伤。然而,这可以通过图像流式细胞仪或图像细胞术技术来实现,这必须进行研究。
CD19 CAR T 细胞的过继转移在治疗血液系统恶性肿瘤患者方面取得了显著的成功。尽管如此,患者32 的反应和不可预测的毒性存在很大差异,这可能部分是由于 CAR T 输注产品内的异质性。因此,人们对分析群体中单个 CAR T 细胞的表型组成和细胞毒能力越来越感兴趣。随着 CAR 疗法越来越多地在自身免疫性疾病和其他形式的癌症中进行测试,这一点将尤为重要。此处描述的微流体设备和方案提供了一种强大且通用的方法来检查 CAR T 细胞和其他基于细胞的疗法的异质性。
披露声明
作者声明以下相互竞争的利益:MBB 已获得 Janssen、Roche 和 Kite/Gilead 的咨询酬金,与当前工作无关。D.L.P. 和 P.M. 是 Samplix 的员工。
致谢
作者要感谢 CITCO 和 Samplix 的成员和员工,他们提供的有益讨论和建议。MBB 得到了灵北基金会 (R381-2021-1278) 的早期职业临床医生科学家奖学金的支持。这项工作得到了欧登塞大学医院的精英研究资助的支持。此外,这项研究还得到了欧洲创新委员会项目190144395对 Samplix ApS 的资助。
材料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Blocker BSA (BSA) | Thermo Scientific | 37525 | |
| CellTrace Far Red Cell Proliferation Kit (far red fluorescent dye) | Invitrogen | C34564 | |
| CellTrace Violet Cell Proliferation Kit (violet fluorescent dye) | Invitrogen | C34557 | |
| DE Stabilizing Solution (stabilizing solution) | Samplix | REDIVSTABSOL1500 | |
| DPBS (dPBS) | Gibco | 14190-094 | |
| Dulbecco’s PBS (dPBS) | Capricorn Scientific | PBS-1A | |
| Dynabeads Human T-Activator (CD3/CD28 activation beads) | Gibco | 11132D | |
| Fetal Bovine Serum (FBS) | Capricorn Scientific | FBS-HI-12A | |
| Lenti-X Concentrator (PEG-based reagent) | Takara Bio | 631232 | |
| MACSelect LNGFR Microbeads (anti-NGFR magnetic beads) | Miltenyi Biotec | 130-091-330 | |
| OptiPrep density gradient medium (gradient medium) | Stemcell | 7820 | |
| Penicillin-Streptomycin (P/S) | Capricorn Scientific | PS-B | |
| Propidium iodide (PI) | Invitrogen | BMS500PI | |
| Recombinant Human IL-2 (IL-2) | Peprotech | 200-02 | |
| RPMI-1640 with Stable Glutamine (RPMI-1640) | Capricorn Scientific | RPMI-STA | |
| RPMI-1640 without L-Glutamine and phenol red | Gibco | 32404-014 | |
| Xdrop DE oil I (oil) | Samplix | REOILDEC1900 | |
| Xdrop Granzyme B substrate (GzmB substrate) | Samplix | REGRB100 | |
| Zombie-NIR viability dye (viability dye) | BioLegend | 423106 | |
| Plasticware etc. | |||
| 8-chamber glass slide | Chemometec | 942-0003 | |
| Cell culture plate, 12 well | TH Geyer | 7696791 | |
| DNA LoBind tube, 2 mL (DNA tube) | Eppendorf | 30108078 | |
| Eppendorf tube, 1.5 mL (1.5 mL tube) | Eppendorf | 30108051 | |
| Falcon tube, 15 mL (15 mL tube) | TPP | 91015 | |
| Falcon tube, 5 mL (5 mL tube) | Falcon (VWR) | 734-0443 | |
| Green cell suspension flasks for cell incubations (T75 flask) | Sarstedt | 148.19.22 | |
| Green cell suspension plates for cell incubations (96 well plate) | Sarstedt | 148.32.20 | |
| LS Separation Columns (separation column) | Miltenyi Biotec | 130-042-401 | |
| Xdrop DE Gaskets (gaskets) | Samplix | #GADEA100 | |
| Xdrop DE50 Cartridge (encapsulation cartridge) | Samplix | #CADE50A100 | |
| Antibodies | |||
| anti-CCR7 PE-Dazzle 594 | BioLegend | 353236 | |
| anti-CD19 CAR FMC63 Idiotype Antibody, PE | Miltenyi Biotec | 130-127-342 | |
| anti-CD3 APC | Biolegend | 300439 | |
| anti-CD3 BV480 | BD Biosciences | 566105 | |
| anti-CD3 FITC | BD Biosciences | 345763 | |
| anti-CD4 BUV661 | BD Biosciences | 612962 | |
| anti-CD4 StarBright Violet 760 | Bio-Rad | MCA1267SBV760T | |
| anti-CD45RA BUV395 | BD Biosciences | 740298 | |
| anti-CD8 PE-Cy7 | BioLegend | 344712 | |
| anti-CD8 StarBright Violet | Bio-Rad | MCA1226SBV760 | |
| anti-NGFR FITC | BioLegend | 345106 | |
| anti-NGFR PE | BioLegend | 345106 | |
| Cells | |||
| JeKo-1 Mantle-cell lymphoma cell-line (JeKo-1) | ATCC | CRL-3006 | |
| Primary peripheral blood mononuclear cells (PBMCs) | |||
| Equipment | |||
| Countess 3 Automated Cell Counter | Thermo Fisher Scientific | A50298 | |
| DynaMag-2 Magnet | Invitrogen | 12321D | |
| NovoCyte Quanteon Flow Cytometer (flow cytometer) | Agilent | 2010011AA | |
| Xdrop (microfluidics device) | Samplix | IN00110-EU |
参考文献
- Pasqui, D. M., Latorraca, C. D. O. C., Pacheco, R. L., Riera, R. CAR-T cell therapy for patients with hematological malignancies. A systematic review. Eur J Haematol. 109 (6), 601-618 (2022).
- Krejcik, J., et al. Harnessing the immune system to fight multiple myeloma. Cancers. 13 (18), 4546 (2021).
- Tokarew, N., Ogonek, J., Endres, S., von Bergwelt-Baildon, M., Kobold, S. Teaching an old dog new tricks: next-generation CAR T cells. British J Cancer. 120 (1), 26-37 (2019).
- Bogetofte Barnkob, M., Vitting-Seerup, K., Rønn Olsen, L. Target isoforms are an overlooked challenge and opportunity in chimeric antigen receptor cell therapy. Immunother Adv. 2 (1), ltac009 (2022).
- Daei Sorkhabi, A., et al. The current landscape of CAR T-cell therapy for solid tumors: Mechanisms, research progress, challenges, and counterstrategies. Front Immunol. 14, 1113882 (2023).
- . Considerations for the Development of Chimeric Antigen Receptor (CAR) T Cell Products Available from: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/considerations-development-chimeric-antigen-receptor-car-t-cell-products (2024)
- Roddie, C., O'Reilly, M., Dias Alves Pinto, J., Vispute, K., Lowdell, M. Manufacturing chimeric antigen receptor T cells: issues and challenges. Cytotherapy. 21 (3), 327-340 (2019).
- Wang, L., et al. Improvement of in vitro potency assays by a resting step for clinical-grade chimeric antigen receptor engineered T cells. Cytotherapy. 21 (5), 566-578 (2019).
- Burrows, S. R., Fernan, A., Argaet, V., Suhrbier, A. Bystander apoptosis induced by CD8+ cytotoxic T cell (CTL) clones: implications for CTL lytic mechanisms. Int Immunol. 5 (9), 1049-1058 (1993).
- Gattinoni, L., et al. Acquisition of full effector function in vitro paradoxically impairs the in vivo antitumor efficacy of adoptively transferred CD8+ T cells. J Clin Invest. 115 (6), 1616-1626 (2005).
- Chen, G. M., et al. Integrative bulk and single-cell profiling of premanufacture T-cell populations reveals factors mediating long-term persistence of CAR T-cell therapy. Cancer Dis. 11 (9), 2186-2199 (2021).
- Frazer, G. L., Gawden-Bone, C. M., Dieckmann, N. M. G., Asano, Y., Griffiths, G. M. Signal strength controls the rate of polarization within CTLs during killing. J Cell Biol. 220 (10), e202104093 (2021).
- Hermans, I. F., et al. The VITAL assay: a versatile fluorometric technique for assessing CTL- and NKT-mediated cytotoxicity against multiple targets in vitro and in vivo. J Immunol Meth. 285 (1), 25-40 (2004).
- Zaritskaya, L., Shurin, M. R., Sayers, T. J., Malyguine, A. M. New flow cytometric assays for monitoring cell-mediated cytotoxicity. Expert Rev Vaccines. 9 (6), 601-616 (2010).
- Piccinini, C., et al. In vitro CAR-T cell killing: validation of the potency assay. Cancer Immunol Immunother CII. 73 (9), 168 (2024).
- Martinez, E. M., et al. High-throughput flow cytometric method for the simultaneous measurement of CAR-T cell characterization and cytotoxicity against solid tumor cell lines. SLAS Disc Adv Life Sci. 23 (7), 603-612 (2018).
- Jedema, I., van der Werff, N. M., Barge, R. M. Y., Willemze, R., Falkenburg, J. H. F. New CFSE-based assay to determine susceptibility to lysis by cytotoxic T cells of leukemic precursor cells within a heterogeneous target cell population. Blood. 103 (7), 2677-2682 (2004).
- Liu, L., et al. Cellular and molecular imaging of CAR-T cell-based immunotherapy. Adv Drug Delivery Rev. 203, 115135 (2023).
- Liadi, I., et al. Defining potency of CAR+ T cells: Fast and furious or slow and steady. Oncoimmunology. 8 (10), e1051298 (2019).
- Xhangolli, I., et al. Single-cell analysis of CAR-T cell activation reveals a mixed TH1/TH2 response independent of differentiation. Genom Proteom Bioinfo. 17 (2), 129-139 (2019).
- Zhou, Y., et al. Evaluation of single-cell cytokine secretion and cell-cell interactions with a hierarchical loading microwell chip. Cell Rep. 31 (4), 107574 (2020).
- LaBelle, C. A., Zhang, R. J., Hunsucker, S. A., Armistead, P. M., Allbritton, N. L. Microraft arrays for serial-killer CD19 chimeric antigen receptor T cells and single cell isolation. Cytometry J Int Soc Anal Cytol. 103 (3), 208-220 (2023).
- Hellmann, M. J., et al. Heterogeneously deacetylated chitosans possess an unexpected regular pattern favoring acetylation at every third position. Nat Comm. 15 (1), 6695 (2024).
- Wong, K. U., et al. Assessment of chimeric antigen receptor T cytotoxicity by droplet microfluidics in vitro. Antibody Therapeut. 5 (2), 85-99 (2022).
- Antona, S., Platzman, I., Spatz, J. P. Droplet-based cytotoxicity assay: Implementation of time-efficient screening of antitumor activity of natural killer cells. ACS omega. 5 (38), 24674-24683 (2020).
- Subedi, N., et al. An automated real-time microfluidic platform to probe single NK cell heterogeneity and cytotoxicity on-chip. Sci Rep. 11 (1), 17084 (2021).
- Zhang, Y., et al. Enhanced CRISPR/Cas12a-based quantitative detection of nucleic acids using double emulsion droplets. Biosens Bioelect. 257, 116339 (2024).
- Kochenderfer, J. N., et al. Construction and preclinical evaluation of an anti-CD19 chimeric antigen receptor. J Immunother. 32 (7), 689-702 (2009).
- Michaels, Y. S., et al. Precise tuning of gene expression levels in mammalian cells. Nat Comm. 10 (1), 818 (2019).
- Yuan, Y., et al. Droplet encapsulation improves accuracy of immune cell cytokine capture assays. Lab on a Chip. 20 (8), 1513-1520 (2020).
- Brower, K. K., et al. Double emulsion flow cytometry with high-throughput single droplet isolation and nucleic acid recovery. Lab on a Chip. 20 (12), 2062-2074 (2020).
- Kirouac, D. C., et al. Deconvolution of clinical variance in CAR-T cell pharmacology and response. Nat Biotechnol. 41 (11), 1606-1617 (2023).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。