È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Terapia plasmonica fototermica del cancro: fantocci che imitano il tessuto tumorale inclusi in nanoparticelle per la visualizzazione della distribuzione fototermica della temperatura
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo presenta il protocollo per la preparazione di fantocci di tessuto tumorale che replicano le proprietà ottiche per la terapia fototermica plasmonica. Descrive in dettaglio la preparazione dei fantocci, le valutazioni fototermiche e la convalida del modello numerico sviluppato basato su misurazioni della temperatura fototermica per la valutazione dei parametri terapeutici, offrendo un'alternativa etica ed economica agli studi in vivo per i test preliminari.
Abstract
La terapia fototermica plasmonica (PPTT), un trattamento emergente del cancro, prevede la somministrazione di nanoparticelle (NP) a un tumore, seguita da irradiazione nel vicino infrarosso (NIR) per generare calore localizzato che distrugge le cellule tumorali. Prima di somministrare PPTT, è necessario stimare i parametri terapeutici - concentrazione di NP, intensità e durata dell'irradiazione. A tal fine, vengono eseguite simulazioni numeriche. Tuttavia, per garantire un calcolo robusto, queste simulazioni devono essere convalidate attraverso esperimenti fototermici su fantocci che imitano il tessuto tumorale replicando le proprietà ottiche del tessuto tumorale. Per la PPTT, i parametri terapeutici sono governati dalla dispersione e dall'assorbimento della radiazione incidente da parte del tessuto e delle NP. Pertanto, è possibile condurre esperimenti di validazione su fantocci che imitano il coefficiente di dispersione ridotto (μs') e il coefficiente di assorbimento (μa) del tumore/tessuto bersaglio.
In particolare, questo protocollo fornisce istruzioni per la preparazione di fantocci che imitano μs' e μ un tumore al seno iniettato con nanobarre d'oro, circondato da tessuto mammario normale. Il protocollo descrive anche l'irradiazione NIR, il monitoraggio della temperatura e la convalida dei risultati numerici confrontando le temperature spaziotemporali con quelle misurate utilizzando le termocoppie. I protocolli presentati in questo studio hanno facilitato la preparazione di fantocci cilindrici di tessuto tumorale mammario a base di idrogel con dimensioni (φ40 x 12 mm) e una regione tumorale centrale (φ20 x 6 mm), comprendenti l'1% di agarosio come matrice di base e intralipidi come costituente di scattering e regione tumorale incorporata con nanobarre d'oro a una concentrazione di 25 μg/mL. I risultati rappresentativi di un caso di studio illustrano l'applicazione di fantocci fabbricati per la convalida di simulazioni numeriche per PPTT. Lo studio conclude che i protocolli dimostrati sono preziosi per condurre esperimenti fototermici volti a ottimizzare e pianificare i parametri terapeutici prima degli esperimenti in vivo e convalidare le simulazioni numeriche per PPTT.
Introduzione
La terapia fototermica plasmonica (PPTT) è una modalità emergente di trattamento localizzato del cancro che prevede la somministrazione di nanoparticelle (NP) nel sito del tumore, seguita da irradiazione con radiazioni nel vicino infrarosso (NIR). Le NP sono tipicamente somministrate per via intratumorale (IT) o endovenosa (IV)1. Dopo l'irradiazione NIR, l'interazione plasmonica della radiazione incidente e delle NP porta alla generazione di calore localizzato sulla superficie delle NP, che poi si dissipa nel tessuto tumorale circostante 2,3. Questo riscaldamento localizzato eleva la temperatura nella regione tumorale, portando alla morte delle cellule tumorali attraverso l'ablazione termica 4,5. Un trattamento efficace del cancro può essere ottenuto mantenendo temperature specifiche, come 46 ºC per 1 ora6, 50-52 ºC per 4-6 minuti7 o 60 ºC per danni istantanei8 attraverso vari processi biologici.
Vari agenti fototermici sono stati esplorati e riportati per l'applicazione della terapia fototermica e la loro efficacia terapeutica è stata valutata attraverso studi in vitro o in vivo . Questi agenti includono materiali organici9 come coloranti nel vicino infrarosso (ad esempio, verde indociania, IR780, IR820), agenti fototermici a base di polimeri (ad esempio, polidopamina) e materiali inorganici10, tra cui NP a base di metalli nobili o NP plasmoniche (ad esempio, NP d'oro)11, zolfo/ossidi di metalli di transizione12 e MXeni13. Tra queste, le NP plasmoniche, in particolare le NP d'oro, offrono diversi vantaggi rispetto agli agenti fototermici tradizionali (ad esempio, i coloranti), come una migliore stabilità fototermica, una maggiore efficienza di conversione fototermica e una risposta plasmonica sintonizzabile attraverso variazioni di forma e dimensione10. Queste caratteristiche rendono le NP d'oro candidati ideali per la terapia fototermica, con alcune attualmente in fase di sperimentazione clinica14.
Per ottimizzare l'efficacia terapeutica e garantire un sufficiente danno termico del tumore durante la PPTT, è essenziale stimare i parametri del trattamento come il dosaggio di NP (in termini di concentrazione) e i parametri di radiazione NIR (inclusa l'intensità e la durata dell'irradiazione) prima dell'applicazione preclinica/clinica della PPTT. Le simulazioni numeriche sono tipicamente impiegate per stabilire questi parametri. Sono stati sviluppati vari metodi numerici per valutare il danno termico all'interno del tessuto tumorale, con il metodo di Boltzmann su reticolo che è uno di questi approcci15,16. Tuttavia, affinché queste simulazioni siano affidabili, devono essere convalidate utilizzando analoghi tissutali noti come fantocci che imitano i tessuti. Questi fantocci possono essere preparati per replicare le proprietà ottiche, termiche, biologiche o meccaniche dei tessuti reali, fungendo da sostituti per condurre test preliminari, valutazione del trattamento e convalida di dispositivi, materiali o metodi di nuova concezione destinati ad applicazioni biologiche17,18. Ciò può ridurre la sofferenza inutile degli animali o dei soggetti umani e affrontare le preoccupazioni etiche associate a tali esperimenti19,20.
La progettazione e la fabbricazione di un fantoccio dipendono dall'applicazione prevista21. Ad esempio, durante le fototerapie come la PPTT, la dose di radiazione incidente è influenzata dalla quantità di luce assorbita o diffusa dalle NP e dai tessuti22,23. Pertanto, i fantocci ottici che imitano le proprietà ottiche, in particolare il coefficiente di scattering ridotto (μs') e il coefficiente di assorbimento (μa) dei tessuti biologici, vengono utilizzati per le valutazioni PPTT e la successiva validazione delle simulazioni numeriche24,25. I fantocci ottici sono tipicamente composti da tre costituenti principali: una matrice di base, agenti di scattering e agenti di assorbimento17,26. La matrice di base mantiene i componenti di dispersione e assorbimento in concentrazioni adeguate per replicare le proprietà ottiche desiderate. Questi fantocci possono essere classificati in fantocci solidi, liquidi e semisolidi (idrogel), a seconda del tipo di matrice di base. Per gli studi di terapia termica come la PPTT, i fantocci di idrogel, in particolare i fantocci a base di agarosio, sono preferiti a causa della loro biocompatibilità, della dispersione e dell'assorbimento intrinseci trascurabili, del semplice processo di fabbricazione e della flessibilità di essere fusi nelle forme e nelle dimensioni desiderate corrispondenti alle geometrie del tumore19,22. Ancora più importante, i fantocci preparati a base di agarosio possono essere utilizzati fino a ~70-80 ºC di temperatura di massa, poiché la temperatura di fusione dei fantocci di tipo agarosio è di ~80 ºC19. Per PPTT, poiché è sufficiente un intervallo di temperatura di ~50-80 ºC, tali fantocci a base di agarosio possono essere utilizzati per valutazioni fototermiche basate su PPTT.
Sono stati sviluppati e segnalati vari fantocci che imitano i tessuti a base di idrogel per varie applicazioni. Mustari et al. hanno sviluppato fantocci che imitano i tessuti a base di agarosio e hanno dimostrato la loro utilità nella convalida di un sistema ottico di nuova concezione18. In un altro studio, sono stati preparati fantocci termocromici che imitano i tessuti per misurare l'entità del danno termico durante la terapia con ultrasuoni focalizzati ad alta intensità (HIFU)27. Sono stati inoltre preparati fantocci che imitano i tessuti a base di poliacrilammide per analizzare l'effetto della cavitazione durante la terapia antitumorale basata su HIFU28. L'obiettivo di questo studio è dimostrare un metodo passo-passo per fabbricare fantocci che imitano il tessuto tumorale insieme al protocollo per esperimenti fototermici basati su fantocci per valutazioni PPTT. Questo protocollo dettagliato proposto mira a promuovere l'adozione e la riproducibilità della preparazione del fantoccio e dei successivi metodi di sperimentazione fototermica basati su fantoccio per testare le prestazioni fototermiche di nanostrutture di nuova concezione, convalidando così le simulazioni numeriche e aiutando la pianificazione del pretrattamento o l'ottimizzazione dei parametri terapeutici di PPTT. Questo articolo descrive un protocollo di preparazione dei fantocci specificamente progettato per i tumori al seno sotto la superficie; Tuttavia, gli stessi passaggi possono essere adattati per la fabbricazione di vari tipi di tessuto tumorale (di varie forme e dimensioni) alterando la composizione degli agenti di assorbimento ottico e di diffusione. Ad esempio, le dimostrate valutazioni fototermiche basate su fantocci che imitano i tessuti sono state impiegate in studi precedentemente riportati per convalidare le simulazioni PPTT per il tumore dell'avambraccio sotto la superficie24, l'IDC25 sotto la superficie e i tumori della pelle29.
Questo articolo descrive le fasi di preparazione di un fantoccio ottico che imita le μdi un tumore al seno sottosuperficiale o sottocutaneo, in particolare il carcinoma duttale invasivo (IDC), situato a 3 mm sotto la superficie della pelle e circondato da tessuto mammario normale. Il fantoccio è di geometria cilindrica preparato utilizzando agarosio come matrice di base e intralipidico (IL) come agente di diffusione aggiunto in concentrazioni adeguate per imitare μdel tessuto mammario normale e canceroso. L'agarosio, un idrogel trasparente con dispersione e assorbimento trascurabili, è una matrice base ideale per fantocci ottici18,30. Inoltre, l'IL, un'emulsione di grasso al 20% che imita la struttura a doppio strato delle membrane cellulari, è ampiamente utilizzata come agente di dispersione31,32 ed è stata scelta per questo studio per replicare le μ del tessuto mammario normale e canceroso. Il fantoccio è progettato per imitare il tumore al seno (IDC) iniettato con nanobarre d'oro (AuNR) come NP plasmoniche, circondato da tessuto mammario normale senza AuNR. Tra le varie NP d'oro utilizzate nella PPTT, le AuNR sono state selezionate per questo studio a causa della loro forte risposta plasmonica nella regione NIR e del loro uso diffuso negli studi preclinici di PPTT, compresi quelli che coinvolgono pazienti canini e felini14. Il protocollo dimostra la preparazione di due tipi di fantoccio: uno con un tumore caratterizzato da distribuzione AuNR come visto con l'iniezione endovenosa e l'altro con un tumore che riflette la distribuzione AuNR ottenuta tramite iniezione IT. Seguendo il protocollo di preparazione del fantoccio, vengono descritte la configurazione sperimentale per l'irradiazione NIR e le fasi per condurre valutazioni fototermiche sui fantocci. Infine, viene fornita una guida passo passo per interpretare i risultati della distribuzione della temperatura ottenuti da queste valutazioni e per confrontare i dati sperimentali con i risultati della simulazione numerica. Questo confronto aiuta a convalidare un metodo numerico sviluppato, consentendo la messa a punto di parametri di trattamento ottimali su misura per un tumore.
Protocollo
NOTA: I fantocci sono stati preparati utilizzando agarosio e intralipidi sulla base di composizioni riportate in letteratura per ottenere le proprietà ottiche desiderate. Non è stato utilizzato alcun tessuto biologico reale proveniente da pazienti o cadaveri. Pertanto, la preparazione di questi fantasmi è libera da vincoli etici e non richiede il consenso informato.
1. Selezione o fabbricazione di uno stampo adatto
- . Selezione di uno stampo adatto
- Scegli uno stampo che corrisponda alla forma e alle dimensioni desiderate per i fantasmi. Per i fantocci cilindrici con una regione tumorale uniformemente distribuita con NP e circondata da tessuto normale, utilizzare una piastra di Petri di vetro e un piccolo becher come stampo8 (Figura 1A).
NOTA: Questi passaggi servono per preparare fantocci che imitano il tessuto tumorale in geometria cilindrica. Per altre forme o dimensioni, selezionare uno stampo appropriato. Se non è disponibile uno stampo adatto, fabbricarne uno utilizzando la stampa tridimensionale (3D), come descritto nel passaggio 1.2.
- Scegli uno stampo che corrisponda alla forma e alle dimensioni desiderate per i fantasmi. Per i fantocci cilindrici con una regione tumorale uniformemente distribuita con NP e circondata da tessuto normale, utilizzare una piastra di Petri di vetro e un piccolo becher come stampo8 (Figura 1A).
- Fabbricazione di stampi mediante stampa 3D
- Progetta un modello 3D utilizzando il software CAD (Computer-Aided Design) (ad esempio, SolidWorks, Autodesk Inventor o CATIA) in base alla forma e alle dimensioni desiderate. Per seguire questo protocollo, progettare un cilindro cavo (diametro interno 40 mm, spessore 2 mm e altezza 12 mm; vedere il file supplementare 1) e due stampi di mascheratura cilindrici solidi (dimensioni φ20 x 6 mm e φ14 x 3 mm), come mostrato nella Figura 1B.
- Per la progettazione/disegno di cilindri cavi, nel software CAD, creare due cerchi con diametri di 40 mm e 44 mm. Quindi, estrudere la geometria per 12 mm.
- Per gli stampi di mascheratura cilindrici solidi, creare cerchi con diametri di 20 mm e 14 mm, quindi estrudere rispettivamente per 6 mm e 3 mm (vedere File supplementare 2 e File supplementare 3). Disegna un rettangolo (lati 44 mm e 5 mm) su un lato del cilindro ed estrudilo per 2 mm.
- Converti i modelli 3D in formato Gcode utilizzando un software compatibile con la stampante 3D (ad esempio, Cura) per la stampa.
- Utilizzare questo Gcode per stampare gli stampi (ad esempio, in questo caso, utilizzando acido polilattico [PLA] φ1,75 mm, 1 kg di eSun) utilizzando una stampante 3D.
NOTA: Il rettangolo viene disegnato per sospendere gli stampi di mascheratura. Diversi stampi possono essere progettati e fabbricati per preparare fantasmi con altre forme desiderate.
- Progetta un modello 3D utilizzando il software CAD (Computer-Aided Design) (ad esempio, SolidWorks, Autodesk Inventor o CATIA) in base alla forma e alle dimensioni desiderate. Per seguire questo protocollo, progettare un cilindro cavo (diametro interno 40 mm, spessore 2 mm e altezza 12 mm; vedere il file supplementare 1) e due stampi di mascheratura cilindrici solidi (dimensioni φ20 x 6 mm e φ14 x 3 mm), come mostrato nella Figura 1B.
2. Preparazione di soluzioni fantasma che imitano il tessuto tumorale25
NOTA: In questo studio, i fantocci ottici a base di agarosio di geometria cilindrica che imitano il tessuto tumorale sono preparati per assomigliare a un tumore mammario sub-superficiale iniettato con AuNR, tramite iniezione IT o IV, come mostrato nella Figura 2. Il fantoccio IT ha due regioni: una regione tumorale centrale con AuNR e una regione di tessuto normale circostante. Il fantoccio IV ha tre regioni: una regione tumorale con AuNR alla periferia del tumore, una regione tumorale nuda centrale senza AuNR e una regione di tessuto normale circostante. Poiché le proprietà ottiche (μa e μs') differiscono per il tumore e il tessuto normale, vengono preparate soluzioni fantoccio separate per ogni regione con composizioni diverse e saranno discusse separatamente.
- Preparazione di una soluzione fantasma che imita il tessuto mammario normale (Soluzione 1)
NOTA: Questa soluzione verrà utilizzata sia per i fantocci IT che per quelli IV. Le fasi di preparazione della Soluzione 1 sono mostrate nella Figura 3A.- Calcolare il volume teorico della soluzione in base alle dimensioni dello stampo.
NOTA: In questo caso, per lo stampo cilindrico di φ40 x 12 mm, il volume calcolato è di 15 cm3 o 15 mL per phantom. Poiché è necessario preparare due di questi fantocci, il volume totale è di 15 ml x 2, ovvero 30 ml. Pertanto, preparare 35 mL di soluzione per tenere conto dell'evaporazione o della fuoriuscita durante la fase di preparazione del fantasma. - Calcolare la quantità (peso/concentrazione/volume) di tutti i costituenti fantasma - agarosio (come materiale di base) e IL (come costituente di diffusione) - da aggiungere alla soluzione da 35 mL.
- Aggiungere 0,35 g di agarosio per preparare 35 mL di soluzione corrispondenti alla concentrazione dell'1% p/v.
- Stimare la concentrazione di IL corrispondente alla μs' desiderata del tessuto mammario normale (cioè 10,1 cm-1 33) sulla base della concentrazione di IL rispetto ai dati di μs' disponibili in letteratura. Quindi, calcolare il volume di IL (20% di emulsione) da aggiungere alla soluzione fantasma utilizzando l'equazione (1):
 (1)
(1)
Dove C1 e V1 sono rispettivamente la concentrazione dello stock di reagenti (in questo caso il 20% di stock di IL) e il volume della soluzione stock di reagente da aggiungere (in questo caso deve essere calcolato). C2 è la concentrazione richiesta del reagente (da ottenere dalla letteratura) nella soluzione di lavoro finale e V2 è il volume totale della soluzione di lavoro finale (qui, 35 mL).
NOTA: Qui, per μs' di 10,1 cm-1, la concentrazione di IL stimata dalla letteratura riportata è dell'1,04%34,35. Utilizzando i passaggi precedenti, il volume di IL (20% di stock di IL) da aggiungere è di 1,82 ml.
- Pesare 0,35 g di agarosio e aggiungerlo a 33,18 ml di acqua deionizzata (DI) in un becher. Coprire il bicchiere con un foglio di alluminio per evitare perdite d'acqua.
- Scaldare il becher contenente la soluzione su una piastra calda a 120 °C mescolando fino a quando la soluzione diventa trasparente.
- Abbassare la temperatura della piastra riscaldante a 60 ºC. Dopo 15 minuti, aggiungere 1,82 ml di IL mescolando. Conservare la soluzione risultante, la Soluzione 1, sotto agitazione a 60 ºC fino all'uso (pronta per essere versata).
NOTA: La soluzione fantasma a 60 ºC deve essere conservata in condizioni di agitazione. In caso contrario, porta alla solidificazione della soluzione.
- Calcolare il volume teorico della soluzione in base alle dimensioni dello stampo.
- Preparazione di una soluzione di fantoccio tumorale incorporato in AuNR (Soluzione 2)
NOTA: Questa soluzione verrà utilizzata sia per i fantocci IT che per quelli IV. Le fasi di preparazione della Soluzione 2 sono mostrate nella Figura 3B.- Calcolare il volume della regione tumorale da riempire (φ20 x 6 mm).
NOTA: Il volume approssimativo per due di questi fantocci tumorali è di 3,8 mL. Quindi, il volume della soluzione da preparare sarebbe di 4,5 ml. - Calcolare la quantità di costituenti fantasma tumorali da aggiungere - agarosio, IL e AuNR - utilizzando passaggi simili a quelli menzionati nella Sezione 2.1.
- Aggiungere 45 mg per preparare 4,5 mL di soluzione corrispondenti alla concentrazione dell'1% p/v.
- IL:μs' del tumore al seno è di 4,6 cm-1 33 e per imitare lo stesso, la corrispondente concentrazione di IL richiesta è 0,472%34,35. Pertanto, aggiungere 106,2 μL di IL dal 20% di IL stock a 4,5 mL di soluzione di fantoccio tumorale.
- La concentrazione desiderata di AuNR nel fantoccio è di 25 μg/mL. Per ottenere lo stesso risultato, aggiungere 3,21 mL di soluzione di AuNRs (concentrazione madre: 35 μg/mL) alla soluzione del fantoccio tumorale.
- Aggiungere 45 mg di agarosio a 1,18 ml di acqua deionizzata in un becher e coprirlo con un foglio di alluminio.
- Posizionare il becher su una piastra calda e mescolare a 120 ºC fino a quando la soluzione diventa trasparente.
- Ridurre la temperatura della piastra riscaldante a 60 ºC e lasciare la soluzione per 15 minuti.
- Aggiungere 106,2 μL di IL e 3,21 mL di sospensione AuNR (35 μg/mL) in condizioni di agitazione. Conservare la soluzione risultante, la Soluzione 2, sotto agitazione a 60 ºC fino a quando non viene versata.
- Calcolare il volume della regione tumorale da riempire (φ20 x 6 mm).
- Preparazione di una soluzione fantasma tumorale nuda (senza AuNR) (Soluzione 3)
NOTA: Questa soluzione verrà utilizzata solo per il fantoccio IV. Le fasi di preparazione della Soluzione 2 sono mostrate nella Figura 3C.- Calcolare il volume teorico della sospensione da aggiungere per creare una regione tumorale nuda (~ φ20 x 6 mm).
NOTA: Il volume approssimativo per i fantocci tumorali è di 1,9 ml. Quindi, il volume della soluzione da preparare sarebbe di 2,5 ml. - Calcolare la quantità di costituenti fantasma tumorali da aggiungere - agarosio e IL - utilizzando passaggi simili come indicato nella Sezione 2.1.
- Aggiungere 25 mg di agarosio per preparare 2,5 mL di soluzione in modo da raggiungere una concentrazione dell'1% p/v.
- IL:μs' del tumore al seno è di 4,6 cm-1 33 e per imitare lo stesso, la corrispondente concentrazione di IL richiesta è 0,472%34,35. Aggiungere 59 μl di stock IL al 20%.
- Aggiungere 25 mg di agarosio a 2,44 ml di acqua deionizzata in un becher e coprirlo con un foglio di alluminio.
- Posizionare il becher su una piastra calda e mescolare a 120 ºC fino a quando la soluzione diventa trasparente.
- Ridurre la temperatura della piastra riscaldante a 60 ºC e lasciare la soluzione per 15 minuti.
- Aggiungere 59 μl di IL alla soluzione in condizioni di agitazione. Conservare la soluzione risultante, la Soluzione 3, in condizioni di agitazione a 60 ºC fino al versamento.
- Calcolare il volume teorico della sospensione da aggiungere per creare una regione tumorale nuda (~ φ20 x 6 mm).
3. Preparazione del fantasma che imita il tessuto tumorale 24,25,36
- Preparare gli stampi per la fase di versamento. Per questo, sigillare il fondo degli stampi cilindrici con parafilm e posizionare lo stampo di mascheratura (φ20 x 6 mm) al centro.
- Versare la soluzione 1 negli stampi cilindrici fino al segno superiore dello stampo di mascheratura e lasciarla solidificare (Figura 4A).
- Dopo la solidificazione, rimuovere lo stampo di mascheratura per creare una cavità per la regione tumorale (Figura 4B).
NOTA: Il protocollo sarà lo stesso sia per i fantocci IT che IV fino al passaggio 3.3. Il processo sarà discusso separatamente per i fantocci IT e IV dopo il passaggio 3.3. - IT fantasma 24,25,36
- Riempire la cavità con la Soluzione 2 e lasciarla solidificare (Figura 4C).
- Aggiungere la Soluzione 1 alla parte superiore del fantoccio e lasciarlo solidificare completamente (Figura 4D).
- IV fantasma24,25
- Inserire uno stampo per mascheratura più piccolo (φ14 x 3 mm) e riempire la cavità attorno ad esso con la Soluzione 2 (Figura 4E).
- Dopo la solidificazione, rimuovere lo stampo più piccolo e riempire la cavità rimanente con la soluzione 3 (Figura 4F).
- Aggiungere la soluzione 1 verso l'alto e consentire la completa solidificazione (Figura 4G).
4. Inserimento delle termocoppie all'interno del fantoccio 24,25,36
NOTA: Per monitorare la distribuzione spaziale della temperatura, le termocoppie di tipo K vengono inserite all'interno del fantoccio in varie posizioni radiali (r) e assiali (z), come illustrato nella Figura 2. Per l'inserimento della termocoppia in posizioni precise, i capillari in vetro vengono utilizzati come guide per garantire la precisione. Le posizioni della termocoppia sono indicate come (r, z), dove il punto medio sulla superficie superiore del tumore alla profondità z = 3 mm funge da punto di riferimento sia per i fantocci IT che per quelli IV ed è designato come (0, 3), come mostrato nella Figura 2A, B. Quando si selezionano le posizioni radiali e assiali per quantificare il danno termico nella regione tumorale, le posizioni alla periferia del tumore (sia radiali che assiali) sono critiche. Il raggiungimento delle temperature richieste in questi punti periferici durante l'irradiazione NIR garantisce la completa ablazione del tumore. Pertanto, le termocoppie sono posizionate nei punti estremi radiali (del tumore) a z = 3 e 9 mm, cioè (10, 3) e (10, 9), e una termocoppia è posizionata all'interfaccia tumore-tessuto a z = 9 mm (posizione assiale periferica), cioè (0, 9) come illustrato nella Figura 2A, B. Inoltre, per valutare la distribuzione assiale della temperatura, viene inserita una termocoppia tra le posizioni (0, 3) e (0, 9), designata come (0, 6). Infine, per valutare l'aumento di temperatura nella regione del tessuto sano circostante, viene inserita una termocoppia a (15, 3).
- Tagliare i capillari di vetro a lunghezze adeguate in modo che raggiungano le posizioni radiali e assiali desiderate all'interno del fantoccio.
- Inserire le termocoppie all'interno di questi capillari in vetro e forare una per una nelle posizioni radiali e assiali specificate del fantoccio.
- Una volta posizionate tutte le termocoppie, posizionare con cura il fantoccio in una piastra di Petri di vetro per la successiva irradiazione NIR, come mostrato nella Figura 5A.
5. Esposizione all'irradiazione NIR e misurazione delle temperature fototermiche risultanti36
- Posizionare la piastra di Petri in vetro contenente il fantoccio (inserita con termocoppie) in modo che la regione centrale della superficie superiore del fantoccio sia perpendicolare alla punta della fibra ottica della sorgente di luce NIR, come illustrato nella Figura 5A.
NOTA: Il diametro del raggio sulla superficie fantasma può essere regolato modificando la distanza tra la superficie e la punta della fibra ottica. Qui, viene mantenuta una distanza di 9 mm per ottenere un diametro del fascio di 20 mm, che copre la regione tumorale centrale. - Collegare il sistema di acquisizione dati (DAQ) al computer e aprire il software LabVIEW.
- Accendere contemporaneamente la sorgente luminosa NIR (Figura 5B) e il pulsante di riproduzione nel software per registrare i dati di temperatura all'inizio dell'irradiazione.
- Irradiare il fantasma per 20 minuti, quindi spegnere la sorgente di luce NIR e interrompere la registrazione.
- Traccia i dati della temperatura registrata rispetto al tempo.
6. Confronto della temperatura con i risultati della simulazione24,25
NOTA: Gli esperimenti vengono generalmente ripetuti e le temperature vengono registrate a intervalli di tempo prestabiliti in tutte le posizioni delle termocoppie. Per la convalida, vengono eseguiti i passaggi seguenti:
- Calcolare la media e la deviazione standard delle temperature sperimentali in tutte le posizioni della termocoppia (r, z).
- Calcola numericamente le temperature nelle posizioni delle termocoppie considerate.
- Grafico della temperatura media ottenuta dagli esperimenti e della temperatura ottenuta mediante simulazione in tutte le posizioni della termocoppia rispetto al tempo, mostrata nella Figura 6.
- Calcolare l'errore quadratico medio (RMSE) e l'errore assoluto medio (MAE) per tutte le posizioni della termocoppia per quantificare la differenza di temperatura per valutare la convalida, come mostrato nella Tabella 1.
NOTA: MAE e RMSE vengono calcolati utilizzando rispettivamente le equazioni 2 e 3.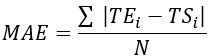 (2)
(2) (3)
(3)
Dove TE, TS e N sono la temperatura ottenuta sperimentalmente, la temperatura calcolata numericamente e il numero di punti dati (qui, le temperature vengono registrate ogni secondo per 20 minuti; quindi, = 1.200), rispettivamente. i rappresenta gli istanti di tempo.
Risultati
La Figura 6 mostra le temperature medie temporali ottenute durante gli esperimenti con un fantoccio di tessuto tumorale incorporato in AuNR in tutte le posizioni della termocoppia, come mostrato nella Figura 2, rispetto alle temperature ottenute durante le simulazioni nelle corrispondenti posizioni della termocoppia. Qui, gli esperimenti sono stati eseguiti 4 volte per ogni distribuzione, cioè d...
Discussione
Questo articolo presenta il protocollo per la preparazione di fantocci ottici a base di tessuto tumorale a base di agarosio. I fantocci sono progettati in modo da imitare le proprietà ottiche del tumore e dei tessuti normali per il loro utilizzo negli studi per PPTT. In questo studio, viene evidenziata l'applicazione di questi fantasmi per la convalida di metodi numerici durante la PPTT. Il passaggio più critico di questo protocollo consiste nel mantenere la temperatura delle soluzioni...
Divulgazioni
Gli autori non hanno interessi concorrenti da rivelare.
Riconoscimenti
Questo studio è stato condotto senza alcun sostegno finanziario da parte di alcun ente pubblico, commerciale o senza scopo di lucro. Gli autori ringraziano il CSIR-Central Scientific Instruments Organisation, Chandigarh, India, per l'infrastruttura e il supporto.
Materiali
| Name | Company | Catalog Number | Comments |
| Agarose | Sigma-Aldrich | 9012-36-6 | Base matrix for phantoms |
| Deionized (DI) water (18.2 MΩ) | NA | NA | Solvent for the preparation of phantom solutions |
| Gold nanorods (AuNRs) | Nanopartz | A12-10-808 | Plasmonic nanoparticles |
| Intralipid (20% emulsion stock) | Sigma-Aldrich | 68890-65-3 | Scattering agent of phantoms |
| Parafilm | Parafilm M | 380020 | To seal the bottom of cylindrical mold |
| Polylactic acid filament | eSun | NA | Material for molds (1.75 mm dia wire) |
| Name of Equipment | Company | Catalog Number | Comments/Description |
| 3D Printer | Creality | Ender-3 | For printing molds |
| Data acquisition (DAQ) system | National Instruments | cDAQ-9171 | For recording temperatures |
| DI water unit | Merck Millipore | Direct-Q3 | For DI water |
| Hot plate with magnetic stirrer | IKA | C-MAG HS 4 | For phantom solutions preparation |
| NIR light source | NA (In-house developed) | NA | For NIR irradiation of phantoms, (800/50 nm; Center wavelength: 800 nm, Bandwidth: 50 nm) |
| Optical Fiber (1/2" × 12") | Edmund Optics | 38-659 | For NIR irradiation of phantoms |
| Type K thermocouples | RS Components | RS Pro 397-1589 | For temperature monitoring at various phantom locations during NIR irradiation |
| Weighing Balance | Wensar | PGB 200 | For weighing agarose |
| Name of Software | Company | Catalog Number | Comments/Description |
| Autodesk Inventor 2021 | Autodesk | NA | For mechanical designing of molds |
| Cura 5.7 | Ultimaker | NA | For converting mechanical design to Gcode for 3D printing |
| Matlab R2024b | MathWorks | NA | For numerical simulations and temperature data plots |
| Name of Labwares used | Company | Catalog Number | Comments/Description |
| Beakers (50 mL) | Borosil | 1000D12 | For phantom solution preparations |
| Beakers (10 mL) | Borosil | 1000006 | For phantom solution preparations |
| Pipette (100-1000 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 063 | For adding constituents into the phantom solution |
| Pipette (10-100 µL) | Eppendorf Research plus, 1-channel, variable | 3123 000 047 | For adding constituents into the phantom solution |
| Spatula | Borosil | LASC8888M06 | For weighing agarose and demolding the phantoms from the molds |
| Tips (100-1000 µL) | Tarsons | 521016 | For adding constituents into the phantom solution |
| Tips (10-100 µL) | Tarsons | 521010Y | For adding constituents into the phantom solution |
Riferimenti
- Riley, R. S., Day, E. S. Gold nanoparticle-mediated photothermal therapy: applications and opportunities for multimodal cancer treatment. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (4), e1449 (2017).
- Webb, J. A., Bardhan, R. Emerging advances in nanomedicine with engineered gold nanostructures. Nanoscale. 6 (5), 2502-2530 (2014).
- Abadeer, N. S., Murphy, C. J. Recent progress in cancer thermal therapy using gold nanoparticles. J Phys Chem C. 120 (9), 4691-4716 (2016).
- Murphy, C. J., et al. Virus-sized gold nanorods: Plasmonic particles for biology. Acc Chem Res. 52 (8), 2124-2135 (2019).
- Overchuk, M., Weersink, R. A., Wilson, B. C., Zheng, G. Photodynamic and photothermal therapies: Synergy opportunities for nanomedicine. ACS Nano. 17 (9), 7979-8003 (2023).
- Goldberg, S. N., Gazelle, G. S., Mueller, P. R. Thermal ablation therapy for focal malignancy. Am J Roentgenol. 174 (2), 323-331 (2000).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Role of optical coefficients and healthy tissue-sparing characteristics in gold nanorod-assisted thermal therapy. Int J Hyperth. 29 (1), 87-97 (2013).
- Khurana, D., Vikas, A. K., Shaw, S., Soni, Polydopamine coated gold nano blackbodies for tumor-selective spatial thermal damage during plasmonic photothermal cancer therapy. IEEE Trans Nanobiosci. 21 (4), 482-489 (2021).
- Jung, H. S., Verwilst, P., Sharma, A., Shin, J., Sessler, J. L., Kim, J. S. Organic molecule-based photothermal agents: an expanding photothermal therapy universe. Chem Soc Rev. 47 (7), 2280-2297 (2018).
- Ge, R. L., Yan, P. N., Liu, Y., Li, Z. S., Shen, S. Q., Yu, Y. Recent advances and clinical potential of near infrared photothermal conversion materials for photothermal hepatocellular carcinoma therapy. Adv Func Mater. 33 (29), 2301138 (2023).
- Shabani, L., et al. An investigation into green synthesis of Ru template gold nanoparticles and the in vitro photothermal effect on the MCF-7 human breast cancer cell line. Appl Phys A. 129 (8), 564 (2023).
- Mosleh-Shirazi, S., et al. Investigation through the anticancer properties of green synthesized spinel ferrite nanoparticles in present and absent of laser photothermal effect. Ceram Int. 49 (7), 11293-11301 (2023).
- Amani, A. M., et al. Innovation applications of MXenes in biomedicine. Mater Today Commun. 40, 109929 (2024).
- Ali, M. R. K., Wu, Y., El-Sayed, M. A. Gold-nanoparticle-assisted plasmonic photothermal therapy advances toward clinical application. J Phys Chem C. 123 (25), 15375-15393 (2019).
- Lahonian, M., Golneshan, A. A. Numerical study of temperature distribution in a spherical tissue in magnetic fluid hyperthermia using Lattice Boltzmann method. IEEE Trans NanoBiosci. 10 (4), 262-268 (2011).
- Shaw, A. K., Soni, S. Role of periodic irradiation and incident beam radius for plasmonic photothermal therapy of subsurface tumors. J Therm Biol. 121, 103859 (2024).
- Pogue, B. W., Patterson, M. S. Review of tissue simulating phantoms for optical spectroscopy, imaging and dosimetry. J Biomed Opt. 11 (4), 041102 (2006).
- Mustari, A., et al. Agarose-based tissue mimicking optical phantoms for diffuse reflectance spectroscopy. J Vis Exp. (138), e57578 (2018).
- Dabbagh, A., Abdullah, B. J. J., Ramasindarum, C., Abu Kasim, N. H. Tissue-mimicking gel phantoms for thermal therapy studies. Ultrason imaging. 36 (4), 291-316 (2014).
- Khurana, D., et al. Experimental investigation of photothermal conversion and thermal conductivity of broadband absorbing gold nanoblackbodies and graphene oxide nanoparticles for plasmonic photothermal cancer therapy. Int Commun Heat Mass Transf. 156, 107597 (2024).
- Ortega-Palacios, R., Leija, L., Vera, A., Cepeda, M. F. J. Measurement of breast-tumor phantom dielectric properties for microwave breast cancer treatment evaluation. , 216-219 (2010).
- Wagnières, G., et al. An optical phantom with tissue-like properties in the visible for use in PDT and fluorescence spectroscopy. Phys Med Biol. 42 (7), 1415 (1997).
- Didychuk, C. L., Ephrat, P., Chamson-Reig, A., Jacques, S. L., Carson, J. J. L. Depth of photothermal conversion of gold nanorods embedded in a tissue-like phantom. Nanotechnology. 20 (19), 195102 (2009).
- Shaw, A. K., Khurana, D., Soni, S. Thermal damage analysis of sub-surface soft tissue sarcoma for Indocyanine Green mediated photothermal cancer therapy. Therm Sci Eng Prog. 46, 102168 (2023).
- Shaw, A. K., Khurana, D., Soni, S. Assessment of thermal damage for plasmonic photothermal therapy of subsurface tumors. Phys Eng Sci Med. 47 (3), 1107-1121 (2024).
- Khurana, D., Soni, S. Tissue-mimicking phantoms for photothermal performance evaluations. Recent Trends in Cancer Therapeutics: Plasmonic Photothermal-Based Multimodal Cancer Therapy. , 109-136 (2024).
- Eranki, A., et al. Tissue-mimicking thermochromic phantom for characterization of HIFU devices and applications. Int J Hyperth. 36 (1), 517-528 (2019).
- McLaughlan, J. R. Controllable nucleation of cavitation from plasmonic gold nanoparticles for enhancing high intensity focused ultrasound applications. J Vis Exp. (140), e58045 (2018).
- Soni, S., Tyagi, H., Taylor, R. A., Kumar, A. Experimental and numerical investigation of heat confinement during nanoparticle-assisted thermal therapy. Int Commun Heat Mass Transf. 69, 11-17 (2015).
- Ntombela, L., Adeleye, B., Chetty, N. Low-cost fabrication of optical tissue phantoms for use in biomedical imaging. Heliyon. 6 (3), e03602 (2020).
- Lai, P., Xu, X., Wang, L. V. Dependence of optical scattering from Intralipid in gelatin-gel based tissue-mimicking phantoms on mixing temperature and time. J Biomed Opt. 19 (3), 035002 (2014).
- Aernouts, B., Van Beers, R., Watté, R., Lammertyn, J., Saeys, W. Dependent scattering in Intralipid®phantoms in the 600-1850 nm range. Opt Express. 22 (5), 6086-6098 (2014).
- Tromberg, B. J., et al. Non-invasive in vivo characterization of breast tumors using photon migration spectroscopy. Neoplasia. 2 (1-2), 26-40 (2000).
- Kanick, S. C., et al. Scattering phase function spectrum makes reflectance spectrum measured from Intralipid phantoms and tissue sensitive to the device detection geometry. Biomed Opt Express. 3 (5), 1086-1100 (2012).
- Yuan, B., Chen, N., Zhu, Q. Emission and absorption properties of indocyanine green in Intralipid solution. J Biomed Opt. 9 (3), 497-503 (2004).
- Khurana, D., et al. Gold nanoblackbodies-based multifunctional nanocomposite for multimodal cancer therapy. Int J Pharm. 642, 123112 (2023).
- Brough, D., Ramos, J., Delpech, B., Jouhara, H. Development and validation of a TRNSYS type to simulate heat pipe heat exchangers in transient applications of waste heat recovery. Int J Thermofluid. 9, 100056 (2021).
- Vardaki, M. Z., Kourkoumelis, N. Tissue phantoms for biomedical applications in Raman spectroscopy: A review. Biomed Eng Computational Biol. 11, 1179597220948100 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon