Method Article
Cartographie cardiaque en temps réel avec un système d’imagerie électrocardiographique non invasif sans image
Dans cet article
Résumé
Cette étude présente une nouvelle approche pour la cartographie cardiaque en temps réel à l’aide d’un système d’imagerie électrocardiographique non invasif et sans image. Ce système permet l’acquisition de cartes cardiaques électrophysiologiques sans nécessiter de tomodensitométrie préopératoire ou d’imagerie par résonance magnétique, ce qui permet un guidage efficace pour les procédures cardiaques telles que les implants d’ablation et de thérapie de resynchronisation cardiaque.
Résumé
Une cartographie cardiaque rapide, sûre et efficace est essentielle pour la prise en charge des arythmies complexes, mais les méthodes actuelles sont confrontées à des limites importantes. L’électrocardiogramme (ECG) à 12 dérivations, bien qu’essentiel pour le diagnostic initial, n’a pas la résolution spatiale et la profondeur nécessaires pour guider des procédures avancées telles que l’ablation par cathéter ou l’implantation d’un dispositif de thérapie de resynchronisation cardiaque. D’autre part, les techniques de cartographie invasives fournissent une activité électrique détaillée, mais nécessitent plusieurs placements de cathéters, ce qui augmente les risques et la complexité de la procédure. Ces méthodes prennent du temps, sont coûteuses et offrent une évaluation limitée en temps réel, en particulier dans les arythmies dynamiques comme la fibrillation auriculaire (FA), l’arythmie instable et la thérapie de resynchronisation cardiaque (CRT).
Cette étude présente un système d’imagerie électrocardiographique non invasif et sans image (Imageless-ECGI) conçu pour compléter les méthodes traditionnelles en fournissant des cartes cardiaques en temps réel, battement par battement. Sans qu’il soit nécessaire de recourir à l’imagerie préopératoire, ce système capture l’activité électrique à haute résolution dans l’ensemble du cœur, offrant ainsi une alternative plus sûre et plus efficace à la cartographie invasive. En combinant l’immédiateté des enregistrements de surface avec la précision spatiale des modèles informatiques modernes, le système Imageless-ECGI comble le fossé entre l’ECG traditionnel et la cartographie invasive, transformant potentiellement le flux de travail dans les laboratoires d’électrophysiologie.
Introduction
La nécessité d’une cartographie électrophysiologique non invasive est devenue de plus en plus importante pour évaluer avec précision l’activité cardiaque, en particulier chez les patients subissant des procédures d’arythmie complexes, telles que l’ablation de la fibrillation auriculaire (FA) et de la tachycardie ventriculaire (VT), ou lors de l’implantation de stimulateurs cardiaques et de dispositifs de thérapie de resynchronisation cardiaque (CRT). Actuellement, la cartographie électroanatomique tridimensionnelle (3D) reste la référence pour guider les opérateurs lors de l’ablation par cathéter1 en fournissant des cartes fonctionnelles complètes pour caractériser les arythmies 2,3. Cependant, l’EAM n’est pas optimale pour capturer les modèles spatio-temporels dynamiques de la FA, des arythmies non soutenues, et la procédure longue et invasive requise pour la cartographie la rend peu pratique pour l’utilisation dans les procédures CRT.
Les méthodes non invasives traditionnelles, telles que l’électrocardiogramme (ECG) à 12 dérivations, bien que très précises pour identifier des foyers d’arythmie spécifiques (par exemple, la voie d’éjection ou la VV cuspidale), offrent un aperçu limité du comportement électrique global du cœur. Cette limitation est particulièrement évidente lorsqu’une cartographie en temps réel est nécessaire pour guider les interventions dans les arythmies dynamiques et complexes, où la localisation précise des zones arythmogènes est cruciale pour des résultats réussis. La cartographie non invasive pourrait jouer un rôle important dans l’amélioration de la planification préopératoire et la fourniture d’un retour d’information en temps réel pendant les interventions électrophysiologiques.
Pour soutenir les électrophysiologistes sur le plan préprocédural, les progrès des modalités d’imagerie cardiaque, telles que la tomodensitométrie (TDM) et l’imagerie par résonance magnétique (IRM), se sont avérés efficaces pour fournir des informations structurelles détaillées, y compris l’épaisseur de la paroi4 et la fibrose myocardique 5,6,7,8 . Cependant, ces modalités se concentrent sur les caractéristiques anatomiques et structurelles, laissant un vide dans la cartographie électrique fonctionnelle. De plus, l’obtention d’images cardiaques de haute qualité nécessite des protocoles de balayage spécialisés, du personnel formé et des méthodes de post-traitement complexes telles que la segmentation avancée et la caractérisation précise des tissus, en particulier pour détecter la fibrose cardiaque.
Les systèmes classiques d’imagerie électrocardiographique (ECGI) sont apparus comme une option non invasive, offrant des résultats prometteurs en reconstruisant l’activité électrique cardiaque basée sur les potentiels de surface corporelle (BSP)9,10,11,12. Malgré leur potentiel, les systèmes ECGI sont confrontés à des limites notables13,14. Tout d’abord, ils ont besoin d’une tomodensitométrie préopératoire pour cartographier les positions des électrodes sur les géométries cardiaques, ce qui rend leur utilisation clinique moins réalisable. Deuxièmement, les méthodes traditionnelles de régularisation utilisées pour résoudre le problème inverse de la cartographie cardiaque introduisent souvent des modèles de propagation non physiologiques, ce qui limite leur précision en milieu clinique.
L’objectif de cette étude était de décrire les caractéristiques et les procédures d’un nouveau système ECGI non invasif capable de cartographier en temps réel sans avoir besoin d’une tomodensitométrie ou d’une IRM15, connu sous le nom d’ECGI sans image. Nous avons exploré les avancées de l’ECGI sans image et présenté des applications cliniques potentielles pour la cartographie électrophysiologique, surmontant les limites des techniques actuelles telles que l’EAM, l’ECG à 12 dérivations et l’ECGI classique dans la gestion des procédures d’arythmie complexes. Cette approche permet de créer des cartes cardiaques dans les minutes qui suivent l’arrivée du patient, ce qui simplifie le flux de travail et réduit le temps de préparation. De plus, le système utilise des algorithmes avancés de traitement du signal pour générer des modèles de propagation physiologique précis, améliorant ainsi la localisation de l’arythmie et les résultats de la procédure.
Protocole
La méthodologie a été validée prospectivement dans une étude clinique observationnelle multicentrique. L’étude a été menée conformément à la Déclaration d’Helsinki et aux normes éthiques des institutions concernées. Le protocole de l’étude, SAVE-COR (NCT05772182), a été approuvé par les comités d’éthique de l’Hospital Universitario Gregorio Marañón, de l’Hospital Clínic de Barcelona et de l’Hospital Universitari i Politècnic La Fe, et le consentement éclairé de tous les patients a été obtenu.
REMARQUE : Les descriptions détaillées des critères d’inclusion et d’exclusion sont les suivantes :
Critères d’inclusion : (i) Indication pour une étude électroanatomique invasive et/ou l’implantation de dispositifs de stimulation intracavitaire. (ii) Avoir obtenu et signé le consentement éclairé pour l’inclusion dans l’étude.
Critères d’exclusion : (i) <18 ans. (ii) Incapacité de subir un cathétérisme endocardique (par exemple, femmes enceintes ou allaitantes). (iii) Incapacité physique ou mentale de comprendre et d’accepter le consentement éclairé. (iv) Incapacité de se tenir debout pour permettre la reconstruction 3D du torse requise pour le système ECGI. (v) Patients atteints de pathologies congénitales.
1. Préparation préopératoire du système ECGI sans image en temps réel
- Vérifiez que l’amplificateur de biopotentiel (Figure 1A) est complètement chargé et placez-le à l’extrémité de la table de la salle d’électrophysiologie (EP), près de l’endroit où les pieds du patient seraient positionnés.
REMARQUE : L’amplificateur de biopotentiel (voir Tableau des matériaux) est un dispositif isolé à 128 canaux responsable de l’amplification et de la numérisation des signaux électriques collectés par les électrodes. - Vérifiez que les câbles droit et gauche ne sont pas endommagés en inspectant les connecteurs de l’amplificateur à une extrémité et les prises noires où le gilet du capteur est connecté à l’autre extrémité (Figure 1B).
REMARQUE : Les câbles droit et gauche (voir tableau des matériaux) ont une longueur de 1,5 m et transmettent les signaux électriques du gilet de capteur à l’amplificateur de biopotentiel. - Branchez les câbles de connexion droit et gauche dans l’amplificateur de biopotentiel (Figure 1C). Chaque câble est associé à une prise qui se distingue par un numéro, qui est le même pour le câble et l’amplificateur.
- Vérifiez que la plate-forme du scanner 3D est complètement chargée et ouvrez l’application de numérisation 3D.
REMARQUE : L’application de numérisation 3D est un logiciel fonctionnant sur une plate-forme de scanner 3D (voir Tableau des matériaux) qui utilise une caméra infrarouge à lumière structurelle pour générer une reconstruction de modèle 3D du torse du patient. L’application détecte également automatiquement l’emplacement des codes QR (Quick Response Response) des électrodes. - Vérifiez que l’interface utilisateur du logiciel ECGI sans image est installée sur le poste de travail PC (voir le tableau des matériaux) et qu’elle est complètement chargée.
REMARQUE : Le logiciel ECGI sans image (voir la table des matériaux) intègre des algorithmes de traitement du signal pour estimer la géométrie cardiaque et fournir des informations précieuses pour diagnostiquer et traiter les arythmies cardiaques ou guider les procédures d’implantation de dispositifs cardiaques 16,17,18,19. L’interface utilisateur du système permet aux utilisateurs de visualiser, sélectionner et analyser les signaux électrocardiographiques, créant ainsi des cartes interactives de l’activité épicardique qui permettent une évaluation non invasive de la fonction cardiaque. - Connectez l’amplificateur de biopotentiel au poste de travail à l’aide d’un câble Ethernet isolé (voir tableau des matériaux). Insérez une extrémité dans le port Ethernet de l’amplificateur et l’autre dans le poste de travail.
REMARQUE : Le câble Ethernet isolé transmet les signaux électriques de l’amplificateur de biopotentiel au poste de travail. - Sélectionnez un gilet à capteur (voir le tableau des matériaux), inspectez l’emballage et vérifiez que l’étanchéité n’est pas endommagée. N’utilisez pas le gilet capteur si l’emballage est ouvert ou endommagé.
- Ouvrez l’emballage du gilet à capteur et vérifiez que les quatre composants du gilet se trouvent à l’intérieur. Choisissez un autre emballage de gilet de capteur si l’un des composants est manquant.
REMARQUE : Le gilet capteur est un réseau d’électrodes haute densité avec 128 électrodes en argent qui permettent de cartographier simultanément l’activité électrique de surface sur l’ensemble du torse du patient. Le gilet est radiotransparent et contient quatre patchs qui recouvrent les surfaces avant et arrière gauche et droite du torse. Chaque électrode comporte un code QR à l’avant, permettant l’identification automatique de la position de l’électrode.
2. Préparation du patient avant l’intervention
- Admettre le patient à l’hôpital le jour même de l’étude électrophysiologique ou de l’implantation du dispositif.
- Placez le patient debout ou assis sur une chaise ou sur la table d’électrothérapie et assurez-vous que toute la zone du torse est exempte de vêtements.
- Effectuez une inspection visuelle de la peau du patient pour vérifier s’il a des équerres, des plaies ou toute autre affection cutanée afin d’éviter d’attacher des électrodes à ces zones.
- En option, toilettez le torse des personnes ayant des poils importants afin de minimiser les artefacts de bruit et de réduire l’inconfort lors du retrait du gilet à capteur.
- Positionnez correctement les quatre parties du gilet capteur (avant droit, avant gauche, arrière droit et arrière gauche) sur le torse du patient (Figure 2A) et ajustez le gilet à la taille du patient en repliant les connexions entre les électrodes si nécessaire.
- En option, pour les procédures CRT, évitez de placer des électrodes dans la zone où l’implant cardiaque sera inséré, souvent situé sur la partie supérieure gauche du thorax.
REMARQUE : Les connexions avec des tirets imprimés peuvent être rompues en toute sécurité si nécessaire, car aucune piste active n’est présente dans ces zones. - Placez les électrodes de la jambe droite (RLD) et de référence (REF) du gilet de capteur sur les jambes droite et gauche, respectivement, aussi loin que possible des autres électrodes du gilet.
- Assurez-vous d’un éclairage adéquat de la pièce et assurez-vous qu’aucun objet ne se trouve à moins de 1,5 m de diamètre autour du torse du patient, car ils pourraient interférer avec ou déformer la reconstruction 3D du torse.
- Positionnez le patient avec ses bras au-dessus de la tête pour éviter toute interférence avec la reconstruction 3D du torse, comme le montre la figure 2C.
- Obtenir la reconstruction 3D du torse du patient.
- Saisissez la plate-forme de scanner 3D et ouvrez l’application de numérisation 3D.
- Balayez le code QR sur le côté latéral du gilet avant droit pour valider le gilet capteur (Figure 2B), en vous assurant qu’il est à usage unique et qu’il n’est pas expiré.
REMARQUE : Une fois le QR code détecté, l’application de scan 3D permet l’acquisition de la reconstruction 3D du torse. - Positionnez la plate-forme du scanner 3D au niveau du torse devant le patient, tenez-la fermement à deux mains et effectuez une rotation à 360° autour du patient pour acquérir la reconstruction 3D du torse (Figure 2C).
REMARQUE : Au fur et à mesure que le balayage progresse, la caméra à lumière structurée infrarouge de la plate-forme du scanner 3D crée un maillage fermé 3D de couleur grise du torse, complétant le processus lors d’une rotation complète. En règle générale, le processus de reconstruction 3D du torse prend 1 à 2 minutes. - Effectuez une inspection visuelle de la reconstruction 3D du torse pour vous assurer que tout le torse est recouvert d’une ombre grise et qu’aucun trou n’est présent dans le treillis reconstruit.
- Enregistrez la reconstruction 3D du torse dans l’application une fois le scan terminé.
- Demandez au patient de s’allonger sur la table de la salle d’électrothérapie.
- Connectez les quatre parties du gilet de capteur aux câbles de connexion droit et gauche correspondants (Figure 1D). Fixez les connecteurs de gilet avant droit et arrière droit à la prise de câble droite et les connecteurs de gilet avant gauche et arrière gauche à la prise de câble gauche.
- Allumez l’amplificateur de biopotentiel pour permettre au logiciel ECGI sans image de recevoir des signaux électrophysiologiques en temps réel.
3. Estimation de la géométrie cardiaque du patient
- Connectez-vous en tant qu’utilisateur au logiciel ECGI sans image en temps réel installé sur le poste de travail (Figure 3). Fournissez un nom d’utilisateur et un mot de passe.
- Cliquez sur le bouton Ajouter un patient et entrez les détails d’identification pour enregistrer un nouveau patient dans la fenêtre d’accueil de l’interface utilisateur (Figure 4). Ensuite, créez une nouvelle séance associée au patient, en fournissant le type d’intervention et les données de base suivantes : sexe, âge, taille et poids.
REMARQUE : Un seul patient peut avoir plusieurs séances. Par exemple, dans les études cliniques avec suivis, si un patient subit un deuxième enregistrement ECGI, une nouvelle séance peut être créée sans ajouter à nouveau le patient. - Connectez la plate-forme du scanner 3D au poste de travail à l’aide d’un câble USB-C.
- Cliquez sur le bouton Charger le balayage du torse et téléchargez la reconstruction 3D du torse dans la fenêtre Géométrie du torse (Figure 5).
REMARQUE : Le logiciel détectera automatiquement la localisation des 128 électrodes à partir du gilet du capteur. Chaque composant du gilet a différentes couleurs d’électrodes : avant droit = rouge, avant gauche = bleu, arrière droit = rose et arrière gauche = orange. - En option, ajustez manuellement les positions des électrodes en cliquant sur chaque électrode et en la repositionnant sur la surface du torse.
- Sélectionnez le bouton Calculer la géométrie et l’option Estimer la géométrie cardiaque pour estimer la géométrie cardiaque du patient dans la fenêtre Géométrie du torse (Figure 5).
REMARQUE : Le logiciel estime la géométrie cardiaque à l’aide d’une méthodologie basée sur un modèle statistique de forme (SSM) (Figure 6A), comme détaillé dans la littérature précédente20. L’algorithme traite d’abord la reconstruction 3D du torse du patient et les données basales (sexe, âge, taille et poids) en entrée. Par la suite, le SSM, intégrant des géométries de torse et de cœur basées sur l’IRM, s’ajuste de manière itérative pour s’adapter au maillage 3D du torse du patient. Cela détermine la géométrie, la position et l’orientation optimales du cœur dans le corps du patient (Figure 6B). Ce processus élimine le besoin d’une tomodensitométrie ou d’une IRM pré-procédurale, ce qui permet de générer la première carte cardiaque non invasive en 10 à 15 minutes. Il est important de noter qu’un message contextuel informe l’utilisateur si la reconstruction 3D du torse n’a pas une résolution suffisante ou contient des artefacts qui pourraient affecter la précision des résultats de l’estimation.
4. Cartographie ECGI non invasive sans image pour guider l’implant de stimulation du système de conduction pour la thérapie de resynchronisation cardiaque (CSP-CRT) en temps réel (cas 4)
- Allez dans la fenêtre de l’amplificateur et cliquez sur le bouton Connecter l’amplificateur pour commencer à acquérir des signaux électrophysiologiques en temps réel (Figure 7). Cliquez sur les différents fils pour visualiser les signaux sur l’écran de l’amplificateur.
- Accédez à la fenêtre en temps réel (Figure 8) pour obtenir une cartographie cardiaque non invasive en temps réel.
REMARQUE : La fenêtre en temps réel permet de visualiser les signaux en temps réel, exclut les signaux bruyants, crée des faiseurs temporels, délimite automatiquement les segments d’analyse (par exemple, l’onde P et le complexe QRS), et calcule et affiche des cartes ECGI non invasives. - Excluez les signaux bruyants en cliquant sur le bouton d’affichage à 128 dérivations , en sélectionnant l’option Utilisateur uniquement comme mode de sélection des dérivations bruyantes et en double-cliquant sur les signaux bruyants pour les exclure avant de générer la carte ECGI. Cela améliore la qualité du calcul de la cartographie, car l’ECGI est un problème mal posé21.
REMARQUE : Les fils du gilet du capteur affichés en vert indiquent des signaux de bonne qualité et sont utilisés pour le calcul du problème inverse, tandis que les fils indiqués en rouge sont bruyants et sont exclus de l’analyse (Figure 8A). - Cliquez sur le bouton d’affichage à 12 dérivations pour visualiser une estimation de l’ECG à 12 dérivations en temps réel (Figure 8B).
- Assurez-vous que le bouton RT ON est actif pour mettre à jour automatiquement les signaux dans la section d’analyse du signal (Figure 8C). Cette option déclenche et définit automatiquement le début et le décalage du complexe QRS à analyser.
REMARQUE : Le bouton RT peut être commuté en mode RT OFF pour geler les signaux, ce qui permet à l’utilisateur de délimiter manuellement le complexe QRS lorsque la délimitation automatique du système n’est pas optimale. - Configurez l’analyse de la cartographie d’activation ECGI en cliquant sur le bouton Options pour générer automatiquement une carte du rythme basal optimale pour la procédure CSP-CRT :
- Sélectionnez l’option Analyser le ventricule pour cartographier uniquement les ventricules.
- Sélectionnez l’option d’analyse 17 basée sur les ondelettes pour l’algorithme des temps d’activation.
- Sélectionnez l’option Battement moyen pour la fonction Type de mappage afin de calculer la vague moyenne des 10 derniers complexes QRS.
- Conservez les paramètres par défaut pour les fonctions Correction de décalage, Nombre de temps et Option de synchronisation .
- Sélectionnez l’option deux panneaux dans la section de visualisation des cartes et assurez-vous que la carte de gauche est définie sur le mode de mise à jour , afin qu’elle soit continuellement mise à jour avec chaque nouveau complexe QRS moyen analysé.
- Visualisez la carte d’activation basale bi-ventriculaire sur le côté gauche (Figure 8D, panneau de gauche). Le système calcule automatiquement la matrice de transfert entre les mailles du torse et du cœur pour reconstruire l’activité électrique épicardique du cœur sur la base de la méthode des éléments limites 22,23,24.
REMARQUE : La carte d’activation décrit la progression temporelle de la dépolarisation à travers l’épicarde cardiaque, aidant à identifier les origines de l’activation et les modèles réentrants ou focaux. Les activations sont calculées en (1) transformant chaque électrogramme reconstruit en une somme d’ondelettes sinusoïdales pour tous les échantillons de temps de pente négative et l’amplitude proportionnelle à la pente à ce moment-là et (2) en sélectionnant l’instant de l’amplitude maximale du signal transformé comme l’instant du temps d’activation17. - Écrivez le nom et enregistrez la carte de base en cliquant sur le bouton Enregistrer la carte et passez la carte en mode Freeze une fois qu’elle est reproductible. Une carte ECGI reproductible a une durée d’activation et des modèles de propagation cohérents sur au moins trois cartes consécutives.
REMARQUE : Dans les procédures CSP-CRT, la carte basale (Figure 12A) servira de référence pour évaluer la synchronie bi-ventriculaire pendant le processus de vissage de l’électrode dans la région septale jusqu’à ce qu’elle atteigne la zone de la branche gauche du faisceau (Figure 12C). - Configurez l’analyse de la cartographie d’activation ECGI en cliquant sur le bouton Options pour obtenir des cartes optimales pendant le processus de vissage et de stimulation dans la région septale :
- Sélectionnez Analyser le ventricule pour cartographier uniquement les ventricules.
- Sélectionnez l’option d’analyse basée sur les ondelettes pour l’algorithme des temps d’activation.
- Sélectionnez l’option de battement unique pour le type de cartographie afin d’analyser l’onde d’un seul battement afin de capturer les changements de signaux électrocardiographiques pendant le processus de vissage et de stimulation simultané à différentes positions septales.
- Conservez les paramètres par défaut pour les fonctions Correction de décalage, Nombre de temps et Option de synchronisation .
- Réglez la carte du panneau de droite en mode Mise à jour pour vous assurer qu’elle est continuellement mise à jour avec chaque complexe QRS à un temps nouvellement analysé pendant le processus de vissage.
- Synchronisez la plage de palette de couleurs de la carte du panneau de droite avec la carte de base à l’aide du menu Valeurs liées et liez leurs positions de caméra via le menu Caméra liée (Figure 8D, panneau de droite).
REMARQUE : Lorsque la sonde est vissée dans la région septale, des cartes ECGI battement par battement sont automatiquement générées à diverses positions (c’est-à-dire le septum ventriculaire droit, le septum moyen, le septum profond et la branche du faisceau gauche). Ces cartes sont comparées à la carte basale en normalisant la gamme de cartes de couleurs sur toutes les cartes ECGI évaluées (Figure 12B, C). Cette configuration permet de visualiser clairement les changements dans les modèles d’activation pendant que le fil est vissé. - Écrivez le nom et enregistrez chaque carte en cliquant sur le bouton Enregistrer la carte chaque fois qu’un changement dans le schéma d’activation est observé pendant le processus de vissage dans la région septale, en continuant jusqu’à ce que la zone de la branche gauche du faisceau soit atteinte.
5. Analyse supplémentaire non invasive de la cartographie ECGI sans image
REMARQUE : Différentes cartes cardiaques peuvent être dérivées des signaux ECGI calculés pour évaluer le substrat cardiaque, caractériser les arythmies, évaluer la CRT ou extraire des paramètres cliniquement pertinents pendant les procédures. Le type de cartes qui peuvent être générées dépend du rythme cardiaque spécifique analysé, avec des approches distinctes pour les rythmes réguliers et irréguliers.
- Utilisez la section d’analyse du signal de la fenêtre en temps réel pour analyser les différents rythmes que les patients peuvent présenter pendant la procédure électrophysiologique :
- Analysez les rythmes réguliers, en définissant l’analyse à un battement ou à battement moyen comme fonction de type de cartographie , lorsque le patient est dans un rythme stabilisé/régulier, tel que le rythme sinusal, la stimulation auriculaire ou ventriculaire, le flutter auriculaire ou la tachycardie ventriculaire. Calculez la carte d’activation et la carte de vitesse de conduction (CV) à partir d’une analyse régulière du rythme.
- Analysez le rythme irrégulier, en utilisant l’analyse du rythme irrégulier comme fonction de type de cartographie lorsque le patient est en fibrillation auriculaire. Le système permet de sélectionner des segments AF étendus (par exemple, 1 min) pour supprimer les complexes QRST et capturer les modèles spatio-temporels dynamiques de l’AF. Calculez la carte de phase , la carte d’histogramme du rotor et la carte de fréquence dominante à partir de l’analyse du rythme irrégulier.
- En option, appuyez sur le menu déroulant de la sélection de la carte et choisissez la carte d’activation si un rythme régulier a été analysé. Voir l’étape 4.8 pour une description détaillée de la carte d’activation .
- En option, appuyez sur le menu déroulant de la sélection de la carte et choisissez la carte de vitesse de conduction si un rythme régulier a été analysé.
REMARQUE : La vitesse de conduction est une métrique dérivée de la carte d’activation. Cette mesure représente le temps qu’il faut à un front d’onde pour se déplacer dans chaque zone de l’épicarde. Le calcul du CV repose sur des gradients spatiaux de cartes temporelles d’activation sur les surfaces cardiaques, avec des champs de vecteurs de vitesse appliqués pour identifier les régions de propagation efficace. Les zones avec des vecteurs directionnels uniformes indiquaient une propagation électrique stable, tandis que les régions avec des disparités angulaires, indiquant une propagation inefficace, sont interpolées à l’aide d’une fonction de base radiale25. CV permet d’identifier les zones de décélération de conduction lors de la cartographie du substrat qui sont liées aux taux de récidive de l’arythmie17. - En option, appuyez sur le menu déroulant de la sélection de la carte et choisissez la carte de phase lors de l’analyse d’un rythme irrégulier.
REMARQUE : La carte de phase suit la progression d’une région définie du myocarde à travers le potentiel d’action au fil du temps. Ce type de carte est dynamique puisqu’il représente la progression du potentiel cardiaque. Dans la carte de phase, la transformée de Hilbert est appliquée pour calculer la phase du signal ECGI. Chaque phase correspond à un état donné du potentiel d’action sur chaque cycle du signal (π pour le repos, π/2 pour la dépolarisation, 0 pour le plateau et -π pour la repolarisation)26. - Si vous le souhaitez, appuyez sur le menu déroulant de la sélection de la carte et choisissez la carte Histogramme du rotor lors de l’analyse d’un rythme irrégulier.
REMARQUE : Une carte d’histogramme de rotor, dérivée d’une carte de phase, est une représentation des emplacements les plus fréquents des singularités de phase, qui sont des zones avec une activité réentrante concentrée et sont affichées en rouge. En bref, les singularités de phase sont définies comme des points clés où la phase se décale de -π à π. Les PS ne montrant pas une progression spatiale progressive des phases dans leur environnement sont écartés. Enfin, le nombre de tours pour chaque rotor est quantifié pour obtenir la carte de l’histogramme du rotor 18. La précision de l’algorithme dans l’identification des modèles de propagation pendant la FA et les régions spécifiques présentant des rentrées a été systématiquement évaluée par rapport à la cartographie endocardique, démontrant une corrélation de 71 %16. - Si vous le souhaitez, appuyez sur le menu déroulant de la sélection de la carte et sélectionnez la carte de fréquence dominante (DF) lors de l’analyse d’un rythme irrégulier.
REMARQUE : Les cartes DF affichent la fréquence électrique prédominante dans chaque région cardiaque au fil du temps, ce qui permet d’identifier les zones d’activité électrique rapide qui peuvent servir de moteurs de la FA. Les DF sont calculées comme la fréquence avec la densité spectrale de puissance la plus élevée dans le périodogramme de Welch27,28. Son analyse permet de détecter des zones à forte stabilité ou variabilité de l’activité fibrillatoire au sein des oreillettes. Un histogramme est utilisé pour évaluer la distribution temporelle des fréquences dominantes, fournissant une représentation claire et quantitative de l’activité électrique la plus pertinente et facilitant l’identification des régions présentant un comportement anormal.
Résultats
Cas 1 - Planification et guidage de l’ablation par cathéter d’un flutter auriculaire atypique
Il s’agit d’un patient de 59 ans (indice de masse corporelle -IMC-30) ayant des antécédents d’hypertension, de tabagisme, de valvulopathie cardiaque, de classification EHRA IIb et un score CHA2DS 2-VASc de 1 avec une indication d’ablation par cathéter due à un flutter auriculaire atypique (AFL) basé sur un ECG à 12 dérivations (Figure 9A). Le patient n’avait aucun antécédent d’ablation par cathéter. L’IRM tardive pré-procédurale d’amélioration du gadolinium (EGL-IRM) a révélé une fibrose étendue dans la paroi postérieure de l’oreillette gauche (AL), avec une planimétrie normale de 24 cm² et une fraction d’éjection ventriculaire gauche (FEVG) préservée de 54 %.
L’ECGI non invasive sans image a été réalisée quelques minutes avant l’introduction du cathéter via une gaine fémorale. Un cycle complet de l’AFL (209 ms), exempt de complexes QRST, a été sélectionné pour l’analyse. La cartographie a révélé un circuit macro-réentrant autour de la valve mitrale (MV), identifiant la ligne périmitrale comme la cible d’ablation optimale pour la terminaison de l’arythmie (Figure 9B). Par la suite, une EAM par contact (figure 9C) a été réalisée, ce qui a confirmé le modèle de propagation observé dans l’ECGI non invasif sans image. L’ablation le long de la ligne périmitrale a permis de terminer avec succès l’arythmie.
Dans ce cas clinique, l’arythmie a été caractérisée avec précision avant l’EAM invasive, ce qui a permis de localiser précisément le schéma de propagation de l’arythmie et de rationaliser la procédure d’ablation. Cependant, pour les tachycardies auriculaires complexes, telles que l’AFL ou la tachycardie focale, l’ECGI sans image offre une cartographie en temps réel à un seul battement, ce qui le rend particulièrement précieux en cas d’arythmie non soutenue. Son adaptabilité aux changements de schémas d’arythmie au cours d’une procédure garantit une cartographie précise et dynamique. De plus, alors que le diagnostic de l’AFL dans le sens inverse des aiguilles d’une montre est généralement simple à partir d’un ECG à 12 dérivations, il peut être difficile de localiser et d’identifier avec précision le mécanisme des tachyarythmies complexes. Par conséquent, la réalisation d’un ECGI sans image lors d’une consultation médicale ou quelques minutes avant peut améliorer la sécurité et l’efficacité de la procédure en fournissant des conseils en amont pour la planification de l’ablation par cathéter et en éliminant les approches transeptales inutiles.
Cas 2 - Evolution des singularités de phase lors de l’ablation par cathéter de la fibrillation auriculaire persistante
Il s’agit d’un patient de 63 ans (IMC 31) avec une fraction d’éjection ventriculaire gauche préservée (FEVG, 55 %), pas de LA dilatée, et la New York Heart Association (NYHA) de I était indiquée pour l’ablation par cathéter en raison d’une FA persistante. Aucune tomodensitométrie ou IRM préopératoire n’a été effectuée. Le patient avait des antécédents d’ablation par cathéter pour l’isolement de la veine pulmonaire (IVP) en décembre 2019.
À son arrivée, le patient était en FA. La cartographie du substrat a été réalisée à l’aide d’un ECGI sans image tout au long de la procédure d’ablation (Figure 10A). Au départ, l’ECGI a identifié des singularités de phase dans la paroi latérale de l’oreillette droite (RA), la base de l’appendice auriculaire droit (RAA), la paroi postérieure auriculaire gauche (PW) et la base de l’appendice auriculaire gauche (LAA). Ces résultats étaient corrélés avec des EGM à haute fréquence et fragmentées observées à l’aide de cathéters endocavitaires, et une IVP adéquate a été confirmée par la reconstruction de l’EAM LA. L’ablation en champ pulsé (PFA) a été amorcée à la base LAA, ce qui a entraîné un changement de rythme de la FA à l’AFL atypique. L’ECGI sans image a révélé une AFL périmitrale, qui a été confirmée par un entraînement à partir du pôle distal du cathéter du sinus coronaire. Une ligne mitrale a été créée ; cependant, l’AF a été réductée. Par la suite, une isolation complète du PW a été obtenue. Malgré cela, l’ECGI sans image a continué à identifier des singularités de phase significatives à la base RAA. Après plusieurs applications de PFA ciblant cette zone, le rythme sinusal a été atteint (Figure 10B).
Ce cas clinique est une représentation de la façon dont la FA présente des défis uniques en raison de la grande variabilité de l’activité électrique dans les oreillettes. L’ECGI sans image a efficacement capturé les modèles spatio-temporels de la progression de la FA pendant l’ablation, avec jusqu’à trois cartes non invasives acquises pour guider la modification du substrat jusqu’à ce que la RS soit atteinte. Les traitements standard, comme l’isolement de la veine pulmonaire, ont des taux de récidive relativement élevés29. Les principales difficultés du traitement de la FA résident dans deux domaines : (1) déterminer quels patients bénéficieront de l’IVP seule, et (2) pour ceux nécessitant une approche plus large, identifier les régions en dehors de la zone de l’IVP dont l’ablation réduira le plus efficacement la récidive de l’arythmie. Au cours du rythme sinusal, l’ECGI sans image a démontré sa capacité à générer des cartes CV, qui se sont avérées utiles pour prédire le succès de l’ablation de l’IVP17. Cependant, dans ce cas, l’ECGI sans image a capturé simultanément les modèles de dynamique de la FA, fournissant aux cliniciens une vue complète de la façon dont la FA se propage et aidant à identifier les régions clés à l’origine de l’arythmie. L’analyse des résultats doit se concentrer sur la corrélation entre les facteurs de FA détectés par ECGI sans image et les critères cliniques, tels que la survie sans arythmie à long terme, afin de valider davantage son utilité dans l’optimisation des stratégies d’ablation de la FA.
Cas 3 - Guidage de l’optimisation de la stimulation biventriculaire pour la thérapie de resynchronisation cardiaque
Il s’agit d’une patiente de 67 ans présentant une cardiomyopathie dilatée non ischémique, une FEVG de 25 %, aucun signe d’augmentation tardive du gadolinium à l’IRM préopératoire, avec un bloc de branche gauche (LBBB) sur l’ECG de base et une durée QRS de 156 ms. Le patient était indiqué pour la stimulation biventriculaire (BiVP) dans le cadre de la TRC.
Au cours de la procédure de TRC cardiaque, l’ECGI sans image en temps réel a été utilisé pour évaluer la synchronisation ventriculaire avant et après l’implantation du stimulateur cardiaque. Au rythme initial, la dernière région d’activation du patient a été identifiée dans la paroi basale-latérale du ventricule gauche (VG), comme le montre la figure 11A. Le temps total d’activation ventriculaire (TAT) a été mesuré à 116 ms, indiquant une asynchronie ventriculaire significative. Différentes configurations de dispositifs ont été évaluées à l’aide de l’ECGI, la configuration optimale étant déterminée comme étant BiVP en utilisant l’activation simultanée des pôles distal et proximal de la sonde VG, et un retard auriculo-ventriculaire de 140 ms. Comme le montre la figure 11B, les trois points de stimulation ventriculaire n’ont entraîné aucune région activée tardivement, ce qui indique une synchronisation réussie, avec un TAT amélioré de 70 ms.
La thérapie de resynchronisation cardiaque vise à rétablir la coordination électrique dans les ventricules et à améliorer la fonction cardiaque chez les patients atteints d’insuffisance cardiaque et de QRS prolongé. Dans ce cas, l’ECGI sans image a fourni une cartographie en temps réel qui a été essentielle pour guider l’optimisation du BiVP pendant la procédure CRT. Il a permis une évaluation précise des modèles d’activation ventriculaire et a permis d’identifier la configuration optimale du dispositif, assurant ainsi une synchronisation ventriculaire complète. La nature non invasive et la rétroaction immédiate de l’ECGI ont permis aux cliniciens d’affiner la programmation des leads. En revanche, alors que des études soulignent la valeur de l’ECGI pour guider le placement de la sonde ventriculaire gauche près de la dernière régionactivée 30, les contraintes anatomiques peuvent limiter son applicabilité. Les paramètres de resynchronisation basaux et finaux déterminés par l’ECGI, tels que le TAT, doivent être liés aux résultats cliniques en surveillant la réponse clinique du patient à la CRT au fil du temps, y compris l’amélioration des symptômes et la fonction ventriculaire à long terme.
Cas 4 - Implant de stimulation de système de conduction de guidage pour la thérapie de resynchronisation cardiaque en temps réel
Ce cas clinique est une patiente de 45 ans présentant une dysfonction ventriculaire sévère (EFVG 15 %) et une LBBB d’une durée QRS de 172 ms. Le patient a été indiqué pour une TRC de défibrillateur cardioverti implantable utilisant une approche de stimulation par système de conduction (CSP).
L’ECGI sans image en temps réel a été utilisé lors de l’implantation du dispositif pour surveiller la synchronisation ventriculaire tout au long du processus de vissage des électrodes dans la région septale. Comme le montre la figure 12, la carte ECGI de base a identifié la paroi latérale du VG comme la dernière zone activée, avec un TAT de 133 ms. La cartographie ECGI battement par battement pendant le vissage des électrodes a démontré des améliorations progressives de la synchronisation ventriculaire, avec une synchronisation optimale obtenue en atteignant la branche gauche du faisceau, ce qui a entraîné un TAT de 95 ms.
Ce cas a démontré le potentiel de l’ECGI sans image en temps réel pour guider l’implantation de LBBP pendant une procédure CRT. Ses capacités de cartographie en temps réel à battement unique ont permis l’analyse du TAT ventriculaire et la resynchronisation à chaque étape de l’implantation de la sonde dans la région septale. Le système a fourni une mesure rapide, visuelle et facile à interpréter, remédiant au manque de normalisation des critères CSP électrocardiographiques. Ainsi que dans les procédures BiVP-CRT, d’autres études sont nécessaires pour déterminer si les paramètres ECGI sans image sont significativement corrélés avec la réponse clinique CRT et comment ils se comparent aux prédicteurs ECG à 12 dérivations.
Cas 5 - Planification et guidage de l’ablation par cathéter de la tachycardie ventriculaire
Il s’agit d’un patient de 53 ans (IMC 25,4) atteint d’une cardiomyopathie ischémique, d’une dysfonction ventriculaire sévère (FEVG 15 %) et d’une classe II de la NYHA qui a été référé pour une procédure d’ablation par cathéter en raison d’une TV récurrente. L’IRM préopératoire a révélé une fibrose endocardique étendue et des canaux arythmogènes localisés dans les segments inféro-basal et inféro-médial du ventricule gauche. Le patient avait des antécédents d’ablation par cathéter TV en 2018.
Une cartographie ECGI sans image (Figure 13A) et une EAM invasive (Figure 13B) ont été réalisées simultanément tout au long de la procédure. Le processus d’ablation par cathéter a impliqué une cartographie basée sur le substrat pendant la stimulation apicale ventriculaire droite (RV) et l’induction de la TV à l’aide d’une stimulation programmée. L’ECGI sans image a identifié une région de conduction ralentissant dans le segment inféro-basal du VG lors de la cartographie du rythme sinusal avant l’introduction du cathéter. Ce résultat était cohérent avec la fibrose observée à l’IRM. La stimulation subséquente à partir de l’apex ventriculaire droit (VD) a confirmé un ralentissement de la conduction dans les segments basal et médial du VG, identifiant cette zone comme le substrat arythmogène probable. Une TV d’une durée de cycle de 380 ms a été brièvement induite, nécessitant une cardioversion en raison de l’instabilité hémodynamique. Par conséquent, seul un nombre limité de points EAM a été acquis. Cependant, en utilisant un seul cycle de VT, l’ECGI sans image a réussi à identifier l’isthme VT dans la même région où l’encombrement isochronal a été observé dans les cartes rythmées.
L’utilisation de l’ECGI sans image en temps réel dans ce cas de TV a permis de relever avec succès deux défis cliniques majeurs dans la prise en charge de la TV : (1) la localisation précise des cibles d’ablation potentielles pendant le rythme sinusal et (2) la caractérisation de la TV avec instabilité hémodynamique. À partir d’un seul battement, l’isthme VT a été identifié avec précision dans les cartes d’activation du substrat et de l’arythmie. Le système a permis aux opérateurs d’identifier les substrats arythmogènes avant ou pendant l’ablation et de caractériser plusieurs VT inductibles en temps réel à partir d’un seul cycle.

Figure 1 : Composants matériels ECGI sans image. (A) Amplificateur bipotentiel doté de ports de connexion par câble spécifiques. (B) Câbles droit et gauche, équipés de connecteurs d’amplificateur à une extrémité et de connecteurs de prise de gilet de capteur à l’autre. (C) Configuration montrant les câbles droit et gauche connectés à l’amplificateur bipotentiel. (D) Déroulement schématique de la procédure de connexion du gilet de capteur aux prises de câble. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Procédure de scanner de reconstruction 3D du torse. (A) Le gilet capteur de potentiel de surface corporelle à 128 fils, composé de quatre composants (avant-droite, avant-gauche, arrière-droite, arrière-gauche), est placé sur le torse du patient avant la reconstruction 3D. Chaque électrode possède un code QR unique pour l’identification automatique. Les connexions entre les électrodes peuvent être pliées pour s’adapter au gilet à la forme du corps du patient. (B) Le code QR sur le composant avant-droit valide le gilet, permettant à l’application de scanner 3D d’initier la reconstruction du torse. (C) La plate-forme de scanner 3D, via l’application de scanner 3D, génère le torse reconstruit à l’aide d’une caméra à lumière structurée infrarouge. Abréviations : FR : avant-droite ; FL : avant gauche ; BR : à l’arrière droit ; et BL : à l’arrière gauche. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Écran de connexion de l’interface utilisateur ECGI sans image nécessitant un nom d’utilisateur et un mot de passe désignés pour l’accès au logiciel. Veuillez cliquer ici pour voir une version agrandie de cette figure.
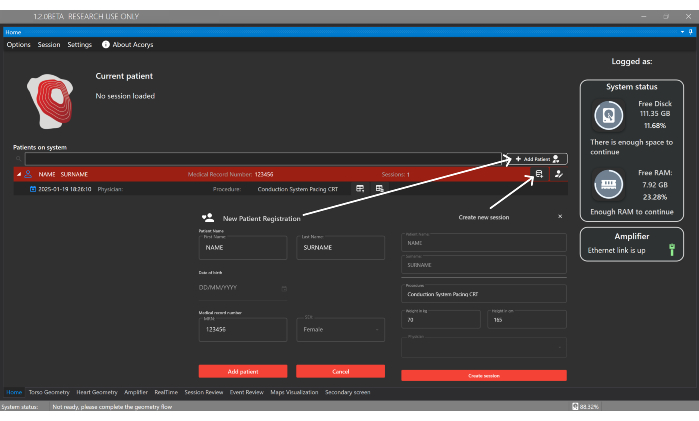
Figure 4 : Fenêtre d’accueil. La fenêtre d’accueil permet la gestion des patients, des médecins et des utilisateurs, ainsi que la configuration des sessions des patients. Il affiche également des informations sur les sessions importées et l’état du système et de l’amplificateur. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Fenêtre de géométrie du torse. La fenêtre Géométrie du torse permet aux utilisateurs de télécharger et d’afficher le modèle 3D du torse, de segmenter les électrodes et de sélectionner le type de géométrie du cœur via le bouton Calculer la géométrie, ce qui permet l’estimation ou de fournir une segmentation à partir d’une tomodensitométrie/IRM personnalisée. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 6 : Estimation de la géométrie cardiaque. (A) Algorithme SSM utilisant les caractéristiques basales et la reconstruction 3D du torse du patient pour estimer la géométrie cardiaque. (B) Estimation de la géométrie cardiaque à l’intérieur de la MSS du torse affichant les vues antéro-postérieure (côté gauche) et postéro-antérieure (côté droit). Abréviations : 3D : tridimensionnel ; SSM : modèle statistique de forme. Veuillez cliquer ici pour voir une version agrandie de cette figure.
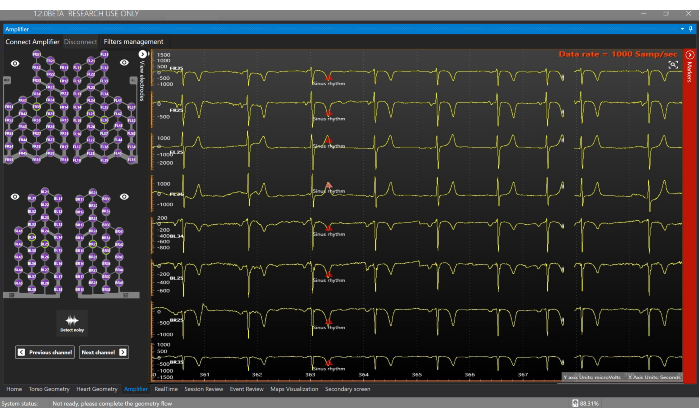
Figure 7 : Fenêtre de l’amplificateur. La fenêtre de l’amplificateur permet de visualiser en temps réel les signaux obtenus à partir de chaque électrode du gilet du capteur. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 8 : Fenêtre en temps réel. (A) Représentation schématique des fils actifs à partir du gilet du réseau d’électrodes à haute densité. Les électrodes vertes contiennent des signaux de bonne qualité tandis que les électrodes rouges contiennent des signaux bruyants et ne participent pas au calcul du problème inverse. (B) Estimation des 12 dérivations de l’électrocardiogramme en temps réel. (C) Déclenchement et délimitation automatiques de l’apparition et du décalage du complexe QRS (fenêtre de couleur verte). Le signal moyen de toutes les pistes participant au calcul de mappage est indiqué en bleu. (D) La section Visualisation des cartes prend en charge les vues simples, doubles ou quatre cartes. Cet exemple montre une vue à double mappage avec des mappages d’activation pour les états de stimulation des branches basale et gauche du bundle (mappage final) au cours d’une procédure CRT. La carte basale est en mode gel, restant statique, tandis que la carte finale est en mode de mise à jour, recalculant à chaque complexe QRS nouvellement analysé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
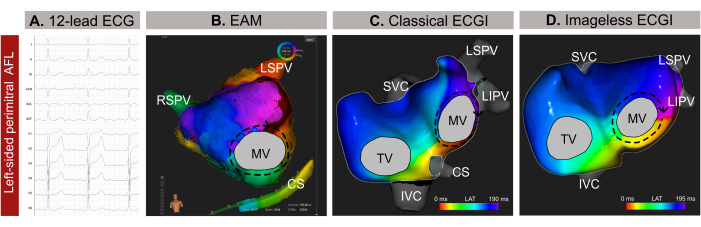
Figure 9 : Exemple graphique d’un AFL atypique gauche et les différentes capacités diagnostiques de l’ECG à 12 dérivations, de l’ECGI sans image et de l’EAM invasif. (A) Les signaux ECG à 12 dérivations de l’AFL atypique présentent des ondes supraventriculaires positives en V1. (B) ECGI sans image utilisant une géométrie cardiaque estimée à partir d’un SSM et affichant une vue antéro-postérieure. Le circuit de propagation montre toutes les couleurs autour du MV, un motif typique d’un AFL périmitral. (C) La cartographie d’activation locale dérivée de l’EAM et affichant une vue antéro-postérieure montre une macro-rentrée autour du MV, confirmant le diagnostic de l’ECGI sans image. Abréviations : ECG : électrocardiogramme ; EAM : cartographie électroanatomique ; ECGI : imagerie électrocardiographique. SVC : veine cave supérieure ; VCI : veine cave inférieure ; CS : sinus coronaire ; LSPV : veine pulmonaire supérieure gauche ; RIPV : veine pulmonaire inférieure droite ; RSPV : veine pulmonaire supérieure droite. Veuillez cliquer ici pour voir une version agrandie de cette figure.
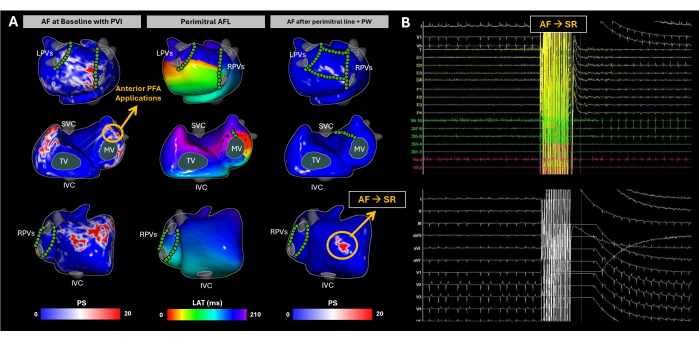
Figure 10 : Suivi de l’évolution du substrat auriculaire pendant l’ablation par cathéter AF à l’aide d’une cartographie ECGI non invasive sans image. (A) Vues postéro-antérieure, antéro-postéro et latérale droite d’ECGI sans image, avec des sites PFA marqués par des cercles verts. La carte PS de base met en évidence les rentrées dans la paroi latérale RA, la base RAA, la paroi postérieure LA et la base LAA. La PFA à la base de LAA a fait passer le rythme à l’AFL périmitral. Bien que la ligne mitrale et l’isolation de la paroi postérieure aient été terminées, la FA a de nouveau été induite spontanément. L’ECGI a révélé la PS dans la base RAA, qui est devenue la cible de l’ablation. Plusieurs applications de PFA ont été effectuées dans cette zone et le rythme sinusal a été rétabli. (B) L’ECG à 12 dérivations et les signaux intracardiaques au moment où la FA est passée à la RS. Abréviations : SVC : veine cave supérieure ; VCI : veine cave inférieure ; LPV : veines pulmonaires gauches ; RPV : veines pulmonaires droites ; AF : fibrillation auriculaire, SR : rythme sinusal, PS : singularités de phase, LAT : temps d’activation locaux, TV : valve tricuspide, MV : valve mitrale, PVI : isolation de la veine pulmonaire, AFL : flutter auriculaire, PW : paroi postérieure et PFA : ablation en champ pulsé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
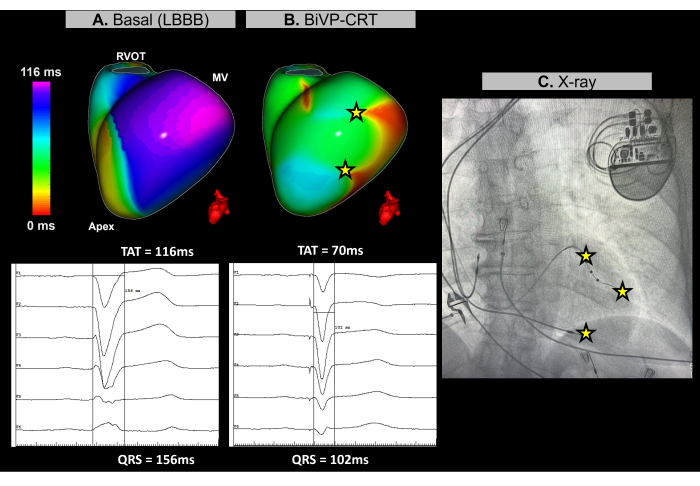
Figure 11 : Optimisation de la stimulation biventriculaire à l’aide de l’ECGI sans image. (A) Rythme de base du patient. La carte ECGI sans image (vue latérale gauche) révèle une région activée tardivement (violette) dans la paroi latérale du VG, avec un TAT de 116 ms, indiquant une dyssynchronie ventriculaire. Cela correspond à l’ECG de base, qui montre un complexe QRS large (156 ms) avec un modèle LBBB. (B) Configuration post-implantation du stimulateur cardiaque. Suite à une BiVP avec activation simultanée des pôles distal et proximal de la sonde VG et un retard auriculo-ventriculaire de 140 ms, la carte ECGI sans image ne montre aucune région activée retardée (pas de zone violette), indiquant une activation ventriculaire synchrone et un TAT réduit de 70 ms. Ceci est cohérent avec le complexe QRS raccourci observé dans l’ECG final, où la durée du QRS diminue à 102 ms. (C) Vue radiographique antéro-postérieure du stimulateur cardiaque implanté, montrant l’emplacement des électrodes du stimulateur cardiaque. L’activité de stimulation des pôles distal et proximal de la sonde VG est également reflétée dans la carte ECGI. Abréviations : LBBB : bloc de branche gauche, BiVP : stimulation biventriculaire, CRT : thérapie de resynchronisation cardiaque, RVOT : voie d’éjection ventriculaire droite, MV : valve mitrale, TAT : temps d’activation total. Veuillez cliquer ici pour voir une version agrandie de cette figure.
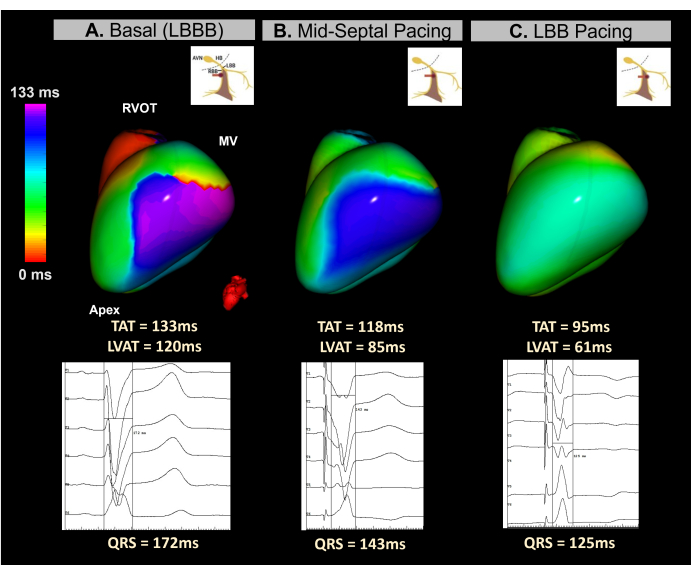
Figure 12 : Évaluation non invasive de la TRC par stimulation du système de conduction à l’aide d’un ECGI sans image. (A) Rythme de base du patient. La carte ECGI (vue latérale gauche) indique une région d’activation retardée (violette) sur la paroi latérale du VG, avec un TAT de 133 ms, suggérant une dyssynchronie ventriculaire. Cela correspond à l’ECG de base, qui présente un complexe QRS large (172 ms) typique du LBBB. (B) Phase intermédiaire (stimulation mi-septale) lors de l’implantation de la sonde LBBP. La carte non invasive montre une correction partielle de la région retardée dans le VG, la couleur passant du violet au bleu. Cela s’accompagne d’une réduction de la durée du complexe QRS. (C) La position finale du fil LBBP pendant le processus de vissage. La carte montre une correction complète de la zone retardée, la couleur passant du violet au vert, indiquant une activation synchrone des deux ventricules. Abréviations : LBBB : bloc de branche gauche, LBB : branche gauche, RVOT : voie d’éjection ventriculaire droite, MV : valve mitrale, TAT : temps d’activation total. Veuillez cliquer ici pour voir une version agrandie de cette figure.
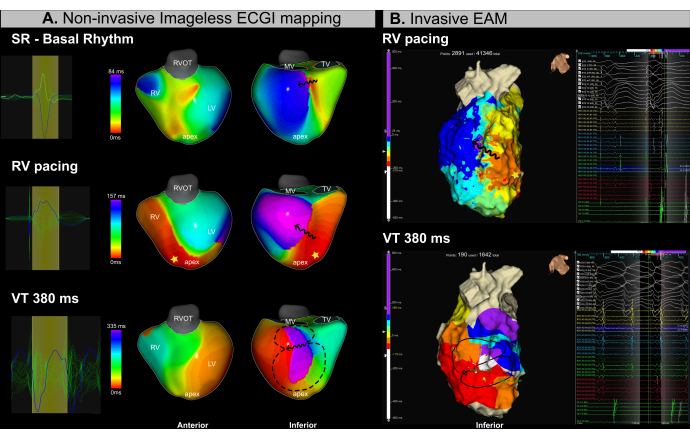
Figure 13 : Évaluation non invasive de l’isthme de la TV à l’aide de l’ECGI sans image. (A) La cartographie ECGI sans image pendant la procédure d’ablation de la VT identifie le substrat arythmogène et l’isthme de la VT dans les régions inféro-basale et infero-médiale du VG. La première rangée correspond au rythme sinusal, la rangée du milieu à la stimulation apicale du RV et la rangée du bas au VT. (B) L’EAM invasive obtenue lors de la procédure d’ablation par TEV montre une cartographie de l’activation isochronale dans les mêmes régions identifiées par ECGI. La rangée supérieure correspond à la stimulation apicale du VD, tandis que la rangée du bas représente le VT. Abréviations : RV : ventricule droit, LV : ventricule gauche, SR : rythme sinusal, RVOT : voie d’éjection ventriculaire droite, MV : valve mitrale, TV : valve tricuspide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Cette description méthodologique met en évidence l’utilité clinique d’une approche ECGI non invasive, à un seul battement et en temps réel, qui peut prendre en charge une variété de procédures électrophysiologiques, telles que l’ablation par cathéter et la CRT, sans avoir besoin d’imagerie cardiaque pré-procédurale comme la tomodensitométrie ou l’IRM 15,17,31,32 Dans ce rapport, l’ECGI sans image présente des caractéristiques techniques clés qui pourraient favoriser son adoption clinique. Bien que l’ECGI se soit déjà avéré être un outil puissant pour la cartographie cardiaque d’un large éventail d’arythmies 19,33,34,35,36, il continue de faire face à plusieurs défis cliniques et techniques 13,14.
Les systèmes ECGI classiques nécessitent une tomodensitométrie spécifiquement le même jour que la cartographie cardiaque, avec les électrodes ECGI en place 9,10,12,37,38. Cette approche ajoute du temps supplémentaire en raison de la nécessité de segmenter la tomodensitométrie (cœur et électrodes), ce qui retarde la génération de la carte ECGI initiale d’environ 1 à 3 heures. En revanche, le système ECGI sans image présenté dans ce rapport utilise un balayage 3D infrarouge du thorax avec des électrodes à haute densité, qui peut être effectué quelques minutes avant l’intervention ou lors de consultations médicales15,17. Le système segmente automatiquement les électrodes thoraciques et estime la géométrie cardiaque du patient, rationalisant ainsi le processus de cartographie cardiaque non invasive et réduisant considérablement le temps entre l’arrivée du patient et la disponibilité de la première carte ECGI. La validation antérieure de l’approche ECGI sans image a montré que l’utilisation de la géométrie cardiaque estimée introduit des erreurs minimales, maintenant la précision des cartes non invasives. Chez les patients atteints de FA, une forte corrélation a été observée entre les signaux ECGI dérivés de géométries cardiaques estimées et réelles, même avec des translations géométriques15. Pour les arythmies régulières, telles que la tachycardie auriculaire complexe, les comparaisons avec l’EAM ont démontré une grande précision dans l’identification de la chambre cardiaque impliquée, la détermination du mécanisme (focal ou réentrant) et l’inférence de la cible d’ablation31. Dans le cas de la TV, l’approche a été évaluée pour guider les opérateurs vers les zones de l’isthme de la TV pendant le rythme sinusal (RS)39, ce qui montre le potentiel d’identifier les patients à risque de TV en prévention primaire. De plus, une forte congruence régionale entre l’ECGI sans image et les cartes d’activation EAM a été observée pendant la stimulation des sinus coronaires, en particulier aux sites d’activation précoce et tardive40.
Dans la TRC, les changements morphologiques en temps réel dans l’ECG à 12 dérivations sont généralement utilisés pour confirmer la resynchronisation lors de l’implantation de la sonde, en particulier dans les procédures CSP où l’ECG est évalué à différents stades de la mise en place de la sonde septale jusqu’à ce que la zone LBB soit atteinte. Cependant, les algorithmes ECG publiés sont souvent complexes, présentent des différences significatives entre eux et, dans certains cas, sont difficiles à mettre en œuvre dans la pratique clinique 41,42,43. Peut-être en raison de cette complexité, aucun paramètre électrocardiographique spécifique pour la stimulation de la branche gauche (LBBP) n’a été identifié de manière cohérente qui puisse prédire de manière fiable si un patient répondra à la resynchronisation cardiaque. L’approche ECGI sans image en temps réel offre une cartographie simple et détaillée, battement par battement, tout au long de l’implantation de la sonde, évaluant la correction de la dyssynchronie en évaluant des paramètres tels que le temps d’activation du ventricule gauche, comme démontré chez les patients avec l’indication32 de la TRC ou ceux avec le bloc AV44. Par conséquent, avec des recherches plus approfondies, les paramètres ECGI en temps réel pourraient potentiellement guider les opérateurs dans l’optimisation de l’emplacement de l’implantation de la sonde ou la prédiction de la réponse du patient à la CRT.
Bien que le potentiel de l’ECGI sans image en temps réel ait été présenté dans ce rapport méthodologique, d’autres nouvelles approches de cartographie non invasives utilisant des simulations d’arythmie ont également visé à éliminer le besoin d’imagerie pré-procédurale. L’étude VMAP (Vectorcardiographic Mapping of Arrhythmogenic Probability) a démontré une précision régionale significative dans la localisation des sites d’arythmie ventriculaire45 et semble prometteuse pour identifier l’emplacement des facteurs de FA au-delà de l’ablation non PVI46. Le VMAP utilise l’ECG à 12 dérivations en combinaison avec plusieurs modèles informatiques pour identifier les cibles d’arythmie sans s’appuyer sur des données géométriques spécifiques au patient. Cependant, cette approche peut être sous-optimale pour les arythmies auriculaires comme la FA, où les composants à haute fréquence sur l’ECG de surface sont cruciaux pour identifier les moteurs d’arythmie de manière non invasive. Ces composants sont généralement capturés par des électrodes sur les surfaces postérieure et antéro-latérale27, qui ne sont pas représentées dans l’ECG standard à 12 dérivations utilisé dans la pratique clinique.
Malgré la nécessité d’une investigation clinique plus approfondie, l’ECGI sans image en temps réel a le potentiel de devenir un outil précieux pour la cartographie cardiaque non invasive dans un large éventail d’arythmies. Sa simplicité méthodologique et son flux de travail rationalisé en milieu hospitalier permettent aux cliniciens de recueillir davantage de données cliniques, ce qui pourrait améliorer à la fois les résultats des patients et les futures avancées technologiques. En conclusion, l’avenir de la cartographie cardiaque non invasive réside dans l’évolution vers une approche entièrement sans image, permettant une intégration plus rapide et plus fluide dans la pratique clinique quotidienne, des consultations de routine à la cartographie en temps réel pendant les procédures électrophysiologiques.
Déclarations de divulgation
JRP, BPS, JSC, IHR, RM, CF, EZ, JM, DL, FA, MSG et AMC ont reçu des honoraires honorifiques de Corify Care SL. AMC, MSG et FA sont les cofondateurs de Corify Care SL et JRP, BPS, JSC, IHR, JM, DL, JBG, FA, LM, MSG et AMC en sont actionnaires. TFA a reçu des subventions de recherche de Biosense-Webster. IRL a reçu des honoraires en tant que conférencier et consultant d’Abbott et de Biosense-Webster. APS a reçu des honoraires de conférencier et de consultant de Bisosense-Webster, Abbott et Boston-Scientific. JMT a reçu des honoraires en tant que conférencier et consultant d’Abbott, de Boston-Scientific et de Medtronic. EA a reçu des honoraires de conférenciers et de consultants de Biosense-Webster et de Bayer. LM déclare des honoraires en tant que consultant, conférencier et conseil consultatif de Boston-Scientific, Abbott, Johnson&Johnson et Medtronic, et est actionnaire de Galgo Medical SL. JBG déclare des honoraires en tant que consultant et conférencier de Microport CRM et d’Abbott, en plus du soutien sans restriction d’une subvention d’Abbott pour une bourse. MPL a reçu des honoraires de conférencier de Medtronic.
Remerciements
Cette recherche a été financée par l’Institut européen d’innovation et de technologie (EIT) dans le cadre de la convention de subvention SAVE-COR n° 220385 et de la subvention CIAICO/2022/020 financée par la Generalitat Valenciana (EFICACIA). Un soutien supplémentaire a été apporté par la Generalitat Valenciana (subvention CIAPOS/2021/238, ACIF/2021/205, CIBEFP/2022/9), MCIN/AEI/10.13039/501100011033 et ESF Investing in Your Future (subvention RYC2018-024346-I), l’Instituto de Salud Carlos III (subvention CIBERCV16 CB16/11/00354) et la Catalogne, Espagne (subvention 2021_SGR_01350, SGR21/GENCAT). Nous remercions également le soutien du Programme CERCA/Generalitat de Catalunya. MPL financé (2023-2025) par le biais d’un contrat Río Hortega CM22/00107 [Instituto de Salud Carlos III (ISCIII) ; Fondo Social Europeo (FSE)]. Les auteurs remercient Neus Portella et Sheila Marco pour leur soutien administratif, ainsi que les équipes médicales et infirmières pour leur soutien clinique à l’Hospital Clínic de Barcelona, à l’Hospital General Universitario Gregorio Marañón, à l’Hospital Universitari i Politècnic La Fe. Ils remercient également Almudena Albertos de Corify Care SL, Madrid, Espagne et Arantxa Carrasco de l’Universitat Politecnica de Valencia.
matériels
| Name | Company | Catalog Number | Comments |
| ACORYS Mapping System | Corify Care SL | ACORYS | Imageless ECGI system |
| ACORYS 3D Scan Software | Corify Care SL | ACSCAN | 3D scanner app |
| ACORYS Amplifier | Corify Care SL | ACAMP | Biopotential amplifier |
| ACORYS Sensor Vest | Corify Care SL | ACSEN | Sensor vest, 4 components (Front Right, Front Left, Back Right and Back Left) |
| ACORYS Software | Corify Care SL | ACSOF, version 1.2 | Imageless ECGI software |
| Affera mapping system | Medtronic | AFR-00003 | |
| CADENCE Adult mulifuntion defibrillation electrodes | Cardinal Health | 22660R | |
| Catheter extension cable | Medtronic | AFR-00006 | |
| Desktop or portable PC workstation | Any | Windows 11 as the operating system | Imageless ECGI workstation. The processor must be at least an Intel i7 from the 2020 generation or newer. It requires a minimum of 32 GB of RAM and 500 GB of SSD storage. Additionally, a compatible version of .NET Framework must be installed. An internet connection is not required. |
| Dynamic XT 10E 2 5 2 MM Diagnostic Catheter | Boston Scientific | M0042011010 | |
| EP-TRACER 2 ProCart | Cardiotek | The system includes several components provided by the company | |
| External Defibrillator Monitor | PHILLIPS | Efficia DFM100 | |
| Fentanyl | Kern pharma | 1004000143-03 | |
| Heparine | Reig Jofre | 608737.4 O | |
| HexaFlow irrigation pump | Medtronic | AFR-00005 | |
| HexaGen RF generator | Medtronic | AFR-00004 | |
| HexaPulse PF generator | Medtronic | AFR-00008 | |
| INTELLAMAP ORIO Mapping Catheter | Boston Scientific | M004RC64S0 | |
| IntellaNav StablePoint Ablation Catheter | Boston Scientific | M004ERFSDS96200 | |
| iPad mini | Apple | 6th generation A2567 | 3D scanner platform |
| iPadOS | Apple | 15.3 or superior | 3D scanner platform |
| Isolated Ethernet Cable | Corify Care SL | ACNET | Ethernet cable |
| Isoprenaline | Reig Jofre | 7227007 | |
| Left Connector Cable | Corify Care SL | ACCAB_L | Left cables |
| Location Reference Patch Kit | Boston Scientific | M004RAPATCH20 | |
| Location reference patch kit | Medtronic | AFR-00007 | |
| MetriQ Tubing Set | Boston Scientific | M0041170 | |
| Midazolam | Normon | X5XF1 | |
| Physiological Saline Solution for Irrigation | Fabrenius Kabi | br14801 | |
| Propofol | B Braun | 855437.9 OH | |
| Remifentanil | Kern pharma | 672786.7 | |
| RHYTHMIA HD | Boston Scientific | M004 RBINSTALL2ROW0 | |
| Right Connector Cable | Corify Care SL | ACCAB_R | Right cables |
| Single Patient Use ECG Electrodes | Ambu | M-00-S | |
| Sphere-9 mapping and ablation catheter | Medtronic | AFR-00001 | |
| Structure SDK | Structure | 2.2.1 for iOS or superior | 3D scanner platform, infrared structured light camera |
| Structure Sensor Pro | Structure | ST02B. Firmware version 1.2 or superior | 3D scanner platform, infrared structured light camera |
| Sugamadex Teva | Normon | 7340157-OH | |
| Tubing set | Medtronic | AFR-00002 | |
| WorkMate Claris System | Abbott | H700123 | |
| X-Ray C-Arm | Phillips | The system includes several components provided by the company |
Références
- Narayan, S. M., John, R. M. Advanced electroanatomic mapping: current and emerging approaches. Curr Treat Options Cardiovasc Med. 26 (4), 69-91 (2024).
- Raiman, M., Tung, R. Automated isochronal late activation mapping to identify deceleration zones: rationale and methodology of a practical electroanatomic mapping approach for ventricular tachycardia ablation. Comput Biol Med. 102, 336-340 (2018).
- Guichard, J. -. B., et al. Substrate mapping for ventricular tachycardia ablation through high-density whole-chamber double extra stimuli. JACC Clin Electrophysiol. 10 (7), 1534-1547 (2024).
- Takigawa, M., et al. Are wall thickness channels defined by computed tomography predictive of isthmuses of postinfarction ventricular tachycardia. Heart Rhythm. 16 (11), 1661-1668 (2019).
- Vázquez-Calvo, S., et al. Noninvasive detection of slow conduction with cardiac magnetic resonance imaging for ventricular tachycardia ablation. Europace. 26 (2), euae025 (2024).
- Sánchez-Somonte, P., et al. Scar channels in cardiac magnetic resonance to predict appropriate therapies in primary prevention. Heart Rhythm. 18 (8), 1336-1343 (2021).
- Roca-Luque, I., et al. Post-ablation cardiac magnetic resonance to assess ventricular tachycardia recurrence (PAM-VT study). Eur Heart J Cardiovasc Imaging. 25 (2), 188-198 (2023).
- Roca-Luque, I., et al. Ventricular scar channel entrances identified by new wideband cardiac magnetic resonance sequence to guide ventricular tachycardia ablation in patients with cardiac defibrillators. Europace. 22 (4), 598-606 (2020).
- Rudy, Y., Burnes, J. E. Noninvasive electrocardiographic imaging. Ann Noninvasive Electrocardiol. 4 (3), 340-359 (1999).
- Haissaguerre, M., et al. Noninvasive panoramic mapping of human atrial fibrillation mechanisms: a feasibility report. J Cardiovasc Electrophysiol. 24 (6), 711-717 (2013).
- Tsyganov, A., et al. Mapping of ventricular arrhythmias using a novel noninvasive epicardial and endocardial electrophysiology system. J Electrocardiol. 51 (1), 92-98 (2018).
- Pereira, H., Niederer, S., Rinaldi, C. A. Electrocardiographic imaging for cardiac arrhythmias and resynchronization therapy. Europace. 22 (10), 1447-1462 (2020).
- Duchateau, J., et al. Performance and limitations of noninvasive cardiac activation mapping. Heart Rhythm. 16 (3), 435-442 (2019).
- Cluitmans, M., et al. Validation and opportunities of electrocardiographic imaging: from technical achievements to clinical applications. Front Physiol. 9, 1305 (2018).
- Molero, R., González-Ascaso, A., Climent, A. M., Guillem, M. S. Robustness of imageless electrocardiographic imaging against uncertainty in atrial morphology and location. J Electrocardiol. 77, 58-61 (2023).
- Rodrigo, M., et al. Noninvasive assessment of complexity of atrial fibrillation: correlation with contact mapping and impact of ablation. Circ Arrhythm Electrophysiol. 13 (3), e007700 (2020).
- Invers-Rubio, E., et al. Regional conduction velocities determined by noninvasive mapping are associated with arrhythmia-free survival after atrial fibrillation ablation. Heart Rhythm. 21 (9), 1570-1580 (2024).
- Fambuena-Santos, C., et al. AF driver detection in pulmonary vein area by electrocardiographic imaging: relation with a favorable outcome of pulmonary vein isolation. Front Physiol. 14, 1057700 (2023).
- San Antonio, R., et al. Optimized single-point left ventricular pacing leads to improved resynchronization compared with multipoint pacing. Pacing Clin Electrophysiol. 44 (3), 519-527 (2021).
- Zacur, E., et al. MRI-Based Heart and Torso Personalization for Computer Modeling and Simulation of Cardiac Electrophysiology. Imaging for Patient-Customized Simulations and Systems for Point-of-Care Ultrasound. 10549, (2017).
- Bell, J. B., Tikhonov, A. N., Arsenin, V. Y. Solutions of ill-posed problems. Math Comput. 32 (144), 1320 (1978).
- Oster, H. S., Taccardi, B., Lux, R. L., Ershler, P. R., Rudy, Y. Electrocardiographic imaging: noninvasive characterization of intramural myocardial activation from inverse-reconstructed epicardial potentials and electrograms. Circulation. 97 (15), 1496-1507 (1998).
- Figuera, C., et al. Regularization techniques for ECG imaging during atrial fibrillation: a computational study. Front Physiol. 7, 466 (2016).
- Molero, R., et al. Improving electrocardiographic imaging solutions: a comprehensive study on regularization parameter selection in L-curve optimization in the atria. Comput Biol Med. 182, 109141 (2024).
- Hernández-Romero, I., et al. Local conduction velocity estimation during wavefront collisions and reentrant scenarios. 2022 Computing in Cardiology (CinC). , (2022).
- Rodrigo, M., et al. Technical considerations on phase mapping for identification of atrial reentrant activity in direct- and inverse-computed electrograms. Circ Arrhythm Electrophysiol. 10 (9), e005008 (2017).
- Guillem, M. S., et al. Noninvasive localization of maximal frequency sites of atrial fibrillation by body surface potential mapping. Circ Arrhythm Electrophysiol. 6 (2), 294-301 (2013).
- Pedrón-Torrecilla, J., et al. Noninvasive estimation of epicardial dominant high-frequency regions during atrial fibrillation. J Cardiovasc Electrophysiol. 27 (4), 435-442 (2016).
- Tzeis, S. 2024 European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace. 26 (4), euae043 (2024).
- Parreira, L., et al. Noninvasive three-dimensional electrical activation mapping to predict cardiac resynchronization therapy response: site of latest left ventricular activation relative to pacing site. Europace. 25 (4), 1458-1466 (2023).
- Reventos-Presmanes, J., et al. Noninvasive electrocardiographic imaging for the characterization of complex atrial tachyarrhythmias. Europace. 25 (Supplement_1), (2023).
- Regany, M., et al. ECG imaging as a real time tool to guide left bundle branch pacing implant in patients with left bundle branch block and resynchronization therapy indication. Europace. 26 (Supplement_1), (2024).
- Rudy, Y. Noninvasive electrocardiographic imaging of arrhythmogenic substrates in humans. Circ Res. 112 (5), 863-874 (2013).
- Shah, A. J., et al. Validation of novel 3-dimensional electrocardiographic mapping of atrial tachycardias by invasive mapping and ablation. J Am Coll Cardiol. 62 (10), 889-897 (2013).
- Graham, A. J., et al. Evaluation of ECG imaging to map hemodynamically stable and unstable ventricular arrhythmias. Circ Arrhythm Electrophysiol. 13 (2), e007377 (2020).
- Pujol-Lopez, M., et al. Conduction system pacing vs biventricular pacing in heart failure and wide QRS patients. JACC Clin Electrophysiol. 8 (11), 1431-1445 (2022).
- Rudy, Y., Lindsay, B. D. Electrocardiographic imaging of heart rhythm disorders. Cardiac Electrophysiol Clin. 7 (1), 17-35 (2015).
- Haissaguerre, M., et al. Driver domains in persistent atrial fibrillation. Circulation. 130 (7), 530-538 (2014).
- Reventos-Presmanes, J., et al. Noninvasive assessment of the ventricular tachycardia isthmus during sinus rhythm. Europace. 26 (Supplement_1), (2024).
- Ros, S., et al. Imageless electrocardiographic imaging for atrial electrophysiological characterization: a validation study. Europace. 26, (2024).
- Wu, S., et al. Left bundle branch pacing for cardiac resynchronization therapy: nonrandomized on-treatment comparison with his bundle pacing and biventricular pacing. Can J Cardiol. 37 (2), 319-328 (2021).
- Pujol-López, M., et al. Stepwise application of ECG and electrogram-based criteria to ensure electrical resynchronization with left bundle branch pacing. Europace. 25 (6), euad128 (2023).
- Zhu, K., Chang, D., Li, Q. Which is more likely to achieve cardiac synchronization: left bundle branch pacing or left ventricular septal pacing. Front Cardiovasc Med. 9, 845312 (2022).
- Martinez-Perez, M., et al. Real-time assessment of LV synchrony in AV block population undergoing LBB pacing using ECG imaging. Europace. 26 (Supplement_1), (2024).
- Krummen, D. E., et al. Forward-solution noninvasive computational arrhythmia mapping: the VMAP study. Circ Arrhythm Electrophysiol. 15 (9), (2022).
- Gu, K., et al. Ablation of non-pulmonary vein atrial fibrillation drivers identified by vMap in addition to pulmonary vein isolation improves procedural outcomes. 29th annual AF Symposium 2024. , (2024).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon