Method Article
Echtzeit-Kardiokartierung mit einem nichtinvasiven bildlosen elektrokardiographischen Bildgebungssystem
In diesem Artikel
Zusammenfassung
Diese Studie stellt einen neuartigen Ansatz für die Echtzeit-Kardiokartierung unter Verwendung eines nicht-invasiven, bildlosen elektrokardiographischen Bildgebungssystems vor. Dieses System ermöglicht die Aufnahme elektrophysiologischer Herzkarten, ohne dass eine vorprozedurale Computertomographie oder Magnetresonanztomographie erforderlich ist, und ermöglicht eine effiziente Führung für kardiale Eingriffe wie Ablation und kardiale Resynchronisationstherapie-Implantate.
Zusammenfassung
Ein schnelles, sicheres und effektives kardiales Mapping ist für die Behandlung komplexer Herzrhythmusstörungen von entscheidender Bedeutung, doch die derzeitigen Methoden stoßen an erhebliche Einschränkungen. Das 12-Kanal-Elektrokardiogramm (EKG) ist zwar für die Erstdiagnose unerlässlich, verfügt jedoch nicht über die räumliche Auflösung und Tiefe, die für fortschrittliche Verfahren wie die Katheterablation oder die Implantation eines kardialen Resynchronisationstherapiegeräts erforderlich sind. Auf der anderen Seite bieten invasive Kartierungstechniken eine detaillierte elektrische Aktivität, erfordern jedoch mehrere Katheterplatzierungen, was die Verfahrensrisiken und die Komplexität erhöht. Diese Methoden sind zeitaufwändig, teuer und bieten eine begrenzte Echtzeitbewertung, insbesondere bei dynamischen Arrhythmien wie Vorhofflimmern (VHF), instabilen Arrhythmien und kardialer Resynchronisationstherapie (CRT).
In dieser Studie wird ein nicht-invasives, bildloses elektrokardiographisches Bildgebungssystem (Imageless-EKGI) vorgestellt, das als Ergänzung zu herkömmlichen Methoden entwickelt wurde, indem es Echtzeit-Herzkarten von Schlag zu Schlag liefert. Ohne dass eine präprozedurale Bildgebung erforderlich ist, erfasst dieses System die hochauflösende elektrische Aktivität im gesamten Herzen und bietet eine sicherere und effizientere Alternative zur invasiven Kartierung. Durch die Kombination der Unmittelbarkeit von Oberflächenaufzeichnungen mit der räumlichen Genauigkeit moderner Computermodelle schließt das Imageless-ECGI-System die Lücke zwischen traditionellem EKG und invasiver Kartierung und verändert möglicherweise den Arbeitsablauf in elektrophysiologischen Laboren.
Einleitung
Der Bedarf an nicht-invasiver elektrophysiologischer Kartierung für die genaue Beurteilung der Herzaktivität ist immer wichtiger geworden, insbesondere bei Patienten, die sich komplexen Arrhythmieeingriffen unterziehen, wie z. B. Vorhofflimmern (VHF) und ventrikulärer Tachykardie (VT) Ablation oder während der Implantation von Herzschrittmachern und Geräten für die kardiale Resynchronisationstherapie (CRT). Derzeit ist das dreidimensionale (3D) elektroanatomische Mapping (EAM) nach wie vor der Goldstandard für die Anleitung von Bedienern während der Katheterablation1, indem es umfassende funktionelle Karten zur Charakterisierung von Arrhythmien bereitstellt 2,3. EAM ist jedoch suboptimal für die Erfassung der dynamischen raumzeitlichen Muster von Vorhofflimmern und nicht anhaltenden Arrhythmien, und das lange und invasive Verfahren, das für die Kartierung erforderlich ist, macht es für den Einsatz in CRT-Verfahren unpraktisch.
Traditionelle nicht-invasive Methoden, wie z. B. das 12-Kanal-Elektrokardiogramm (EKG), sind zwar sehr genau für die Identifizierung spezifischer Arrhythmieherde (z. B. Ausflusstrakt oder Höcker-VT), bieten jedoch nur einen begrenzten Einblick in das globale elektrische Verhalten des Herzens. Diese Einschränkung wird besonders deutlich, wenn eine Echtzeit-Kartierung erforderlich ist, um Eingriffe bei dynamischen und komplexen Arrhythmien zu steuern, bei denen eine präzise Lokalisierung arrhythmogener Bereiche für erfolgreiche Ergebnisse entscheidend ist. Nicht-invasives Mapping könnte eine wichtige Rolle bei der Verbesserung der präprozeduralen Planung und der Bereitstellung von Echtzeit-Feedback bei elektrophysiologischen Eingriffen spielen.
Um Elektrophysiologen vor dem Verfahren zu unterstützen, haben sich Fortschritte bei kardialen Bildgebungsmodalitäten wie der Computertomographie (CT) und der Magnetresonanztomographie (MRT) als wirksam erwiesen, um detaillierte strukturelle Informationen zu liefern, einschließlich der Wandstärke4 und der Myokardfibrose 5,6,7,8 . Diese Modalitäten konzentrieren sich jedoch auf anatomische und strukturelle Merkmale, so dass eine Lücke in der funktionellen elektrischen Abbildung entsteht. Darüber hinaus erfordert die Gewinnung hochwertiger Herzbilder spezielle Scanprotokolle, geschultes Personal und komplexe Nachbearbeitungsmethoden wie fortschrittliche Segmentierung und präzise Gewebecharakterisierung, insbesondere für die Erkennung von Herzfibrose.
Klassische elektrokardiographische Bildgebungssysteme (EKGI) haben sich als nicht-invasive Option herauskristallisiert und bieten vielversprechende Ergebnisse, indem sie die elektrische Aktivität des Herzens auf der Grundlage von Körperoberflächenpotentialen (BSP) rekonstruieren9,10,11,12. Trotz ihres Potenzials sind ECGI-Systeme mit erheblichen Einschränkungen konfrontiert13,14. Erstens erfordern sie präprozedurale CT-Scans, um Elektrodenpositionen auf Herzgeometrien abzubilden, was ihren Einsatz in der klinischen Routine weniger praktikabel macht. Zweitens führen traditionelle Regularisierungsmethoden, die zur Lösung des inversen Problems des kardialen Mappings verwendet werden, oft zu nicht-physiologischen Ausbreitungsmustern, was ihre Genauigkeit im klinischen Umfeld einschränkt.
Das Ziel dieser Studie war es, die Merkmale und Verfahren eines neuartigen nicht-invasiven EKGI-Systems zu beschreiben, das in der Lage ist, Echtzeit-Mapping ohne CT oder MRT15 durchzuführen, bekannt als bildloses EKGI. Wir untersuchten die Fortschritte des bildlosen EKGis und präsentierten potenzielle klinische Anwendungen für elektrophysiologisches Mapping, indem wir die Einschränkungen aktueller Techniken wie EAM, 12-Kanal-EKG und klassisches EKG bei der Behandlung komplexer Arrhythmieverfahren überwanden. Dieser Ansatz ermöglicht die Erstellung von Herzkarten innerhalb von Minuten nach der Ankunft des Patienten, wodurch der Arbeitsablauf optimiert und die Vorbereitungszeit verkürzt wird. Darüber hinaus verwendet das System fortschrittliche Signalverarbeitungsalgorithmen, um genaue physiologische Ausbreitungsmuster zu generieren und so die Lokalisierung von Arrhythmien und die Verfahrensergebnisse zu verbessern.
Protokoll
Die Methodik wurde in einer multizentrischen klinischen Beobachtungsstudie prospektiv validiert. Die Studie wurde in Übereinstimmung mit der Deklaration von Helsinki und den ethischen Standards der beteiligten Institutionen durchgeführt. Das Studienprotokoll SAVE-COR (NCT05772182) wurde von den Ethikkommissionen des Hospital Universitario Gregorio Marañón, des Hospital Clínic de Barcelona und des Hospital Universitari i Politècnic La Fe genehmigt und die Einverständniserklärung aller Patienten eingeholt.
HINWEIS: Detaillierte Beschreibungen der Ein- und Ausschlusskriterien lauten:
Einschlusskriterien: (i) Indikation für eine invasive elektroanatomische Studie und/oder Implantation von intrakavitären Stimulationsgeräten. ii) Einholung und Unterzeichnung einer Einverständniserklärung für die Aufnahme in die Studie.
Ausschlusskriterien: i) <18 Jahre. (ii) Unfähigkeit, sich einer endokardialen Katheterisierung zu unterziehen (z. B. schwangere oder stillende Frauen). (iii) Körperliche oder geistige Unfähigkeit, die Einwilligungserklärung zu verstehen und zu akzeptieren. (iv) Unfähigkeit, aufrecht zu stehen, um die für das ECGI-System erforderliche 3D-Rumpfrekonstruktion zu ermöglichen. (v) Patienten mit angeborenen Pathologien.
1. Vorbereitung des bildlosen EKGI-Systems in Echtzeit vor dem Eingriff
- Vergewissern Sie sich, dass der Biopotentialverstärker (Abbildung 1A) vollständig geladen ist, und platzieren Sie ihn am Ende des Elektrophysiologie-Raumtisches (EP) in der Nähe der Stelle, an der sich die Füße des Patienten befinden würden.
HINWEIS: Der Biopotentialverstärker (siehe Materialtabelle) ist ein isoliertes 128-Kanal-Gerät, das für die Verstärkung und Digitalisierung der von den Elektroden gesammelten elektrischen Signale verantwortlich ist. - Vergewissern Sie sich, dass das rechte und das linke Kabel nicht beschädigt sind, indem Sie die Verstärkeranschlüsse an einem Ende und die schwarzen Buchsen, an denen die Sensorweste angeschlossen ist, am anderen Ende überprüfen (Abbildung 1B).
HINWEIS: Das rechte und linke Kabel (siehe Materialtabelle) sind 1,5 m lang und übertragen elektrische Signale von der Sensorweste zum Biopotentialverstärker. - Stecken Sie das rechte und das linke Anschlusskabel in den Biopotentialverstärker (Abbildung 1C). Jedem Kabel ist ein Stecker zugeordnet, der sich durch eine Zahl unterscheidet, die sowohl für das Kabel als auch für den Verstärker gleich ist.
- Stellen Sie sicher, dass die 3D-Scanner-Plattform vollständig aufgeladen ist, und öffnen Sie die 3D-Scananwendung.
HINWEIS: Bei der 3D-Scananwendung handelt es sich um eine Software, die auf einer 3D-Scannerplattform läuft (siehe Materialtabelle), die eine Infrarot-Strukturlichtkamera verwendet, um eine 3D-Modellrekonstruktion des Oberkörpers des Patienten zu erstellen. Die Anwendung erkennt auch automatisch die Position der QR-Codes (Quick Response) der Elektrode. - Stellen Sie sicher, dass auf der PC-Workstation (siehe Materialtabelle) die bildlose ECGI-Software-Benutzeroberfläche (UI) installiert und vollständig aufgeladen ist.
HINWEIS: Die bildlose EKGI-Software (siehe Materialtabelle) enthält Signalverarbeitungsalgorithmen, um die Herzgeometrie zu schätzen und wertvolle Informationen für die Diagnose und Behandlung von Herzrhythmusstörungen oder die Steuerung von Implantationsverfahren für Herzgeräte zu liefern 16,17,18,19. Die Benutzeroberfläche des Systems ermöglicht es Benutzern, elektrokardiographische Signale zu visualisieren, auszuwählen und zu analysieren und interaktive Karten der epikardialen Aktivität zu erstellen, die eine nicht-invasive Bewertung der Herzfunktion ermöglichen. - Verbinden Sie den Biopotential-Verstärker über ein isoliertes Ethernet-Kabel mit der Workstation (siehe Materialtabelle). Stecken Sie ein Ende in den Ethernet-Anschluss des Verstärkers und das andere in die Workstation.
HINWEIS: Das isolierte Ethernet-Kabel überträgt elektrische Signale vom Biopotentialverstärker zur Workstation. - Wählen Sie eine Sensorweste aus (siehe Materialtabelle), überprüfen Sie die Verpackung und stellen Sie sicher, dass die Versiegelung unbeschädigt ist. Verwenden Sie die Sensorweste nicht, wenn die Verpackung geöffnet oder beschädigt ist.
- Öffnen Sie die Verpackung der Sensorweste und vergewissern Sie sich, dass sich die vier Komponenten der Weste darin befinden. Wählen Sie eine andere Verpackung der Sensorweste, wenn eine der Komponenten fehlt.
HINWEIS: Bei der Sensorweste handelt es sich um ein Elektrodenarray mit hoher Dichte und 128 Silberelektroden, die eine gleichzeitige Kartierung der elektrischen Oberflächenaktivität über den gesamten Rumpf des Patienten ermöglichen. Die Weste ist röntgendurchlässig und enthält vier Pflaster, die die vordere und hintere linke und rechte Fläche des Rumpfes bedecken. Jede Elektrode verfügt über einen QR-Code auf der Vorderseite, der eine automatische Identifizierung der Elektrodenposition ermöglicht.
2. Vorbereitung des Patienten vor dem Eingriff
- Nehmen Sie den Patienten am selben Tag ins Krankenhaus auf, an dem die elektrophysiologische Untersuchung oder die Implantation des Geräts durchgeführt wird.
- Positionieren Sie den Patienten stehend oder sitzend auf einem Stuhl oder dem EP-Tisch und stellen Sie sicher, dass der gesamte Rumpfbereich frei von Kleidung ist.
- Führen Sie eine Sichtprüfung der Haut des Patienten durch, um zu überprüfen, ob der Patient Wunden, Wunden oder andere Hauterkrankungen hat, um das Anbringen von Elektroden an diesen Bereichen zu vermeiden.
- Optional können Sie den Oberkörper für Personen mit starken Haaren pflegen, um Geräuschartefakte zu minimieren und Beschwerden beim Entfernen der Sensorweste zu reduzieren.
- Positionieren Sie die vier Teile der Sensorweste (vorne rechts, vorne links, hinten rechts und hinten links) richtig auf dem Oberkörper des Patienten (Abbildung 2A) und passen Sie die Weste an die Größe des Patienten an, indem Sie bei Bedarf die Verbindungen zwischen den Elektroden einklappen.
- Vermeiden Sie optional bei CRT-Eingriffen die Platzierung von Elektroden in dem Bereich, in dem das Herzimplantat eingesetzt wird, oft in der linken oberen Brust.
HINWEIS: Verbindungen mit gedruckten Strichen können bei Bedarf sicher unterbrochen werden, da in diesen Bereichen keine aktiven Spuren vorhanden sind. - Platzieren Sie die RLD- (Right-Leg-Driven) und die Referenzelektroden (REF) der Sensorweste so weit wie möglich von den anderen Westenelektroden entfernt auf dem rechten bzw. linken Bein.
- Sorgen Sie für eine ausreichende Raumbeleuchtung und stellen Sie sicher, dass sich keine Objekte innerhalb eines Durchmessers von 1,5 m um den Oberkörper des Patienten befinden, da diese die 3D-Torsorekonstruktion stören oder verzerren können.
- Positionieren Sie den Patienten mit den Armen über dem Kopf, um eine Beeinträchtigung der 3D-Rumpfrekonstruktion zu vermeiden, wie in Abbildung 2C zu sehen ist.
- Erhalten Sie die 3D-Torso-Rekonstruktion des Patienten.
- Holen Sie sich die 3D-Scanner-Plattform und öffnen Sie die 3D-Scananwendung.
- Scannen Sie den QR-Code auf der seitlichen Seite der Westenkomponente vorne rechts, um die Sensorweste zu validieren (Abbildung 2B), und stellen Sie sicher, dass sie einmalig verwendet werden kann und nicht abgelaufen ist.
HINWEIS: Sobald der QR-Code erkannt wurde, ermöglicht die 3D-Scananwendung die Erfassung der 3D-Torsorekonstruktion. - Positionieren Sie die 3D-Scannerplattform auf Höhe des Oberkörpers vor dem Patienten, halten Sie sie mit beiden Händen fest und führen Sie eine 360°-Drehung um den Patienten durch, um die 3D-Rumpfrekonstruktion zu erfassen (Abbildung 2C).
HINWEIS: Im Verlauf des Scans erstellt die Infrarot-Strukturlichtkamera von der 3D-Scannerplattform ein graues geschlossenes 3D-Netz des Rumpfes und schließt den Vorgang nach einer vollständigen Umdrehung ab. In der Regel dauert die 3D-Torsorekonstruktion 1-2 Minuten. - Führen Sie eine visuelle Inspektion der 3D-Torso-Rekonstruktion durch, um sicherzustellen, dass der gesamte Torso von einem grauen Schatten bedeckt ist und dass keine Löcher im rekonstruierten Netz vorhanden sind.
- Speichern Sie die 3D-Torsorekonstruktion in der Anwendung, sobald der Scan abgeschlossen ist.
- Lassen Sie den Patienten auf den EP-Zimmertisch legen.
- Verbinden Sie die vier Teile der Sensorweste mit den entsprechenden rechten und linken Anschlusskabeln (Abbildung 1D). Befestigen Sie die Westenstecker vorne-rechts und hinten rechts an der rechten Kabelbuchse und die Westenstecker vorne-links und hinten links an der linken Kabelbuchse.
- Schalten Sie den Biopotentialverstärker ein, damit die bildlose EKGI-Software elektrophysiologische Signale in Echtzeit empfangen kann.
3. Schätzung der Herzgeometrie des Patienten
- Melden Sie sich als Benutzer bei der auf der Workstation installierten Echtzeit-Bildlos-EKGI-Software an (Abbildung 3). Geben Sie einen Benutzernamen und ein Passwort ein.
- Klicken Sie auf die Schaltfläche Patient hinzufügen und geben Sie Identifikationsdetails ein, um einen neuen Patienten im Startfenster der Benutzeroberfläche zu registrieren (Abbildung 4). Erstellen Sie dann eine neue Sitzung, die dem Patienten zugeordnet ist, und geben Sie die Art des Verfahrens und die folgenden Basaldaten an: Geschlecht, Alter, Größe und Gewicht.
HINWEIS: Ein einzelner Patient kann mehrere Sitzungen haben. Wenn sich ein Patient beispielsweise in klinischen Studien mit Nachbeobachtungen einer zweiten EKGI-Registrierung unterzieht, kann eine neue Sitzung erstellt werden, ohne den Patienten erneut hinzuzufügen. - Verbinden Sie die 3D-Scanner-Plattform über ein USB-C-Kabel mit der Workstation.
- Klicken Sie auf die Schaltfläche Torso-Scan laden , und laden Sie die 3D-Torso-Rekonstruktion im Fenster Torsogeometrie hoch (Abbildung 5).
HINWEIS: Die Software erkennt automatisch die Lokalisierung der 128 Elektroden von der Sensorweste. Jede Westenkomponente hat unterschiedliche Elektrodenfarben: Vorne rechts = rot, vorne links = blau, hinten rechts = pink und hinten links = orange. - Optional können Sie die Elektrodenpositionen manuell anpassen, indem Sie auf jede Elektrode klicken und sie auf der Rumpfoberfläche neu positionieren.
- Wählen Sie die Schaltflächen "Compute Geometry " und die Option "Estimate Heart Geometry " aus, um die Herzgeometrie des Patienten im Fenster "Torsogeometrie" zu schätzen (Abbildung 5).
HINWEIS: Die Software schätzt die Herzgeometrie unter Verwendung einer Methodik, die auf einem statistischen Formmodell (SSM) (Abbildung 6A) basiert, wie in der vorherigen Literaturbeschrieben 20. Der Algorithmus verarbeitet zunächst die 3D-Rumpfrekonstruktion des Patienten und die Basaldaten (Geschlecht, Alter, Größe und Gewicht) als Eingabe. Anschließend passt sich das SSM unter Einbeziehung von MRT-basierten Rumpf- und Herzgeometrien iterativ an das 3D-Rumpfnetz des Patienten an. Dadurch wird die optimale Geometrie, Position und Ausrichtung des Herzens im Körper des Patienten bestimmt (Abbildung 6B). Dieser Prozess macht eine präprozedurale CT oder MRT überflüssig und ermöglicht die Erstellung der ersten nicht-invasiven Herzkarte innerhalb von 10-15 Minuten. Es ist wichtig zu beachten, dass eine Popup-Meldung den Benutzer informiert, wenn die 3D-Torsorekonstruktion nicht ausreichend aufgelöst ist oder Artefakte enthält, die die Genauigkeit der Schätzergebnisse beeinträchtigen könnten.
4. Nicht-invasives bildloses EKGI-Mapping zur Führung eines Implantats mit Reizleitungssystem für die kardiale Resynchronisationstherapie (CSP-CRT) in Echtzeit (Fall 4)
- Gehen Sie zum Verstärkerfenster und klicken Sie auf die Schaltfläche Verstärker verbinden , um mit der Erfassung elektrophysiologischer Signale in Echtzeit zu beginnen (Abbildung 7). Klicken Sie auf die verschiedenen Leitungen, um die Signale im Verstärkerbildschirm zu visualisieren.
- Wechseln Sie zum Echtzeitfenster (Abbildung 8), um eine nichtinvasive kardiale Kartierung in Echtzeit zu erhalten.
HINWEIS: Das Echtzeitfenster ermöglicht die Visualisierung von Echtzeitsignalen, schließt verrauschte Signale aus, erstellt zeitliche Ersteller, grenzt automatisch Analysesegmente ab (z. B. P-Welle und QRS-Komplex) und berechnet und zeigt nicht-invasive EKGI-Karten an. - Schließen Sie verrauschte Signale aus, indem Sie auf die Schaltfläche für die 128-Kanal-Ansicht klicken, die Option Nur Benutzer als Auswahlmodus für verrauschte Ableitungen auswählen und auf verrauschte Signale doppelklicken, um sie auszuschließen, bevor Sie die ECGI-Karte erstellen. Dies verbessert die Qualität der Mapping-Berechnung, da ECGI ein schlecht gestelltes Problem darstellt21.
HINWEIS: Grün dargestellte Sensorwesten-Elektroden weisen auf Signale von guter Qualität hin und werden für die inverse Problemberechnung verwendet, während rot dargestellte Elektroden verrauscht sind und von der Analyse ausgeschlossen werden (Abbildung 8A). - Klicken Sie auf die Schaltfläche 12-Kanal-Ansicht , um ein geschätztes 12-Kanal-EKG in Echtzeit zu visualisieren (Abbildung 8B).
- Stellen Sie sicher, dass die RT ON-Taste aktiv ist, um die Signale im Signalanalysebereich automatisch zu aktualisieren (Abbildung 8C). Diese Option löst automatisch den Beginn und den Offset des zu analysierenden QRS-Komplexes aus und definiert diesen.
HINWEIS: Die RT-Taste kann in den RT OFF-Modus geschaltet werden, um die Signale einzufrieren, so dass der Benutzer den QRS-Komplex manuell abgrenzen kann, wenn die automatische Abgrenzung des Systems suboptimal ist. - Konfigurieren Sie die ECGI-Aktivierungszuordnungsanalyse, indem Sie auf die Schaltfläche Optionen klicken, um automatisch eine optimale Basalrhythmuskarte für das CSP-CRT-Verfahren zu generieren:
- Wählen Sie die Option Ventrikel analysieren , um nur die Ventrikel zu kartieren.
- Wählen Sie die Wavelet-basierte Analyseoption17 für den Aktivierungszeiten-Algorithmus.
- Wählen Sie die Option "Average Beat " für die Funktion "Mapping Type " aus, um die durchschnittliche Welle der letzten 10 QRS-Komplexe zu berechnen.
- Behalten Sie die Standardeinstellungen für die Funktionen "Offset-Korrektur", "Beat-Nummer" und " Sync-Option " bei.
- Wählen Sie die Option "Zwei Bereiche" im Abschnitt "Kartenvisualisierung" aus, und stellen Sie sicher, dass die linke Karte auf den Aktualisierungsmodus eingestellt ist, damit sie kontinuierlich mit jedem neu analysierten durchschnittlichen QRS-Komplex aktualisiert wird.
- Visualisieren Sie die biventrikuläre Basalaktivierungskarte auf der linken Seite (Abbildung 8D linkes Bild). Das System berechnet automatisch die Transfermatrix zwischen dem Rumpf und den Herznetzen, um die epikardiale elektrische Aktivität des Herzens auf der Grundlage der Grenzelementmethode 22,23,24 zu rekonstruieren.
HINWEIS: Die Aktivierungskarte zeigt das zeitliche Fortschreiten der Depolarisation im gesamten kardialen Epikard und hilft bei der Lokalisierung von Aktivierungsursprüngen und der Identifizierung von Wiedereintritts- oder Fokalmustern. Aktivierungen werden berechnet, indem (1) jedes rekonstruierte Elektrogramm in eine Summe sinusförmiger Wavelets für alle negativen Steigungszeitabtastungen und die Amplitude proportional zur Steigung zu diesem Zeitpunkt transformiert wird und (2) der Zeitpunkt der maximalen Amplitude des transformierten Signals als Zeitpunkt der Aktivierungszeit17 ausgewählt wird. - Schreiben Sie den Namen und speichern Sie die Basalkarte, indem Sie auf die Schaltfläche Karte speichern klicken, und schalten Sie die Karte in den Freeze-Modus , sobald sie reproduzierbar ist. Eine reproduzierbare ECGI-Karte weist eine konsistente Aktivierungsdauer und Ausbreitungsmuster über mindestens drei aufeinanderfolgende Karten auf.
HINWEIS: Bei CSP-CRT-Verfahren dient die Basalkarte (Abbildung 12A) als Referenz für die Bewertung der biventrikulären Synchronität während des Elektrodenschraubprozesses im septalen Bereich bis zum Erreichen des Bereichs des linken Bündelasts (Abbildung 12C). - Konfigurieren Sie die ECGI-Aktivierungsmapping-Analyse, indem Sie auf die Schaltfläche Optionen klicken, um optimale Karten während des Verschraubungs- und Stimulationsprozesses im Septumbereich zu erhalten:
- Wählen Sie Ventrikel analysieren , um nur die Ventrikel zu kartieren.
- Wählen Sie die Wavelet-basierte Analyseoption für den Aktivierungszeiten-Algorithmus aus.
- Wählen Sie die Option "Einzelbeat" für den Mapping-Typ aus, um die Welle eines einzelnen Beats zu analysieren und Änderungen der elektrokardiographischen Signale während des gleichzeitigen Schraub- und Stimulationsprozesses an verschiedenen Septumpositionen zu erfassen.
- Behalten Sie die Standardeinstellungen für die Funktionen "Offset-Korrektur", "Beat-Nummer" und " Sync-Option " bei.
- Legen Sie die Karte im rechten Bereich auf den Aktualisierungsmodus fest, um sicherzustellen, dass sie während des Verschraubungsvorgangs kontinuierlich mit jedem neu analysierten Single-Beat-QRS-Komplex aktualisiert wird.
- Synchronisieren Sie den Farbzuordnungsbereich der Karte im rechten Bereich mit der Basalkarte mithilfe des Menüs "Verknüpfte Werte " und verknüpfen Sie deren Kamerapositionen über das Menü "Verknüpfte Kamera" (Abbildung 8D rechter Bereich).
HINWEIS: Wenn die Elektrode in den Septumbereich geschraubt wird, werden automatisch Beat-to-Beat-ECGI-Maps an verschiedenen Positionen erstellt (d. h. rechtsventrikuläres Septum, mittleres Septum, tiefes Septum und linker Schenkel). Diese Karten werden mit der basalen Karte verglichen, indem der Farbkartenbereich über alle ausgewerteten ECGI-Karten hinweg standardisiert wird (Abbildung 12B, C). Dieser Aufbau ermöglicht eine klare Visualisierung von Änderungen in Aktivierungsmustern, während das Kabel festgeschraubt wird. - Schreiben Sie den Namen und speichern Sie jede Map, indem Sie auf die Schaltfläche Save Map klicken , wenn während des Verschraubungsvorgangs im Septumbereich eine Änderung des Aktivierungsmusters beobachtet wird, und fahren Sie fort, bis der Bereich des linken Bündelasts erreicht ist.
5. Zusätzliche nicht-invasive bildlose EKGI-Mapping-Analyse
HINWEIS: Aus den berechneten EKGI-Signalen können verschiedene kardiale Karten abgeleitet werden, um das kardiale Substrat zu beurteilen, Herzrhythmusstörungen zu charakterisieren, CRT zu bewerten oder klinisch relevante Metriken während des Eingriffs zu extrahieren. Die Art der Karten, die erstellt werden können, hängt vom spezifischen Herzrhythmus ab, der analysiert wird, mit unterschiedlichen Ansätzen für regelmäßige und unregelmäßige Rhythmen.
- Verwenden Sie den Abschnitt Signalanalyse des Echtzeitfensters , um die verschiedenen Rhythmen zu analysieren, die Patienten während des elektrophysiologischen Verfahrens aufweisen können:
- Analysieren Sie regelmäßige Rhythmen, indem Sie die Einzelschlag- oder Durchschnittsbeat-Analyse als Mapping-Typ-Funktion festlegen, wenn sich der Patient in einem stabilisierten/regelmäßigen Rhythmus befindet, z. B. Sinusrhythmus, atriale oder ventrikuläre Stimulation, Vorhofflattern oder ventrikuläre Tachykardie. Berechnen Sie die Aktivierungskarte und die Leitungsgeschwindigkeit (CV) aus der regulären Rhythmusanalyse.
- Analysieren Sie unregelmäßigen Rhythmus mit der Analyse des unregelmäßigen Rhythmusschlags als Mapping-Typ-Funktion, wenn der Patient unter Vorhofflimmern leidet. Das System ermöglicht die Auswahl erweiterter AF-Segmente (z. B. 1 min), um QRST-Komplexe zu unterdrücken und die dynamischen raumzeitlichen Muster des AF zu erfassen. Berechnen Sie das Phasen-Map, das Rotor-Histogramm-Map und das Dominantfrequenz-Map aus der Analyse des unregelmäßigen Rhythmus.
- Drücken Sie optional auf das Dropdown-Menü der Map-Auswahl und wählen Sie die Aktivierungs-Map, wenn ein regelmäßiger Rhythmus analysiert wurde. In Schritt 4.8 finden Sie eine detaillierte Beschreibung der Aktivierungszuordnung .
- Drücken Sie optional auf das Dropdown-Menü der Map-Auswahl und wählen Sie die Conduction Velocity Map, wenn ein regelmäßiger Rhythmus analysiert wurde.
HINWEIS: Die Leitungsgeschwindigkeit ist eine Metrik, die aus der Aktivierungskarte abgeleitet wird. Diese Metrik stellt die Zeit dar, die eine Wellenfront benötigt, um durch jeden Bereich des Epikards zu wandern. Die CV-Berechnung stützt sich auf räumliche Gradienten von Aktivierungszeitkarten über Herzoberflächen, wobei Geschwindigkeitsvektorfelder angewendet werden, um Regionen mit effektiver Ausbreitung zu identifizieren. Bereiche mit einheitlichen Richtungsvektoren zeigten eine stabile elektrische Ausbreitung an, während Bereiche mit Winkeldisparitäten, die auf eine ineffektive Ausbreitung hindeuten, unter Verwendung einer radialen Basisfunktion25 interpoliert werden. CV ermöglicht die Identifizierung von Bereichen der Leitungsverlangsamung während des Substrat-Mappings, die mit den Wiederauftretensraten von Arrhythmien zusammenhängen17. - Drücken Sie optional auf das Dropdown-Menü der Map-Auswahl und wählen Sie die Phasen-Map, wenn Sie einen unregelmäßigen Rhythmus analysieren.
HINWEIS: Die Phasenkarte verfolgt den Verlauf einer definierten Region des Myokards durch das Aktionspotential im Laufe der Zeit. Diese Art von Karte ist dynamisch, da sie den Verlauf des kardialen Potenzials darstellt. In der Phasenkarte wird die Hilbert-Transformation angewendet, um die Phase des ECGI-Signals zu berechnen. Jede Phase entspricht einem gegebenen Zustand des Aktionspotentials über jeden Zyklus des Signals (π für Ruhe, π/2 für die Depolarisation, 0 für das Plateau und -π für die Repolarisation)26. - Drücken Sie optional auf das Dropdown-Menü der Map-Auswahl und wählen Sie das Rotor-Histogramm-Map , wenn Sie einen unregelmäßigen Rhythmus analysieren.
HINWEIS: Eine Rotor-Histogramm-Map, die von einer Phasenkarte abgeleitet wurde, ist eine Darstellung der häufigsten Positionen von Phasensingularitäten, d. h. Bereiche mit konzentrierter Reentrantenaktivität, die rot dargestellt werden. Kurz gesagt, werden Phasensingularitäten als Schlüsselpunkte definiert, an denen die Phasenverschiebungen von -π zu π sind. PSs, die in ihrer Umgebung keinen allmählichen räumlichen Verlauf der Phasen zeigen, werden verworfen. Schließlich wird die Anzahl der Umdrehungen für jeden Rotor quantifiziert, um das Rotor-Histogramm-Map 18 zu erhalten. Die Präzision des Algorithmus bei der Identifizierung von Ausbreitungsmustern während des Vorhofflimmerns und der spezifischen Regionen, die einen Wiedereintritt aufweisen, wurde systematisch anhand der endokardialen Kartierung bewertet, wobei eine Korrelation von 71 % gezeigt wurde16. - Drücken Sie optional auf das Dropdown-Menü der Map-Auswahl und wählen Sie die Dominant Frequency (DF) Map aus, wenn Sie einen unregelmäßigen Rhythmus analysieren.
HINWEIS: DF-Karten zeigen die vorherrschende elektrische Frequenz in jeder Herzregion im Zeitverlauf an und helfen dabei, Bereiche mit schneller elektrischer Aktivität zu identifizieren, die als Treiber für Vorhofflimmern dienen können. DF wird als die Frequenz mit der höchsten spektralen Leistungsdichte im Welch-Periodogrammberechnet 27,28. Seine Analyse ermöglicht die Detektion von Bereichen mit hoher Stabilität oder Variabilität der Flimmeraktivität innerhalb der Vorhöfe. Ein Histogramm wird verwendet, um die zeitliche Verteilung der dominanten Frequenzen zu bewerten, eine klare und quantitative Darstellung der relevantesten elektrischen Aktivität zu liefern und die Identifizierung von Bereichen mit abnormalem Verhalten zu erleichtern.
Ergebnisse
Fall 1 - Planung und Anleitung der Katheterablation eines atypischen Vorhofflatters
Bei diesem Fall handelt es sich um einen 59-jährigen männlichen Patienten (Body-Mass-Index -BMI- 30) mit einer Vorgeschichte von Bluthochdruck, Rauchen, Herzklappenerkrankungen, EHRA IIb-Klassifikation und einem CHA2DS 2-VASc-Score von 1 mit einer Indikation einer Katheterablation aufgrund von atypischem Vorhofflattern (AFL) basierend auf einem 12-Kanal-EKG (Abbildung 9A). Der Patient hatte keine Vorgeschichte einer Katheterablation. Die präprozedurale späte Gadolinium-Enhancement-MRT (LGE-MRT) zeigte eine ausgedehnte Fibrose in der hinteren Wand des linken Vorhofs (LA) mit einer normalen LA-Planimetrie von 24 cm² und einer erhaltenen linksventrikulären Ejektionsfraktion (LVEF) von 54%.
Das nicht-invasive bildlose EKGI wurde nur wenige Minuten vor der Kathetereinführung über eine Femurschleuse durchgeführt. Für die Analyse wurde ein vollständiger Zyklus des AFL (209 ms) ausgewählt, der frei von QRST-Komplexen ist. Die Kartierung zeigte einen Makro-Reentranten-Schaltkreis um die Mitralklappe (MV), der die perimitrale Linie als optimales Ablationsziel für die Beendigung der Arrhythmie lokalisierte (Abbildung 9B). Im Anschluss daran wurde eine kontaktbasierte EAM (Abbildung 9C) durchgeführt, die das im nicht-invasiven bildlosen EGGI beobachtete Ausbreitungsmuster bestätigte. Die Ablation entlang der perimitralen Linie beendete die Arrhythmie erfolgreich.
In diesem klinischen Fall wurde die Arrhythmie vor der invasiven EAM genau charakterisiert, was eine präzise Lokalisierung des Ausbreitungsmusters der Arrhythmie ermöglichte und das Ablationsverfahren rationalisierte. Bei komplexen atrialen Tachykardien wie AFL oder fokaler Tachykardie bietet das bildlose ECGI jedoch ein Echtzeit-Single-Beat-Mapping, was es besonders wertvoll bei nicht anhaltenden Arrhythmien macht. Seine Anpassungsfähigkeit an Veränderungen der Arrhythmiemuster während eines Eingriffs gewährleistet ein präzises und dynamisches Mapping. Während die Diagnose einer AFL gegen den Uhrzeigersinn in der Regel anhand eines 12-Kanal-EKGs einfach ist, kann es eine Herausforderung sein, den Mechanismus komplexer Tachyarrhythmien genau zu lokalisieren und zu identifizieren. Folglich kann die Durchführung eines bildlosen EKGis in ärztlicher Beratung oder Minuten vorher die Verfahrenssicherheit und -effizienz erhöhen, indem es eine vorgelagerte Anleitung für die Planung der Katheterablation bietet und unnötige transseptale Zugänge eliminiert.
Fall 2 - Entwicklung von Phasensingularitäten während der Katheterablation bei persistierendem Vorhofflimmern
Bei diesem Fall handelt es sich um einen 63-jährigen männlichen Patienten (BMI 31) mit erhaltener linksventrikulärer Ejektionsfraktion (LVEF, 55%), keiner dilatativen LA, und die New York Heart Association (NYHA) von I war aufgrund von persistierendem Vorhofflimmern für eine Katheterablation indiziert. Es wurde keine präprozedurale CT- oder MRT-Bildgebung durchgeführt. Der Patient hatte im Dezember 2019 eine Katheterablation zur Pulmonalvenenisolierung (PVI) in der Vorgeschichte.
Bei seiner Ankunft hatte der Patient Vorhofflimmern. Das Substrat-Mapping wurde während des gesamten Ablationsverfahrens mit einem bildlosen ECGI durchgeführt (Abbildung 10A). Zu Studienbeginn identifizierte das ECGI Phasensingularitäten in der Seitenwand des rechten Vorhofs (RA), der Basis des rechten Vorhofohrs (RAA), der linken Vorhofhinterwand (PW) und der Basis des linken Vorhofohrs (LAA). Diese Befunde korrelierten mit hochfrequenten und fragmentierten EGMs, die mit endocavitarischen Kathetern beobachtet wurden, und eine adäquate PVI wurde durch die LA EAM-Rekonstruktion bestätigt. An der LAA-Basis wurde eine Pulsfeldablation (PFA) eingeleitet, die zu einem Rhythmuswechsel von AF zu atypischer AFL führte. Das bildlose ECGI zeigte ein perimitrales AFL, das durch Entrainment vom distalen Pol des Koronarsinuskatheters bestätigt wurde. Es entstand eine Mitrallinie; Vorhofflimmern wurde jedoch wieder induziert. Anschließend wurde eine vollständige PW-Isolierung erreicht. Trotzdem identifizierte das bildlose ECGI weiterhin signifikante Phasensingularitäten an der RAA-Base. Nach mehreren PFA-Anwendungen, die auf diesen Bereich abzielten, wurde ein Sinusrhythmus erreicht (Abbildung 10B).
Dieser klinische Fall ist ein Beispiel dafür, wie Vorhofflimmern aufgrund der hohen Variabilität der elektrischen Aktivität in den Vorhöfen einzigartige Herausforderungen mit sich bringt. Das bildlose ECGI erfasste effektiv räumlich-zeitliche Muster der AF-Progression während der Ablation, wobei bis zu drei nicht-invasive Karten aufgenommen wurden, um die Substratmodifikation bis zum Erreichen der SR zu steuern. Standardbehandlungen, wie die Isolierung der Lungenvenen, haben relativ hohe Rezidivraten29. Die Hauptschwierigkeiten bei der Behandlung von Vorhofflimmern liegen in zwei Bereichen: (1) der Bestimmung, welche Patienten allein von PVI profitieren werden, und (2) bei denjenigen, die einen breiteren Ansatz benötigen, die Identifizierung der Regionen außerhalb des PVI-Bereichs, deren Ablation das Wiederauftreten von Arrhythmien am effektivsten reduziert. Während des Sinusrhythmus hat das bildlose ECGI die Fähigkeit gezeigt, CV-Karten zu erstellen, die sich bei der Vorhersage des Erfolgs der PVI-Ablation als nützlich erwiesenhaben 17. In diesem Fall erfasste das bildlose ECGI jedoch gleichzeitig die Dynamikmuster des Vorhofflimmerns, was den Ärzten einen umfassenden Überblick darüber gab, wie sich Vorhofflimmern ausbreitet, und dabei half, Schlüsselregionen zu identifizieren, die die Arrhythmie verursachen. Die Ergebnisanalyse sollte sich auf die Korrelation zwischen den ablierten bildlosen EKGI-detektierten Vorhofflimmertreibern und klinischen Endpunkten, wie z. B. dem langfristigen arrhythmiefreien Überleben, konzentrieren, um ihren Nutzen bei der Optimierung von AF-Ablationsstrategien weiter zu validieren.
Fall 3 - Anleitung zur Optimierung der biventrikulären Stimulation für die kardiale Resynchronisationstherapie
Bei diesem Fall handelt es sich um eine 67-jährige Patientin mit nicht-ischämischer dilatativer Kardiomyopathie, einer LVEF von 25%, keinem Hinweis auf eine späte Gadolinium-Anreicherung in der präprozeduralen MRT, mit einem Linksschenkelblock (LBBB) im Ausgangs-EKG und einer QRS-Dauer von 156 ms. Der Patient war für eine biventrikuläre Stimulation (BiVP) im Rahmen einer CRT indiziert.
Während des kardialen CRT-Verfahrens wurde ein bildloses Echtzeit-EKG verwendet, um die ventrikuläre Synchronisation vor und nach der Herzschrittmacherimplantation zu beurteilen. Im Ausgangsrhythmus wurde die späteste Aktivierungsregion des Patienten in der basal-lateralen Wand des linken Ventrikels (LV) identifiziert, wie in Abbildung 11A dargestellt. Die ventrikuläre Gesamtaktivierungszeit (TAT) wurde bei 116 ms gemessen, was auf eine signifikante ventrikuläre Asynchronität hinweist. Verschiedene Gerätekonfigurationen wurden mittels ECGI evaluiert, wobei der optimale Aufbau als BiVP unter gleichzeitiger Aktivierung der distalen und proximalen Pole der LV-Elektrode und einer atrioventrikulären Verzögerung von 140 ms bestimmt wurde. Wie in Abbildung 11B gezeigt, führten die drei ventrikulären Stimulationspunkte zu keinen spät aktivierten Regionen, was auf eine erfolgreiche Synchronisation hindeutet, mit einer verbesserten TAT von 70 ms.
Die kardiale Resynchronisationstherapie zielt darauf ab, die elektrische Koordination in den Ventrikeln wiederherzustellen und die Herzfunktion bei Patienten mit Herzinsuffizienz und verlängertem QRS zu verbessern. In diesem Fall lieferte das bildlose ECGI ein Echtzeit-Mapping, das für die BiVP-Optimierung während des CRT-Verfahrens von entscheidender Bedeutung war. Es ermöglichte eine präzise Bewertung ventrikulärer Aktivierungsmuster und half bei der Identifizierung der optimalen Gerätekonfiguration, um eine vollständige ventrikuläre Synchronisation zu gewährleisten. Die nicht-invasive Natur und das unmittelbare Feedback von ECGI ermöglichten es den Klinikern, die Elektrodenprogrammierung zu verfeinern. Im Gegensatz dazu betonen Studien zwar den Wert des ECGIs bei der Steuerung der linksventrikulären Elektrodenplatzierung in der Nähe der zuletzt aktivierten Region30, anatomische Einschränkungen können jedoch seine Anwendbarkeit einschränken. Durch das ECGI bestimmte basale und finale Resynchronisationsparameter, wie z. B. TAT, sollten mit den klinischen Ergebnissen in Beziehung gesetzt werden, indem das klinische Ansprechen des Patienten auf die CRT im Laufe der Zeit überwacht wird, einschließlich der Verbesserung der Symptome und der langfristigen ventrikulären Funktion.
Fall 4 - Führung eines Implantats mit Reizleitungssystem für die kardiale Resynchronisationstherapie in Echtzeit
Bei diesem klinischen Fall handelt es sich um eine 45-jährige Patientin mit schwerer ventrikulärer Dysfunktion (LVEF 15%) und LBBB mit einer QRS-Dauer von 172 ms. Der Patient war für einen implantierbaren kardiovertierten Defibrillator CRT mit einem Conduction System (CSP)-Stimulationsansatz indiziert.
Während der Geräteimplantation wurde ein bildloses Echtzeit-EKGI verwendet, um die ventrikuläre Synchronität während des gesamten Prozesses der Elektrodenverschraubung im Septumbereich zu überwachen. Wie in Abbildung 12 gezeigt, identifizierte die ECGI-Basiskarte die laterale Wand des LV als den zuletzt aktivierten Bereich mit einer TAT von 133 ms. Das Beat-to-Beat-ECGI-Mapping während der Elektrodenverschraubung zeigte eine fortschreitende Verbesserung der ventrikulären Synchronität, wobei eine optimale Synchronisation beim Erreichen des linken Bündelastes erreicht wurde, was zu einer TAT von 95 ms führte.
Dieser Fall zeigte das Potenzial des bildlosen Echtzeit-EKGis zur Steuerung der LBBP-Implantation während eines CRT-Verfahrens. Die Single-Beat-Echtzeit-Mapping-Funktionen ermöglichten die Analyse der ventrikulären TAT und die Resynchronisation bei jedem Schritt der Elektrodenimplantation im Septumbereich. Das System bot eine schnelle, visuelle und leicht zu interpretierende Metrik, die den Mangel an Standardisierung bei elektrokardiographischen CSP-Kriterien behebt. Neben BiVP-CRT-Verfahren sind weitere Studien erforderlich, um festzustellen, ob bildlose EKG-Parameter signifikant mit dem klinischen CRT-Ansprechen korrelieren und wie sie im Vergleich zu 12-Kanal-EKG-Prädiktoren abschneiden.
Fall 5 - Planung und Anleitung der Katheterablation bei ventrikulärer Tachykardie
Bei diesem Fall handelt es sich um einen 53-jährigen männlichen Patienten (BMI 25,4) mit ischämischer Kardiomyopathie, schwerer ventrikulärer Dysfunktion (LVEF 15 %), und NYHA Klasse II wurde aufgrund einer rezidivierenden VT zu einem Katheterablationsverfahren überwiesen. Die präprozedurale MRT zeigte eine ausgedehnte endokardiale Fibrose und arrhythmogene Kanäle, die an den inferobasalen und infero-medialen Segmenten des linken Ventrikels lokalisiert sind. Der Patient hatte in der Vorgeschichte eine VT-Katheterablation im Jahr 2018.
Während des gesamten Eingriffs wurden gleichzeitig ein bildloses EKGI-Mapping (Abbildung 13A) und ein invasives EAM (Abbildung 13B) durchgeführt. Der Katheterablationsprozess umfasste ein substratbasiertes Mapping während der rechtsventrikulären (RV) apikalen Stimulation und der VT-Induktion mittels programmierter Stimulation. Das bildlose ECGI identifizierte eine Region, in der sich die Reizleitung im inferobasalen Segment des LV während des Sinusrhythmus-Mappings vor der Kathetereinführung verlangsamte. Dieser Befund stimmte mit der im MRT beobachteten Fibrose überein. Die anschließende Stimulation von der rechtsventrikulären (RV) Spitze aus bestätigte eine Verlangsamung der Überleitungsleitung im basalen und medialen Segment des LV, wodurch dieser Bereich als wahrscheinliches arrhythmogenes Substrat identifiziert wurde. Eine VT mit einer Zykluslänge von 380 ms wurde kurzzeitig induziert, was aufgrund der hämodynamischen Instabilität eine Kardioversion erforderte. Folglich wurde nur eine begrenzte Anzahl von EAM-Punkten erworben. Unter Verwendung eines einzigen VT-Zyklus identifizierte das bildlose ECGI jedoch erfolgreich den VT-Isthmus in derselben Region, in der isochrones Crowding in den schrittweisen Karten beobachtet wurde.
Der Einsatz von bildlosem Echtzeit-ECGI in diesem VT-Fall löste erfolgreich zwei große klinische Herausforderungen im VT-Management: (1) die präzise Lokalisierung potenzieller Ablationsziele während des Sinusrhythmus und (2) die Charakterisierung von VT mit hämodynamischer Instabilität. Mit einem einzigen Schlag wurde der VT-Isthmus sowohl in den Substrat- als auch in den Arrhythmieaktivierungskarten genau identifiziert. Das System ermöglichte es den Bedienern, arrhythmogene Substrate vor oder während der Ablation zu identifizieren und mehrere induzierbare VTs in Echtzeit aus einem einzigen Zyklus zu charakterisieren.

Abbildung 1: Bildlose ECGI-Hardwarekomponenten. (A) Bipotenter Verstärker mit speziellen Kabelanschlüssen. (B) Rechte und linke Kabel, ausgestattet mit Verstärkeranschlüssen an einem Ende und Sensorwestenbuchsen am anderen Ende. (C) Konfiguration mit dem rechten und linken Kabel, das an den Bipotential-Verstärker angeschlossen ist. (D) Schematischer Ablauf des Verfahrens zum Anschließen der Sensorweste an die Kabelbuchsen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Verfahren des 3D-Scanners zur Torsorekonstruktion. (A) Die 128-Kanal-Körperoberflächen-Potentialsensorweste, bestehend aus vier Komponenten (Vorder-Rechts, Vorder-Links, Hinten-Rechts, Hinten-Links), wird vor der 3D-Rekonstruktion auf den Oberkörper des Patienten aufgesetzt. Jede Elektrode verfügt über einen eindeutigen QR-Code zur automatischen Identifizierung. Die Verbindungen zwischen den Elektroden können gefaltet werden, um die Weste an die Körperform des Patienten anzupassen. (B) Der QR-Code auf der Vorder-Rechts-Komponente validiert die Weste und ermöglicht es der 3D-Scanner-Anwendung, die Rekonstruktion des Oberkörpers zu initiieren. (C) Die 3D-Scanner-Plattform erzeugt über die 3D-Scanner-Anwendung den rekonstruierten Torso mit Hilfe einer Infrarot-Kamera mit strukturiertem Licht. Abkürzungen: FR: vorne-rechts; FL: vorne links; BR: hinten rechts; und BL: hinten links. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Anmeldebildschirm der ECGI-Benutzeroberfläche ohne Bild, der einen bestimmten Benutzernamen und ein Kennwort für den Zugriff auf die Software erfordert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
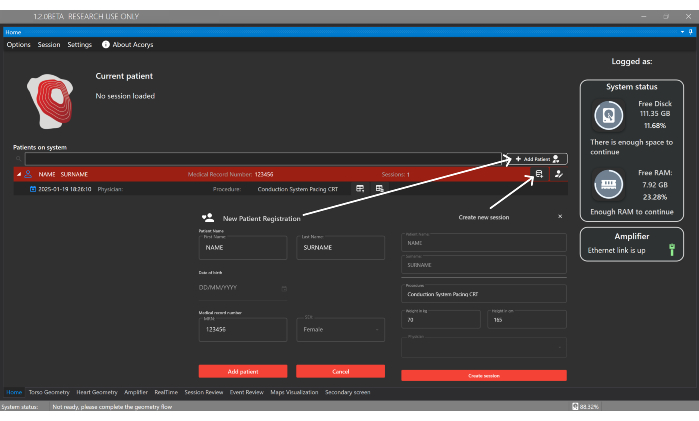
Abbildung 4: Home-Fenster. Das Home-Fenster ermöglicht die Verwaltung von Patienten, Ärzten und Benutzern sowie die Konfiguration von Patientensitzungen. Es zeigt auch Informationen über die importierten Sessions und den Status des Systems und des Verstärkers an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Fenster "Torsogeometrie". Das Fenster "Torsogeometrie " ermöglicht es Benutzern, das 3D-Torsomodell hochzuladen und anzuzeigen, Elektroden zu segmentieren und die Art der Herzgeometrie über die Schaltfläche "Geometrie berechnen " auszuwählen, die die Schätzung ermöglicht oder eine Segmentierung aus personalisierter CT/MRT ermöglicht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Schätzung der kardialen Geometrie. (A) SSM-Algorithmus unter Verwendung basaler Merkmale und der 3D-Torsorekonstruktion des Patienten zur Schätzung der Herzgeometrie. (B) Geschätzte kardiale Geometrie innerhalb des SSM des Rumpfes mit antero-posteriorer (links) und postero-anteriorer (rechts) Ansicht. Abkürzungen: 3D: dreidimensional; SSM: Statistisches Formmodell. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
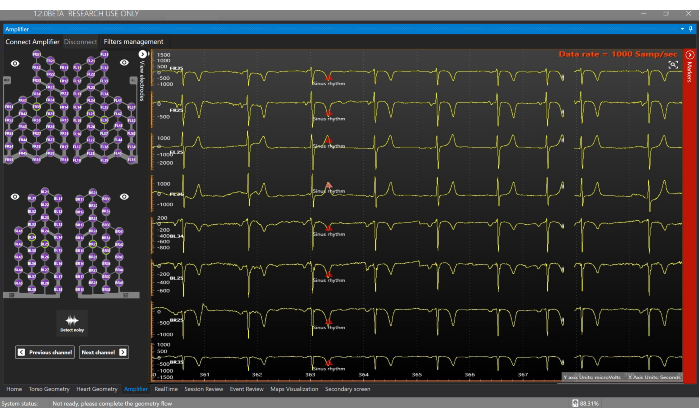
Abbildung 7: Verstärker-Fenster. Das Verstärkerfenster ermöglicht die Echtzeit-Visualisierung der Signale, die von jeder Elektrode der Sensorweste empfangen werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 8: Echtzeitfenster. (A) Schematische Darstellung der aktiven Elektroden aus der Elektrodenarray-Weste mit hoher Dichte. Grüne Elektroden enthalten Signale von guter Qualität, während rote Elektroden verrauschte Signale enthalten und nicht an der Berechnung des inversen Problems teilnehmen. (B) Schätzung der 12 Ableitungen des Elektrokardiogramms in Echtzeit. (C) Automatisches Auslösen und Abgrenzen des Beginns und Offsets des QRS-Komplexes (grünes Fenster). Das durchschnittliche Signal aller Leitungen, die an der Mapping-Berechnung beteiligt sind, wird in Blau dargestellt. (D) Der Abschnitt "Kartenvisualisierung" unterstützt Einzel-, Doppel- oder Vier-Kartenansichten. Dieses Beispiel zeigt eine Dual-Mapping-Ansicht mit Aktivierungszuordnungen für den Status der basalen und linken Bündelverzweigung (endgültige Zuordnung) während einer CRT-Prozedur. Die Basalkarte befindet sich im Einfriermodus und bleibt statisch, während sich die endgültige Karte im Aktualisierungsmodus befindet und mit jedem neu analysierten QRS-Komplex neu berechnet wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
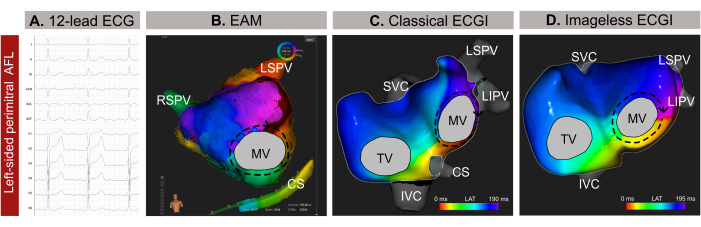
Abbildung 9: Grafisches Beispiel eines linksseitigen atypischen AFL und die unterschiedlichen diagnostischen Möglichkeiten des 12-Kanal-EKGs, des bildlosen EKGis und des invasiven EAM. (A) Die 12-Kanal-EKG-Signale des atypischen AFL weisen in V1 positive supraventrikuläre Wellen auf. (B) Bildloses EKG unter Verwendung einer geschätzten Herzgeometrie aus einem SSM und mit einer antero-posterioren Ansicht. Der Ausbreitungskreis zeigt alle Farben um das MV herum, ein typisches Muster für eine perimitrale AFL. (C) Das lokale Aktivierungsmapping, das aus dem EAM abgeleitet wurde und eine antero-posteriore Ansicht zeigt, zeigt einen Makro-Wiedereintritt um das MV, was die Diagnose des bildlosen EKGI bestätigt. Abkürzungen: EKG: Elektrokardiogramm; EAM: elektroanatomische Kartierung; EKGI: elektrokardiographische Bildgebung. SVC: obere Hohlvene; IVC: untere Hohlvene; CS: Koronarsinus; LSPV: linke obere Lungenvene; RIPV: rechte untere Lungenvene; RSPV: rechte obere Lungenvene. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
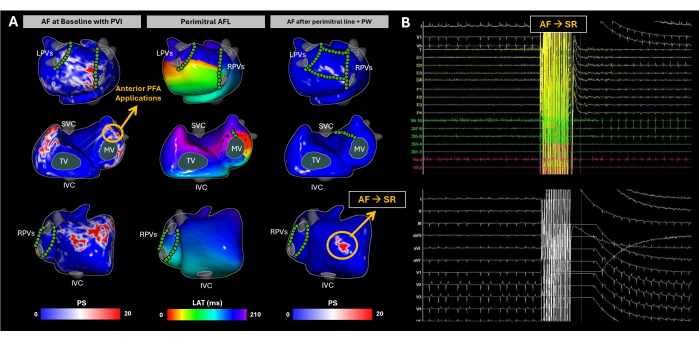
Abbildung 10: Verfolgung der Evolution des atrialen Substrats während der AF-Katheterablation mittels nichtinvasiver bildloser EKGI-Kartierung. (A) Postero-anteriore, antero-postero und rechtslaterale Ansichten eines bildlosen EKGIs, wobei PFA-Stellen durch grüne Kreise markiert sind. Die PS-Basiskarte zeigt Wiedereintritte in der RA-Seitenwand, der RAA-Basis, der LA-Hinterwand und der LAA-Basis. PFA an der LAA-Basis stellte den Rhythmus auf perimitrale AFL um. Trotz der vollständigen Isolierung der Mitrallinie und der hinteren Wand wurde das Vorhofflimmern spontan erneut induziert. ECGI entdeckte PS in der RAA-Basis, die zum Ablationsziel wurde. In diesem Bereich wurden mehrere PFA-Anwendungen durchgeführt, und der Sinusrhythmus wurde wiederhergestellt. (B) Das 12-Kanal-EKG und die intrakardialen Signale zum Zeitpunkt der Umstellung des Vorhofflimmerns auf SR. Abkürzungen: SVC: obere Hohlvene; IVC: untere Hohlvene; LPVs: linke Lungenvenen; RPVs: rechte Lungenvenen; AF: Vorhofflimmern, SR: Sinusrhythmus, PS: Phasensingularitäten, LAT: lokale Aktivierungszeiten, TV: Trikuspidalklappe, MV: Mitralklappe, PVI: Pulmonalvenenisolierung, AFL: Vorhofflattern, PW: Hinterwand und PFA: gepulste Feldablation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
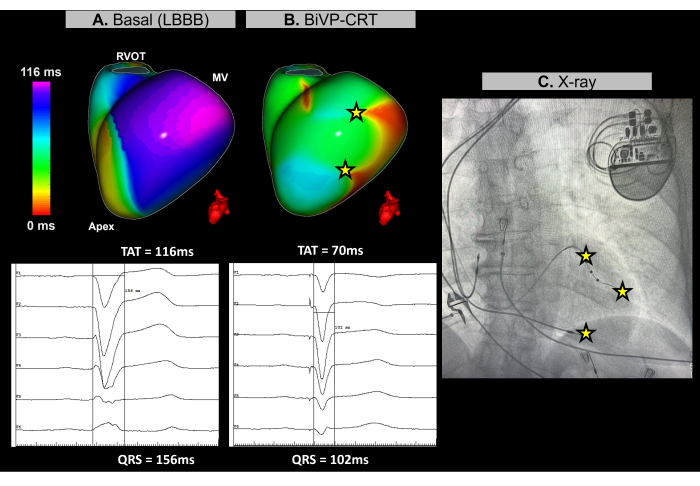
Abbildung 11: Optimierung der biventrikulären Stimulation mittels bildlosem EKGI. (A) Ausgangsrhythmus des Patienten. Die bildlose EKGI-Karte (links-laterale Ansicht) zeigt eine spät aktivierte Region (violett) in der lateralen Wand des LV mit einer TAT von 116 ms, was auf eine ventrikuläre Dyssynchronie hinweist. Dies stimmt mit dem Basis-EKG überein, das einen breiten QRS-Komplex (156 ms) mit einem LBBB-Muster zeigt. (B) Konfiguration nach der Implantation eines Herzschrittmachers. Nach der BiVP mit gleichzeitiger Aktivierung der distalen und proximalen Pole der LV-Elektrode und einer atrioventrikulären Verzögerung von 140 ms zeigt die bildlose EKGI-Karte keine verzögert aktivierten Regionen (kein violetter Bereich), was auf eine synchrone ventrikuläre Aktivierung und eine reduzierte TAT von 70 ms hinweist. Dies stimmt mit dem verkürzten QRS-Komplex überein, der im abschließenden EKG beobachtet wurde, bei dem die QRS-Dauer auf 102 ms abnimmt. (C) Antero-posteriore Röntgenaufnahme des implantierten Herzschrittmachers, die die Position der Schrittmacherelektroden zeigt. Die Stimulationsaktivität sowohl des distalen als auch des proximalen Pols der LV-Ableitung spiegelt sich ebenfalls in der ECGI-Karte wider. Abkürzungen: LBBB: Linksschenkelblock, BiVP: biventrikuläre Stimulation, CRT: kardiale Resynchronisationstherapie, RVOT: rechtsventrikulärer Ausflusstrakt, MV: Mitralklappe, TAT: Gesamtaktivierungszeit. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
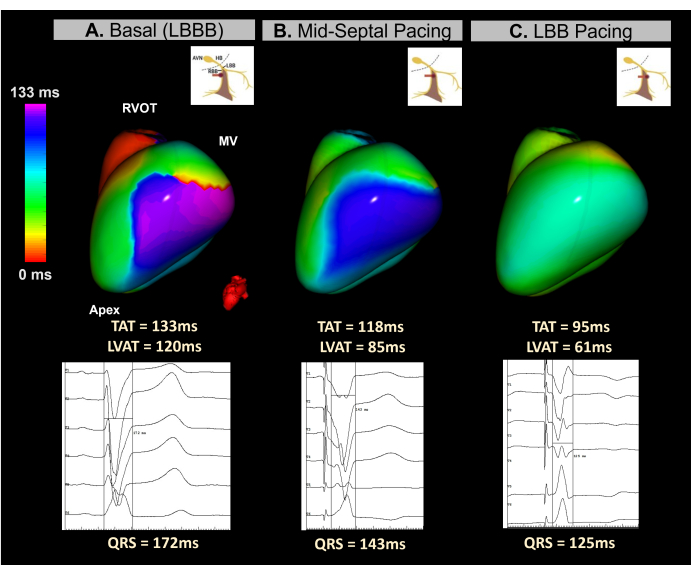
Abbildung 12: Nichtinvasive Bewertung der CRT über die Stimulation des Leitungssystems unter Verwendung eines bildlosen EKGs. (A) Ausgangsrhythmus des Patienten. Die EKGI-Karte (links-laterale Ansicht) zeigt eine Region mit verzögerter Aktivierung (violett) an der lateralen Wand des LV mit einer TAT von 133 ms, was auf eine ventrikuläre Dyssynchronie hindeutet. Dies entspricht dem Basis-EKG, das einen für LBBB typischen breiten QRS-Komplex (172 ms) aufweist. (B) Zwischenphase (mittlere septale Stimulation) während der Implantation der LBBP-Elektrode. Die nicht-invasive Karte zeigt eine partielle Korrektur der verzögerten Region in der LV, wobei sich die Farbe von violett nach blau verschiebt. Dies geht einher mit einer Verkürzung der Dauer des QRS-Komplexes. (C) Die endgültige Position der LBBP-Leitung während des Schraubvorgangs. Die Karte zeigt eine vollständige Korrektur des verzögerten Bereichs, wobei die Farbe von violett zu grün übergeht, was auf eine synchrone Aktivierung beider Ventrikel hinweist. Abkürzungen: LBBB: linker Schenkelblock, LBB: linker Schenkel, RVOT: rechtsventrikulärer Ausflusstrakt, MV: Mitralklappe, TAT: Gesamtaktivierungszeit. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
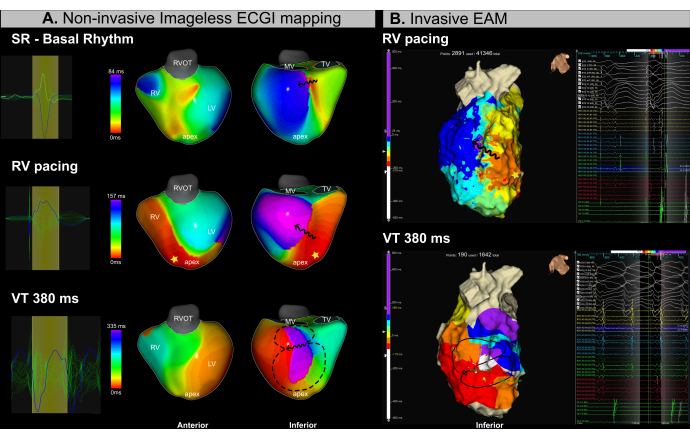
Abbildung 13: Nichtinvasive Beurteilung des VT-Isthmus mittels bildlosem EKGI. (A) Bildloses EKGI-Mapping während des VT-Ablationsverfahrens identifiziert das arrhythmogene Substrat und den VT-Isthmus in den inferobasalen und infero-medialen Regionen des LV. Die erste Reihe entspricht dem Sinusrhythmus, die mittlere Reihe der apikalen RV-Stimulation und die untere Reihe der VT. (B) Invasive EAM, die während des VT-Ablationsverfahrens erhalten wurden, zeigen eine isochrone Aktivierungskartierung in denselben Regionen, die mit dem ECGI identifiziert wurden. Die obere Zeile entspricht der apikalen Stimulation von RV, während die untere Reihe VT darstellt. Abkürzungen: RV: rechter Ventrikel, LV: linker Ventrikel, SR: Sinusrhythmus, RVOT: rechtsventrikulärer Ausflusstrakt, MV: Mitralklappe, TV: Trikuspidalklappe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Diese methodische Beschreibung unterstreicht den klinischen Nutzen eines nicht-invasiven Single-Beat- und Echtzeit-EKGI-Ansatzes, der eine Vielzahl von elektrophysiologischen Verfahren wie Katheterablation und CRT unterstützen kann, ohne dass eine präprozedurale kardiale Bildgebung wie CT oder MRT erforderlich ist 15,17,31,32 In diesem Bericht zeigt das bildlose EKGI die wichtigsten technischen Merkmale, die seine klinische Einführung fördern können. Während sich das ECGI bereits als leistungsfähiges Instrument für die kardiale Kartierung eines breiten Spektrums von Arrhythmien erwiesenhat 19,33,34,35,36, steht es weiterhin vor mehreren klinischen und technischen Herausforderungen 13,14.
Klassische EKG-Systeme benötigen einen CT-Scan speziell am selben Tag wie das Herzmapping, wobei die EKGI-Elektroden an Ort und Stelle sind 9,10,12,37,38. Dieser Ansatz fügt zusätzliche Zeit hinzu, da eine CT-Scan-Segmentierung (Herz und Elektroden) erforderlich ist, wodurch die Erstellung der anfänglichen EKGI-Karte um ca. 1-3 Stunden verzögert wird. Im Gegensatz dazu verwendet das in diesem Bericht vorgestellte bildlose EKGI-System einen Infrarot-3D-Scan des Thorax mit Array-Elektroden mit hoher Dichte, der nur wenige Minuten vor dem Eingriff oder während medizinischer Konsultationen durchgeführt werden kann15,17. Das System segmentiert automatisch die Thoraxelektroden und schätzt die Herzgeometrie des Patienten, wodurch der nichtinvasive kardiale Mapping-Prozess optimiert und die Zeit zwischen der Ankunft des Patienten und der Verfügbarkeit der ersten EKGI-Karte erheblich verkürzt wird. Frühere Validierungen des bildlosen EKGI-Ansatzes haben gezeigt, dass die Verwendung der geschätzten Herzgeometrie minimale Fehler verursacht und die Genauigkeit der nicht-invasiven Karten erhalten bleibt. Bei Patienten mit Vorhofflimmern wurde eine starke Korrelation zwischen EKGI-Signalen, die aus geschätzten und tatsächlichen Herzgeometrien abgeleitet wurden, beobachtet, selbst bei geometrischen Translationen15. Bei regelmäßigen Arrhythmien, wie z. B. komplexer atrialer Tachykardie, zeigten Vergleiche mit EAM eine hohe Genauigkeit bei der Identifizierung der beteiligten Herzkammer, der Bestimmung des Mechanismus (fokal oder reentrant) und der Ableitung des Ablationsziels31. Im Falle der VT wurde der Ansatz evaluiert, um die Bediener zu Bereichen mit VT-Isthmus während des Sinusrhythmus (SR) zu führen39, was das Potenzial zeigt, Patienten mit VT-Risiko in der Primärprävention zu identifizieren. Darüber hinaus wurde eine starke regionale Kongruenz zwischen bildlosen EKGI- und EAM-Aktivierungskarten während der Stimulation der Koronarsinus beobachtet, insbesondere an frühen und späten Aktivierungsstellen40.
Bei der CRT werden morphologische Veränderungen im 12-Kanal-EKG in Echtzeit in der Regel verwendet, um die Resynchronisation während der Elektrodenimplantation zu bestätigen, insbesondere bei CSP-Eingriffen, bei denen das EKG in verschiedenen Stadien der septalen Elektrodenplatzierung ausgewertet wird, bis der LBB-Bereich erreicht ist. Die veröffentlichten EKG-Algorithmen sind jedoch oft komplex, weisen erhebliche Unterschiede zwischen ihnen auf und sind in einigen Fällen in der klinischen Praxis schwer zu implementieren 41,42,43. Möglicherweise aufgrund dieser Komplexität wurde kein spezifischer elektrokardiographischer Parameter für die Stimulation des linken Schenkels (LBBP) identifiziert, der zuverlässig vorhersagen kann, ob ein Patient auf eine kardiale Resynchronisation ansprechen wird. Der bildlose Echtzeit-EKGI-Ansatz bietet ein einfaches und detailliertes Beat-by-Beat-Mapping während der gesamten Elektrodenimplantation, wobei die Dyssynchroniekorrektur durch Auswertung von Parametern wie der linksventrikulären Aktivierungszeit bewertet wird, wie bei Patienten mit CRT-Indikation32 oder Patienten mit AV-Block44 nachgewiesen wurde. Daher könnten Echtzeit-EKGI-Parameter bei weiteren Untersuchungen den Bediener möglicherweise bei der Optimierung der Elektrodenimplantation oder der Vorhersage des Ansprechens des Patienten auf die CRT unterstützen.
Obwohl das Potenzial des bildlosen Echtzeit-EKGis in diesem methodischen Bericht vorgestellt wurde, zielen auch andere neuartige nicht-invasive Kartierungsansätze mit Arrhythmie-Simulationen darauf ab, die Notwendigkeit einer präprozeduralen Bildgebung zu eliminieren. Die Studie zur vektorkardiographischen Kartierung der arrhythmogenen Wahrscheinlichkeit (VMAP) zeigte eine signifikante regionale Genauigkeit bei der Lokalisierung ventrikulärer Arrhythmiestellen45 und ist vielversprechend bei der Identifizierung der Lokalisation von Vorhofflimmer-Treibern jenseits der Nicht-PVI-Ablation46. VMAP verwendet das 12-Kanal-EKG in Kombination mit mehreren Computermodellen, um Arrhythmieziele zu identifizieren, ohne sich auf patientenspezifische geometrische Daten verlassen zu müssen. Dieser Ansatz kann jedoch bei atrialen Arrhythmien wie Vorhofflimmern suboptimal sein, bei denen hochfrequente Komponenten im Oberflächen-EKG entscheidend sind, um Arrhythmietreiber nicht-invasiv zu identifizieren. Diese Komponenten werden typischerweise von Elektroden an der hinteren und anterolateralen Oberfläche27 erfasst, die in dem in der klinischen Praxis verwendeten Standard-12-Kanal-EKG nicht dargestellt sind.
Trotz des Bedarfs an weiteren klinischen Untersuchungen hat das bildlose Echtzeit-EKG das Potenzial, ein wertvolles Werkzeug für die nichtinvasive kardiale Kartierung eines breiten Spektrums von Herzrhythmusstörungen zu werden. Die methodische Einfachheit und der optimierte Patientenablauf im Krankenhaus ermöglichen es Klinikern, mehr klinische Daten zu sammeln, was sowohl die Patientenergebnisse als auch zukünftige technologische Fortschritte verbessern könnte. Zusammenfassend lässt sich sagen, dass die Zukunft des nicht-invasiven kardiologischen Mappings in der Entwicklung hin zu einem vollständig bildlosen Ansatz liegt, der eine schnellere und reibungslosere Integration in die tägliche klinische Praxis ermöglicht, von Routinekonsultationen bis hin zu Echtzeit-Mappings bei elektrophysiologischen Eingriffen.
Offenlegungen
JRP, BPS, JSC, IHR, RM, CF, EZ, JM, DL, FA, MSG und AMC erhielten die Ehrenauszeichnung von Corify Care SL. AMC, MSG und FA sind Mitbegründer von Corify Care SL und JRP, BPS, JSC, IHR, JM, DL, JBG, FA, LM, MSG und AMC sind Anteilseigner. TFA hat Forschungsstipendien von Biosense-Webster erhalten. IRL hat Honorare als Dozent und Berater von Abbott und Biosense-Webster erhalten. APS hat Honorare für Referenten und Berater von Bisosense-Webster, Abbott und Boston-Scientific erhalten. JMT hat Honorare als Dozent und Berater von Abbott, Boston-Scientific und Medtronic erhalten. EA hat von Biosense-Webster und Bayer Honorare für Referenten und Berater erhalten. LM meldet Honorare als Berater, Dozent und Beirat von Boston-Scientific, Abbott, Johnson&Johnson und Medtronic und ist Anteilseigner von Galgo Medical SL. JBG meldet Honorare als Berater und Referent von Microport CRM und Abbott, zusätzlich zu der uneingeschränkten Unterstützung eines Stipendiums von Abbott. MPL hat von Medtronic ein Honorar für Referenten erhalten.
Danksagungen
Diese Forschung wurde vom Europäischen Innovations- und Technologieinstitut (EIT) im Rahmen der Finanzhilfevereinbarung SAVE-COR Nr. 220385 und aus dem von der Generalitat Valenciana (EFICACIA) finanzierten Zuschuss CIAICO/2022/020 finanziert. Zusätzliche Unterstützung kam von der Generalitat Valenciana (Zuschuss CIAPOS/2021/238, ACIF/2021/205, CIBEFP/2022/9), MCIN/AEI/10.13039/501100011033 und ESF Investing in Your Future (Zuschuss RYC2018-024346-I), Instituto de Salud Carlos III (Zuschuss CIBERCV16 CB16/11/00354) und Katalonien (Spanien) (Zuschuss 2021_SGR_01350, SGR21/GENCAT). Wir danken auch der Unterstützung durch das CERCA-Programm/Generalitat de Catalunya. MPL finanziert (2023-2025) durch einen Río Hortega-Vertrag CM22/00107 [Instituto de Salud Carlos III (ISCIII); Fondo Social Europeo (FWB)]. Die Autoren danken Neus Portella und Sheila Marco für die Unterstützung im Sekretariat und den medizinischen und pflegerischen Teams für ihre klinische Unterstützung im Hospital Clínic de Barcelona, Hospital General Universitario Gregorio Marañón und Hospital Universitari i Politècnic La Fe. Sie sind auch Almudena Albertos von Corify Care SL, Madrid, Spanien, und Arantxa Carrasco von der Universitat Politecnica de Valencia zu verdanken.
Materialien
| Name | Company | Catalog Number | Comments |
| ACORYS Mapping System | Corify Care SL | ACORYS | Imageless ECGI system |
| ACORYS 3D Scan Software | Corify Care SL | ACSCAN | 3D scanner app |
| ACORYS Amplifier | Corify Care SL | ACAMP | Biopotential amplifier |
| ACORYS Sensor Vest | Corify Care SL | ACSEN | Sensor vest, 4 components (Front Right, Front Left, Back Right and Back Left) |
| ACORYS Software | Corify Care SL | ACSOF, version 1.2 | Imageless ECGI software |
| Affera mapping system | Medtronic | AFR-00003 | |
| CADENCE Adult mulifuntion defibrillation electrodes | Cardinal Health | 22660R | |
| Catheter extension cable | Medtronic | AFR-00006 | |
| Desktop or portable PC workstation | Any | Windows 11 as the operating system | Imageless ECGI workstation. The processor must be at least an Intel i7 from the 2020 generation or newer. It requires a minimum of 32 GB of RAM and 500 GB of SSD storage. Additionally, a compatible version of .NET Framework must be installed. An internet connection is not required. |
| Dynamic XT 10E 2 5 2 MM Diagnostic Catheter | Boston Scientific | M0042011010 | |
| EP-TRACER 2 ProCart | Cardiotek | The system includes several components provided by the company | |
| External Defibrillator Monitor | PHILLIPS | Efficia DFM100 | |
| Fentanyl | Kern pharma | 1004000143-03 | |
| Heparine | Reig Jofre | 608737.4 O | |
| HexaFlow irrigation pump | Medtronic | AFR-00005 | |
| HexaGen RF generator | Medtronic | AFR-00004 | |
| HexaPulse PF generator | Medtronic | AFR-00008 | |
| INTELLAMAP ORIO Mapping Catheter | Boston Scientific | M004RC64S0 | |
| IntellaNav StablePoint Ablation Catheter | Boston Scientific | M004ERFSDS96200 | |
| iPad mini | Apple | 6th generation A2567 | 3D scanner platform |
| iPadOS | Apple | 15.3 or superior | 3D scanner platform |
| Isolated Ethernet Cable | Corify Care SL | ACNET | Ethernet cable |
| Isoprenaline | Reig Jofre | 7227007 | |
| Left Connector Cable | Corify Care SL | ACCAB_L | Left cables |
| Location Reference Patch Kit | Boston Scientific | M004RAPATCH20 | |
| Location reference patch kit | Medtronic | AFR-00007 | |
| MetriQ Tubing Set | Boston Scientific | M0041170 | |
| Midazolam | Normon | X5XF1 | |
| Physiological Saline Solution for Irrigation | Fabrenius Kabi | br14801 | |
| Propofol | B Braun | 855437.9 OH | |
| Remifentanil | Kern pharma | 672786.7 | |
| RHYTHMIA HD | Boston Scientific | M004 RBINSTALL2ROW0 | |
| Right Connector Cable | Corify Care SL | ACCAB_R | Right cables |
| Single Patient Use ECG Electrodes | Ambu | M-00-S | |
| Sphere-9 mapping and ablation catheter | Medtronic | AFR-00001 | |
| Structure SDK | Structure | 2.2.1 for iOS or superior | 3D scanner platform, infrared structured light camera |
| Structure Sensor Pro | Structure | ST02B. Firmware version 1.2 or superior | 3D scanner platform, infrared structured light camera |
| Sugamadex Teva | Normon | 7340157-OH | |
| Tubing set | Medtronic | AFR-00002 | |
| WorkMate Claris System | Abbott | H700123 | |
| X-Ray C-Arm | Phillips | The system includes several components provided by the company |
Referenzen
- Narayan, S. M., John, R. M. Advanced electroanatomic mapping: current and emerging approaches. Curr Treat Options Cardiovasc Med. 26 (4), 69-91 (2024).
- Raiman, M., Tung, R. Automated isochronal late activation mapping to identify deceleration zones: rationale and methodology of a practical electroanatomic mapping approach for ventricular tachycardia ablation. Comput Biol Med. 102, 336-340 (2018).
- Guichard, J. -. B., et al. Substrate mapping for ventricular tachycardia ablation through high-density whole-chamber double extra stimuli. JACC Clin Electrophysiol. 10 (7), 1534-1547 (2024).
- Takigawa, M., et al. Are wall thickness channels defined by computed tomography predictive of isthmuses of postinfarction ventricular tachycardia. Heart Rhythm. 16 (11), 1661-1668 (2019).
- Vázquez-Calvo, S., et al. Noninvasive detection of slow conduction with cardiac magnetic resonance imaging for ventricular tachycardia ablation. Europace. 26 (2), euae025 (2024).
- Sánchez-Somonte, P., et al. Scar channels in cardiac magnetic resonance to predict appropriate therapies in primary prevention. Heart Rhythm. 18 (8), 1336-1343 (2021).
- Roca-Luque, I., et al. Post-ablation cardiac magnetic resonance to assess ventricular tachycardia recurrence (PAM-VT study). Eur Heart J Cardiovasc Imaging. 25 (2), 188-198 (2023).
- Roca-Luque, I., et al. Ventricular scar channel entrances identified by new wideband cardiac magnetic resonance sequence to guide ventricular tachycardia ablation in patients with cardiac defibrillators. Europace. 22 (4), 598-606 (2020).
- Rudy, Y., Burnes, J. E. Noninvasive electrocardiographic imaging. Ann Noninvasive Electrocardiol. 4 (3), 340-359 (1999).
- Haissaguerre, M., et al. Noninvasive panoramic mapping of human atrial fibrillation mechanisms: a feasibility report. J Cardiovasc Electrophysiol. 24 (6), 711-717 (2013).
- Tsyganov, A., et al. Mapping of ventricular arrhythmias using a novel noninvasive epicardial and endocardial electrophysiology system. J Electrocardiol. 51 (1), 92-98 (2018).
- Pereira, H., Niederer, S., Rinaldi, C. A. Electrocardiographic imaging for cardiac arrhythmias and resynchronization therapy. Europace. 22 (10), 1447-1462 (2020).
- Duchateau, J., et al. Performance and limitations of noninvasive cardiac activation mapping. Heart Rhythm. 16 (3), 435-442 (2019).
- Cluitmans, M., et al. Validation and opportunities of electrocardiographic imaging: from technical achievements to clinical applications. Front Physiol. 9, 1305 (2018).
- Molero, R., González-Ascaso, A., Climent, A. M., Guillem, M. S. Robustness of imageless electrocardiographic imaging against uncertainty in atrial morphology and location. J Electrocardiol. 77, 58-61 (2023).
- Rodrigo, M., et al. Noninvasive assessment of complexity of atrial fibrillation: correlation with contact mapping and impact of ablation. Circ Arrhythm Electrophysiol. 13 (3), e007700 (2020).
- Invers-Rubio, E., et al. Regional conduction velocities determined by noninvasive mapping are associated with arrhythmia-free survival after atrial fibrillation ablation. Heart Rhythm. 21 (9), 1570-1580 (2024).
- Fambuena-Santos, C., et al. AF driver detection in pulmonary vein area by electrocardiographic imaging: relation with a favorable outcome of pulmonary vein isolation. Front Physiol. 14, 1057700 (2023).
- San Antonio, R., et al. Optimized single-point left ventricular pacing leads to improved resynchronization compared with multipoint pacing. Pacing Clin Electrophysiol. 44 (3), 519-527 (2021).
- Zacur, E., et al. MRI-Based Heart and Torso Personalization for Computer Modeling and Simulation of Cardiac Electrophysiology. Imaging for Patient-Customized Simulations and Systems for Point-of-Care Ultrasound. 10549, (2017).
- Bell, J. B., Tikhonov, A. N., Arsenin, V. Y. Solutions of ill-posed problems. Math Comput. 32 (144), 1320 (1978).
- Oster, H. S., Taccardi, B., Lux, R. L., Ershler, P. R., Rudy, Y. Electrocardiographic imaging: noninvasive characterization of intramural myocardial activation from inverse-reconstructed epicardial potentials and electrograms. Circulation. 97 (15), 1496-1507 (1998).
- Figuera, C., et al. Regularization techniques for ECG imaging during atrial fibrillation: a computational study. Front Physiol. 7, 466 (2016).
- Molero, R., et al. Improving electrocardiographic imaging solutions: a comprehensive study on regularization parameter selection in L-curve optimization in the atria. Comput Biol Med. 182, 109141 (2024).
- Hernández-Romero, I., et al. Local conduction velocity estimation during wavefront collisions and reentrant scenarios. 2022 Computing in Cardiology (CinC). , (2022).
- Rodrigo, M., et al. Technical considerations on phase mapping for identification of atrial reentrant activity in direct- and inverse-computed electrograms. Circ Arrhythm Electrophysiol. 10 (9), e005008 (2017).
- Guillem, M. S., et al. Noninvasive localization of maximal frequency sites of atrial fibrillation by body surface potential mapping. Circ Arrhythm Electrophysiol. 6 (2), 294-301 (2013).
- Pedrón-Torrecilla, J., et al. Noninvasive estimation of epicardial dominant high-frequency regions during atrial fibrillation. J Cardiovasc Electrophysiol. 27 (4), 435-442 (2016).
- Tzeis, S. 2024 European Heart Rhythm Association/Heart Rhythm Society/Asia Pacific Heart Rhythm Society/Latin American Heart Rhythm Society expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace. 26 (4), euae043 (2024).
- Parreira, L., et al. Noninvasive three-dimensional electrical activation mapping to predict cardiac resynchronization therapy response: site of latest left ventricular activation relative to pacing site. Europace. 25 (4), 1458-1466 (2023).
- Reventos-Presmanes, J., et al. Noninvasive electrocardiographic imaging for the characterization of complex atrial tachyarrhythmias. Europace. 25 (Supplement_1), (2023).
- Regany, M., et al. ECG imaging as a real time tool to guide left bundle branch pacing implant in patients with left bundle branch block and resynchronization therapy indication. Europace. 26 (Supplement_1), (2024).
- Rudy, Y. Noninvasive electrocardiographic imaging of arrhythmogenic substrates in humans. Circ Res. 112 (5), 863-874 (2013).
- Shah, A. J., et al. Validation of novel 3-dimensional electrocardiographic mapping of atrial tachycardias by invasive mapping and ablation. J Am Coll Cardiol. 62 (10), 889-897 (2013).
- Graham, A. J., et al. Evaluation of ECG imaging to map hemodynamically stable and unstable ventricular arrhythmias. Circ Arrhythm Electrophysiol. 13 (2), e007377 (2020).
- Pujol-Lopez, M., et al. Conduction system pacing vs biventricular pacing in heart failure and wide QRS patients. JACC Clin Electrophysiol. 8 (11), 1431-1445 (2022).
- Rudy, Y., Lindsay, B. D. Electrocardiographic imaging of heart rhythm disorders. Cardiac Electrophysiol Clin. 7 (1), 17-35 (2015).
- Haissaguerre, M., et al. Driver domains in persistent atrial fibrillation. Circulation. 130 (7), 530-538 (2014).
- Reventos-Presmanes, J., et al. Noninvasive assessment of the ventricular tachycardia isthmus during sinus rhythm. Europace. 26 (Supplement_1), (2024).
- Ros, S., et al. Imageless electrocardiographic imaging for atrial electrophysiological characterization: a validation study. Europace. 26, (2024).
- Wu, S., et al. Left bundle branch pacing for cardiac resynchronization therapy: nonrandomized on-treatment comparison with his bundle pacing and biventricular pacing. Can J Cardiol. 37 (2), 319-328 (2021).
- Pujol-López, M., et al. Stepwise application of ECG and electrogram-based criteria to ensure electrical resynchronization with left bundle branch pacing. Europace. 25 (6), euad128 (2023).
- Zhu, K., Chang, D., Li, Q. Which is more likely to achieve cardiac synchronization: left bundle branch pacing or left ventricular septal pacing. Front Cardiovasc Med. 9, 845312 (2022).
- Martinez-Perez, M., et al. Real-time assessment of LV synchrony in AV block population undergoing LBB pacing using ECG imaging. Europace. 26 (Supplement_1), (2024).
- Krummen, D. E., et al. Forward-solution noninvasive computational arrhythmia mapping: the VMAP study. Circ Arrhythm Electrophysiol. 15 (9), (2022).
- Gu, K., et al. Ablation of non-pulmonary vein atrial fibrillation drivers identified by vMap in addition to pulmonary vein isolation improves procedural outcomes. 29th annual AF Symposium 2024. , (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten