Method Article
Administration oropharyngée de bléomycine dans le modèle murin de fibrose pulmonaire
Dans cet article
Résumé
Ce protocole démontre la technique d’aspiration oropharyngée pour une utilisation dans le modèle murin de bléomycine de la fibrose pulmonaire.
Résumé
La pneumopathie interstitielle (MPI) représente un large spectre de troubles caractérisés par la cicatrisation progressive et souvent irréversible du parenchyme pulmonaire, la plus fréquente étant la fibrose pulmonaire idiopathique (FPI). Plusieurs modèles animaux de FPI ont été développés, le modèle murin de bléomycine étant le plus largement utilisé. La bléomycine est une chimiothérapie connue pour induire des dommages à l’ADN dans l’épithélium alvéolaire, entraînant des lésions pulmonaires aiguës et une fibrose pulmonaire chez l’homme. Les modèles de FPI chez les rongeurs utilisent l’administration de bléomycine par diverses méthodes, la plus courante étant l’intratrachéale (IT). Récemment, la technique d’aspiration oropharyngée (OA) s’est avérée aussi efficace que l’IT pour plusieurs agents fibrosants, avec beaucoup moins d’effets secondaires et une voie d’administration plus facile. Ce protocole détaille la méthode d’administration de la bléomycine dans le poumon murin et met en évidence des exemples d’applications potentielles en aval pour la quantification des données. Cette méthodologie offre un moyen simple, rapide et sûr d’utiliser ce modèle animal largement utilisé pour étudier les mécanismes moléculaires sous-jacents à la FPI.
Introduction
La pneumopathie interstitielle (MPI) fait référence à un groupe hétérogène de troubles caractérisés par une cicatrisation progressive et irréversible de l’espace alvéolaire, de l’interstitium et des voies respiratoires distales1. La fibrose pulmonaire idiopathique (FPI) est la forme la plus courante de MPI et entraîne une survie médiane d’environ trois ans2. La FPI est une maladie en phase terminale, la transplantation pulmonaire orthotopique étant une thérapie de rattrapage pour certains patients. Il existe actuellement deux thérapies approuvées par la FDA pour la FPI, qui ne font que ralentir le taux de progression plutôt que de stabiliser ou d’améliorer la fonction pulmonaire des patients 3,4. D’importants efforts de recherche sont en cours pour élucider les fondements de la FPI et identifier de nouvelles cibles thérapeutiques. Il existe une myriade de modèles animaux pour étudier la pathogenèse de la FPI, chacun ayant ses propres avantages et inconvénients5. Bien qu’aucun modèle ne soit en mesure de récapituler entièrement la complexité des maladies humaines, ces approches offrent un aperçu significatif des mécanismes moléculaires de la FPI et peuvent compléter les études translationnelles.
Le modèle murin de bléomycine reste le modèle in vivo de FPI6 le plus largement utilisé et le mieux caractérisé. La bléomycine est un agent peptidique qui induit des cassures de l’ADN simple et double brin. Après sa découverte en 1962, la bléomycine s’est avérée efficace dans le traitement d’un certain nombre de cancers, y compris les tumeurs testiculaires et le lymphome, mais son utilisation a été limitée par la pneumonie dose-dépendante et la fibrose pulmonaire qui en résulte 7,8. Cette toxicité pulmonaire est récapitulée chez la souris. Lorsqu’elle est administrée en une seule dose, après une phase inflammatoire initiale, la fibrose peut être observée à partir du 5e jour, avec un pic les jours 14 à 219, 10 et 11 (Figure 1). La résolution spontanée se produit après environ 6 semaines, bien que des changements fibrotiques permanents puissent être obtenus avec des doses répétitivesde 12. Étant donné sa nature transitoire et inflammatoire, le modèle de bléomycine13 présente certains inconvénients inhérents, mais il offre un système rapide, robuste et reproductible pour commencer à répondre à certaines des principales lacunes dans la compréhension de notre domaine de la PID et permet aux chercheurs de comparer les résultats des cinq dernières décennies. D’autres approches d’installation incluent les modèles asbestosis et silice murin, qui offrent des parcours temporels similaires (jours 14-28)6,14,15,16. Cependant, ces modèles génèrent un schéma histologique plus compatible avec la pneumoconiose que la FPI et nécessitent l’utilisation de particules en suspension dans l’air, ce qui nécessite une manipulation soigneuse. Alternativement, il existe des modèles animaux qui utilisent l’expression de transgènes induits par l’épithélium, tels que la toxine diphtérique et le TGF-β1. Celles-ci récapitulent les lésions non inflammatoires des cellules épithéliales alvéolaires de type 2 observées dans la FPI, mais prennent un peu plus de temps (21-30d) et nécessitent l’utilisation d’animaux spécialisés qui doivent être rétrocroisés dans tout modèle transgénique d’intérêt existant. Enfin, il a été démontré que la surexpression des cytokines médiée par l’adénovie, y compris le TGF-β1, l’IL-β1 et le TNF-α, induit une fibrose pulmonaire chez les rongeurs, généralement au jour 14,17, 18, 19. Ces modèles de surexpression de cytokines permettent une administration intranasale pratique, mais nécessitent une purification et une manipulation soigneuses.
Il existe plusieurs approches pour l’administration de la bléomycine, notamment par voie intratrachéale (IT), intranasale, intrapéritonéale, sous-cutanée et intraveineuse6. L’administration de l’IT est la méthode la plus courante, impliquant traditionnellement une intubation endotrachéale ou une trachéotomie chirurgicale20, qui nécessitent toutes deux une sédation profonde, une finesse technique et sont associées à la morbidité et à la mortalité périopératoires. Récemment, la technique d’aspiration oropharyngée (OA) s’est avérée aussi efficace que l’IT, avec beaucoup moins d’effets secondaires et une voie d’accouchement plus facile 14,21,22,23,24,25,26. Ici, nous présentons un protocole visuel détaillé pour la méthode OA d’administration de la bléomycine dans le poumon murin et mettons en évidence diverses applications potentielles en aval pour la quantification des données.
Protocole
Les études animales décrites dans ces expériences ont été menées selon des protocoles (ARC-2021-025, ARC-2010-039) approuvés par le Comité de recherche animale de l’UCLA (ARC) et le Comité institutionnel de protection et d’utilisation des animaux (IACUC). Le respect total de toutes les réglementations et politiques étatiques et fédérales concernant l’utilisation d’animaux de laboratoire a été maintenu. Les animaux ont été logés dans l’installation de soins aux animaux de l’UCLA et soignés par le personnel qualifié de la Division de laboratoire et de médecine animale de l’UCLA (DLAM) dans des conditions exemptes d’agents pathogènes. Des souris C57BL/6 de type sauvage ont été obtenues dans le commerce et ont été laissées s’acclimater pendant au moins 14 jours. Des souris mâles âgées de 8 à 12 semaines ont été utilisées pour ces études, avec un poids corporel moyen de 20 à 25 g. Des souris femelles peuvent également être utilisées, bien qu’il soit important de faire correspondre le sexe et l’âge des animaux dans les groupes et les conditions expérimentaux27. Les détails commerciaux des animaux, des réactifs et de l’équipement utilisés dans cette étude sont répertoriés dans la table des matériaux.
1. Administration oropharyngée de bléomycine
- Préparation de la bléomycine
REMARQUE : Utilisez de la bléomycine de qualité pharmaceutique pour assurer l’uniformité et la reproductibilité entre les animaux et les expériences. Doser la bléomycine en unités de médicament par kg d’animal (U/kg), et non en milligrammes (mg) par kg.- Dissoudre la poudre de bléomycine dans du PBS stérile de qualité pharmaceutique jusqu’à une concentration de base de 10 U/mL. La bléomycine doit être préparée sous une hotte chimique en utilisant les précautions chimiothérapeutiques appropriées. Conservez les aliquotes à -20 °C jusqu’à 6 mois.
- Préparez la concentration de travail finale. La dose est basée sur le poids (0,5 à 3 U/kg), et des ajustements sont apportés au besoin en fonction de la bléomycine utilisée et du but de l’expérience (p. ex., survie ou dosage létal).
- Ajustez le volume final d’administration au besoin. Pour ces études, diluer la bléomycine à 0,375 U/mL, ce qui équivaut à 50 μL pour une souris de 25 g, ce qui donne une concentration de travail finale de 0,75 U/kg.
2. Induction de l’anesthésie
- Préparez le cocktail d’anesthésie en diluant la kétamine et la xylazine dans du PBS à des concentrations de travail de 10 mg/mL et 1 mg/mL, respectivement. Effectuez cette étape dans des conditions stériles à l’aide de réactifs de qualité pharmaceutique et conformément aux protocoles approuvés par l’établissement.
- Administrer 10 μL du cocktail par gramme de poids corporel de l’animal (concentration de travail : kétamine 100 mg/kg, xylazine 10 mg/kg) par injection intrapéritonéale à l’aide d’une aiguille de 27,5 g et d’une seringue de 1 mL.
- Assurez-vous que la souris est correctement anesthésiée et qu’elle ne répond pas aux stimuli nocifs, tels que le pincement des orteils. Les effets devraient être visibles dans les 5 minutes. S’il réagit toujours, administrez de la kétamine/xylazine supplémentaire par incréments de 20 μL jusqu’à ce que le niveau d’anesthésie souhaité soit atteint. Appliquez une pommade ophtalmique pour prévenir la sécheresse oculaire sous anesthésie.
REMARQUE : La kétamine est préférée aux autres anesthésiques et sédatifs injectés en raison de son profil d’effets secondaires favorable. Il a des effets minimes sur l’hémodynamique, y compris la fréquence cardiaque et la fréquence respiratoire. L’isoflurane inhalé peut être utilisé comme agent anesthésique alternatif. Dans ces études, la kétamine/xylazine est préférée car elle entraîne une sédation prolongée et une toux ou un reflux minime de bléomycine après l’administration.
- Assurez-vous que la souris est correctement anesthésiée et qu’elle ne répond pas aux stimuli nocifs, tels que le pincement des orteils. Les effets devraient être visibles dans les 5 minutes. S’il réagit toujours, administrez de la kétamine/xylazine supplémentaire par incréments de 20 μL jusqu’à ce que le niveau d’anesthésie souhaité soit atteint. Appliquez une pommade ophtalmique pour prévenir la sécheresse oculaire sous anesthésie.
3. Administration de l’oropharynx
- Une fois correctement sédative, suspendez la souris sur la plate-forme procédurale à un angle de 60° à 80° en la suspendant par ses incisives avant pour ouvrir efficacement l’oropharynx (Figure 2A).
- Obstruez le passage nasal avec une pince microvasculaire lisse, forçant la souris à respirer par son oropharynx.
- Rétractez la langue de l’oropharynx à l’aide d’une pince.
- À l’aide d’une pipette pas à pas avec une pointe stub leur-stub, placez doucement le volume désiré de bléomycine, ou contrôle salin, à l’arrière de l’oropharynx. Assurez-vous qu’une bulle de liquide est visiblement (Figure 2B).
- Continuez à maintenir la langue en place jusqu’à ce que l’animal aspire la solution. Cela devrait être visible et souvent audible.
REMARQUE : Si l’animal aspire rapidement la solution, la visualisation à l’arrière de l’oropharynx peut être transitoire, en quelques secondes. Quoi qu’il en soit, s’il réussit, l’animal démontrera un changement brusque et transitoire dans son rythme respiratoire, prenant des respirations rapides et superficielles. Des bulles peuvent se produire, ce qui indique en outre que le liquide a réussi à pénétrer dans les voies respiratoires inférieures. Une toux occasionnelle peut également survenir. Il s’agit généralement d’un volume négligeable de la solution de bléomycine et ne devrait pas affecter les résultats expérimentaux, ce qui permet à l’animal de rester inclus dans l’étude. Évitez les doses répétitives, car elles augmentent le risque d’asphyxie et modifient la dose finale basée sur le poids. - Une fois l’aspiration confirmée, retirez soigneusement le pince-nez.
- Observez l’animal en position suspendue pendant 15 à 30 s pour éviter tout reflux de la solution de bléomycine, puis remettez-le dans sa cage.
REMARQUE : Un volume maximal de 50 μL est recommandé pour minimiser le risque d’asphyxie. En fonction de la dose souhaitée de bléomycine et du poids de la souris, ajustez la concentration de la solution de bléomycine au besoin. Lorsque vous pratiquez cette technique, utilisez un colorant à base d’eau tel que le bleu Evans pour confirmer que la solution est administrée dans les voies respiratoires inférieures, plutôt que dans l’estomac14.
4. Récupération des animaux
- Après le traitement, placez l’animal sur le côté dans sa cage avec un coussin chauffant en dessous pour maintenir la thermoneutralité.
- Surveillez les souris jusqu’à ce qu’elles soient pleinement conscientes. Cela prend généralement 1 à 2 heures, en fonction de la dose de kétamine utilisée et du métabolisme de l’animal. Pincez doucement les orteils et maintenez l’animal euthermique pour faciliter le réveil.
- Surveillez cliniquement les souris sur une base quotidienne pour détecter les changements de poids corporel, de toilettage, de niveau d’activité et d’état respiratoire. À l’instar d’autres méthodes d’administration de la bléomycine, les animaux peuvent subir une perte de poids significative au cours de la période de 14 à 21 jours, ce qui est un marqueur clé de l’efficacité du modèle.
- Selon les protocoles de l’ARC et de l’IACUC, euthanasier les animaux si la perte de poids dépasse 20 % du poids de départ de l’animal. La prévalence et la gravité de la perte de poids dépendent de la dose de bléomycine utilisée et de la démographie des souris (voir ci-dessus).
5. Prélèvement et traitement des tissus et analyse finale
- En fonction de la question expérimentale et du moment souhaité, euthanasiez les souris en suivant les protocoles de l’IACUC et prélevez leurs poumons28 au moment approprié. Les effets de la bléomycine sont souvent très apparents visuellement par rapport au contrôle, ce qui indique une administration réussie. Dans ces études, les souris ont été sacrifiées aux jours 7, 14 et 21.
- Pour l’histologie, disséquer les poumons en bloc et les fixer dans 4 % de PFA pendant 24 h. Procéder à l’enrobage de paraffine, à la section, à l’hématoxyline et à l’éosine (H&E) et/ou à la coloration trichrome de Masson comme décrit précédemment 28,29,30.
- Pour mesurer le collagène, homogénéisez le poumon droit et utilisez un kit disponible dans le commerce (voir le tableau des matériaux) pour mesurer la teneur en hydroxyproline comme décrit précédemment31.
- Pour la cytométrie en flux, digérer le poumon droit à l’aide du dissociateur tissulaire et d’une solution enzymatique pour obtenir une suspension unicellulaire. Effectuer la coloration et l’analyse par cytométrie en flux comme décrit précédemment 32,33,34.
Résultats
Le protocole décrit ici résume la voie d’administration par aspiration oropharyngée dans le modèle murin de bléomycine. Dans ces expériences, les animaux ont été traités soit avec de la bléomycine (0,75U/kg de poids corporel), soit avec du PBS pour un contrôle fictif. Les jours 7, 14 et 21, les souris ont été euthanasiées, leurs poumons ont été explantés et leurs tissus ont été réparés, comme décrit précédemment35. La fibrose a été évaluée à l’aide d’une coloration histologique à l’hématoxyline et à l’éosine (H&E). Au jour 7, une modification fibrotique des cloisons alvéolaires peut être observée, ainsi que de petites modifications inflammatoires/fibrotiques, par rapport au contrôle PBS (Figure 3A, B). Au 14e jour, des zones de fibrose plus grandes et plus confluentes sont observées, avec une destruction significative de l’architecture alvéolaire normale (Figure 3C). Au jour 21, ces changements fibrotiques significatifs persistent (Figure 3D). Ces changements histopathologiques ont été quantifiés à l’aide du système de notation d’Ashcroftmodifié 29, qui a démontré un degré similaire de fibrose entre les jours 14 et 21 (figure 3E).
Bien que l’histopathologie reste la référence, des tests supplémentaires peuvent être effectués pour quantifier objectivement les changements fibrotiques et inflammatoires induits par la bléomycine. Pour confirmer les résultats H&E, des dosages d’hydroxyproline ont été effectués le 14 au31e jour, qui ont démontré une augmentation de la quantité totale de collagène contenue avec la bléomycine (figure 4A). De plus, l’ARN a été isolé à partir d’homogénats pulmonaires entiers au 14e jour, et une réaction en chaîne par polymérase quantitative (qPCR) a démontré la régulation à la hausse des gènes profibrotiques Col3a1 et Tgfb avec la bléomycine (Figure 4B). Pour caractériser les modifications immunitaires induites par la bléomycine oropharyngée, la cytométrie en flux a été réalisée comme décrit précédemment 32,33,34 (Figure 4C). En réponse à l’arthrose, une infiltration robuste de cellules myéloïdes dans le poumon murin est observée, y compris les macrophages interstitiels (IM), les macrophages alvéolaires dérivés de monocytes (MoAM) et les neutrophiles (Figure 4D). Ces données démontrent que la technique d’aspiration oropharyngée est une méthodologie sûre, pratique et reproductible pour induire une fibrose pulmonaire avec la bléomycine dans le modèle animal murin.
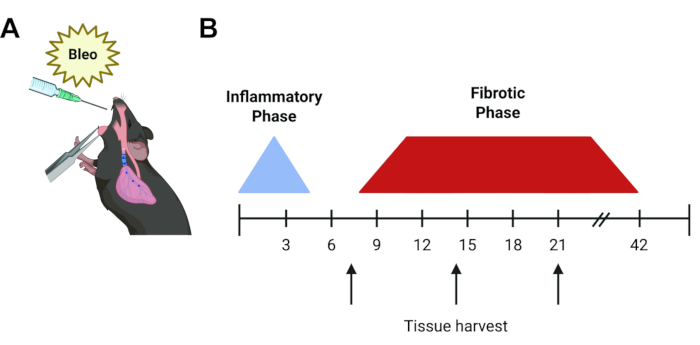
Figure 1 : Chronologie du protocole expérimental. (A) Représentation graphique de l’administration oropharyngée de la bléomycine dans le poumon murin. (B) Chronologie de l’évolution de la bléomycine. La phase inflammatoire initiale dure de 48 à 72 h et est suivie d’une phase fibrotique commençant environ le jour 7, qui se résout après 6 semaines pour les injections individuelles. Les flèches représentent les temps potentiels courants de prélèvement de tissus (jour 7, 14 ou 21) en fonction de la question de l’expérience et des tests utilisés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
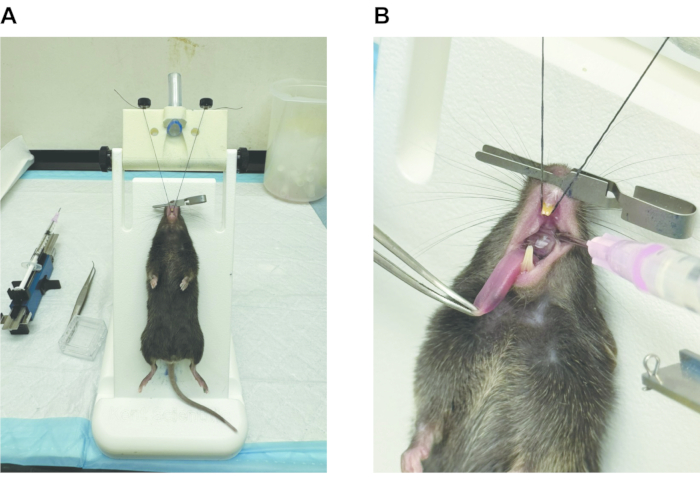
Figure 2 : Schéma de l’administration de la bléomycine oropharyngée. (A) Une fois correctement sédative, la souris est suspendue par ses incisives avant à 60°-80° sur une plate-forme sécurisée. (B) Le passage nasal est occlus à l’aide d’une pince microvasculaire non dentée. La langue est rétractée de l’oropharynx et, à l’aide d’une pipette pas à pas avec une pointe stub leur-stub, la solution de bléomycine, ou contrôle PBS, est administrée à l’arrière de l’oropharynx. Une bulle de liquide visible doit être visible jusqu’à ce qu’elle soit aspirée dans les voies respiratoires inférieures. Veuillez cliquer ici pour voir une version agrandie de cette figure.
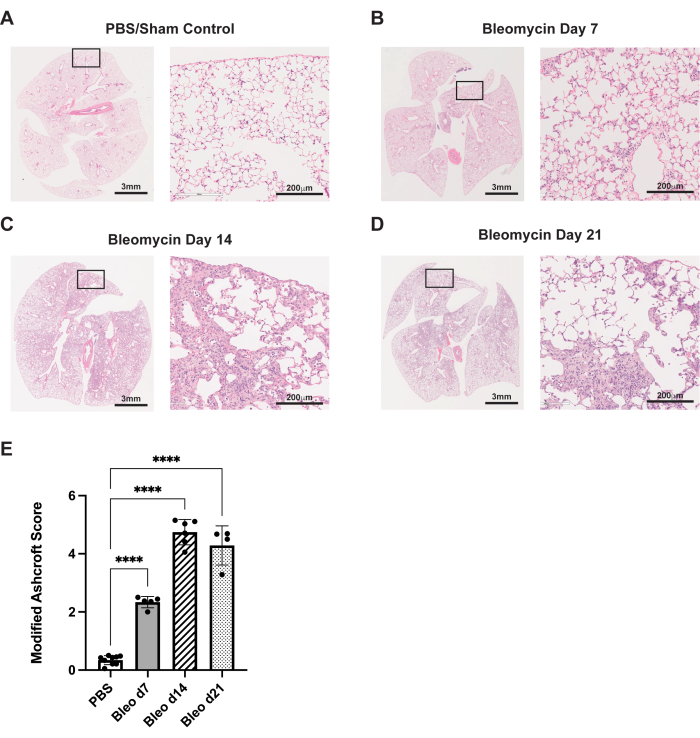
Figure 3 : L’administration de bléomycine par aspiration oropharyngée entraîne des modifications histologiques fibrotiques robustes. Les souris Wildtype C57Bl/6 ont été traitées avec une dose unique de bléomycine (0,75U/kg) ou de PBS au jour 0. (A) Les témoins fictifs démontrent une histologie pulmonaire normale. (B-D) La bléomycine entraîne une fibrose progressive et une distorsion architecturale du poumon murin. (E) Notation Ashcroft modifiée des échantillons histologiques. Les barres d’erreur représentent l’écart-type. p < 0,0001 déterminé par l’ANOVA à un facteur. Les images sont représentatives de trois expériences indépendantes réalisées avec 4 à 8 animaux par groupe. Les images 20x (à droite, barres d’échelle : 200 μm) proviennent des encarts désignés sur les images 1x (à gauche, barres d’échelle : 3 mm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
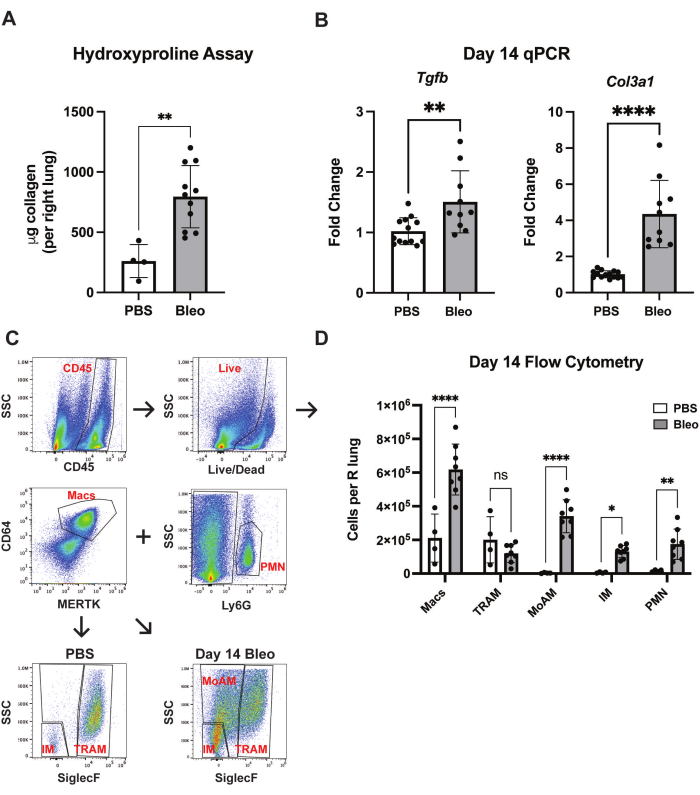
Figure 4 : Quantification des changements profibrotiques et pro-inflammatoires induits par la bléomycine. (A) Des poumons ont été prélevés au jour 14 sur des souris sauvages C57Bl/6 traitées soit avec de la bléomycine (0,75U/kg) soit du PBS. Des dosages d’hydroxyproline ont été effectués et la teneur en collagène a été mesurée (mg par poumon droit). (B) L’ARN a été isolé dans du tissu pulmonaire homogénéisé d’animaux traités à la bléomycine ou au PBS au jour 14. Une PCR quantitative a été réalisée pour mesurer le niveau de transcrits Col1a1 et Tgfb. Le changement de pli lié au groupe témoin PBS a été calculé à l’aide de la méthode 2CP en référence au gène interne de l’entretien. (C) Stratégie de flow gating des populations myéloïdes dans le poumon murin. (D) Quantification des populations myéloïdes dans le poumon murin au jour 14, en réponse à la bléomycine. Les données sont représentatives de trois expériences indépendantes avec 4 à 8 animaux par groupe et par expérience. Les barres d’erreur représentent l’écart-type. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001 déterminée par le test t de Student non apparié (hydroxyproline et qPCR) ou l’ANOVA à deux facteurs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Un protocole vidéo détaillé est fourni sur la technique d’aspiration oropharyngée pour l’administration de la bléomycine à utiliser dans le modèle murin de fibrose pulmonaire. De plus, nous soulignons les applications potentielles en aval pour quantifier les changements fibrotiques et inflammatoires induits par la bléomycine OA.
Bien qu’aucun animal ne récapitule complètement la complexité des maladies humaines, le modèle murin de bléomycine a été utilisé au cours des cinq dernières décennies et reste le plus largement mis en œuvre pour étudier la pathogenèse de la FPI36. Il existe une multitude de façons d’administrer la bléomycine dans les modèles de rongeurs, notamment par injection intratrachéale (IT), intranasale (IN), intraveineuse (IV), intrapéritonéale et sous-cutanée6. Alors que l’administration IV imite plus étroitement le mécanisme de la pneumonie induite par la bléomycine chez l’homme, la voie IT est plus couramment utilisée ; La fibrose est obtenue avec une dose unique, sans toxicités systémiques associées à des doses plus élevées, et est plus rentable8. L’administration de l’IT nécessite soit une intubation endotrachéale, soit une exploration chirurgicale du cou et de la trachéotomie, les deux nécessitant des niveaux profonds de sédation et un haut degré de compétence procédurale, tout en entraînant une morbidité et une mortalité périprocédurales associées importantes. L’administration d’IN est une alternative raisonnable à l’IT, cependant, il a été démontré qu’elle provoque des schémas de distribution plus variables et des lésions pulmonaires37,38. L’approche de l’arthrose a connu une utilisation accrue et représente un substitut apparemment plus reproductible à l’administration de bléomycine et d’autres agents fibrosants dans le poumon murin 14,21,22,23,24,25,26. Récemment, les voies d’administration de l’OA et de l’IT de la bléomycine ont été directement comparées chez la souris, démontrant une efficacité égale et une lésion fibrotique homogène, tout en minimisant la mortalité périprocédurale21. De même, dans cette étude, aucune souris n’est morte lors de l’administration d’OA (données non présentées), soulignant le profil technique et éthique favorable de cette méthode.
Le degré de fibrose et le moment de la lésion induite par la bléomycine dépendent de plusieurs facteurs. Après l’instillation de la bléomycine dans le poumon murin, une période inflammatoire initiale de lésions pulmonaires aiguës se produit, suivie d’une phase fibroproliférative qui commence après 5 à 7 jours10. Habituellement, les paramètres de la maladie sont évalués entre les jours 14 et 21, lorsqu’une fibrose soutenue est atteinte (figure 3C). La présente étude s’est concentrée sur le jour 14, qui s’est avéré être le moment optimal pour mesurer les paramètres de la fibrose pulmonaire, car les animaux ont développé une fibrose étendue, avec moins de variabilité et une mortalité plus faible que celle observée au jour 2111. Après une dose unique, la fibrose se résout spontanément après environ 6 semaines chez la souris. Pour saisir l’irréversibilité observée avec de nombreuses formes de MPI chez l’homme, les chercheurs ont développé des modèles de dosage répétitif pour obtenir des changements fibrotiques permanents dans des modèles murins 9,12.
Des études antérieures ont démontré une variance de souche en ce qui concerne la gravité de la fibrose obtenue avec une dose unique de bléomycine, les souris C57Bl/6 étant des « répondeurs élevés », les souris DBA/2 et Swiss étant des « répondeurs intermédiaires », et les souris BALB/c étant des souris « faiblement répondeuses »39. De plus, l’âge et le sexe des souris utilisées influencent également le degré d’inflammation et de fibrose. Les souris plus âgées (52-54 semaines) ont montré une fibrose accrue que les souris plus jeunes (8-12 semaines), et les souris mâles semblent plus sensibles à la bléomycine, en général, que leurs homologues femelles 9,40. Ces observations suggèrent des facteurs génétiques sous-jacents influençant la réponse inflammatoire et la cicatrisation des plaies, et les chercheurs devraient comparer l’âge et le sexe des souris lorsqu’ils testent des voies thérapeutiques potentielles, comme le suggèrent les récentes directives officielles de l’American Thoracic Society (ATS)25.
La bléomycine représente un modèle inflammatoire de fibrose. Les lésions épithéliales initiales induites par la bléomycine entraînent une production transitoire et aiguë de cytokines et le recrutement de neutrophiles dans les poumons41,42. La FPI elle-même n’est pas cliniquement caractérisée par un fort phénotype immunologique, à part des exacerbations aiguës, bien que d’autres types de MPI, tels que ceux associés à la maladie du tissu conjonctif (CTD-ILD), soient plus clairement entraînés par une dysrégulation immunitaire 43,44,45. Par conséquent, en fonction de l’hypothèse testée, les chercheurs peuvent choisir d’étudier des interventions qui interceptent les axes de la maladie à des moments plus tôt ou plus tard. De plus, il est recommandé d’envisager un deuxième modèle pour valider les résultats clés lors du dépistage des thérapies précliniques, telles que la silice, la surexpression adénovirale du TGF-β1, les lésions épithéliales induites par la diphtérie ou les modèles de souris humanisées 5,17,46,47,48.
En conclusion, la technique d’aspiration oropharyngée représente une alternative robuste, reproductible, traduisible et sûre à l’administration intratrachéale de bléomycine pour induire une fibrose dans le poumon murin.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
Ce travail a été soutenu par la subvention de formation en recherche institutionnelle (T32) Ruth L. Kirchstein National Research Service Award (NRSA) des NIH accordée à RW (2T32HL072752-16). Les auteurs tiennent également à souligner le soutien du Centre de santé pulmonaire de la Fondation Saul et Joyce Brandman.
matériels
| Name | Company | Catalog Number | Comments |
| anti-mouse CD45, Brlliant Violet 605 | BioLegend | 103155 | |
| anti-mouse CD64, AlexaFluor 647 | BioLegend | 139322 | |
| anti-mouse Ly6G, AlexaFluor 700 | BioLegend | 127622 | |
| anti-mouse MerTK, PE/Cy7 | BioLegend | 151522 | |
| anti-mouse SiglecF, PE | BD Biosciences | 552126 | |
| BD Luer-Stub Adaptors | Fisher Scientific | 13-681-21 | |
| Bleomycin | McKesson | 1129996 | From NorthStar Rx 16714088601 |
| Endotracheal Mouse Intubation Kit | Kent Scientific | ETI-MSE | |
| Fixable Live/Dead Violet | Thermo | L34955 | |
| FlowJo v10 Software | FlowJo | ||
| gentleMACS Dissociator | Miltenyi | 130-093-235 | |
| Hydroxyproline Assay Kit | Sigma | MAK463 | |
| Liberase TM | Roche | 5401127001 | |
| Moria Vessel Clamp | Fine Science Tools | 18350-11 | |
| Mouse Endotracheal Intubation Kit | Kent | ETI-MSE | |
| Stepper Pipette | Dymax | TI15469 | |
| Wildtype C57BL/6 mice | Jackson Laboratories | JAX, stain #000664 |
Références
- Martinez, F. J., et al. Idiopathic pulmonary fibrosis. Nat Rev Dis Primers. 3, 17074(2017).
- Hutchinson, J., Fogarty, A., Hubbard, R., Mckeever, T. Global incidence and mortality of idiopathic pulmonary fibrosis: A systematic review. Eur Respir J. 46 (3), 795-806 (2015).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E. Jr, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Moore, B. B., Hogaboam, C. M. Murine models of pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 294 (2), L152-L160 (2008).
- Umezawa, H. Chemistry and mechanism of action of bleomycin. Fed Proc. 33 (11), 2296-2302 (1974).
- Muggia, F. M., Louie, A. C., Sikic, B. I. Pulmonary toxicity of antitumor agents. Cancer Treat Rev. 10 (4), 221-243 (1983).
- Degryse, A. L., et al. Repetitive intratracheal bleomycin models several features of idiopathic pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 299 (4), L442-L452 (2010).
- Kolb, P., et al. The importance of interventional timing in the bleomycin model of pulmonary fibrosis. Eur Respir J. 55 (6), 1901105(2020).
- Izbicki, G., Segel, M. J., Christensen, T. G., Conner, M. W., Breuer, R. Time course of bleomycin-induced lung fibrosis. Int J Exp Pathol. 83 (3), 111-119 (2002).
- Chung, M. P., et al. Role of repeated lung injury and genetic background in bleomycin-induced fibrosis. Am J Respir Cell Mol Biol. 29 (3 Pt 1), 375-380 (2003).
- Moeller, A., Ask, K., Warburton, D., Gauldie, J., Kolb, M. The bleomycin animal model: A useful tool to investigate treatment options for idiopathic pulmonary fibrosis. Int J Biochem Cell Biol. 40 (3), 362-382 (2008).
- Lakatos, H. F., et al. Oropharyngeal aspiration of a silica suspension produces a superior model of silicosis in the mouse when compared to intratracheal instillation. Exp Lung Res. 32 (5), 181-199 (2006).
- Sanchez, V. C., Pietruska, J. R., Miselis, N. R., Hurt, R. H., Kane, A. B. Biopersistence and potential adverse health impacts of fibrous nanomaterials: What have we learned from asbestos. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 1 (5), 511-529 (2009).
- Barbarin, V., et al. The role of pro- and anti-inflammatory responses in silica-induced lung fibrosis. Respir Res. 6 (1), 112(2005).
- Sime, P. J., Xing, Z., Graham, F. L., Csaky, K. G., Gauldie, J. Adenovector-mediated gene transfer of active transforming growth factor-beta1 induces prolonged severe fibrosis in rat lung. J Clin Invest. 100 (4), 768-776 (1997).
- Kolb, M., Margetts, P. J., Anthony, D. C., Pitossi, F., Gauldie, J. Transient expression of il-1beta induces acute lung injury and chronic repair leading to pulmonary fibrosis. J Clin Invest. 107 (12), 1529-1536 (2001).
- Sime, P. J., et al. Transfer of tumor necrosis factor-alpha to rat lung induces severe pulmonary inflammation and patchy interstitial fibrogenesis with induction of transforming growth factor-beta1 and myofibroblasts. Am J Pathol. 153 (3), 825-832 (1998).
- Orlando, F., et al. Induction of mouse lung injury by endotracheal injection of bleomycin. J Vis Exp. (146), e58922(2019).
- Barbayianni, I., Ninou, I., Tzouvelekis, A., Aidinis, V. Bleomycin revisited: A direct comparison of the intratracheal micro-spraying and the oropharyngeal aspiration routes of bleomycin administration in mice. Front Med (Lausanne). 5, 269(2018).
- Egger, C., et al. Administration of bleomycin via the oropharyngeal aspiration route leads to sustained lung fibrosis in mice and rats as quantified by ute-MRI and histology. PLoS One. 8 (5), e63432(2013).
- Bale, S., Sunkoju, M., Reddy, S. S., Swamy, V., Godugu, C. Oropharyngeal aspiration of bleomycin: An alternative experimental model of pulmonary fibrosis developed in Swiss mice. Indian J Pharmacol. 48 (6), 643-648 (2016).
- Scotton, C. J., et al. Increased local expression of coagulation factor x contributes to the fibrotic response in human and murine lung injury. J Clin Invest. 119 (9), 2550-2563 (2009).
- Jenkins, R. G., et al. An official American Thoracic Society Workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Rao, G. V., et al. Efficacy of a technique for exposing the mouse lung to particles aspirated from the pharynx. J Toxicol Environ Health A. 66 (15), 1441-1452 (2003).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. Am J Physiol Lung Cell Mol Physiol. 301 (4), L510-L518 (2011).
- Birjandi, S. Z., et al. CD4(+)CD25(hi)Foxp3(+) cells exacerbate bleomycin-induced pulmonary fibrosis. Am J Pathol. 186 (8), 2008-2020 (2016).
- Hubner, R. H., et al. Standardized quantification of pulmonary fibrosis in histological samples. Biotechniques. 44 (4), 507-514 (2008).
- Joshi, N., et al. A spatially restricted fibrotic niche in pulmonary fibrosis is sustained by M-CSF/M-CSFR signalling in monocyte-derived alveolar macrophages. Eur Respir J. 55 (1), 1900646(2020).
- Belperio, J. A., et al. Interaction of IL-13 and C10 in the pathogenesis of bleomycin-induced pulmonary fibrosis. Am J Respir Cell Mol Biol. 27 (4), 419-427 (2002).
- Misharin, A. V., Morales-Nebreda, L., Mutlu, G. M., Budinger, G. R., Perlman, H. Flow cytometric analysis of macrophages and dendritic cell subsets in the mouse lung. Am J Respir Cell Mol Biol. 49 (4), 503-510 (2013).
- Misharin, A. V., et al. Monocyte-derived alveolar macrophages drive lung fibrosis and persist in the lung over the life span. J Exp Med. 214 (8), 2387-2404 (2017).
- Tighe, R. M., et al. Improving the quality and reproducibility of flow cytometry in the lung. An official American Thoracic Society workshop report. Am J Respir Cell Mol Biol. 61 (2), 150-161 (2019).
- Limjunyawong, N., Mock, J., Mitzner, W. Instillation and fixation methods useful in mouse lung cancer research. J Vis Exp. 102, e52964(2015).
- Adamson, I. Y., Bowden, D. H. The pathogenesis of bleomycin-induced pulmonary fibrosis in mice. Am J Pathol. 77 (2), 185-197 (1974).
- Southam, D. S., Dolovich, M., O'byrne, P. M., Inman, M. D. Distribution of intranasal instillations in mice: Effects of volume, time, body position, and anesthesia. Am J Physiol Lung Cell Mol Physiol. 282 (4), L833-L839 (2002).
- Foster, W. M., Walters, D. M., Longphre, M., Macri, K., Miller, L. M. Methodology for the measurement of mucociliary function in the mouse by scintigraphy. J Appl Physiol (1985). 90 (3), 1111-1117 (2001).
- Schrier, D. J., Kunkel, R. G., Phan, S. H. The role of strain variation in murine bleomycin-induced pulmonary fibrosis. Am Rev Respir Dis. 127 (1), 63-66 (1983).
- Hecker, L., et al. Reversal of persistent fibrosis in aging by targeting nox4-nrf2 redox imbalance. Sci Transl Med. 6 (231), 231ra247(2014).
- Chaudhary, N. I., Schnapp, A., Park, J. E. Pharmacologic differentiation of inflammation and fibrosis in the rat bleomycin model. Am J Respir Crit Care Med. 173 (7), 769-776 (2006).
- Kim, S. N., et al. Dose-response effects of bleomycin on inflammation and pulmonary fibrosis in mice. Toxicol Res. 26 (3), 217-222 (2010).
- Wells, A. U., Denton, C. P. Interstitial lung disease in connective tissue disease--mechanisms and management. Nat Rev Rheumatol. 10 (12), 728-739 (2014).
- Idiopathic Pulmonary Fibrosis Clinical Research Network. Prednisone, azathioprine, and n-acetylcysteine for pulmonary fibrosis. N Engl J Med. 366 (21), 1968-1977 (2012).
- Raghu, G., et al. An official ATS/ERS/JRS/ALAT statement: Idiopathic pulmonary fibrosis: Evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 183 (6), 788-824 (2011).
- Kolb, M., et al. Differences in the fibrogenic response after transfer of active transforming growth factor-beta1 gene to lungs of "fibrosis-prone" and "fibrosis-resistant" mouse strains. Am J Respir Cell Mol Biol. 27 (2), 141-150 (2002).
- Sisson, T. H., et al. Targeted injury of type ii alveolar epithelial cells induces pulmonary fibrosis. Am J Respir Crit Care Med. 181 (3), 254-263 (2010).
- Pierce, E. M., et al. Therapeutic targeting of cc ligand 21 or cc chemokine receptor 7 abrogates pulmonary fibrosis induced by the adoptive transfer of human pulmonary fibroblasts to immunodeficient mice. Am J Pathol. 170 (4), 1152-1164 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon