Method Article
Administración orofaríngea de bleomicina en el modelo murino de fibrosis pulmonar
En este artículo
Resumen
Este protocolo demuestra la técnica de aspiración orofaríngea para su uso en el modelo murino de fibrosis pulmonar con bleomicina.
Resumen
La enfermedad pulmonar intersticial (EPI) representa un amplio espectro de trastornos caracterizados por la cicatrización progresiva y a menudo irreversible del parénquima pulmonar, siendo la más común la fibrosis pulmonar idiopática (FPI). Se han desarrollado varios modelos animales de fibrosis pulmonar idiopática, siendo el modelo murino de bleomicina el más utilizado. La bleomicina es un quimioterapéutico conocido por inducir daño en el ADN en el epitelio alveolar, lo que resulta en lesión pulmonar aguda y fibrosis pulmonar en humanos. Los modelos de roedores de la FPI utilizan la administración de bleomicina a través de varios métodos, siendo el más común el intratraqueal (IT). Recientemente, se ha demostrado que la técnica de aspiración orofaríngea (OA) es tan eficaz como la IT para múltiples agentes fibrosantes, con considerablemente menos efectos secundarios y una vía de administración más fácil. Este protocolo detalla el método de administración de bleomicina en el pulmón murino y destaca ejemplos de posibles aplicaciones posteriores para la cuantificación de datos. Esta metodología ofrece una forma sencilla, rápida y segura de utilizar este modelo animal ampliamente utilizado para estudiar los mecanismos moleculares que subyacen a la FPI.
Introducción
La enfermedad pulmonar intersticial (EPI) se refiere a un grupo heterogéneo de trastornos caracterizados por la cicatrización progresiva e irreversible del espacio alvéolo, el intersticio y las vías respiratorias distales1. La fibrosis pulmonar idiopática (FPI) es la forma más común de EPI y conlleva una mediana de supervivencia de aproximadamente tres años2. La fibrosis pulmonar idiopática es una afección terminal, y el trasplante de pulmón ortotópico es una terapia de rescate para pacientes seleccionados. Actualmente existen dos terapias aprobadas por la FDA para la FPI, las cuales simplemente ralentizan la tasa de progresión en lugar de estabilizar o mejorar la función pulmonar de los pacientes 3,4. Se están llevando a cabo importantes esfuerzos de investigación para dilucidar los fundamentos de la FPI e identificar nuevas dianas terapéuticas. Existen innumerables modelos animales para estudiar la patogénesis de la FPI, cada uno con sus propias ventajas y desventajas5. Si bien ningún modelo es capaz de recapitular completamente la complejidad de las enfermedades humanas, estos enfoques ofrecen una visión significativa de los mecanismos moleculares de la FPI y pueden complementar los estudios traslacionales.
El modelo murino de bleomicina sigue siendo el modelo in vivo más ampliamente utilizado y mejor caracterizado de la FPI6. La bleomicina es un agente peptídico que induce roturas de ADN monocatenario y bicatenario. Tras su descubrimiento en 1962, se descubrió que la bleomicina era eficaz en el tratamiento de varios tipos de cáncer, incluidos los tumores testiculares y el linfoma, sin embargo, su uso se ha visto limitado por la neumonitis dependiente de la dosis y la fibrosis pulmonar resultante 7,8. Esta toxicidad pulmonar se recapitula en ratones. Cuando se administra en una sola dosis, después de una fase inflamatoria inicial, la fibrosis puede observarse comenzando cerca del día 5, alcanzando su punto máximo en los días 14-21 9,10,11 (Figura 1). La resolución espontánea ocurre después de aproximadamente 6 semanas, aunque se pueden lograr cambios fibróticos permanentes con dosis repetidas12. Dada la naturaleza transitoria e inflamatoria, existen algunos inconvenientes inherentes con el modelo de bleomicina13, sin embargo, ofrece un sistema rápido, robusto y reproducible para comenzar a responder algunas de las principales brechas en la comprensión de la EPI en nuestro campo y permite a los investigadores comparar los resultados de las últimas cinco décadas. Otros enfoques de instalación incluyen los modelos murinos de asbestosis y sílice, que ofrecen cursos de tiempo similares (días 14-28)6,14,15,16. Sin embargo, estos modelos generan un patrón histológico más consistente con la neumoconiosis que con la FPI y requieren el uso de partículas en el aire, lo que requiere un manejo cuidadoso. Alternativamente, existen modelos animales que utilizan la expresión de transgenes impulsados por el epitelio, como la toxina diftérica y el TGF-β1. Estos recapitulan la lesión de células epiteliales alveolares no inflamatorias de tipo 2 observada en la FPI, sin embargo, toman un poco más de tiempo (21-30d) y requieren el uso de animales especializados que deben retrocruzarse con cualquier modelo transgénico existente de interés. Por último, se ha demostrado que la sobreexpresión de citocinas mediada por adenovirales, incluidos TGF-β1, IL-β1 y TNF-α, induce fibrosis pulmonar en roedores, generalmente en el día14 17,18,19. Estos modelos de sobreexpresión de citocinas permiten una administración intranasal conveniente, aunque requieren una purificación y manipulación cuidadosas.
Existen múltiples abordajes para la administración de bleomicina, incluyendo vía intratraqueal (IT), intranasal, intraperitoneal, subcutánea e intravenosa6. El tratamiento IT es el más común, tradicionalmente la intubación endotraqueal o la traqueostomía quirúrgica20, ambos requieren sedación profunda, finura técnica y se asocian con morbimortalidad perioperatoria. Recientemente, la técnica de aspiración orofaríngea (OA) ha demostrado ser tan eficaz como la IT, con considerablemente menos efectos secundarios y una vía de administración más fácil 14,21,22,23,24,25,26. Aquí, presentamos un protocolo visual detallado para el método de OA de administración de bleomicina en el pulmón murino y destacamos varias aplicaciones potenciales posteriores para la cuantificación de datos.
Protocolo
Los estudios en animales descritos en estos experimentos se llevaron a cabo bajo los protocolos (ARC-2021-025, ARC-2010-039) aprobados por el Comité de Investigación Animal (ARC) de UCLA y el Comité Institucional de Cuidado y Uso de Animales (IACUC). Se mantuvo el cumplimiento total de todas las regulaciones y políticas estatales y federales con respecto al uso de animales de laboratorio. Los animales fueron alojados en el Centro de Cuidado Animal de UCLA y atendidos por el personal calificado de la División de Medicina de Laboratorio y Animal (DLAM) de UCLA en condiciones libres de patógenos. Los ratones silvestres C57BL/6 se obtuvieron comercialmente y se les permitió aclimatarse durante al menos 14 días. Para estos estudios se utilizaron ratones macho de 8 a 12 semanas de edad, con un peso corporal medio de 20 a 25 g. También se pueden utilizar ratones hembra, aunque es importante que los animales coincidan por sexo y edad en todos los grupos y condiciones experimentales27. Los detalles comerciales de los animales, reactivos y equipos utilizados en este estudio se enumeran en la Tabla de Materiales.
1. Administración orofaríngea de bleomicina
- Preparación de bleomicina
NOTA: Utilice bleomicina de grado farmacéutico para garantizar la consistencia y la reproducibilidad entre los animales y los experimentos. Dosis de bleomicina en unidades de fármaco por kg de animal (U/kg), no miligramos (mg) por kg.- Disuelva el polvo de bleomicina en PBS estéril de grado farmacéutico hasta una concentración de 10 U/mL. La bleomicina debe prepararse bajo una cubierta química utilizando las precauciones quimioterapéuticas adecuadas. Almacene las alícuotas a -20 °C durante un máximo de 6 meses.
- Preparar la concentración de trabajo final. La dosis se basa en el peso (0,5-3 U/kg) y se realizan los ajustes necesarios en función de la bleomicina utilizada y del propósito del experimento (por ejemplo, supervivencia o dosis letal).
- Ajuste el volumen final de administración según sea necesario. Para estos estudios, diluya la bleomicina a 0,375 U/mL, lo que equivale a 50 μL para un ratón de 25 g, lo que da como resultado una concentración de trabajo final de 0,75 U/kg.
2. Inducción de la anestesia
- Prepare el cóctel de anestesia diluyendo ketamina y xilacina en PBS a concentraciones de trabajo de 10 mg/mL y 1 mg/mL, respectivamente. Realice este paso en condiciones estériles utilizando reactivos de grado farmacéutico y de acuerdo con los protocolos aprobados institucionalmente.
- Administrar 10 μL del cóctel por gramo de peso corporal del animal (concentración de trabajo: ketamina 100 mg/kg, xilacina 10 mg/kg) mediante inyección intraperitoneal utilizando una aguja de 27,5 G y una jeringa de 1 mL.
- Asegúrese de que el ratón esté correctamente anestesiado y no responda a estímulos nocivos, como el pellizco en los dedos de los pies. Los efectos deberían verse en 5 minutos. Si aún responde, administre ketamina/xilacina adicional en incrementos de 20 μL hasta alcanzar el nivel deseado de anestesia. Aplique ungüento oftálmico para prevenir la sequedad ocular mientras está bajo anestesia.
NOTA: Se prefiere la ketamina sobre otros anestésicos y sedantes inyectados debido a su perfil de efectos secundarios favorables. Tiene efectos mínimos sobre la hemodinámica, incluida la frecuencia cardíaca y la frecuencia respiratoria. El isoflurano inhalado se puede utilizar como agente anestésico alternativo. En estos estudios, se prefiere la ketamina/xilacina porque produce una sedación prolongada y una tos o reflujo mínimos de bleomicina después de la administración.
- Asegúrese de que el ratón esté correctamente anestesiado y no responda a estímulos nocivos, como el pellizco en los dedos de los pies. Los efectos deberían verse en 5 minutos. Si aún responde, administre ketamina/xilacina adicional en incrementos de 20 μL hasta alcanzar el nivel deseado de anestesia. Aplique ungüento oftálmico para prevenir la sequedad ocular mientras está bajo anestesia.
3. Administración orofaríngea
- Una vez debidamente sedado, suspenda el ratón en la plataforma de procedimiento en un ángulo de 60°-80° colgándolo por sus incisivos frontales para abrir eficazmente la orofaringe (Figura 2A).
- Ocluye las fosas nasales con una pinza microvascular lisa, obligando al ratón a respirar a través de su orofaringe.
- Retraiga la lengua fuera de la orofaringe con fórceps.
- Con una pipeta escalonada con punta de leur-stub, coloque suavemente el volumen deseado de bleomicina, o control salino, en la parte posterior de la orofaringe. Asegúrese de que una burbuja de líquido sea muy visible (Figura 2B).
- Continúe sosteniendo la lengua en su lugar hasta que el animal aspire la solución. Esto debe ser visible y, a menudo, audible.
NOTA: Si el animal aspira rápidamente la solución, la visualización en la parte posterior de la orofaringe puede ser transitoria, en pocos segundos. De todos modos, si tiene éxito, el animal demostrará un cambio abrupto y transitorio en su patrón de respiración, tomando respiraciones rápidas y poco profundas. Puede producirse un burbujeo del líquido, lo que indica que el líquido ha entrado con éxito en el tracto respiratorio inferior. También puede causar tos ocasional. Por lo general, se trata de un volumen insignificante de la solución de bleomicina y no debería afectar a los resultados experimentales, permitiendo que el animal permanezca incluido en el estudio. Evite la dosificación repetitiva, ya que aumenta el riesgo de asfixia y altera la dosis final basada en el peso. - Una vez confirmada la aspiración, retire con cuidado la pinza nasal.
- Observe al animal en posición de suspensión durante 15-30 s para asegurarse de que no haya reflujo de la solución de bleomicina, luego devuélvalo a su jaula.
NOTA: Se recomienda un volumen máximo de 50 μL para minimizar el riesgo de asfixia. Dependiendo de la dosis deseada de bleomicina y del peso del ratón, ajuste la concentración de la solución de bleomicina según sea necesario. Cuando practiques esta técnica, usa un tinte a base de agua como el azul de Evans para confirmar que la solución se administra en el tracto respiratorio inferior, en lugar de en el estómago.
4. Recuperación de animales
- Después del tratamiento, coloque al animal de lado en su jaula con una almohadilla térmica debajo para mantener la termoneutralidad.
- Monitorea a los ratones hasta que estén completamente conscientes. Esto suele tardar entre 1 y 2 horas, dependiendo de la dosis de ketamina utilizada y del metabolismo del animal. Pellizque suavemente los dedos de los pies y mantenga a los animales eutérmicos para facilitar el despertar.
- Monitoree clínicamente a los ratones a diario para detectar cambios en el peso corporal, el aseo, el nivel de actividad y el estado respiratorio. Al igual que otros métodos de administración de bleomicina, los animales pueden experimentar una pérdida de peso significativa durante el curso de 14 a 21 días, que es un marcador clave de la eficacia del modelo.
- Según los protocolos de ARC e IACUC, se sacrifica a los animales si la pérdida de peso supera el 20% del peso inicial del animal. La prevalencia y la gravedad de la pérdida de peso dependen de la dosis de bleomicina utilizada y de la demografía de los ratones (véase más arriba).
5. Recolección de tejidos, procesamiento y análisis de puntos finales
- Dependiendo de la pregunta experimental y el momento deseado, se debe sacrificar a los ratones siguiendo los protocolos de la IACUC y extraer sus pulmones28 en el momento adecuado. Los efectos de la bleomicina suelen ser visualmente evidentes en comparación con el control, lo que indica una administración satisfactoria. En estos estudios, los ratones fueron sacrificados en los días 7, 14 y 21.
- Para la histología, diseccionar los pulmones en bloque y fijarlos en PFA al 4% durante 24 h. Proceda con la inclusión de parafina, el corte, la hematoxilina y la eosina (H&E) y/o la tinción tricrómica de Masson como se describió anteriormente 28,29,30.
- Para la medición del colágeno, homogeneice el pulmón derecho y utilice un kit disponible en el mercado (ver Tabla de Materiales) para medir el contenido de hidroxiprolina como se describió anteriormente31.
- Para la citometría de flujo, se digiere el pulmón derecho utilizando el disociador de tejidos y una solución enzimática para obtener una suspensión unicelular. Realizar la tinción y el análisis por citometría de flujo como se ha descrito anteriormente 32,33,34.
Resultados
El protocolo descrito aquí resume la vía de administración de la aspiración orofaríngea en el modelo murino de bleomicina. En estos experimentos, los animales fueron tratados con bleomicina (0,75 U/kg de peso corporal) o PBS para el control simulado. En los días 7, 14 y 21, los ratones fueron sacrificados, se les explantaron los pulmones y se fijó el tejido, comose describió anteriormente. La fibrosis se evaluó mediante tinción histológica de hematoxilina y eosina (H&E). Para el día 7, se puede ver un cambio fibrótico de los tabiques alveolares, junto con pequeños cambios inflamatorios/fibróticos, en comparación con el control de PBS (Figura 3A, B). Hacia el día 14, se observan áreas de fibrosis más grandes y confluentes, con una destrucción significativa de la arquitectura alveolar normal (Figura 3C). En el día 21, estos cambios fibróticos significativos permanecen (Figura 3D). Estos cambios histopatológicos se cuantificaron mediante el sistema de puntuación de Ashcroft modificado29, que demostró un grado similar de fibrosis entre los días 14 y 21 (Figura 3E).
Si bien la histopatología sigue siendo el estándar de oro, se pueden realizar ensayos adicionales para cuantificar objetivamente los cambios fibróticos e inflamatorios inducidos por la bleomicina. Para confirmar los hallazgos de H&E, se realizaron ensayos de hidroxiprolina el día 1431, que demostraron un aumento en la cantidad total de contenido de colágeno con bleomicina (Figura 4A). Además, se aisló ARN de homogeneizados de pulmón completo el día 14, y una reacción en cadena de la polimerasa cuantitativa (qPCR) demostró la regulación positiva de los genes profibróticos Col3a1 y Tgfb con bleomicina (Figura 4B). Para caracterizar los cambios inmunes inducidos por la bleomicina orofaríngea, se realizó citometría de flujo como se describió previamente 32,33,34 (Figura 4C). En respuesta a la bleomicina OA, se observa una fuerte infiltración de células mieloides en el pulmón murino, incluyendo macrófagos intersticiales (MI), macrófagos alveolares derivados de monocitos (MoAM) y neutrófilos (Figura 4D). Estos datos demuestran que la técnica de aspiración orofaríngea es una metodología segura, cómoda y reproducible para inducir fibrosis pulmonar con bleomicina en el modelo animal murino.
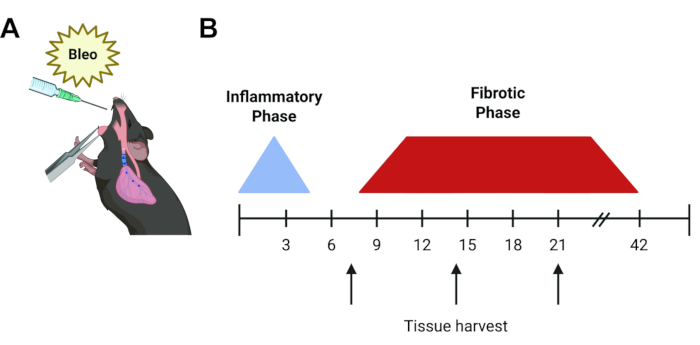
Figura 1: Cronología del protocolo experimental. (A) Representación gráfica de la administración orofaríngea de bleomicina en el pulmón murino. (B) Cronología del curso de la enfermedad de bleomicina. La fase inflamatoria inicial dura 48-72 h y es seguida por una fase fibrótica que comienza aproximadamente el día 7, que se resuelve después de 6 semanas para inyecciones individuales. Las flechas representan los tiempos comunes de recolección de tejido potencial (día 7, 14 o 21) dependiendo de la pregunta del experimento y los ensayos que se utilicen. Haga clic aquí para ver una versión más grande de esta figura.
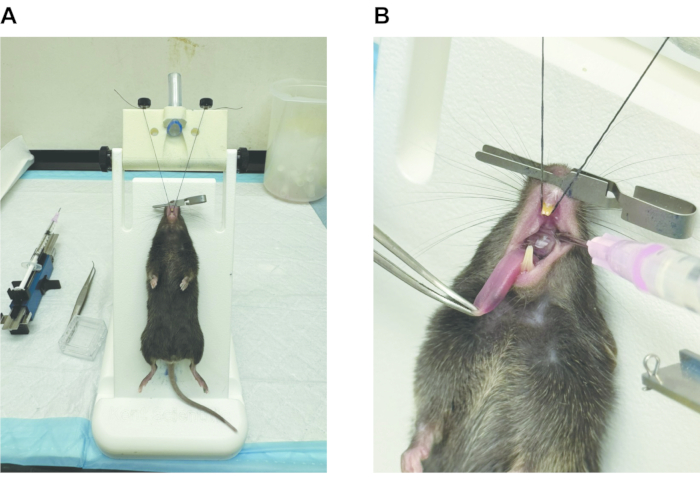
Figura 2: Esquema de la administración orofaríngea de bleomicina. (A) Una vez sedado adecuadamente, el ratón se sujeta por sus incisivos frontales a 60°-80° en una plataforma segura. (B) El conducto nasal se ocluye con una pinza microvascular no dentada. La lengua se retrae de la orofaringe y, mediante una pipeta escalonada con punta de leur-stub, se administra la solución de bleomicina, o control PBS, en la parte posterior de la orofaringe. Una burbuja visible de líquido debe ser visible hasta que se aspire hacia el tracto respiratorio inferior. Haga clic aquí para ver una versión más grande de esta figura.
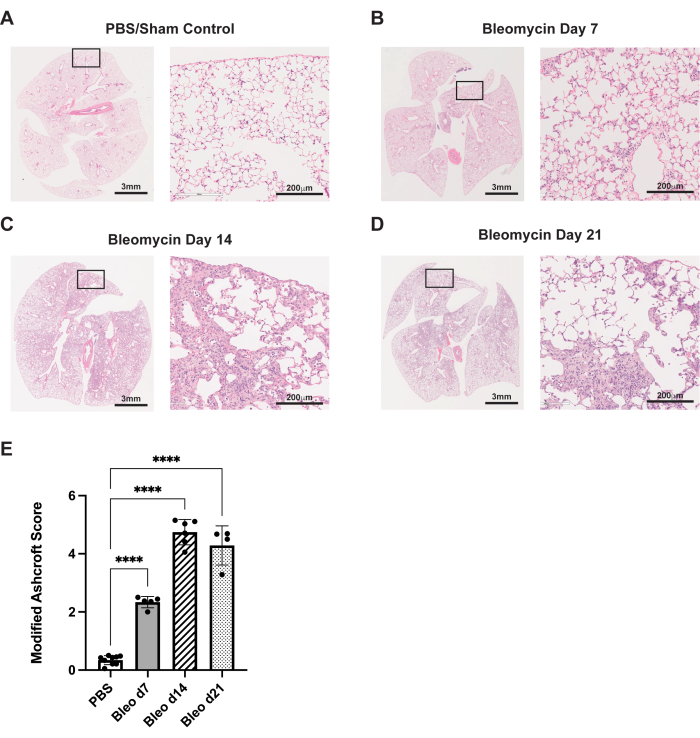
Figura 3: La administración de bleomicina a través de la aspiración orofaríngea da lugar a cambios histológicos fibróticos robustos. Los ratones de tipo salvaje C57Bl/6 fueron tratados con una dosis única de bleomicina (0,75U/kg) o PBS en el día 0. (A) Los controles simulados demuestran una histología pulmonar normal. (B-D) La bleomicina provoca fibrosis progresiva y distorsión arquitectónica del pulmón murino. (E) Puntuación de Ashcroft modificada de muestras histológicas. Las barras de error representan la desviación estándar. p < 0,0001 determinado por el ANOVA de un factor. Las imágenes son representativas de tres experimentos independientes realizados con 4-8 animales por grupo. Las imágenes 20x (derecha, barras de escala: 200 μm) son de los recuadros designados en las imágenes de 1x (izquierda, barras de escala: 3 mm). Haga clic aquí para ver una versión más grande de esta figura.
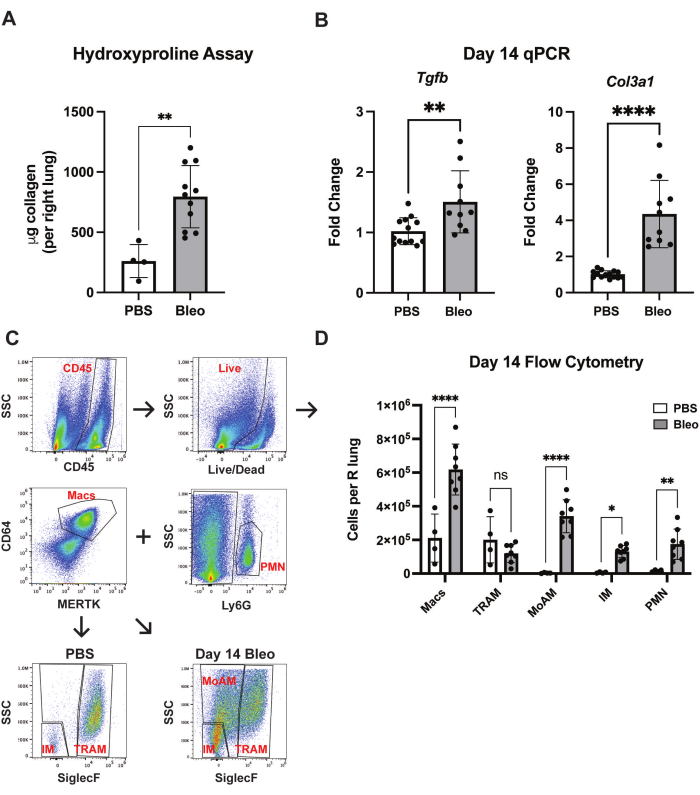
Figura 4: Cuantificación de los cambios profibróticos y proinflamatorios inducidos por la bleomicina. (A) Los pulmones se recolectaron en el día 14 de ratones silvestres C57Bl/6 tratados con bleomicina (0,75U/kg) o PBS. Se realizaron ensayos de hidroxiprolina y se midió el contenido de colágeno (mg por pulmón derecho). (B) El ARN se aisló de tejido pulmonar homogeneizado de animales tratados con bleomicina o PBS en el día 14. Se realizó una PCR cuantitativa para medir el nivel de transcripciones de Col1a1 y Tgfb . El cambio de pliegue relacionado con el grupo control PBS se calculó utilizando el método 2CP en referencia al gen interno de limpieza. (C) Estrategia de compuerta de flujo de poblaciones mieloides en el pulmón murino. (D) Cuantificación de poblaciones mieloides en el pulmón murino en el día 14, en respuesta a bleomicina. Los datos son representativos de tres experimentos independientes con 4-8 animales por grupo por experimento. Las barras de error representan la desviación estándar. *p < 0,05, **p < 0,01, ***p < 0,001, ****p < 0,0001 según lo determinado por la prueba t de Student no apareada (hidroxiprolina y qPCR) o ANOVA de dos vías. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Se proporciona un protocolo de vídeo detallado sobre la técnica de aspiración orofaríngea para la administración de bleomicina para su uso en el modelo murino de fibrosis pulmonar. Además, destacamos las posibles aplicaciones posteriores para cuantificar los cambios fibróticos y de inflamación inducidos por la bleomicina OA.
Si bien ningún animal recapitula completamente la complejidad de la enfermedad humana, el modelo de ratón de bleomicina se ha utilizado durante las últimas cinco décadas y sigue siendo el más ampliamente implementado para estudiar la patogénesis de la FPI36. Existen multitud de formas de administrar bleomicina en modelos de roedores, incluyendo la inyección intratraqueal (IT), intranasal (IN), intravenosa (IV), intraperitoneal y subcutánea6. Si bien la administración intravenosa imita más de cerca el mecanismo de la neumonitis inducida por bleomicina en humanos, la vía IT se usa más comúnmente; La fibrosis se logra con una dosis única, sin toxicidades sistémicas asociadas a dosis más altas, y es más costo-efectiva8. La administración de IT requiere intubación endotraqueal o exploración quirúrgica del cuello y la traqueostomía, que requieren niveles profundos de sedación y un alto grado de habilidad en el procedimiento, al tiempo que conllevan una importante morbilidad y mortalidad perioperatoria asociada. La administración de IN es una alternativa razonable a la IT, sin embargo, se ha demostrado que causa patrones de distribución más variables y lesión pulmonar37,38. El abordaje de la artrosis ha experimentado un uso cada vez mayor y representa un sustituto aparentemente más reproducible para la administración de bleomicina y otros agentes fibrosantes en el pulmón murino 14,21,22,23,24,25,26. Recientemente, se compararon directamente las vías de administración de bleomicina OA e IT en ratones, demostrando igual eficacia y lesión fibrótica homogénea, al tiempo que se minimiza la mortalidad perioperatoria21. Del mismo modo, en este estudio, ningún ratón murió tras la administración de artrosis (datos no mostrados), lo que subraya el perfil técnico y ético favorable de este método.
El grado de fibrosis y el momento de la lesión inducida por la bleomicina dependen de varios factores. Después de la instilación de bleomicina en el pulmón murino, se produce un período inflamatorio inicial de lesión pulmonar aguda, seguido de una fase fibroproliferativa que comienza después de 5-7 días10. De forma rutinaria, los criterios de valoración de la enfermedad se evalúan entre los días 14 y 21, cuando se alcanza la fibrosis sostenida (Figura 3C). El presente estudio se centró en el día 14, que ha demostrado ser el momento óptimo para medir los parámetros de fibrosis pulmonar, ya que los animales han desarrollado una fibrosis extensa, con menor variabilidad y menor mortalidad que la observada en el día 2111. Después de una sola dosis, se ha observado que la fibrosis se resuelve espontáneamente después de aproximadamente 6 semanas en ratones. Para capturar la irreversibilidad observada con muchas formas de EPI en humanos, los investigadores han desarrollado modelos de dosificación repetitivos para lograr cambios fibróticos permanentes en modelos murinos 9,12.
Estudios previos han demostrado una varianza de la cepa en cuanto a la gravedad de la fibrosis lograda con una dosis única de bleomicina, siendo los ratones C57Bl/6 "respondedores altos", los ratones DBA/2 y suizos los "respondedores intermedios", y los ratones BALB/c los ratones "respondedores bajos"39. Además, la edad y el sexo de los ratones utilizados también influyen en el grado de inflamación y fibrosis. Los ratones más viejos (52-54 semanas) mostraron una mayor fibrosis que los ratones más jóvenes (8-12 semanas), y los ratones machos parecen más susceptibles a la bleomicina, en general, que sus contrapartes femeninas 9,40. Estas observaciones sugieren factores genéticos subyacentes que influyen en la respuesta inflamatoria y de cicatrización de heridas, y los investigadores deben hacer coincidir la edad y el sexo de los ratones cuando prueben posibles vías terapéuticas, como sugieren las recientes directrices oficiales de la American Thoracic Society (ATS)25.
La bleomicina representa un modelo inflamatorio de fibrosis. El daño epitelial inicial inducido por la bleomicina da lugar a una producción transitoria y aguda de citocinas y al reclutamiento de neutrófilos en el pulmón41,42. La FPI en sí misma no se caracteriza clínicamente por un fenotipo inmunológico fuerte, aparte de las exacerbaciones agudas, aunque otros tipos de EPI, como los asociados con la enfermedad del tejido conectivo (CTD-EPI), están más claramente impulsados por la desregulación inmune 43,44,45. Por lo tanto, dependiendo de la hipótesis que se esté probando, los investigadores pueden optar por estudiar intervenciones que intercepten los ejes de la enfermedad en puntos de tiempo más tempranos o más tardíos. Además, se recomienda considerar un segundo modelo para validar los hallazgos clave en el cribado de terapias preclínicas, como la sílice, la sobreexpresión adenoviral de TGF-β1, el daño epitelial inducido por difteria o los modelos de ratón humanizados 5,17,46,47,48.
En conclusión, la técnica de aspiración orofaríngea representa una alternativa robusta, reproducible, traducible y segura a la administración intratraqueal de bleomicina para inducir fibrosis en el pulmón murino.
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Este trabajo fue apoyado por la Beca de Capacitación en Investigación Institucional (T32) del Premio del Servicio Nacional de Investigación Ruth L. Kirchstein (NRSA) de los NIH otorgada a RW (2T32HL072752-16). Los autores también desean agradecer el apoyo del Centro de Salud Pulmonar de la Fundación Saul y Joyce Brandman.
Materiales
| Name | Company | Catalog Number | Comments |
| anti-mouse CD45, Brlliant Violet 605 | BioLegend | 103155 | |
| anti-mouse CD64, AlexaFluor 647 | BioLegend | 139322 | |
| anti-mouse Ly6G, AlexaFluor 700 | BioLegend | 127622 | |
| anti-mouse MerTK, PE/Cy7 | BioLegend | 151522 | |
| anti-mouse SiglecF, PE | BD Biosciences | 552126 | |
| BD Luer-Stub Adaptors | Fisher Scientific | 13-681-21 | |
| Bleomycin | McKesson | 1129996 | From NorthStar Rx 16714088601 |
| Endotracheal Mouse Intubation Kit | Kent Scientific | ETI-MSE | |
| Fixable Live/Dead Violet | Thermo | L34955 | |
| FlowJo v10 Software | FlowJo | ||
| gentleMACS Dissociator | Miltenyi | 130-093-235 | |
| Hydroxyproline Assay Kit | Sigma | MAK463 | |
| Liberase TM | Roche | 5401127001 | |
| Moria Vessel Clamp | Fine Science Tools | 18350-11 | |
| Mouse Endotracheal Intubation Kit | Kent | ETI-MSE | |
| Stepper Pipette | Dymax | TI15469 | |
| Wildtype C57BL/6 mice | Jackson Laboratories | JAX, stain #000664 |
Referencias
- Martinez, F. J., et al. Idiopathic pulmonary fibrosis. Nat Rev Dis Primers. 3, 17074(2017).
- Hutchinson, J., Fogarty, A., Hubbard, R., Mckeever, T. Global incidence and mortality of idiopathic pulmonary fibrosis: A systematic review. Eur Respir J. 46 (3), 795-806 (2015).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E. Jr, et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Moore, B. B., Hogaboam, C. M. Murine models of pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 294 (2), L152-L160 (2008).
- Umezawa, H. Chemistry and mechanism of action of bleomycin. Fed Proc. 33 (11), 2296-2302 (1974).
- Muggia, F. M., Louie, A. C., Sikic, B. I. Pulmonary toxicity of antitumor agents. Cancer Treat Rev. 10 (4), 221-243 (1983).
- Degryse, A. L., et al. Repetitive intratracheal bleomycin models several features of idiopathic pulmonary fibrosis. Am J Physiol Lung Cell Mol Physiol. 299 (4), L442-L452 (2010).
- Kolb, P., et al. The importance of interventional timing in the bleomycin model of pulmonary fibrosis. Eur Respir J. 55 (6), 1901105(2020).
- Izbicki, G., Segel, M. J., Christensen, T. G., Conner, M. W., Breuer, R. Time course of bleomycin-induced lung fibrosis. Int J Exp Pathol. 83 (3), 111-119 (2002).
- Chung, M. P., et al. Role of repeated lung injury and genetic background in bleomycin-induced fibrosis. Am J Respir Cell Mol Biol. 29 (3 Pt 1), 375-380 (2003).
- Moeller, A., Ask, K., Warburton, D., Gauldie, J., Kolb, M. The bleomycin animal model: A useful tool to investigate treatment options for idiopathic pulmonary fibrosis. Int J Biochem Cell Biol. 40 (3), 362-382 (2008).
- Lakatos, H. F., et al. Oropharyngeal aspiration of a silica suspension produces a superior model of silicosis in the mouse when compared to intratracheal instillation. Exp Lung Res. 32 (5), 181-199 (2006).
- Sanchez, V. C., Pietruska, J. R., Miselis, N. R., Hurt, R. H., Kane, A. B. Biopersistence and potential adverse health impacts of fibrous nanomaterials: What have we learned from asbestos. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 1 (5), 511-529 (2009).
- Barbarin, V., et al. The role of pro- and anti-inflammatory responses in silica-induced lung fibrosis. Respir Res. 6 (1), 112(2005).
- Sime, P. J., Xing, Z., Graham, F. L., Csaky, K. G., Gauldie, J. Adenovector-mediated gene transfer of active transforming growth factor-beta1 induces prolonged severe fibrosis in rat lung. J Clin Invest. 100 (4), 768-776 (1997).
- Kolb, M., Margetts, P. J., Anthony, D. C., Pitossi, F., Gauldie, J. Transient expression of il-1beta induces acute lung injury and chronic repair leading to pulmonary fibrosis. J Clin Invest. 107 (12), 1529-1536 (2001).
- Sime, P. J., et al. Transfer of tumor necrosis factor-alpha to rat lung induces severe pulmonary inflammation and patchy interstitial fibrogenesis with induction of transforming growth factor-beta1 and myofibroblasts. Am J Pathol. 153 (3), 825-832 (1998).
- Orlando, F., et al. Induction of mouse lung injury by endotracheal injection of bleomycin. J Vis Exp. (146), e58922(2019).
- Barbayianni, I., Ninou, I., Tzouvelekis, A., Aidinis, V. Bleomycin revisited: A direct comparison of the intratracheal micro-spraying and the oropharyngeal aspiration routes of bleomycin administration in mice. Front Med (Lausanne). 5, 269(2018).
- Egger, C., et al. Administration of bleomycin via the oropharyngeal aspiration route leads to sustained lung fibrosis in mice and rats as quantified by ute-MRI and histology. PLoS One. 8 (5), e63432(2013).
- Bale, S., Sunkoju, M., Reddy, S. S., Swamy, V., Godugu, C. Oropharyngeal aspiration of bleomycin: An alternative experimental model of pulmonary fibrosis developed in Swiss mice. Indian J Pharmacol. 48 (6), 643-648 (2016).
- Scotton, C. J., et al. Increased local expression of coagulation factor x contributes to the fibrotic response in human and murine lung injury. J Clin Invest. 119 (9), 2550-2563 (2009).
- Jenkins, R. G., et al. An official American Thoracic Society Workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Rao, G. V., et al. Efficacy of a technique for exposing the mouse lung to particles aspirated from the pharynx. J Toxicol Environ Health A. 66 (15), 1441-1452 (2003).
- Redente, E. F., et al. Age and sex dimorphisms contribute to the severity of bleomycin-induced lung injury and fibrosis. Am J Physiol Lung Cell Mol Physiol. 301 (4), L510-L518 (2011).
- Birjandi, S. Z., et al. CD4(+)CD25(hi)Foxp3(+) cells exacerbate bleomycin-induced pulmonary fibrosis. Am J Pathol. 186 (8), 2008-2020 (2016).
- Hubner, R. H., et al. Standardized quantification of pulmonary fibrosis in histological samples. Biotechniques. 44 (4), 507-514 (2008).
- Joshi, N., et al. A spatially restricted fibrotic niche in pulmonary fibrosis is sustained by M-CSF/M-CSFR signalling in monocyte-derived alveolar macrophages. Eur Respir J. 55 (1), 1900646(2020).
- Belperio, J. A., et al. Interaction of IL-13 and C10 in the pathogenesis of bleomycin-induced pulmonary fibrosis. Am J Respir Cell Mol Biol. 27 (4), 419-427 (2002).
- Misharin, A. V., Morales-Nebreda, L., Mutlu, G. M., Budinger, G. R., Perlman, H. Flow cytometric analysis of macrophages and dendritic cell subsets in the mouse lung. Am J Respir Cell Mol Biol. 49 (4), 503-510 (2013).
- Misharin, A. V., et al. Monocyte-derived alveolar macrophages drive lung fibrosis and persist in the lung over the life span. J Exp Med. 214 (8), 2387-2404 (2017).
- Tighe, R. M., et al. Improving the quality and reproducibility of flow cytometry in the lung. An official American Thoracic Society workshop report. Am J Respir Cell Mol Biol. 61 (2), 150-161 (2019).
- Limjunyawong, N., Mock, J., Mitzner, W. Instillation and fixation methods useful in mouse lung cancer research. J Vis Exp. 102, e52964(2015).
- Adamson, I. Y., Bowden, D. H. The pathogenesis of bleomycin-induced pulmonary fibrosis in mice. Am J Pathol. 77 (2), 185-197 (1974).
- Southam, D. S., Dolovich, M., O'byrne, P. M., Inman, M. D. Distribution of intranasal instillations in mice: Effects of volume, time, body position, and anesthesia. Am J Physiol Lung Cell Mol Physiol. 282 (4), L833-L839 (2002).
- Foster, W. M., Walters, D. M., Longphre, M., Macri, K., Miller, L. M. Methodology for the measurement of mucociliary function in the mouse by scintigraphy. J Appl Physiol (1985). 90 (3), 1111-1117 (2001).
- Schrier, D. J., Kunkel, R. G., Phan, S. H. The role of strain variation in murine bleomycin-induced pulmonary fibrosis. Am Rev Respir Dis. 127 (1), 63-66 (1983).
- Hecker, L., et al. Reversal of persistent fibrosis in aging by targeting nox4-nrf2 redox imbalance. Sci Transl Med. 6 (231), 231ra247(2014).
- Chaudhary, N. I., Schnapp, A., Park, J. E. Pharmacologic differentiation of inflammation and fibrosis in the rat bleomycin model. Am J Respir Crit Care Med. 173 (7), 769-776 (2006).
- Kim, S. N., et al. Dose-response effects of bleomycin on inflammation and pulmonary fibrosis in mice. Toxicol Res. 26 (3), 217-222 (2010).
- Wells, A. U., Denton, C. P. Interstitial lung disease in connective tissue disease--mechanisms and management. Nat Rev Rheumatol. 10 (12), 728-739 (2014).
- Idiopathic Pulmonary Fibrosis Clinical Research Network. Prednisone, azathioprine, and n-acetylcysteine for pulmonary fibrosis. N Engl J Med. 366 (21), 1968-1977 (2012).
- Raghu, G., et al. An official ATS/ERS/JRS/ALAT statement: Idiopathic pulmonary fibrosis: Evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med. 183 (6), 788-824 (2011).
- Kolb, M., et al. Differences in the fibrogenic response after transfer of active transforming growth factor-beta1 gene to lungs of "fibrosis-prone" and "fibrosis-resistant" mouse strains. Am J Respir Cell Mol Biol. 27 (2), 141-150 (2002).
- Sisson, T. H., et al. Targeted injury of type ii alveolar epithelial cells induces pulmonary fibrosis. Am J Respir Crit Care Med. 181 (3), 254-263 (2010).
- Pierce, E. M., et al. Therapeutic targeting of cc ligand 21 or cc chemokine receptor 7 abrogates pulmonary fibrosis induced by the adoptive transfer of human pulmonary fibroblasts to immunodeficient mice. Am J Pathol. 170 (4), 1152-1164 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados