Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation de plaquettes humaines lavées pour des études quantitatives de flux métaboliques
Dans cet article
Résumé
Le métabolisme plaquettaire est intéressant, en particulier en ce qui concerne le rôle de l’hyperactivité et de l’hypoactivité plaquettaires dans les saignements et les troubles thrombotiques. L’isolement des plaquettes du plasma est nécessaire pour certains tests métaboliques ; Voici une méthode d’isolement des métabolites intracellulaires à partir de plaquettes lavées.
Résumé
Les plaquettes sont des cellules sanguines qui jouent un rôle essentiel dans l’hémostase et la réponse immunitaire innée. L’hyperactivité et l’hypoactivité plaquettaires ont été impliquées dans les troubles métaboliques, augmentant le risque de thrombose et d’hémorragie. L’activation plaquettaire et le métabolisme sont étroitement liés, les nombreuses méthodes permettant de mesurer la première étant relativement peu nombreuses pour la seconde. Pour étudier le métabolisme des plaquettes sans l’interférence d’autres cellules sanguines et de composants plasmatiques, les plaquettes doivent être isolées, un processus qui n’est pas trivial en raison de la sensibilité au cisaillement des plaquettes et de la capacité à s’activer de manière irréversible. Voici un protocole d’isolement plaquettaire (lavage) qui produit des plaquettes quiescentes sensibles à la stimulation par les agonistes plaquettaires. Des étapes de centrifugation successives sont utilisées avec l’ajout d’inhibiteurs plaquettaires pour isoler les plaquettes du sang total et les remettre en suspension dans un tampon isosmotique contrôlé. Cette méthode produit de manière reproductible une récupération de 30 à 40 % des plaquettes du sang total avec une faible activation, mesurée par les marqueurs de sécrétion de granules et d’activité de l’intégrine. La numération plaquettaire et la concentration de carburant peuvent être contrôlées avec précision pour permettre à l’utilisateur de sonder une variété de situations métaboliques.
Introduction
Les plaquettes sont de petites cellules anucléées (2 à 4 m de diamètre) qui jouent un rôle important dans l’hémostase, le processus étroitement régulé de formation de caillots1. Bien qu’elles soient essentielles à l’intégrité vasculaire, les plaquettes sont également impliquées dans des événements indésirables pour la santé. Les plaquettes sont impliquées dans la thrombose veineuse profonde (TVP) et la thrombose artérielle (AT), qui sont des caillots qui obstruent les vaisseaux sanguins, entraînant une diminution de l’apport sanguin localement, ou, si des morceaux du caillot se détachent (embolisation), elles peuvent bloquer l’apport sanguin aux poumons, au cœur ou au cerveau 2,3,4,5,6,7 . L’hyperréactivité plaquettaire est une comorbidité de l’hypertension, du diabète et du cancer, entraînant une augmentation de l’incidence de la TVP et de l’AT 8,9,10. L’activation plaquettaire et le métabolisme sont étroitement liés11,12, d’où un intérêt accru pour le ciblage du métabolisme plaquettaire en tant que stratégie thérapeutique 13,14. Il y a un débat sur le recâblage métabolique exact qui se produit lors de l’activation, et c’est un domaine d’étude actif15. Cet intérêt accru pour le dysfonctionnement plaquettaire dans la maladie et ses liens avec le métabolisme souligne la nécessité d’une méthode reproductible pour isoler les plaquettes et étudier leur métabolisme.
Les plaquettes humaines sont généralement obtenues par ponction veineuse, puis isolées du sang total. Les plaquettes lavées sont séparées du sang total par des étapes successives de lavage et de centrifugation16. Cela a été fait à l’origine par le groupe17 de Mustard, et légèrement modifié par le groupe18 de Cazenave. Une autre alternative est les plaquettes filtrées sur gel, qui peuvent être obtenues à partir de plasma riche en plaquettes (PRP) par chromatographie d’exclusion stérique à l’aide d’une colonne garnie de billes de gel d’agarose19. De nombreux protocoles de lavage existent pour le sang humain et de rongeur, et sont optimisés pour divers dosages 20,21,22,23, mais pas pour mesurer le métabolisme plaquettaire.
Les techniques d’étude du métabolisme plaquettaire comprennent les mesures bioénergétiques via l’analyseur Seahorse XF 11,24,25,26,27, les mesures de flux extracellulaires 11,13,24, la métabolomique 14,28 et l’analyse des flux métaboliques assistée par isotopes (13C-MFA)29. Dans les études métabolomiques, l’objectif est généralement de déterminer les voies altérées entre deux conditions différentes (par exemple, plaquettes au repos ou plaquettes activées14). Les études métabolomiques impliquent l’utilisation de la chromatographie en phase liquide couplée à la spectrométrie de masse (LC-MS). Ces études peuvent être effectuées pour les métabolites intracellulaires ou extracellulaires et sont souvent associées à une analyse des voies ou à une analyse en composantes principales (ACP)14,28. L’analyse du flux métabolique assistée par isotopes (13C-MFA) consiste à nourrir les cellules avec un substrat marqué appelé traceur et à mesurer comment ce traceur se propage à travers un réseau réactionnel avec LC-MS. Cette technique permet de calculer les flux à travers les voies métaboliques avec une résolution de niveau de réactionde 29,30. Dans le sang total et le plasma riche en plaquettes (PRP), la concentration de carburant (glucose, glutamine, acétate, etc.) est soumise à une variabilité d’un donneur à l’autre, et l’albumine et la globuline liant les hormones sexuelles présentes dans le plasma peuvent modifier la concentration active d’hormones, de médicaments et d’autres molécules biologiquement pertinentes31. Les plaquettes lavées offrent une méthode de suspension des plaquettes dans un milieu défini par l’utilisateur, y compris les concentrations de carburant connues, qui est compatible avec 13C-MFA32.
On décrit ici une méthode de lavage des plaquettes pour produire des plaquettes qui peuvent être utilisées dans des tests métaboliques. Le protocole produit des plaquettes quiescentes avec une faible contamination par les globules rouges et les globules blancs. L’état d’activation plaquettaire a été surveillé par cytométrie en flux des marqueurs d’activation plaquettaire. Ce protocole permet d’obtenir de manière reproductible une récupération plaquettaire d’au moins 30 à 40 % par rapport à la numération plaquettaire dans le sang total. Les plaquettes lavées obtenues avec cette technique sont adaptées aux techniques d’analyse métabolique, et la méthode d’extraction des métabolites intracellulaires peut être adaptée à l’analyse au choix de l’utilisateur (LC-MS, GC-MS, dosage photométrique, etc.).
Protocole
L’étude a reçu l’approbation de l’Institutional Review Board du campus médical Anschutz de l’Université du Colorado. Le consentement écrit de tous les participants à l’étude a été obtenu. Les participants ont déclaré qu’ils n’avaient pas consommé d’alcool au cours des 48 heures précédentes ni d’anti-inflammatoires non stéroïdiens (AINS) au cours des dix jours précédents. Ce projet est soutenu par le National Heart, Lung, and Blood Institute des National Institutes of Health sous le numéro de bourse R61HL141794.
1. Prélèvement sanguin
- Préparez-vous pour la prise de sang. Il est recommandé que le prélèvement sanguin soit effectué par un phlébotomiste qualifié.
- Effectuez une ponction veineuse sur l’intérieur du bras à l’aide d’une aiguille de 19 G.
- Recueillir les premiers ~2 mL dans un vacutainer sans additif et l’éliminer. Il s’agit d’éliminer les molécules de signalisation chimiques des cellules endothéliales endommagées qui peuvent activer les plaquettes. Une fois les 2 mL initiaux prélevés, retirer le garrot pour réduire la contrainte de cisaillement sur les plaquettes.
- Prélever le reste du sang dans des vacutainers antiocoagulants de citrate de dextrose (ACD-A) dans un rapport de 14:3 (sang :ACD-A). Retournez doucement chaque vacutainer après le prélèvement sanguin pour mélanger le sang et l’anticoagulant.
2. Lavage des plaquettes
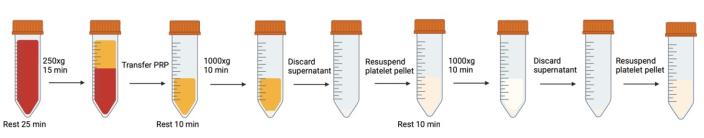
Figure 1 : Étapes successives de centrifugation et de remise en suspension impliquées dans le lavage des plaquettes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
REMARQUE : Évitez la génération de bulles d’air. Utilisez des pipettes de transfert pour éliminer les bulles lorsqu’elles se forment, en particulier avant la centrifugation. Chaque fois que les tubes de sang/plaquettes sont ouverts/fermés, il est recommandé de respirer dans le tube avant de fermer le capuchon pour augmenter le niveau de CO2 .
- Préchauffez la centrifugeuse à 37 °C pour réduire les effets de la température. Entre chaque étape de centrifugation du protocole, maintenez la centrifugeuse à 37 °C.
- Préchauffer le bain-marie à 37 °C. Placez le tampon Tyrode modifié avec du glucose dans le bain-marie.
REMARQUE : la recette modifiée du tampon de Tyrode se trouve dans le fichier supplémentaire 1. - Combinez le sang total recueilli de tous les vacutainers dans des tubes coniques en polypropylène de 50 ml. À l’aide d’une pointe de pipette coupée en biseau à un angle de 45°, prélevez le volume d’échantillon approprié pour effectuer un comptage cellulaire (voir Comptage cellulaire).
- Éliminez toutes les bulles générées par l’aspiration soigneuse à l’aide d’une pipette de transfert à alésage étroit.
- Laissez le sang reposer dans un bain-marie pendant 25 minutes à 37 °C Cela permet aux plaquettes dans un état d’activation réversible (après avoir été retirées du corps, transférées d’un tube à l’autre, etc.) de revenir à un état de repos.
- Pour éviter l’activation pendant la centrifugation, ajoutez 500 nM de prostaglandine I2 (PGI2) et 0,02 U/mL d’apyrase au sang total et mélangez doucement en inversant une fois. Retirez toutes les bulles générées à l’aide d’une pipette de transfert à alésage étroit.
REMARQUE : Les instructions pour une bonne recette d’IGP2 et d’apyrase se trouvent dans le dossier supplémentaire 1. - Centrifuger le sang total pour obtenir du plasma riche en plaquettes (PRP) (15 minutes à 250 x g pour 42 mL de sang total) sans frein (37 °C).
- Prélever délicatement le PRP (couche supérieure jaune au-dessus de la couche leucocytaire et de la couche de sang rouge) dans un nouveau tube conique de 50 ml à l’aide d’une pipette de transfert à large diamètre.
- Lors du transfert, inclinez un tube conique propre et faites glisser doucement le PRP sur le côté du tube. Évitez les bulles d’air.
- Laissez environ 3 mm de PRP derrière vous pour éviter de perturber la couche leucocytaire (la couche de globules blancs entre le PRP et le sang rouge). S’il est dérangé, cela ressemblera à un tourbillon soudain de blanc dans la pipette de transfert.
- Prenez le comptage des cellules (voir Comptage des plaquettes) pour déterminer le volume de remise en suspension pour l’étape de lavage suivante.
- Laisser reposer 10 minutes à 37 °C.
- À l’aide d’une pointe de pipette coupée en biseau, prélevez l’échantillon pour la cytométrie en flux (voir Cytométrie en flux).
- Ajouter 500 nM d’IGP2 et 0,02 U/mL d’apyrase au PRP et mélanger en inversant doucement une fois.
- Centrifuger pendant 10 minutes à 1000 x g à 37 °C (accélération : 0, frein : 0). Ne pas utiliser le frein. La pastille n’est pas compacte et un freinage soudain peut provoquer un remixage.
- Pendant la centrifugation, déterminez le volume de remise en suspension. Supposons une récupération de 75 %. Rendre la densité cellulaire d’environ 3x105 cellules/μL.
- Aspirer le surnageant à l’aide d’une pipette de transfert en plastique à large diamètre pour le volume en vrac et d’une pipette de 1 mL (pointe non coupée) pour le reste du liquide près de la pastille. Évitez de toucher les granulés au fond du tube.
- Ajouter 500 nM d’IGP2 et 0,02 U/mL d’apyrase au tampon de Tyrode modifié. Ajoutez lentement la quantité calculée de tampon à partir de l’étape 16 en coulant sur le côté du tube conique.
- À l’aide d’une pointe coupée en biseau et d’une pointe de pipette de 1 ml, remettre doucement la pastille en suspension en la pipetant doucement de haut en bas à plusieurs reprises.
- Réglez le volume sur 300 μL, enfoncez complètement le piston au-dessus de la ligne de liquide, puis placez la pipette sous le liquide et remontez jusqu’à la première butée. Cela permettra au scientifique de remettre la pastille en suspension sans créer accidentellement de bulles d’air qui pourraient activer les plaquettes.
- Parfois, il y a un anneau de globules rouges visibles au fond de la cuillette. Évitez de le suspendre à nouveau.
- Une fois la pastille remise en suspension, utilisez une pipette de transfert à large diamètre pour transférer la pastille remise en suspension dans un nouveau tube conique, en laissant derrière elle les globules rouges ou les cellules visiblement agglomérées.
- Répétez les étapes 11 à 20. Assurez-vous d’ajouter 500 nM d’IGP2 et 0,02 U/mL d’une aliquote fraîche au tampon de Tyrode modifié (ne réutilisez pas le tampon de Tyrode modifié de l’étape 18, l’IGP2 est trop instable).
- Prélever un échantillon pour numération cellulaire. Ajustez la concentration plaquettaire au besoin avec le tampon de Tyrode modifié.
- Utilisez une pointe de pipette à coupe en biseau pour prélever un échantillon pour la cytométrie en flux.
- Laissez les plaquettes reposer pendant 1 h à 37 °C pour laisser le temps aux inhibiteurs de s’estomper et permettre à toute plaquette activée de manière réversible de revenir à un état de repos.
- Mélangez délicatement à l’aide d’une pipette à gros calibre. Prélever des échantillons pour la cytométrie en flux.
- Les plaquettes lavées et au repos sont maintenant prêtes à être utilisées pour l’analyse métabolique.
3. Comptage des plaquettes
- Les plaquettes peuvent être comptées à l’aide d’un compteur de cellules sanguines automatisé (suivre les instructions du fabricant) ou d’un hémocytomètre33.
4. Cytométrie en flux
- Préparation
- Des protocoles détaillés et des revues des meilleures pratiques pour la mise en place de mélanges d’anticorps et la préparation du cytomètre en flux pour mesurer l’activation plaquettaire peuvent être trouvés ailleurs34,35.
- Échantillonnage
- Lors du prélèvement d’un échantillon pour la cytométrie en flux, prélever la suspension plaquettaire à l’aide d’une pointe de pipette à coupe en biseau. Ajoutez-le lentement dans le tube de microcentrifugation avec des anticorps, puis effleurez doucement pour mélanger. Laisser incuber pendant 30 s.
- À l’aide de la pointe de pipette à coupe biseautée, transférez le mélange de suspension plaquettaire et d’anticorps dans le puits approprié sur la plaque à 96 puits.
- Ajouter immédiatement le fixateur au puits pour fixer les cellules.
- Fonctionner sur cytomètre en flux dans les 8 heures suivant la fixation.
- Tests de sensibilité des agonistes
- Après le lavage, réservez 2 tubes coniques de 15 ml, un pour le contrôle au repos et un comme contrôle activé par la thrombine.
- Pipetez doucement 100 μL de suspension plaquettaire dans chaque tube conique à l’aide d’une pointe de pipette coupée en biseau. Laisser reposer à 37 °C pendant 1 h.
- Après l’heure de repos, ajoutez 0,1 U/mL de thrombine dans un tube (les instructions pour la préparation de la thrombine se trouvent dans le fichier supplémentaire 1) et le véhicule dans l’autre. Incuber à 37 °C pendant 15 min.
- Prélever un échantillon de cytométrie en flux de chaque tube pour déterminer la sensibilité des plaquettes à l’agoniste.
5. Échantillonnage pour l’analyse quantitative des flux métaboliques
- Trempe
REMARQUE : L’extinction du métabolisme est une étape nécessaire pour mesurer des flux métaboliques précis. Le refroidissement rapide des cellules et le maintien de leur température à 4 °C ou moins ralentissent suffisamment le métabolisme pour que l’on puisse supposer qu’il est essentiellement arrêté, de sorte que les cellules échantillonnées reflètent avec précision le métabolisme des cellules de la masse. Il existe une variété de méthodes qui peuvent être utilisées, mais pour équilibrer la nécessité d’un refroidissement rapide et la minimisation des fuites, utilisez une solution saline normale36 froide (-4 °C). Si le sel interfère avec l’analyse ultérieure, un autre fluide peut être utilisé (méthanol/eau, éthanol, etc.)37.- Préparez et congelez des aliquotes de solution saline normale. Réaliser chaque aliquote saline à 6 fois le volume de l’échantillon souhaité.
REMARQUE : la recette normale de solution saline se trouve dans le fichier supplémentaire 1. - Pré-refroidissez la microcentrifugeuse à 0 °C.
- Prélever la suspension plaquettaire dans une solution saline normale partiellement congelée (< -4 °C) dans un rapport de 1:6 (p. ex., prélever 150 μL de suspension plaquettaire dans 750 μL de solution saline dans des tubes de microcentrifugation).
REMARQUE :Ne laissez pas la solution plaquettaire/saline sur de la glace pendant plus de 15 min. - Centrifugeuse à 16 000 x g, 0 °C pendant 10 min.
- Conservez le surnageant pour l’analyse externe des métabolites et la pastille pour l’extraction et la mesure des métabolites intracellulaires. Stockez les deux à -20 °C jusqu’à ce qu’ils soient prêts pour l’analyse.
- Répétez ce processus sur l’intervalle de temps et le nombre de points de temps d’échantillonnage souhaités.
- Préparez et congelez des aliquotes de solution saline normale. Réaliser chaque aliquote saline à 6 fois le volume de l’échantillon souhaité.
- Extraction intracellulaire des métabolites
- Ajoutez 0,5 ml d’eau au méthanol 7:3 pré-refroidie à -20 °C à la pastille trempée. Agiter vigoureusement pendant 1 min.
- Congelez dans de l’azote liquide, décongelez à 0 °C, puis répétez l’opération pour 2 cycles supplémentaires.
- Centrifuger les suspensions à 16 000 x g pendant 10 minutes à -4 °C.
- Recueillir le surnageant dans un nouveau tube de microcentrifugation.
- Utilisez la pastille de l’étape 3 et répétez le protocole d’extraction (étapes 1-3) avec 50:50 méthanol :eau. Ajoutez le deuxième extrait collecté au premier. Sécher pendant la nuit.
- Remettre l’extrait séché en suspension dans 150 μL d’eau de qualité LC-MS (ou un autre dissolvant approprié pour l’analyse prévue). Mélanger pendant 15 minutes à 4 °C. Agiter brièvement le tourbillon et transférer dans des tubes de microcentrifugation de 0,22 μm pour éliminer les débris cellulaires. Centrifuger pendant 5 minutes à 16 000 x g et 4 °C.
- Retirer de la centrifugeuse, pipeter 50 μL d’eau optima supplémentaire sur le filtre et centrifuger à nouveau (5 min, 16 000 x g et 4 °C) pour rincer le filtre. Collecter pour analyse.
Résultats
Les résultats représentatifs de la figure 2 représentent 6 donneurs de sang différents, dont 3 hommes et 3 femmes. Le rendement plaquettaire par rapport au sang total est illustré à la figure 2A. La récupération plaquettaire finale était en moyenne de 52 % ± 3 % (écart-type, n = 6). La numération plaquettaire finale par rapport à la contamination par les globules blancs a été mesurée à l’aide d’un analyseur ...
Discussion
Les plaquettes sont très sensibles à leur environnement, y compris le stress de cisaillement et la présence d’agonistes38,39. Cela rend les plaquettes difficiles à manipuler et à isoler, ce qui rend l’utilisation d’inhibiteurs et de pipettes de gros calibre cruciale40. Il est essentiel de bien stocker et de bien préparer l’IGP2, car l’absence de préparation de l’IGP2
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à signaler.
Remerciements
Les auteurs tiennent à remercier les Docteurs Emily Janus-Bell et Clarisse Mouriaux du laboratoire du Dr Pierre Mangin et Katrina Bark du laboratoire du Dr Jorge DiPaola pour leurs conseils et leurs conseils.
matériels
| Name | Company | Catalog Number | Comments |
| 0.22 µM filter Spin-X tubes | Millapore-Sigma | CLS8160 | Reagent prep |
| 19 G x 3/4" needle | McKesson Corporation | 448406 | Phlebotomy |
| 21 G 1.5 inch needle with luer lock | Amazon | B0C39PJD23 | Reagent prep |
| 96 well plate, half area | Greiner Bio-One | 675101 | Flow cytometry |
| ACD-A vaccutainers | Fisher Scientific | 364606 | Phlebotomy |
| Adapter | McKesson Corporation | 609 | Phlebotomy |
| Alcohol swab | VWR | 15648-916 | Phlebotomy |
| Apyrase from potatoes | Sigma | A6410-100UN | Reagent prep |
| CD42a Monoclonal Antibody | Thermo Fisher Scientific | 48-0428-42 | Flow cytometry |
| Chilled microcentrifuge | ThermoFisher Scientific | 75002441 | Quenching |
| D-Glucose | Sigma | G7021 | Reagent prep |
| FITC Anti-Fibrinogen antibody | Abcam | 4217 | Flow cytometry |
| Flow cytometer | Beckman Coulter | 82922828 | Flow cytometry |
| Gauze | VWR | 76049-110 | Phlebotomy |
| Glycerol | Sigma Aldrich | G5516 | Reagent prep |
| HEPES | Sigma Aldrich | H4034 | Reagent prep |
| Human alpha-thrombin | Prolytix | HCT-0020 | Flow cytometry |
| KCl | Sigma Aldrich | P9333 | Reagent prep |
| KH2PO4 | Sigma Aldrich | P5655 | Reagent prep |
| MgCl2 | Sigma | M8266 | Reagent prep |
| Microcentrifuge tubes | VWR | 87003-292 | General |
| Na2HPO4 | Sigma | S3264 | Reagent prep |
| NaCl | Sigma Aldrich | S7653 | Reagent prep |
| NaHCO3 | Sigma Aldrich | S5761 | Reagent prep |
| Narrow bore transfer pipette | VWR | 16001-176 | Platelet washing |
| Paraformaldehyde solution, 4% in PBS | Santa Cruz Biotechnology | sc-281692 | Flow cytometry |
| PECy5 Mouse Anti-Human CD62P | BD Pharmingen | 551142 | Flow cytometry |
| Plate cover | Thermo Fisher Scientific | AB0626 | Flow cytometry |
| Polypropylene 15 mL conical tubes | VWR | 89039-658 | Reagent prep |
| Polypropylene 50 mL conical tubes | VWR | 352070 | Platelet washing |
| Prostaglandin I2 (sodium salt) | Cayman Chemical | 18220 | Reagent prep |
| SKC Inc. C-Chip Disposable Hemocytometers | Fisher Scientific | 22-600-100 | Cell counting |
| Syringe | BD Pharmingen | 14-823-41 | Reagent prep |
| Tourniquet | VWR | 76235-371 | Phlebotomy |
| Vacutainer needle holder | BD | 364815 | Phlebotomy |
| Vortexer | VWR | 102091-234 | Reagent prep |
| Water bath | Thermo Fisher Scientific | TSGP02 | Platelet washing |
| Wide bore transfer pipette | VWR | 76285-362 | Platelet washing |
Références
- Versteeg, H. H., Heemskerk, J. W., Levi, M., Reitsma, P. H. New fundamentals in hemostasis. Physiol Rev. 93 (1), 327-358 (2013).
- Webera, M., et al. Enhanced platelet aggregation with trap-6 and collagen in platelet aggregometry in patients with venous thromboembolism. Thromb Res. 107, 325-328 (2002).
- Herbert, J. M., Bernat, A., Maffrand, J. P. Importance of platelets in experimental venous thrombosis in the rat. Blood. 80 (9), 2281-2286 (1992).
- Puurunen, M. K., Hwang, S. J., O'donnell, C. J., Tofler, G., Johnson, A. D. Platelet function as a risk factor for venous thromboembolism in the framingham heart study. Thromb Res. 151, 57-62 (2017).
- Montoro-Garcia, S., Schindewolf, M., Stanford, S., Larsen, O. H., Thiele, T. The role of platelets in venous thromboembolism. Semin Thromb Hemost. 42 (3), 242-251 (2016).
- Koupenova, M., Kehrel, B. E., Corkrey, H. A., Freedman, J. E. Thrombosis and platelets: An update. Eur Heart J. 38 (11), 785-791 (2017).
- Yeung, J., Li, W., Holinstat, M. Platelet signaling and disease: Targeted therapy for thrombosis and other related diseases. Pharmacol Rev. 70 (3), 526-548 (2018).
- Ferreiro, J. L., Gomez-Hospital, J. A., Angiolillo, D. J. Platelet abnormalities in diabetes mellitus. Diab Vasc Dis Res. 7 (4), 251-259 (2010).
- Buergy, D., Wenz, F., Groden, C., Brockmann, M. A. Tumor-platelet interaction in solid tumors. Int J Cancer. 130 (12), 2747-2760 (2012).
- Gkaliagkousi, E., Passacquale, G., Douma, S., Zamboulis, C., Ferro, A. Platelet activation in essential hypertension: Implications for antiplatelet treatment. Am J Hypertens. 23 (3), 229-236 (2010).
- Fidler, T. P., et al. Deletion of GLUT1 and GLUT3 reveals multiple roles for glucose metabolism in platelet and megakaryocyte function. Cell Rep. 20 (4), 881-894 (2017).
- Fidler, T. P., et al. Glucose metabolism is required for platelet hyperactivation in a murine model of type 1 diabetes. Diabetes. 68 (5), 932-938 (2019).
- Kulkarni, P. P., et al. Aerobic glycolysis fuels platelet activation: Small-molecule modulators of platelet metabolism as anti-thrombotic agents. Haematologica. 104 (4), 806-818 (2019).
- Ghatge, M., Flora, G. D., Nayak, M. K., Chauhan, A. K. Platelet metabolic profiling reveals glycolytic and 1-carbon metabolites are essential for gp vi-stimulated human platelets-brief report. Arterioscler Thromb Vasc Biol. 44 (2), 409-416 (2024).
- Ravera, S., Signorello, M. G., Panfoli, I. Platelet metabolic flexibility: A matter of substrate and location. Cells. 12 (13), (2023).
- Hechler, B., Dupuis, A., Mangin, P. H., Gachet, C. Platelet preparation for function testing in the laboratory and clinic: Historical and practical aspects. Res Pract Thromb Haemost. 3 (4), 615-625 (2019).
- Mustard, J. F., Perry, D. W., Ardille, N. G., Packham, M. A. Preparation of suspensions of washed platelets from humans. British Journal of Haematology. 22, 193-204 (1972).
- Cazenave, J. P., et al. Preparation of washed platelet suspensions from human and rodent blood. Methods Mol Biol. 272, 13-28 (2004).
- Fine, K., Ashbrook, P., Brigden, L., Maldonado, J., Didishelm, P. Gel-filtered human platelets. Ultrastructure, function, and role of proteins in inhibition of aggregation by aspirin. Am J Pathol. 84 (1), (1976).
- Weiss, L., et al. An optimized protocol to isolate quiescent washed platelets from human whole blood and generate platelet releasate under clinical conditions. STAR Protoc. 4 (2), 102150 (2023).
- Burzynski, L. C., Pugh, N., Clarke, M. C. H. Platelet isolation and activation assays. Bio Protoc. 9 (20), e3405 (2019).
- Aurbach, K., Spindler, M., Haining, E. J., Bender, M., Pleines, I. Blood collection, platelet isolation and measurement of platelet count and size in mice-a practical guide. Platelets. 30 (6), 698-707 (2018).
- Narciso, M. G., Nasimuzzaman, M. Purification of platelets from mouse blood. J Vis Exp. (147), (2019).
- Aibibula, M., Naseem, K. M., Sturmey, R. G. Glucose metabolism and metabolic flexibility in blood platelets. J Thromb Haemost. 16 (11), 2300-2314 (2018).
- Ravi, S., et al. Metabolic plasticity in resting and thrombin-activated platelets. PLoS One. 10 (4), e0123597 (2015).
- Nayak, M. K., et al. an inhibitor of pyruvate dehydrogenase kinases, inhibits platelet aggregation and arterial thrombosis. Blood Advances. 2, (2018).
- Hadley, J. B., et al. Hormones, age, and sex affect platelet responsiveness in vitro. Transfusion. 62 (9), 1882-1893 (2022).
- Paglia, G., et al. Comprehensive metabolomic study of platelets reveals the expression of discrete metabolic phenotypes during storage. Transfusion. 54 (11), 2911-2923 (2014).
- Sake, C. L., et al. Isotopically nonstationary (13)c metabolic flux analysis in resting and activated human platelets. Metab Eng. 69, 313-322 (2022).
- Antoniewicz, M. R. A guide to metabolic flux analysis in metabolic engineering: Methods, tools and applications. Metab Eng. 63, 2-12 (2021).
- Larsen, M. T., Kuhlmann, M., Hvam, M. L., Howard, K. A. Albumin-based drug delivery: Harnessing nature to cure disease. Mol Cell Ther. 4 (3), (2016).
- Balduini, C. L., Noris, P. P. latelet count and aging. Haematologica. 9 (6), 953-955 (2014).
- JoVE Science Education Database. Basic methods in cellular and molecular biology. Using a hemacytometer to count cells. , (2023).
- Spurgeon, B. E. J., Naseem, K. M. Platelet flow cytometry: Instrument setup, controls, and panel performance. Cytometry B Clin Cytom. 98 (1), 19-27 (2020).
- Van Velzen, J. F., Laros-Van Gorkom, B. A., Pop, G. A., Van Heerde, W. L. Multicolor flow cytometry for evaluation of platelet surface antigens and activation markers. Thromb Res. 130 (1), 92-98 (2012).
- Sake, C. L., Newman, D. M., Boyle, N. R. Evaluation of quenching methods for metabolite recovery in photoautotrophic synechococcus sp. Pcc 7002. Biotechnol Prog. 36 (5), e3015 (2020).
- Sapcariu, S. C., et al. Simultaneous extraction of proteins and metabolites from cells in culture. MethodsX. 1, 74-80 (2014).
- Rana, A., Westein, E., Niego, B., Hagemeyer, C. E. Shear-dependent platelet aggregation: Mechanisms and therapeutic opportunities. Front Cardiovasc Med. 6, 141 (2019).
- Ding, J., et al. Quantification of shear-induced platelet activation: High shear stresses for short exposure time. Artif Organs. 39 (7), 576-583 (2015).
- Ardlie, N., Perry, D., Packham, M., Mustard, J. Influence of apyrase on stability of suspensions of washed rabbit platelets. Proc Soc Exp Biol Med. 136 (4), (1971).
- Rao, G. H. R., Reddy, K. R., Hagert, K., White, J. G. Influence of ph on the prostacyclin (pg12) mediated inhibition of platelet function. Prostaglandins Medicine. 4, 263-273 (1980).
- Navred, K., et al. A simplified flow cytometric method for detection of inherited platelet disorders-a comparison to the gold standard light transmission aggregometry. PLoS One. 14 (1), e0211130 (2019).
- Aldrighi, J. M., et al. Platelet activation status decreases after menopause. Gynecol Endocrinol. 20 (5), 249-257 (2005).
- Bausset, O., et al. Formulation and storage of platelet-rich plasma homemade product. Biores Open Access. 1 (3), 115-123 (2012).
- Nayak, M. K., et al. The metabolic enzyme pyruvate kinase m2 regulates platelet function and arterial thrombosis. Blood. 137 (12), 1658-1668 (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon