Method Article
In vitro Evaluación de los efectos de los láseres Er, Cr: YSGG y de diodo utilizados en cilindros de titanio
En este artículo
Resumen
En este estudio, los láseres Er, Cr:YSGG y de diodo se aplicaron por separado a la superficie plana de un total de 96 cilindros de titanio especialmente diseñados. Se colocó un termopar en la otra superficie y se midió la temperatura. Rugosidad superficial analizada por perfilómetro, SEM y AFM.
Resumen
Las enfermedades periimplantarias son problemas importantes asociados con los implantes dentales. El objetivo de este estudio fue evaluar la rugosidad de la superficie y los cambios de temperatura cuando se aplican láseres de diodo y de erbio, cromo, itrio-escandio-galio-granate (Er,Cr:YSGG) en cilindros de titanio en el tratamiento de enfermedades periimplantarias no quirúrgicas. Se formaron un total de 13 grupos, incluido el grupo de control, con láseres de diodo de 940 nm (0,8 W-1,3 W-1,8 W) y Er,Cr:YSGG (1,5 W-2,5 W-3,5 W) en 6 modos de potencia diferentes, 20s/W y 40 s/W, y se trataron ocho cilindros de titanio en cada grupo. Durante el proceso, se registraron las temperaturas inicial y final con un termopar colocado en la ranura apical del cilindro. Después de la aplicación, la rugosidad (Ra) de todos los discos se midió con un perfilómetro. Las superficies se escanearon con microscopio electrónico de barrido (SEM) y microscopio de fuerza atómica (AFM) para el examen de superficies bidimensional y tridimensional. Cuando se evaluaron los cambios de temperatura de los cilindros de titanio durante la irradiación, los cilindros irradiados con un láser de diodo durante 40 s fueron significativamente más altos que los irradiados durante 20 s. En los cilindros tratados con Er,Cr:YSGG, la temperatura disminuyó en algunas muestras y aumentó mínimamente en otras muestras. Los valores del perfilómetro (Ra) no fueron estadísticamente significativos en términos de rugosidad para todos los grupos. Sin embargo, las imágenes SEM mostraron un derretimiento y un aumento en el número de microporos en las superficies tratadas. Con las limitaciones de este estudio in vitro , la aplicación del Er,Cr:YSGG y el diodo puede considerarse como un enfoque seguro para el tratamiento de la periimplantitis, particularmente en términos de seguridad térmica. Si bien la rugosidad de la superficie permanece sin cambios, el uso de estos láseres dio como resultado cambios en la fusión y microporos en la topografía del cilindro de Ti. Para determinar cómo estos ajustes del láser afectan la disminución bacteriana y la osteointegración, se necesita investigación adicional.
Introducción
Los implantes dentales son una opción de tratamiento comúnmente aceptada para el reemplazo de dientes perdidos 1,2. La mucositis periimplantaria y la periimplantitis se clasifican como enfermedades periimplantarias. La mucositis periimplantaria se restringe a los tejidos blandos y no hay evidencia de pérdida ósea, con la excepción de la remodelación ósea fisiológica. La periimplantitis es una condición patológica que se asocia con la placa y afecta a los tejidos que rodean a los implantes dentales. Se distingue por la inflamación de la mucosa periimplantaria y el consiguiente aumento de la pérdida de hueso de soporte3. El principal factor etiológico para el inicio y la progresión del trastorno es la disrupción del biofilm de la placa periimplantaria4. Numerosos estudios sobre enfermedades periimplantarias indican que la prevalencia de la mucositis periimplantaria (PIM) oscila entre el 9,7% y el 64,6%, mientras que la prevalencia de periimplantitis (P) varía entre el 4,7% y el 45%5.
Si bien la acumulación de placa es el principal factor etiológico causante de la periimplantitis, su tratamiento se complica por las diversas características topográficas de los implantes. La base del tratamiento no quirúrgico de la periimplantitis es el manejo de la infección mediante el desbridamiento de la superficie del implante y la eliminación de la biopelícula adherida para disminuir la carga bacteriana por debajo del umbral causante de la enfermedad 6,7. La compleja micro y macrotopografía de las interfaces de titanio y la anatomía de los defectos óseos limitan la descontaminación de la superficie. Se ha evaluado la eficacia de diferentes técnicas de descontaminación mecánicas (curetas, dispositivos ultrasónicos, abrasión aire-polvo, cepillos de titanio), químicas (ácido cítrico, clorhexidina, antimicrobianos) y físicas (láser, terapia fotodinámica)en combinación 8. La investigación actual sugiere que el uso combinado de técnicas de intervención no quirúrgica para la periimplantitis es más efectivo que el desbridamiento solo9. La incorporación de agentes antimicrobianos químicos o antibióticos locales/sistémicos en la terapia mecánica ha demostrado una eficacia significativa; Sin embargo, estas intervenciones podrían tener posibles consecuencias adversas10. A medida que la tecnología láser ha avanzado, los láseres dentales se han vuelto cada vez más populares debido a sus efectos antiinfecciosos, desintoxicantes y fáciles de usar en las superficies de los implantes10,11.
El pico de absorción, el modo de funcionamiento del dispositivo y las propiedades del tejido afectan el aumento de calor durante la irradiación láser. Una investigación preclínica crucial reveló que una elevación de la temperatura a 50 °C durante 1 min causaba daño vascular, mientras que un aumento a 60 °C provocaba el cese del flujo sanguíneo y la posterior necrosis ósea12. Una investigación in vitro descubrió que después de solo 10 s de irradiación con láser de diodo, las superficies de los implantes podían alcanzar temperaturas superiores al umbral de seguridad ósea (10 °C). La viabilidad ósea podría verse comprometida por un aumento de temperatura de solo 10 °C13.
Numerosos estudios recientes se han concentrado en examinar el impacto beneficioso de los láseres en este dominio 14,15,16,17,18. Varias longitudes de onda láser demuestran un impacto antibacteriano significativo y seguridad en las superficies de los implantes cuando se aplican los parámetros adecuados. Una serie de variables, como la intensidad, la frecuencia y la longitud de onda, influyen en la eficacia de los tratamientos con láser. Varios estudios han demostrado el efecto bactericida de varias longitudes de onda láser, incluyendo CO2, Er:YAG, Er,Cr:YSGG y varios láseres de diodo, lo que nos permite identificar los efectos beneficiosos de diferentes láseres en el tratamiento de la periimplantitis. Aoki et al 19,20,21. A partir de su revisión, concluyeron que la aplicación del láser facilita la limpieza de la superficie tanto en los tratamientos periimplantarios quirúrgicos como en los no quirúrgicos, incluida la terapia regenerativa, y promueve la cicatrización mediante la activación de las células del tejido circundante22.
Los láseres de diodo tienen la capacidad de ejercer un efecto bactericida en las superficies de los implantes sin afectar el patrón de la superficie del implante. Cuando se trata de tratar la periimplantitis, el láser de diodo puede ser el camino a seguir, ya que promueve la curación de los tejidos periodontales 23,24,25.
Los láseres de erbio, cromo dopado: itrio, escandio, galio, granate (Er,Cr:YSGG) presentan propiedades eficaces para la eliminación de biopelículas y la descontaminación de las superficies de los implantes11. Los láseres de erbio demostraron fuertes efectos bactericidas y propiedades de regeneración ósea sin causar daños mecánicos gracias a sus propiedades hidráulicas11,14.
Existe una escasez de datos sobre las alteraciones causadas por la irradiación láser en los implantes de titanio. Además, aún no se ha definido una metodología definitiva para la irradiación de superficies de titanio, que abarque parámetros láser como la potencia y el tiempo de aplicación. Estudios previos mostraron que la aplicación del láser Er,Cr:YSGG16 no tuvo ningún efecto sobre el cambio de temperatura, sin embargo, los estudios con láser de diodo superaron13 y no superaron16,26 el valor crítico. En la literatura se encuentran disponibles diferentes resultados del efecto del tratamiento con láser sobre el valor de Ra de la superficie de titanio18,27. La hipótesis nula del estudio es que no habrá diferencia entre los láseres Er, Cr: YSGG y los láseres de diodo en términos de cambio de temperatura y rugosidad de las superficies de titanio mediante el uso. Este estudio tuvo como objetivo determinar parámetros de operación seguros mediante el monitoreo de la rugosidad de la superficie y las variaciones de temperatura en el material de titanio utilizando láseres Er, Cr: YSGG y de diodo en varios ajustes de tiempo y potencia. La evaluación del cambio de temperatura se realizó con un termopar, la rugosidad superficial se evaluó con un perfilómetro y las alteraciones superficiales se analizaron mediante técnicas SEM y AFM.
Protocolo
NOTA: Los cilindros de titanio, fabricados con el mismo material que los implantes convencionales y diseñados para replicar la superficie del implante con tecnología SLA, tienen una altura de 10 mm y un diámetro de 5 mm. En el centro de los cilindros se encuentra una cavidad de 7 mm de profundidad y 3 mm de ancho (Fig. 2). El ancho de 3 mm se reduce a 1 mm en el punto más profundo. No es factible medir la rugosidad de la superficie de los implantes estándar con un perfilómetro. Fue posible evaluar la efectividad del láser aplicado sobre una superficie plana de 5 mm de diámetro en la parte superior del cilindro de titanio diseñado por el fabricante, utilizando el mismo material que simula la superficie del implante. Además, para medir los cambios de temperatura desde el centro del cilindro, se ha creado una ranura de 7 mm de profundidad y 3 mm de ancho desde el centro de la superficie inferior del cilindro de titanio hacia las profundidades del cilindro, donde se colocará la punta del termopar. Esta ranura permite evaluar el cambio de temperatura de la superficie tratada desde el interior del cilindro, en lugar de depender de la superficie exterior. Las imágenes tridimensionales se obtuvieron mediante el análisis de las superficies planas de cilindros de titanio especialmente producidos utilizando un microscopio de fuerza atómica (AFM). Se utilizó un diodo de 940 nm (0,8 W28, 1,3 W29, 1,8 W30) y láseres Er,Cr:YSGG (1,5 W31, 2,5 W31, 3,5 W32) de 940 nm a tres potencias diferentes según las recomendaciones de la empresa, y se formaron 12 grupos con un tiempo de aplicación de 20 s y 40 s cada uno. Después de la aplicación, se agregó un grupo de control para la evaluación de la rugosidad. Se imprimió un soporte con un soporte para los dedos a partir de una impresora tridimensional para mantener estable el cilindro de Ti durante la aplicación (Tabla de Materiales).
1. Tamaño de la muestra
- Calcule el tamaño de la muestra utilizando el análisis de potencia del programa G*Power. El número mínimo de muestras para cada grupo se determinó como n=8 muestras para el cambio de temperatura con tamaño de efecto d: 0.6906, desviación estándar 16.8, potencia: 0.80 y α: 0.05.
NOTA: En este estudio, se utilizó como sistema láser un láser Er,Cr:YSGG equipado con un láser de diodo de 940 nm con una punta de 300 μm de diámetro (punta e3) y una punta elástica RFPT5-14 de disparo de 360° (580 μm de diámetro y 14 mm de largo) (Figura 1).

Figura 1: Instrumentos y equipos utilizados. (A) Láser de diodo, (B) Láser Er, Cr:YSGG, (C) Punta E3, (D) Punta RPTF5-14. Haga clic aquí para ver una versión más grande de esta figura.
2. Determinación de los grupos de trabajo
- Tome el vatio recomendado de láseres para la aplicación en el bolsillo en la mucositis periimplantaria como la condición ideal de uso. Además, incluya un valor más bajo y un valor más alto en los grupos de estudio en relación con los vatios recomendados. Los valores utilizados aquí son 1,5 W y 3,5 W para Er,Cr:YSGG, y 0,8 W y 1,8 W para el láser de diodo.
- Determine el tiempo de aplicación como 20 s y 40 s para evaluar el efecto del tiempo de funcionamiento en el cambio de temperatura. Los grupos de estudio se muestran en la Tabla 1.
| Nombre del grupo | Tipo de láser | Número de muestras (n) | Vatios (W) | Tiempo (s) |
| E1 | Er,Cr:YSGG | 8 | 1,5 W | 20 |
| E2 | 8 | 2,5 W | 20 | |
| E3 | 8 | 3,5 W | 20 | |
| E4 | 8 | 1,5 W | 40 | |
| E5 | 8 | 2,5 W | 40 | |
| E6 | 8 | 3,5 W | 40 | |
| D1 | Diodo | 8 | 0,8 W | 20 |
| D2 | 8 | 1,3 W | 20 | |
| D3 | 8 | 1,8 W | 20 | |
| D4 | 8 | 0,8 W | 40 | |
| D5 | 8 | 1,3 W | 40 | |
| D6 | 8 | 1,8 W | 40 | |
| C | Control | 8 |
Tabla 1: Información de las Comisiones de Estudio.
3. Preparación de la configuración experimental
- Con el programa Rhinoceros (gráficos y diseño 3D), diseñe un soporte cilíndrico en 3D con una cavidad ligeramente con un diámetro de 10 mm y un grosor de 5 mm.
- Abre la aplicación. Dibuja un círculo de 10 mm de diámetro. Reduce el círculo en un 50% desde un eje para crear una elipse. Presione Extuder y eleve la elipse en la tercera dimensión.
- Vuelve a dibujar un círculo para apoyar los dedos. Eleva el segundo círculo en la tercera dimensión con la llave del extrusor. Haz que la altura sea menor que el primer círculo.
- Taladre un agujero de 10 mm en el dibujo elíptico con el comando Booleano. Para el soporte de termopar, haga una línea en forma de L con el comando Barrido 1 y cree la 3ª dimensión.
- Dibuja un cuadrado, amplíalo en la 3ª dimensión con el comando extrusor y crea la base. Después de imprimir el diseño, aplica silicona alrededor del agujero por donde vendrá el cilindro de Ti y sécalo. Esto mantendrá el cilindro en su lugar mientras se aplica el láser.
- Lleve una habitación cerrada con aire acondicionado a una temperatura de 27 °C. Fije el soporte en el que se fijarán los cilindros en el medio de una tina de plástico con cinta adhesiva de doble cara.
NOTA: Inserte el cilindro Ti, exprima el aire sobre la superficie. - Coloque el termopar del termómetro en la parte hueca del cilindro de Ti colocado en su ranura en el soporte.
- Prepare un cronómetro para llevar un registro del tiempo de aplicación. Registre los grados por el 3er observador y lleve la cuenta del tiempo con el cronómetro.
4. Procedimiento experimental
- Durante la aplicación del láser, use gafas protectoras para la seguridad del profesional. Inserte la punta RPTF5-14 para el láser Er,Cr:YSGG. Punta de inserto E3 para láser de diodo.
- Encienda el láser Er,Cr:YSGG. Selecciona el modo cerrado de Perio. Aplique láseres de 1,5 W, 2,5 W y 3,5 W durante 20 s y 40 s cada uno. Hay 96 cilindros de Ti con aplicación láser. Irradie un cilindro de Ti con un solo tipo de láser, un vatio y una vez.
- Encienda el láser de diodo. Selecciona el modo Perio Pocket. Aplique láser de 0,8 W, 1,3 W y 1,8 W durante 20 s y 40 s cada uno.
- Haga que el tercer observador inicie el temporizador cuando se inicie el láser. Avístale cuando se acabe el tiempo.
- Aplique la punta láser en un ángulo de 15° con respecto a la superficie, en contacto, zigzagueando sobre toda la superficie durante el tiempo planificado.
- Tenga en cuenta los valores de temperatura inicial y final durante la aplicación. Reste el valor de la temperatura inicial del valor de la temperatura final. Calcula el cambio de temperatura.
NOTA: Tenga en cuenta los valores de cambio de temperatura para un total de 12 grupos, 6 grupos de láser Er, Cr:YSGG y 6 grupos de láser de diodo. - Guarde las muestras en bolsas transparentes con los números de grupo escritos en ellas.
5. Imágenes bidimensionales y tridimensionales de materiales
- Realice análisis de microscopio electrónico de barrido (SEM) y microscopio de fuerza atómica (AFM) para evaluar y demostrar cambios en la morfología de la superficie del cilindro de Ti.
NOTA: Se utilizó el instrumento FEI Quanta FEG 250. - No recubra las muestras antes de colocarlas en el SEM. Hay 13 grupos, incluido 1 grupo de control, 6 grupos de láser de diodo y 6 grupos de láser Er, Cr: YSGG. Para el grupo de control, no realice ningún tratamiento, solo tome imágenes de superficie por AFM y SEM.
- Seleccione al azar un cilindro de cada uno de los 13 grupos de estudio. Insértelos en el dispositivo SEM. Anote la ubicación en la plataforma y el código de muestra para evitar mezclar muestras.
- Coloque el cilindro de Ti en el dispositivo SEM con la superficie plana hacia arriba. Realice análisis utilizando el modo de bajo vacío. Ajuste la presión de la cámara a 60 Pa durante el análisis.
- Una vez que el dispositivo esté completamente listo, grabe imágenes con un aumento de 250x, 1000x y 5000x desde un punto aleatorio en la superficie plana. Repita este procedimiento para todas las muestras.
NOTA: Cuando el dispositivo SEM termina de aspirar, está listo para la recolección de imágenes. - Para la medición de AFM, seleccione al azar un cilindro de Ti de cada grupo de estudio. Realice la medición en el modo de roscado.
- Coloque el cilindro Ti en el instrumento AFM. Coloque la cubierta superior de modo que la punta del instrumento quede sobre la muestra. Compruebe que la luz roja de la ventana del instrumento esté en la superficie que se va a fotografiar.
- Ajuste el voltaje a 2. Acerque la punta a la muestra con el botón Auto land. Inicie el escaneo presionando el botón Iniciar escaneo .
- Tome una imagen digital de 5 μm x 5 μm para cada muestra y grábela a una velocidad de escaneo lenta (1 Hz). Grabe imágenes tomadas con el instrumento AFM desde las superficies planas de los cilindros de Ti. El instrumento AFM visualiza un área de 25 μm2 .
6. Medición de la rugosidad de la superficie
NOTA: Aquí se utilizó el dispositivo Surftest SJ 201, Mitutoyo, Tokio, Japón.
- Ajuste la resolución del perfilómetro a 0,01 mm, la longitud transversal a 3,0 mm y el diámetro de la punta del pin de registro de diamante a 5 μm. Ajuste la velocidad de medición a 0,5 mm/s para determinar el valor Ra.
- Fije el cilindro de Ti con un soporte, use el presel y fije el cilindro de Ti sosteniéndolo de la superficie lateral. Coloque la aguja del perfilómetro en contacto con la superficie de Ti.
- Presione el botón Inicio. Guarde el valor de Ra encontrado. Repita la medición 5 veces en diferentes direcciones en la superficie plana de cada cilindro (Figura 2). Para lograr las distintas direcciones, mueva el cilindro Ti alrededor de sí mismo con la ayuda de una preventa. Repita para toda la longitud del cilindro Ti.
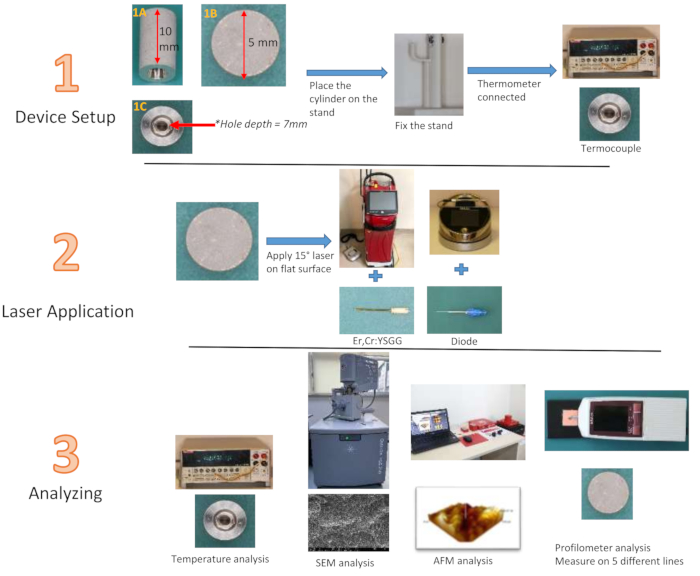
Figura 2: Diagrama de flujo de los grupos de estudio. (1A) Vista lateral del cilindro Ti, (1B) vista superior, (1C) vista inferior Haga clic aquí para ver una versión más grande de esta figura.
7. Análisis estadístico
- Realizar análisis estadísticos utilizando el programa SPSS-Windows statistical package y aplicar las pruebas de Kruskal-Wallis y Mann-Whitney. Establezca el nivel de confianza estadística en 95% (α = 0,05).
Resultados
Al evaluar con base en los tiempos de aplicación de 20 segundos y 40 segundos, se observó una diferencia estadísticamente significativa. Se observó que el cambio de temperatura en las superficies de los cilindros de Ti aplicados con láser 40 s fue mayor que en el láser aplicado con láser 20 s (p=0,037; Figura 3).
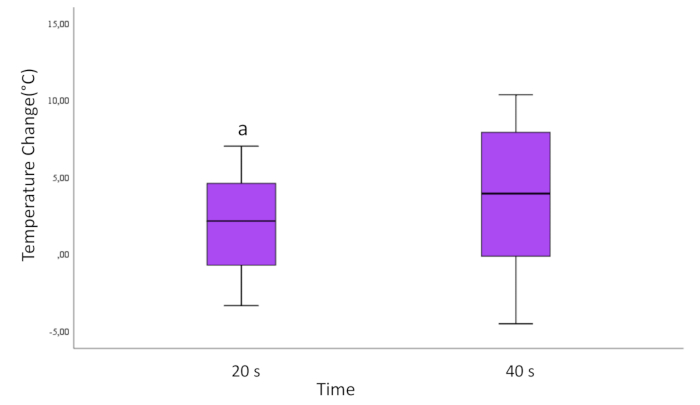
Figura 3: Cambio de temperatura según el tiempo para todas las muestras. Las líneas que suben y bajan desde el cuadro muestran los valores mínimo y máximo de los datos. La línea horizontal dentro del cuadro representa la mediana de los datos. Las marcas redondas son valores atípicos.
a=Diferencia estadísticamente significativa en comparación con el grupo de 40 s. (p<0,05)
Haga clic aquí para ver una versión más grande de esta figura.
Analizamos el cambio de temperatura clasificándolos en dos grupos según los tipos de láser (Er, Cr: YSGG y diodo). Se observó que el cambio de temperatura en los cilindros de Ti que utilizan un láser de diodo es mayor que el de los cilindros que aplican el láser Er,Cr:YSGG. Los resultados son estadísticamente significativos (p=0,001; ver Figura 4). En la evaluación de los cilindros de Ti probados solo para la aplicación de láser de diodo, los resultados indicaron que la aplicación de láser de diodo de 40 s produjo resultados significativamente más altos en comparación con la aplicación de 20 s en todos los valores de vatios (p < 0,001; Figura 4). La línea roja dentro del cuadro de la figura indica el valor medio. Las barras en la parte superior e inferior indican los valores de temperatura máxima y mínima.
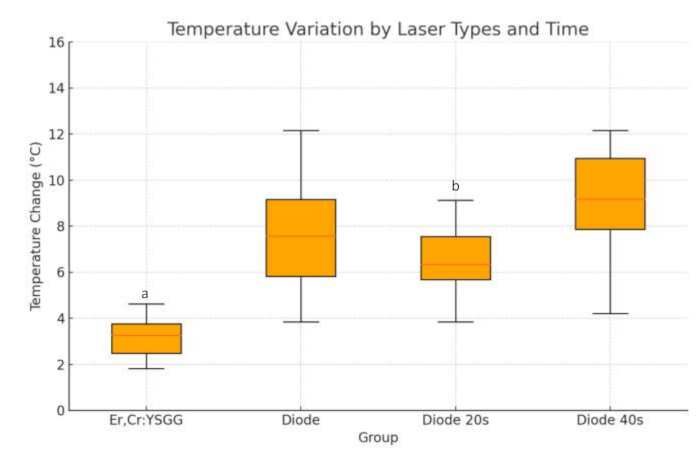
Figura 4: Variación de temperatura por tipos de láser y tiempo para todas las muestras. Las líneas que suben y bajan desde el cuadro muestran los valores mínimo y máximo de los datos. La línea horizontal dentro del cuadro representa la mediana de los datos. Las marcas redondas son valores atípicos.
a=Diferencia estadísticamente significativa en comparación con el grupo de diodos. (p<0,05)
b= Diferencia estadísticamente significativa en comparación con el láser de diodo 40 s. (p<0,05)
Haga clic aquí para ver una versión más grande de esta figura.
La última evaluación estadística del cambio de temperatura se realizó sobre la base del valor de vatios. Se observaron diferencias significativas al investigar solo los parámetros Watt (p < 0.001) y Watt-time (p < 0.001) en los grupos que utilizaron el láser Er,Cr:YSGG. En la aplicación del láser Er,Cr:YSGG, se observó que el tiempo por sí solo no impactó significativamente el cambio de temperatura (p = 0.959). Al evaluar el cambio de temperatura en todos los cilindros de Ti expuestos al láser de diodo, teniendo en cuenta las variables Vatio, tiempo y Vatio-tiempo, se observó una diferencia estadísticamente significativa (p < 0,05). El rango de temperatura de los grupos de láser de diodo con 1,8 vatios aplicados a las superficies de los cilindros de Ti fue notablemente mayor que el de los grupos de láser de diodo con 0,8 vatios aplicados (p = 0,006; Figura 5).

Figura 5: Análisis combinado de temperatura. El análisis se realizó para los tipos de láser Er, Cr:YSGG y de diodo por vatio y tiempo. Haga clic aquí para ver una versión más grande de esta figura.
Análisis de imágenes
En las imágenes SEM, se observó una estructura porosa del tamaño de una micra en todos los grupos, que es la apariencia esperada de superficies de implante arenadas y rugosas con ácido. Con un aumento de 5000x, las superficies de titanio tratadas con láser mostraron un agrandamiento visible de los poros del tamaño de micras en comparación con el grupo de control (círculos rojos). Con aumentos de 250x y 1000x, las superficies de titanio tratadas con láseres de diodo Er, Cr:YSGG y diodo durante 40 s mostraron más fusión que las tratadas durante 20 s (Figura 6). En las imágenes de AFM, la distribución de las hendiduras de la superficie en el grupo de control fue más homogénea que en los grupos tratados con láser (Figura 7, Figura 8). Dado que las imágenes AFM solo visualizaron un área muy pequeña de 25μm2 de la superficie plana del cilindro de titanio, no pudimos obtener un resultado detallado sobre toda la superficie.

Figura 6: Imágenes SEM de todos los grupos de estudio. Los 6 grupos de láser de diodo están etiquetados como D1-D6, mientras que los 6 grupos de láser Er,Cr: YSGG están etiquetados como E1-E6. Las imágenes se toman con aumentos de 250x, 1000x, 5000x. Haga clic aquí para ver una versión más grande de esta figura.
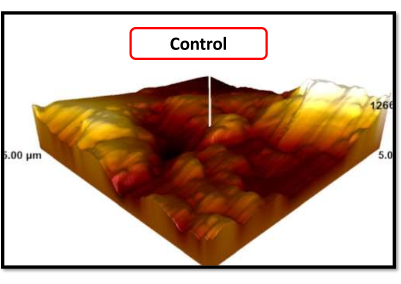
Figura 7: Imagen AFM del grupo de control. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: Imágenes AFM de todos los grupos de estudio. Los 6 grupos de láser de diodo están etiquetados como D1-D6, mientras que los 6 grupos de láser Er,Cr: YSGG están etiquetados como E1-E6. Haga clic aquí para ver una versión más grande de esta figura.
Resultados de rugosidad superficial
El parámetro rugosidad no mostró diferencia estadísticamente significativa en las variables tipo láser (p = 0,841), vatio (p = 0,900), tiempo (p = 0,399) y en la evaluación de las variables tipo láser, vatio y tiempo en conjunto (p = 0,924; Figura 9).
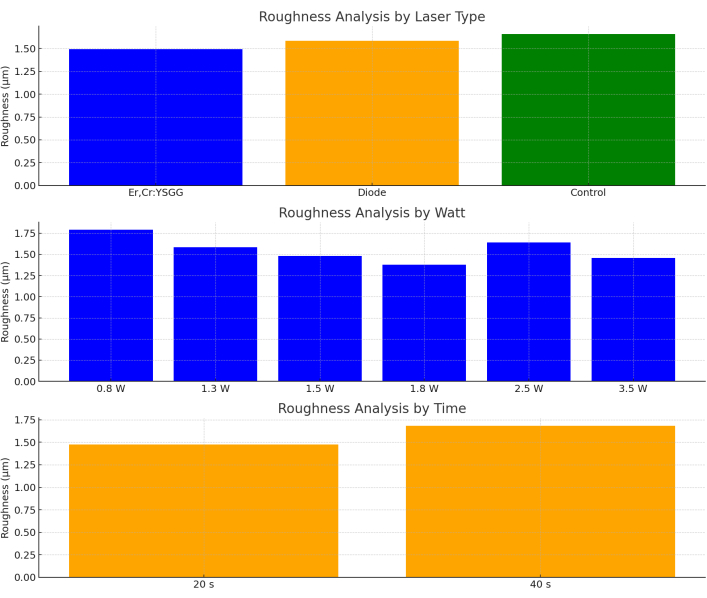
Figura 9: Análisis de rugosidad por tipo de láser, vatio y tiempo. Haga clic aquí para ver una versión más grande de esta figura.
Teniendo en cuenta estos resultados, podemos concluir que los láseres Er,Cr:YSGG y de diodo son seguros para descontaminar la superficie de titanio en la enfermedad periimplantaria. La variación de temperatura fue inferior a 10 °C, lo que indica que los parámetros estaban dentro del rango seguro. Al mismo tiempo, el valor del perfilómetro no cambió significativamente, lo que indica que no hay desventajas en términos de rugosidad de la superficie. Se detectaron cambios faciales en el análisis de imágenes, pero esto no pudo ser respaldado por el análisis de rugosidad. Los resultados del estudio respaldan que los parámetros láser utilizados están dentro del rango seguro.
a=Diferencia estadísticamente significativa en comparación con el grupo de diodos. (p<0,05)
b= Diferencia estadísticamente significativa en comparación con el láser de diodo 40 s. (p<0,05)
Discusión
Se está llevando a cabo un importante debate sobre el método óptimo para descontaminar las superficies de los implantes en el tratamiento de la periimplantitis. En publicaciones anteriores se ha propuesto la utilización de medicamentos locales o sistémicos, la aplicación de láser, la limpieza mecánica y/o química y la implantoplastia. Los resultados de nuestro estudio revelaron que todas las temperaturas medidas aumentan por debajo del umbral crítico de seguridad de 10 °C13. Sin embargo, teniendo en cuenta que se trata de un estudio in vitro y no siempre puede replicar las condiciones clínicas, se observó que el uso del láser Er,Cr:YSGG y el láser de diodo provocó cambios en la fusión y microporos en la topografía del implante, mientras que la rugosidad de la superficie no cambió.
El uso de láseres Ho:YAG y Nd:YAG33 para la descontaminación se informó como inapropiado debido a los efectos en la superficie; sin embargo, se encontró que los láseres Er,Cr:YSGG34 y los láseres de diodo18 eran efectivos para este propósito. El láser de diodo mejora la cicatrización en los tejidos circundantes a través de la expresión de HBD-2 estimulada por la señalización de TGF-β1. El estudio reveló una reducción de la rugosidad superficial y de la colonización por P. gingivalis, junto con un aumento de la viabilidad de los fibroblastos y de la diferenciación de los osteoblastos, tras la aplicación del láser Er,Cr:YSGG en un movimiento en zigzag sobre la superficie de titanio35. Los resultados de este estudio mostraron que el láser Er,Cr:YSGG no causó ningún daño térmico a las superficies de titanio con ajustes de energía de hasta 3,5 W hasta 40 s. Este hallazgo se correlaciona con una revisión de la literatura publicada por Smeo et al.36, que determinó que los láseres de erbio pueden ejercer un impacto antibacteriano sin exceder el umbral de temperatura crítica cuando se utilizan con los parámetros láser correctos.
Los parámetros del láser de diodo de 940 nm en esta investigación fueron 0,8 W, 1,3 W y 1,8 W, que incluyeron diferentes tiempos de potencia de salida e irradiación de 20 s y 40 s13. En dos estudios diferentes que evaluaron el uso de láseres de diodo en superficies de titanio, se utilizaron 20 s37 y 40 s38 como tiempo de aplicación. Del mismo modo, se utilizaron láseres Er,Cr:YSGG aplicados sobre titanio y superficies dentales con tiempos de aplicación de 20 s39 y 40 s40. En un estudio, un láser de diodo superó la temperatura crítica en 18 segundos13. En aplicaciones de láser de diodo, se ha recomendado evitar la exposición prolongada a la superficie de la raíz para evitar el daño térmico a la pulpa (umbral crítico 5,6 °C)28,41. Un estudio que evaluó el efecto del uso de varios láseres en el cambio de temperatura de las superficies de titanio informó que los láseres de diodo y Er:YAG, CO2, Nd:YAG y no excedieron el cambio de temperatura crítico de 10 °C en un tanque de agua42. De manera similar, en este estudio, los grupos de láseres de diodo de 940 nm generaron un aumento de temperatura significativamente más rápido; sin embargo, los valores finales de temperatura estuvieron por debajo del umbral crítico. En la aplicación de un láser de diodo de 940 nm, el aumento de temperatura se puede disminuir seleccionando una potencia de salida reducida y minimizando el tiempo de irradiación. Estos resultados indican una relación positiva entre el aumento de la densidad de potencia/energía 13,43,44 y la temperatura elevada en ausencia de enfriamiento por agua, enfatizando la importancia del enfriamiento por agua durante la irradiación como el láser Er,Cr:YSGG 16,45.
La perfilometría mecánica y 3D-óptica (con y sin contacto) son los métodos in vitro más populares para la medición cuantitativa de la nanotopografía del material dental y la rugosidad de la superficie del implante, mientras que las imágenes SEM son el estándar de oro para la evaluación cualitativa31. La medición de la rugosidad con un perfilómetro de contacto puede dañar la superficie y dar lugar a mediciones inexactas46. Si bien las imágenes SEM no pudieron facilitar el análisis cuantitativo y cualitativo de las muestras, las imágenes AFM pudieron proporcionar información cuantitativa en términos de rugosidad de la superficie y profundidad3D 47. Se observaron alteraciones morfológicas en las superficies de los implantes después del tratamiento con láser, caracterizadas por un aumento en el diámetro de los microporos, una morfología fundida y una mayor prevalencia de microporos con hoyuelos en comparación con el grupo control. En estas condiciones experimentales, la superficie del cilindro de Ti durante el análisis SEM reveló alteraciones superficiales. Además, estas alteraciones se vieron afectadas por el tipo de láser, la potencia utilizada y el tiempo dedicado a la irradiación láser. Los autores estuvieron de acuerdo con la conclusión de que los niveles de daño superficial y tiempo en los láseres diodo18 y Er,Cr:YSGG 21,48 se correlacionan con el aumento de la potencia. La investigación adicional debe examinar si estas modificaciones tienen implicaciones terapéuticas.
La rugosidad de la superficie de los implantes dentales, también conocida como microtopografía, es un factor crucial que influye en la osteointegración. En un estudio reciente, las superficies de titanio se trataron con cuatro protocolos diferentes. Las células madre mesenquimales y de superficie de titanio se conservaron en la superficie tratada con láser y los resultados de adhesión de las células madre fueron mejores que los de otras técnicas (cepillo de Ti-Ni, flujo de aire y fresa dental)49. Todos los valores de Ra del cilindro de Ti examinado se redujeron durante la irradiación láser; sin embargo, no se observaron diferencias estadísticamente significativas antes y después de la irradiación. La irradiación láser de diodo redujo la rugosidad de la superficie al fundir la superficie de Ti cuando se utilizaron niveles de potencia más altos. Estos hallazgos son consistentes con un estudio previo de Stübinger et al.50, en el que se utilizó un láser de diodo de 810 nm para descontaminar la superficie del implante y no mostró ningún efecto significativo sobre la superficie, siendo contradictorio con los resultados del estudio realizado por Kim et al.51 y Rezeka et al.17, utilizando una longitud de onda de 940 nm cuando se trató con potencias de 2 y 3 W y se observó un aumento de la rugosidad superficial con la aplicación del láser.
Este estudio está limitado por la falta de pruebas celulares y microbiológicas. El presente estudio tiene como objetivo evaluar los cambios topográficos en el cilindro de Ti después de la irradiación del diodo y del láser Er,Cr:YSGG; Sin embargo, las implicaciones biológicas de los diversos tratamientos requieren más investigación in vitro e in vivo . Otra limitación es que el análisis estadístico de la rugosidad de la superficie realizado en este estudio involucra solo datos de perfilómetro. El enfoque AFM demostró ser eficaz para evaluar la eficacia de dos tipos de láser utilizados con frecuencia en odontología.
Conclusiones
En nuestra investigación, ninguno de los aumentos de temperatura superó el umbral fisiológico de 10 °C. En consecuencia, las diferencias de temperatura estadísticamente significativas se consideraron clínicamente irrelevantes. El tipo y la potencia del láser no afectaron significativamente a la AR; por lo tanto, la irradiación de un láser de diodo de 0,8, 1,3 y 1,8 W y un láser Er,Cr:YSGG con 1,5 W, 2,5 W y 3,5 W durante 20 s y 40 s puede limpiar la superficie de Ti sin dañarla. Sin embargo, estos hallazgos se llevaron a cabo in vitro y se necesitarán ensayos clínicos para verificar los resultados de este estudio. El presente estudio investigó varias técnicas que simulan un escenario clínico de desbridamiento de implantes.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Los cilindros de titanio utilizados en el estudio fueron producidos por Naxis Implant.
Materiales
| Name | Company | Catalog Number | Comments |
| Atomic Force Microscopy | ezAFM | Compact AFM Model | |
| Diode | Biolase | Epic 10, 940 nm Wavelength | |
| E3 Tip | Fiber Diameter: 300 µm, Fiber Length: 9 mm | ||
| Er,Cr:YSGG Laser | Iplus | 2780 nm Wavelength | |
| Profilometer | Mitutoyo | Surftest SJ-201 Model | |
| RFPT-14 Tip | Outer Tip Diameter: 580 µm, Tip Length: 14 mm | ||
| Scanning Electron Microscope | FEI | Quanta FEG 250 Model | |
| Stand | Custom Design | Rhinoceros application, Flamix PLA filament, Bambulab X1C Device | |
| Thermometer | Keithley | 2000 Series Model, K tip termokulp | |
| Titanium Cylinder | Naxis | 10 mm height, 5 mm diameter, SLA Surface, Titanium |
Referencias
- Guillaume, B. Dental implants: A review. Morphologie. 100 (331), 189-198 (2016).
- Henry, P. J. Tooth loss and implant replacement. Aust Dent J. 45 (3), 150-172 (2000).
- Berglundh, T., Armitage, G., Araujo, M. G., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol. 89 (1), S313-S318 (2018).
- Herrera, D., Berglundh, T., Schwarz, F., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Guarnieri, R., Reda, R., Di Nardo, D., Pagnoni, F., Zanza, A., Testarelli, L. Prevalence of Peri-Implant Mucositis, Peri-Implantitis and Associated Risk Indicators of Implants with and without Laser-Microgrooved Collar Surface: A Long-Term (≥20 Years) Retrospective Study. J Pers Med. 14 (4), (2024).
- Figuero, E., Graziani, F., Sanz, I., Herrera, D., Sanz, M. Management of peri‐implant mucositis and peri‐implantitis. Periodontology 2000. 66 (1), 255-273 (2014).
- Tomasi, C., Wennström, J. L. Full-mouth treatment vs. the conventional staged approach for periodontal infection control. Periodontology 2000. 51 (1), 45-62 (2009).
- Baima, G., Citterio, F., Romandini, M., et al. Surface decontamination protocols for surgical treatment of peri‐implantitis: A systematic review with meta‐analysis. Clin Oral Implants Res. 33 (11), 1069-1086 (2022).
- Subramani, K., Wismeijer, D. Decontamination of titanium implant surface and re-osseointegration to treat peri-implantitis: a literature review. Int J Oral Maxillofac Implants. , Accessed August 4, 2024 (2012).
- Świder, K., Dominiak, M., Grzech-Leśniak, K., Matys, J. Effect of different laser wavelengths on periodontopathogens in peri-implantitis: A review of in vivo studies. Microorganisms. 7 (7), 189(2019).
- Mizutani, K., Aoki, A., Coluzzi, D., Yukna, R., Wang, C. Y., Pavlic, V., Izumi, Y. Lasers in minimally invasive periodontal and peri‐implant therapy. Periodontology 2000. 71 (1), 185-212 (2016).
- Eriksson, R. A., Albrektsson, T. The effect of heat on bone regeneration: An experimental study in the rabbit using the bone growth chamber. J Oral Maxillofac Surg. 42 (11), 705-711 (1984).
- Geminiani, A., Caton, J. G., Romanos, G. E. Temperature change during non-contact diode laser irradiation of implant surfaces. Lasers Med Sci. 27 (2), 339-342 (2012).
- Alpaslan Yayli, N. Z., Talmac, A. C., Keskin Tunc, S., Akbal, D., Altindal, D., Ertugrul, A. S. Erbium, chromium-doped: yttrium, scandium, gallium, garnet and diode lasers in the treatment of peri‐implantitis: Clinical and biochemical outcomes in a randomized-controlled clinical trial. Lasers Med Sci. 37 (1), 665-674 (2022).
- Peters, N., Tawse-Smith, A., Leichter, J., Tompkins, G. Laser therapy: The future of peri-implantitis management. J Periodontol. 22 (1), 1(2012).
- Alhaidary, D., Franzen, R., Hilgers, R. D., Gutknecht, N. First investigation of dual-wavelength lasers (2780 nm Er,Cr:YSGG and 940 nm diode) on implants in a simulating peri-implantitis situation regarding temperature changes in an in vitro pocket model. Photobiomodul Photomed Laser Surg. 37 (8), 508-514 (2019).
- Rezeka, M. A., Metwally, N. A., Abd El Rehim, S. S., Khamis, M. M. Evaluation of the effect of diode laser application on the hydrophilicity, surface topography, and chemical composition of titanium dental implant surface. J Prosthodont. 2024, 1-8 (2025).
- Khalil, M. I., Sakr, H. Implant surface topography following different laser treatments: An in vitro study. Cureus. 15 (5), e38731(2023).
- Tosun, E., Tasar, F., Strauss, R., Kivanc, D. G., Ungor, C. Comparative evaluation of antimicrobial effects of Er:YAG, diode, and CO2 on titanium discs: An experimental study. J Oral Maxillofac Surg. 70 (5), 1064-1069 (2012).
- Stübinger, S., Homann, F., Etter, C., Miskiewicz, M., Wieland, M., Sader, R. Effect of Er:YAG, CO and diode laser irradiation on surface properties of zirconia endosseous dental implants. Lasers Surg Med. 40 (3), 223-228 (2008).
- Park, J., Heo, S., Koak, J., Kim, S. K., Han, C. H., Lee, J. H. Effects of laser irradiation on machined and anodized titanium disks. Int J Oral Maxillofac Implants. 27 (6), Accessed September 22, 2024 1215-1221 (2012).
- Aoki, A., Mizutani, K., Schwarz, F., et al. Periodontal and peri-implant wound healing following laser therapy. Periodontol 2000. 68 (1), 217-269 (2015).
- Roncati, M., Lucchese, A., Carinci, F. Non-surgical treatment of peri-implantitis with the adjunctive use of an 810-nm diode laser. J Indian Soc Periodontol. 17 (6), 812-817 (2013).
- Romanos, G. E., Gutknecht, N., Dieter, S., Schwarz, F., Crespi, R., Sculean, A. Laser wavelengths and oral implantology. Lasers Med Sci. 24 (6), 961-970 (2009).
- Hauser-Gerspach, I., Stübinger, S., Meyer, J. Bactericidal effects of different laser systems on bacteria adhered to dental implant surfaces: An in vitro study comparing zirconia with titanium. Clin Oral Implants Res. 21 (3), 277-283 (2010).
- Hafeez, M., Calce, L., Hong, H., Hou, W., Romanos, G. E. Thermal effects of diode laser-irradiation on titanium implants in different room temperatures in vitro. Photobiomodul Photomed Laser Surg. 40 (8), 554-558 (2022).
- Koopaie, M., Kia Darbandsari, A., Hakimiha, N., Kolahdooz, S. Er,Cr:YSGG laser surface treatment of gamma titanium aluminide: Scanning electron microscopy-energy-dispersive X-ray spectrometer analysis, wettability and Eikenella corrodens and Aggregatibacter actinomycetemcomitans bacteria count - in vitro study. Proc Inst Mech Eng H. 234 (8), 769-783 (2020).
- Kayar, N. A., Hatipoǧlu, M. Could we set a convenient irradiation time to reduce the possibility of thermal pulp damage during diode laser as an adjunct to periodontal treatment? An in vitro analysis. Photobiomodul Photomed Laser Surg. 39 (7), 480-485 (2021).
- Barrak, H., Mahdi, S. S., Alkurtas, S. A., Size, P. Clinical applications of a 940 nm diode laser for laser troughing versus conventional method: A preliminary study. Iraqi J Laser. 23 (2), (2024).
- Beer, F., Körpert, W., Passow, H., et al. Reduction of collateral thermal impact of diode laser irradiation on soft tissue due to modified application parameters. Lasers Med Sci. 27 (5), 917-921 (2012).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an erbium, chromium-doped yttrium, scandium, gallium, and garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Al-Omari, W. M., Palamara, J. E. The effect of Nd:YAG and Er,Cr:YSGG lasers on the microhardness of human dentin. Lasers Med Sci. 28 (1), 151-156 (2013).
- Kreisler, M., Götz, H., Duschner, H., d’Hoedt, B. Effect of Nd:YAG, Ho:YAG, Er:YAG, CO2, and GaAlAs laser irradiation on surface properties of endosseous dental implants. Int J Oral Maxillofac Implants. 17 (5), 202-209 (2002).
- Kottmann, L., Franzen, R., Conrads, G., Wolfart, S., Marotti, J. Effect of Er,Cr:YSGG laser with a side-firing tip on decontamination of titanium disc surface: An in vitro and in vivo study. Int J Implant Dent. 9 (1), 7(2023).
- Yao, W. L., Lin, J. C. Y., Salamanca, E., et al. Er,Cr:YSGG laser performance improves biological response on titanium surfaces. Materials. 13 (3), 756(2020).
- Smeo, K., Nasher, R., Gutknecht, N. Antibacterial effect of Er,Cr:YSGG laser in the treatment of peri-implantitis and their effect on implant surfaces: A literature review. Lasers Dent Sci. 2 (2), 63-71 (2018).
- Fletcher, P., Linden, E., Cobb, C., Zhao, D., Rubin, J., Planzos, P. Efficacy of removal of residual dental cement by laser, ultrasonic scalers, and titanium curette: An in vitro study. Compend Contin Educ Dent. , (2025).
- Lollobrigida, M., Fortunato, L., Serafini, G., et al. The prevention of implant surface alterations in the treatment of peri-implantitis: Comparison of three different mechanical and physical treatments. Int J Environ Res Public Health. 17 (8), 2624(2020).
- Arora, S., Lamba, A. K., Faraz, F., Tandon, S., Ahad, A. Evaluation of the effects of Er,Cr:YSGG laser, ultrasonic scaler and curette on root surface profile using surface analyser and scanning electron microscope: An in vitro study. J Lasers Med Sci. 7 (4), 243-249 (2016).
- Jin, S. H., Lee, E. M., Park, J. B., Kim, K. K., Ko, Y. Decontamination methods to restore the biocompatibility of contaminated titanium surfaces. J Periodontal Implant Sci. 49 (3), 193-204 (2019).
- Kayar, N. A., Hatipoǧlu, M. Can we determine an appropriate timing to avoid thermal pulp hazard during gingivectomy procedure? An in vitro study with diode laser. Photobiomodul Photomed Laser Surg. 39 (2), 94-99 (2021).
- Monzavi, A., Fekrazad, R., Chinipardaz, Z., Shahabi, S., Behruzi, R., Chiniforush, N. Effect of various laser wavelengths on temperature changes during peri-implantitis treatment: An in vitro study. Implant Dent. 27 (3), 311-316 (2018).
- Valente, N. A., Calascibetta, A., Patianna, G., Mang, T., Hatton, M., Andreana, S. Thermodynamic effects of 3 different diode lasers on an implant-bone interface: An ex-vivo study with review of the literature. J Oral Implantol. 43 (2), 94-99 (2017).
- Leja, C., Geminiani, A., Caton, J., Romanos, G. E. Thermodynamic effects of laser irradiation of implants placed in bone: An in vitro study. Lasers Med Sci. 28 (6), 1435-1440 (2013).
- Strever, J. M., Lee, J., Ealick, W., et al. Erbium, chromium:yttrium-scandium-gallium-garnet laser effectively ablates single-species biofilms on titanium disks without detectable surface damage. J Periodontol. 88 (5), 484-492 (2017).
- Bourauel, C., Fries, T., Drescher, D., Plietsch, R. Surface roughness of orthodontic wires via atomic force microscope, laser specular reflectance, and profilometry. Eur J Orthod. 20 (1), Accessed February 13, 2025 79-92 (1998).
- Choi, S., Kim, J. H., Kim, N. J., et al. Morphological investigation of various orthodontic lingual bracket slots using scanning electron microscopy and atomic force microscopy. Microsc Res Tech. 79 (12), 1193-1199 (2016).
- Huang, H. H., Chuang, Y. C., Chen, Z. H., Lee, T. L., Chen, C. C. Improving the initial biocompatibility of a titanium surface using an Er,Cr:YSGG laser-powered hydrokinetic system. Dent Mater. 23 (4), 410-414 (2007).
- Furtsev, T. V., Koshmanova, A. A., Zeer, G. M., et al. Laser cleaning improves stem cell adhesion on the dental implant surface during peri-implantitis treatment. Dent J. 11 (2), 30(2023).
- Stübinger, S., Homann, F., Etter, C., Miskiewicz, M., Wieland, M., Sader, R. Effect of Er:YAG, CO and diode laser irradiation on surface properties of zirconia endosseous dental implants. Lasers Surg Med. 40 (3), 223-228 (2008).
- Kim, H. K., Park, S. Y., Son, K., et al. Alterations in surface roughness and chemical characteristics of sandblasted and acid-etched titanium implants after irradiation with different diode lasers. Appl Sci. 10 (12), 4167(2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados