Method Article
In vitro Bewertung der Auswirkungen von Er-, Cr:YSGG- und Diodenlasern, die auf Titanzylinder verwendet werden
In diesem Artikel
Zusammenfassung
In dieser Studie wurden Er-, Cr:YSGG- und Diodenlaser separat auf die flache Oberfläche von insgesamt 96 speziell konstruierten Titanzylindern aufgebracht. Ein Thermoelement wurde auf die andere Oberfläche gelegt und die Temperatur gemessen. Analyse der Oberflächenrauheit mit Profilometer, REM und AFM.
Zusammenfassung
Periimplantäre Erkrankungen sind wichtige Probleme im Zusammenhang mit Zahnimplantaten. Das Ziel dieser Studie war es, die Oberflächenrauheit und Temperaturänderungen zu bewerten, wenn Dioden- und Erbium-, Chrom-dotierte Yttrium-Scandium-Gallium-Garnet (Er,Cr:YSGG) Laser auf Titanzylindern bei der Behandlung von nicht-chirurgischen periimplantären Erkrankungen eingesetzt werden. Insgesamt wurden 13 Gruppen, einschließlich der Kontrollgruppe, mit 940 nm Dioden- (0,8 W-1,3 W-1,8 W) und Er,Cr:YSGG (1,5 W-2,5 W-3,5 W) Lasern in 6 verschiedenen Leistungsmodi, 20s/W und 40 s/W, gebildet, und in jeder Gruppe wurden acht Titanzylinder behandelt. Während des Prozesses wurden die Anfangs- und Endtemperaturen mit einem Thermoelement aufgezeichnet, das in den apikalen Schlitz des Zylinders eingesetzt wurde. Nach der Anwendung wurde die Rauheit (Ra) aller Scheiben mit einem Profilometer gemessen. Die Oberflächen wurden mit dem Rasterelektronenmikroskop (REM) und dem Rasterkraftmikroskop (AFM) abgetastet, um die Oberfläche zwei- und dreidimensional zu untersuchen. Bei der Auswertung der Temperaturänderungen der Titanzylinder während der Bestrahlung waren die Zylinder, die 40 s lang mit einem Diodenlaser bestrahlt wurden, signifikant höher als die 20 s langen. In den mit Er,Cr:YSGG behandelten Zylindern sank die Temperatur in einigen Proben und stieg in einigen Proben minimal an. Die Profilometerwerte (Ra) waren in Bezug auf die Rauheit nicht für alle Gruppen statistisch signifikant. REM-Aufnahmen zeigten jedoch ein Schmelzen und eine Zunahme der Anzahl der Mikroporen auf den behandelten Oberflächen. Mit den Einschränkungen dieser In-vitro-Studie kann die Anwendung von Er, Cr:YSGG und der Diode als sicherer Ansatz für die Behandlung von Periimplantitis angesehen werden, insbesondere im Hinblick auf die thermische Sicherheit. Während die Oberflächenrauheit unverändert bleibt, führte der Einsatz dieser Laser zu Schmelzveränderungen und Mikroporen auf der Topographie des Ti-Zylinders. Um zu bestimmen, wie sich diese Lasereinstellungen auf die bakterielle Abnahme und Osseointegration auswirken, sind weitere Untersuchungen erforderlich.
Einleitung
Zahnimplantate sind eine allgemein akzeptierte Behandlungsoption für den Ersatz verlorener Zähne 1,2. Die periimplantäre Mukositis und die Periimplantitis werden als periimplantäre Erkrankungen klassifiziert. Die periimplantäre Mukositis ist auf Weichteile beschränkt, und es gibt keine Hinweise auf Knochenverlust, mit Ausnahme des physiologischen Knochenumbaus. Periimplantitis ist eine pathologische Erkrankung, die mit Plaque verbunden ist und das Gewebe um Zahnimplantate herum betrifft. Sie zeichnet sich durch eine Entzündung der periimplantären Schleimhaut und den daraus resultierenden zunehmenden Verlust von Stützknochenaus 3. Der primäre ätiologische Faktor für die Entstehung und das Fortschreiten der Erkrankung ist die Störung des periimplantären Plaque-Biofilms4. Zahlreiche Studien zu periimplantären Erkrankungen deuten darauf hin, dass die Prävalenz der periimplantären Mukositis (PIM) zwischen 9,7 % und 64,6 % liegt, während die Prävalenz der Periimplantitis (P) zwischen 4,7 % und 45 % schwankt5.
Während die Ansammlung von Plaque der wichtigste ätiologische Faktor ist, der eine Periimplantitis verursacht, wird ihre Behandlung durch die unterschiedlichen topographischen Eigenschaften der Implantate erschwert. Die Grundlage der nicht-chirurgischen Behandlung der Periimplantitis ist das Infektionsmanagement durch das Debridement der Implantatoberfläche und die Beseitigung des anhaftenden Biofilms, um die bakterielle Belastung unter die krankheitsverursachende Schwelle zu senken 6,7. Die komplexe Mikro- und Makrotopographie von Titangrenzflächen und die Anatomie von Knochendefekten schränken die Dekontamination von Oberflächen ein. Die Wirksamkeit verschiedener mechanischer (Küretten, Ultraschallgeräte, Luftpulverabrieb, Titanbürsten), chemischer (Zitronensäure, Chlorhexidin, antimikrobielle Mittel) und physikalischer (Laser, photodynamische Therapie) Dekontaminationstechniken wurde in Kombinationbewertet 8. Aktuelle Forschungsergebnisse deuten darauf hin, dass der kombinierte Einsatz von nicht-chirurgischen Interventionstechniken bei Periimplantitis wirksamer ist als das Debridement allein9. Die Einbeziehung chemischer antimikrobieller Wirkstoffe oder lokaler/systemischer Antibiotika in die mechanische Therapie hat sich als signifikant wirksam erwiesen. Dennoch könnten diese Eingriffe zu möglichen nachteiligen Folgen führen10. Mit der Weiterentwicklung der Lasertechnologie werden Dentallaser aufgrund ihrer antiinfektiösen, entgiftenden und benutzerfreundlichen Wirkung auf Implantatoberflächen immer beliebter 10,11.
Die Absorptionsspitze, die Betriebsart des Geräts und die Gewebeeigenschaften beeinflussen den Wärmeanstieg während der Laserbestrahlung. Eine entscheidende präklinische Untersuchung ergab, dass eine Erhöhung der Temperatur auf 50 °C für 1 Minute eine Gefäßschädigung verursachte, während ein Anstieg auf 60 °C zur Einstellung des Blutflusses und einer anschließenden Knochennekrose führte12. Eine In-vitro-Untersuchung ergab, dass die Implantatoberflächen bereits nach 10 s Diodenlaserbestrahlung Temperaturen erreichen können, die über der Knochensicherheitsschwelle (10 °C) liegen. Die Lebensfähigkeit der Knochen könnte durch einen Temperaturanstieg von nur 10 °C beeinträchtigt werden13.
Zahlreiche neuere Studien haben sich auf die Untersuchung der positiven Auswirkungen von Lasern in diesem Bereich konzentriert 14,15,16,17,18. Verschiedene Laserwellenlängen zeigen eine signifikante antibakterielle Wirkung und Sicherheit auf Implantatoberflächen, wenn geeignete Parameter angewendet werden. Eine Reihe von Variablen, darunter Intensität, Frequenz und Wellenlänge, beeinflussen die Wirksamkeit von Laserbehandlungen. Mehrere Studien haben die bakterizide Wirkung verschiedener Laserwellenlängen nachgewiesen, darunter CO2, Er:YAG, Er,Cr:YSGG und verschiedene Diodenlaser, was es uns ermöglicht, die vorteilhaften Wirkungen verschiedener Laser bei der Behandlung von Periimplantitis zu identifizieren. Aoki et al. 19,20,21. Aus ihrer Übersichtsarbeit kam der Schluss, dass die Laseranwendung die Oberflächenreinigung sowohl bei nicht-chirurgischen als auch bei chirurgischen periimplantären Behandlungen, einschließlich der regenerativen Therapie, erleichtert und die Heilung durch Aktivierung der umgebenden Gewebezellen fördert22.
Diodenlaser haben die Fähigkeit, eine bakterizide Wirkung auf Implantatoberflächen auszuüben, ohne das Oberflächenmuster des Implantats zu beeinflussen. Wenn es um die Behandlung von Periimplantitis geht, kann der Diodenlaser der richtige Weg sein, da er die Heilung des parodontalen Gewebes fördert 23,24,25.
Erbium, Chrom-dotiert: Yttrium-, Scandium-, Gallium-, Granat-Laser (Er,Cr:YSGG) weisen wirksame Eigenschaften bei der Beseitigung von Biofilm und der Dekontamination von Implantatoberflächenauf 11. Starke bakterizide Wirkungen und knochenregenerierende Eigenschaften wurden von Erbium-Lasern gezeigt, ohne dank ihrer wasserbetriebenen Eigenschaften mechanische Schäden zu verursachen11,14.
Es gibt einen Mangel an Daten über die Veränderungen, die durch Laserbestrahlung auf Titanimplantaten verursacht werden. Darüber hinaus muss noch eine endgültige Methodik für die Bestrahlung von Titanoberflächen definiert werden, die Laserparameter wie Leistung und Anwendungszeit umfasst. Frühere Studien zeigten, dass die Anwendung des Er,Cr:YSGG-Lasers16 keinen Einfluss auf die Temperaturänderung hatte, jedoch überstiegen Diodenlaserstudien13 und überschrittennicht 16,26 den kritischen Wert. Unterschiedliche Ergebnisse der Wirkung der Laserbehandlung auf den Ra-Wert der Titanoberfläche sind in der Literaturverfügbar 18,27. Die Nullhypothese der Studie ist, dass es keinen Unterschied zwischen Er-, Cr:YSGG-Lasern und Diodenlasern in Bezug auf die Temperatur- und Rauheitsänderung von Titanoberflächen durch die Verwendung geben wird. Diese Studie zielte darauf ab, sichere Betriebsparameter zu bestimmen, indem die Oberflächenrauheit und Temperaturschwankungen auf Titanmaterial mit Er-, Cr:YSGG- und Diodenlasern bei verschiedenen Zeit- und Leistungseinstellungen überwacht wurden. Die Bewertung der Temperaturänderung wurde mit einem Thermoelement durchgeführt, die Oberflächenrauheit wurde mit einem Profilometer beurteilt und die Oberflächenveränderungen wurden durch REM- und AFM-Techniken analysiert.
Protokoll
HINWEIS: Titanzylinder, die aus dem gleichen Material wie herkömmliche Implantate gefertigt sind und so konzipiert sind, dass sie die Implantatoberfläche mit SLA-Technologie nachbilden, haben eine Höhe von 10 mm und einen Durchmesser von 5 mm. In der Mitte der Zylinder befindet sich ein Hohlraum mit einer Tiefe von 7 mm und einer Breite von 3 mm (Abb. 2). Die Breite von 3 mm reduziert sich an der tiefsten Stelle auf 1 mm. Die Messung der Oberflächenrauheit von Standardimplantaten mit einem Profilometer ist nicht möglich. Es war möglich, die Wirksamkeit des Lasers zu beurteilen, der auf eine flache Oberfläche mit einem Durchmesser von 5 mm an der Oberseite des vom Hersteller entworfenen Titanzylinders angewendet wurde, wobei das gleiche Material verwendet wurde, das auch die Implantatoberfläche simuliert. Um Temperaturänderungen von der Mitte des Zylinders aus zu messen, wurde zusätzlich eine 7 mm tiefe und 3 mm breite Nut von der Mitte der Unterseite des Titanzylinders in Richtung der Tiefen des Zylinders geschaffen, wo die Thermoelementspitze platziert wird. Diese Nut ermöglicht die Bewertung der Temperaturänderung der behandelten Oberfläche aus dem Inneren des Zylinders, anstatt von der Außenfläche abhängig zu sein. Dreidimensionale Visualisierungen wurden durch die Analyse der flachen Oberflächen von speziell hergestellten Titanzylindern mit einem Rasterkraftmikroskop (AFM) erhalten. Eine 940-nm-Diode (0,8 W28, 1,3 W29, 1,8 W30) und 2,780 nm Er,Cr:YSGG (1,5 W31, 2,5 W31, 3,5 W32) Laser wurden gemäß den Empfehlungen des Unternehmens bei drei verschiedenen Wattagen verwendet, und es wurden 12 Gruppen mit jeweils 20 s und 40 s Anwendungszeit gebildet. Nach der Anwendung wurde eine Kontrollgruppe zur Rauheitsbewertung hinzugefügt. Ein Ständer mit einer Fingerstütze wurde von einem dreidimensionalen Drucker gedruckt, um den Ti-Zylinder während der Anwendung stabil zu halten (Table of Materials).
1.Stichprobenumfang
- Berechnen Sie die Stichprobengröße mit der Power-Analyse des G*Power-Programms. Die minimale Anzahl von Proben für jede Gruppe wurde als n=8 Proben für Temperaturänderungen mit Effektstärke d: 0,6906, Standardabweichung 16,8, Trennschärfe: 0,80 und α: 0,05 bestimmt.
HINWEIS: In dieser Studie wurde als Lasersystem ein Er,Cr:YSGG-Laser verwendet, der mit einem 940-nm-Diodenlaser mit einer Spitze mit 300 μm Durchmesser (e3-Spitze) und einer 360° feuernden elastischen RFPT5-14-Spitze (580 μm Durchmesser und 14 mm Länge) ausgestattet war (Abbildung 1).

Abbildung 1: Verwendete Instrumente und Geräte. (A) Diodenlaser, (B) Er, Cr:YSGG-Laser, (C) E3-Spitze, (D) RPTF5-14-Spitze. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
2. Festlegung von Arbeitsgruppen
- Nehmen Sie das empfohlene Watt Laser für die Anwendung in der Tasche bei periimplantärer Mukositis als ideale Einsatzbedingung. Fügen Sie außerdem einen niedrigeren und einen höheren Wert in die Studiengruppen relativ zum empfohlenen Watt ein. Die hier verwendeten Werte betragen 1,5 W und 3,5 W für Er,Cr:YSGG und 0,8 W und 1,8 W für den Diodenlaser.
- Bestimmen Sie die Anwendungszeit als 20 s und 40 s, um den Einfluss der Betriebszeit auf die Temperaturänderung zu bewerten. Die Studiengruppen sind in Tabelle 1 dargestellt.
| Name der Gruppe | Laser-Typ | Anzahl der Proben (n) | Watt (W) | Zeit(en) |
| E1 | Er,Cr:YSGG | 8 | 1,5 W | 20 |
| E2 | 8 | 2,5 W | 20 | |
| E3 | 8 | 3,5 W | 20 | |
| E4 | 8 | 1,5 W | 40 | |
| E5 | 8 | 2,5 W | 40 | |
| E6 | 8 | 3,5 W | 40 | |
| D1 | Diode | 8 | 0,8 W | 20 |
| D2 | 8 | 1,3 W | 20 | |
| D3 | 8 | 1,8 W | 20 | |
| D4 | 8 | 0,8 W | 40 | |
| D5 | 8 | 1,3 W | 40 | |
| D6 | 8 | 1,8 W | 40 | |
| C | Steuerung | 8 |
Tabelle 1: Informationen zu den Studiengruppen.
3. Vorbereitung des Versuchsaufbaus
- Entwerfen Sie mit dem Programm Rhinoceros (3D-Grafik und Design) einen Zylinderständer in 3D mit einem leichten Hohlraum mit einem Durchmesser von 10 mm und einer Dicke von 5 mm.
- Öffnen Sie die App. Zeichne einen Kreis mit einem Durchmesser von 10 mm. Reduzieren Sie den Kreis um 50 % von einer Achse, um eine Ellipse zu erstellen. Drücken Sie Extuder, und heben Sie die Ellipse in der dritten Dimension an.
- Zeichne erneut einen Kreis zur Fingerstütze. Heben Sie den zweiten Kreis in der dritten Dimension mit dem Extruderschlüssel an. Machen Sie die Höhe kleiner als der erste Kreis.
- Bohren Sie mit dem Befehl Boolean ein 10-mm-Loch in die elliptische Zeichnung. Um Thermoelemente zu unterstützen, erstellen Sie mit dem Befehl Sweep 1 eine L-förmige Linie, und erstellen Sie die 3. Dimension.
- Zeichnen Sie ein Quadrat, vergrößern Sie es in der 3. Dimension mit dem Befehl extruder und erstellen Sie die Basis. Tragen Sie nach dem Drucken des Designs Silikon um das Loch auf, in das der Ti-Zylinder kommt, und trocknen Sie es. Dadurch bleibt der Zylinder an Ort und Stelle, während der Laser angewendet wird.
- Bringen Sie einen geschlossenen Raum mit Klimaanlage auf eine Temperatur von 27 °C. Befestigen Sie den Ständer, auf dem die Zylinder befestigt werden sollen, mit doppelseitigem Klebeband in der Mitte einer Plastikwanne.
HINWEIS: Setzen Sie den Ti-Zylinder ein und drücken Sie Luft auf die Oberfläche. - Platzieren Sie das Thermoelement des Thermometers in dem hohlen Teil des Ti-Zylinders, der in seinem Schlitz auf dem Ständer platziert ist.
- Bereiten Sie einen Chronometer vor, um die Anwendungszeit im Auge zu behalten. Notieren Sie die Grade mit dem 3. Beobachter und behalten Sie die Zeit mit der Stoppuhr im Auge.
4. Experimenteller Ablauf
- Tragen Sie während der Laseranwendung zur Sicherheit des Arztes eine Schutzbrille. Setzen Sie die RPTF5-14-Spitze für den Er,Cr:YSGG-Laser ein. Einsatzspitze E3 für Diodenlaser.
- Schalten Sie den Er,Cr:YSGG-Laser ein. Wählen Sie Perio Closed Mode aus. Setzen Sie 1,5 W, 2,5 W und 3,5 W Laser für jeweils 20 s und 40 s ein. Es gibt 96 Ti-Zylinder mit aufgebrachtem Laser. Bestrahlung eines Ti-Zylinders mit nur einem Lasertyp, einem Watt und einer Zeit.
- Schalten Sie den Diodenlaser ein. Wählen Sie den Perio Pocket-Modus. Wenden Sie 0,8 W, 1,3 W und 1,8 W Laser für jeweils 20 s und 40 s an.
- Lassen Sie den 3. Beobachter den Timer starten, wenn der Laser startet. Warnen Sie ihn, wenn die Zeit abgelaufen ist.
- Bringen Sie die Laserspitze in einem Winkel von 15° auf die Oberfläche an, in Kontakt und bewegen Sie sich für die geplante Zeit im Zickzack über die gesamte Oberfläche.
- Notieren Sie die Anfangs- und Endtemperaturwerte während der Anwendung. Subtrahieren Sie den Wert der Starttemperatur vom Wert der Endtemperatur. Berechnen Sie die Temperaturänderung.
HINWEIS: Notieren Sie sich die Temperaturänderungswerte für insgesamt 12 Gruppen, 6 Er-, Cr:YSGG- und 6 Diodenlasergruppen. - Bewahren Sie die Proben in durchsichtigen Beuteln auf, auf denen Gruppennummern stehen.
5.Zwei- und dreidimensionale Abbildung von Materialien
- Durchführung von Rasterelektronenmikroskop- (REM) und Rasterkraftmikroskop-Analysen (AFM), um Veränderungen in der Morphologie der Ti-Zylinderoberfläche zu bewerten und zu demonstrieren.
HINWEIS: Es wurde das FEI Quanta FEG 250 Instrument verwendet. - Beschichten Sie die Proben nicht, bevor sie in das REM gegeben werden. Es gibt 13 Gruppen, darunter 1 Kontrollgruppe, 6 Diodenlasergruppen und 6 Er,Cr:YSGG-Lasergruppen. Führen Sie für die Kontrollgruppe keine Behandlung durch, sondern nur Oberflächenbilder mit AFM und REM.
- Wählen Sie nach dem Zufallsprinzip einen Zylinder aus jeder der 13 Studiengruppen aus. Setzen Sie sie in das SEM-Gerät ein. Notieren Sie sich die Position auf der Plattform und den Beispielcode, um eine Vermischung von Beispielen zu vermeiden.
- Platzieren Sie den Ti-Zylinder mit der ebenen Fläche nach oben in der REM-Vorrichtung. Führen Sie Analysen im Niedrigvakuummodus durch. Stellen Sie den Kammerdruck während der Analyse auf 60 Pa ein.
- Sobald das Gerät vollständig einsatzbereit ist, können Sie Bilder mit 250-facher, 1000-facher und 5000-facher Vergrößerung von einem zufälligen Punkt auf der ebenen Oberfläche aufnehmen. Wiederholen Sie diesen Vorgang für alle Proben.
HINWEIS: Wenn das SEM-Gerät mit dem Staubsaugen fertig ist, ist es bereit für die Bildaufnahme. - Für die AFM-Messung wählen Sie nach dem Zufallsprinzip einen Ti-Zylinder aus jeder Studiengruppe aus. Führen Sie die Messung im Klopfmodus durch.
- Setzen Sie den Ti-Zylinder in das AFM-Instrument ein. Platzieren Sie die obere Abdeckung so, dass sich die Spitze des Instruments über der Probe befindet. Vergewissern Sie sich, dass das rote Licht aus dem Fenster am Instrument auf die abzubildende Oberfläche gerichtet ist.
- Stellen Sie die Spannung auf 2. Bewegen Sie die Spitze mit der Auto-Land-Taste näher an die Probe. Starten Sie den Scan, indem Sie auf die Schaltfläche Scan starten klicken.
- Nehmen Sie für jede Probe ein digitales Bild von 5 μm x 5 μm auf und zeichnen Sie es mit einer langsamen Abtastrate (1 Hz) auf. Nehmen Sie Bilder auf, die mit dem AFM-Instrument von den flachen Oberflächen von Ti-Zylindern aufgenommen wurden. Das AFM-Instrument visualisiert einen Bereich von 25μm 2 .
6. Messung der Oberflächenrauheit
HINWEIS: Zum Einsatz kam hier das Gerät Surftest SJ 201, Mitutoyo, Tokyo, Japan.
- Stellen Sie die Auflösung des Profilometers auf 0,01 mm, die Querlänge auf 3,0 mm und den Durchmesser der Diamant-Aufzeichnungsstiftspitze auf 5 μm ein. Stellen Sie die Messgeschwindigkeit auf 0,5 mm/s ein, um den Ra-Wert zu bestimmen.
- Befestigen Sie den Ti-Zylinder mit einer Halterung, verwenden Sie den Presel und fixieren Sie den Ti-Zylinder, indem Sie ihn von der Seitenfläche halten. Platzieren Sie die Nadel des Profilometers in Kontakt mit der Ti-Oberfläche.
- Drücken Sie die Start-Taste. Speichern Sie den gefundenen Ra-Wert. Wiederholen Sie die Messung 5x in verschiedene Richtungen auf der ebenen Fläche jedes Zylinders (Abbildung 2). Um die verschiedenen Richtungen zu erreichen, bewegen Sie den Ti-Zylinder mit Hilfe eines Presells um sich selbst. Wiederholen Sie dies für die gesamte Länge des Ti-Zylinders.
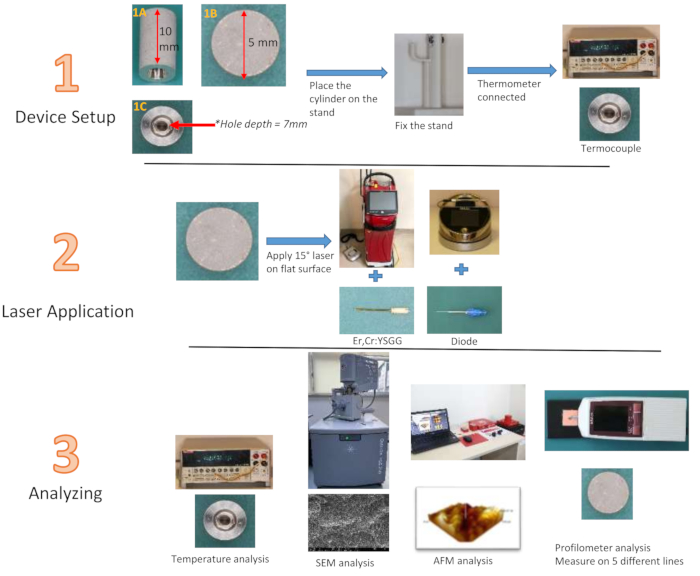
Abbildung 2: Flussdiagramm der Studiengruppen. (1A) Seitenansicht des Ti-Zylinders, (1B) Draufsicht, (1C) Unteransicht Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
7. Statistische Auswertung
- Führen Sie statistische Analysen mit dem SPSS-Windows-Statistikpaketprogramm durch und wenden Sie die Kruskal-Wallis- und Mann-Whitney-Tests an. Legen Sie das statistische Konfidenzniveau auf 95 % fest (α = 0,05).
Ergebnisse
Bei der Auswertung anhand der Anwendungszeiten von 20 Sekunden und 40 Sekunden wurde ein statistisch signifikanter Unterschied beobachtet. Es wurde beobachtet, dass die Temperaturänderung auf den 40 s laserapplizierten Ti-Zylinderoberflächen größer war als die auf dem 20 s Laser (p=0,037; Abbildung 3).
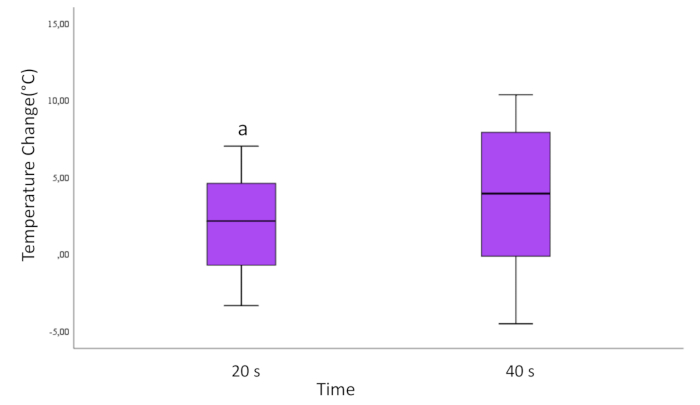
Abbildung 3: Temperaturänderung in Abhängigkeit von der Zeit für alle Proben. Die Zeilen, die vom Feld nach oben und unten verlaufen, zeigen die Minimal- und Maximalwerte der Daten an. Die horizontale Linie innerhalb des Feldes stellt den Median der Daten dar. Rundmarken sind Ausreißer.
a=Statistisch signifikanter Unterschied zur 40-s-Gruppe. (S<0,05)
Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Wir analysierten die Temperaturänderung, indem wir sie basierend auf Lasertypen (Er, Cr:YSGG und Diode) in zwei Gruppen einteilten. Es wurde beobachtet, dass die Temperaturänderung in Ti-Zylindern mit einem Diodenlaser größer ist als in Zylindern, die den Er,Cr:YSGG-Laser anwenden. Die Ergebnisse sind statistisch signifikant (p=0,001; siehe Abbildung 4). Bei der Bewertung von Ti-Zylindern, die nur für die Diodenlaseranwendung getestet wurden, zeigten die Ergebnisse, dass die 40-s-Diodenlaseranwendung im Vergleich zur 20-s-Anwendung über alle Wattwerte hinweg signifikant bessere Ergebnisse lieferte (p < 0,001; Abbildung 4). Die rote Linie innerhalb des Feldes in der Abbildung zeigt den Medianwert an. Die Balken oben und unten zeigen die maximalen und minimalen Temperaturwerte an.
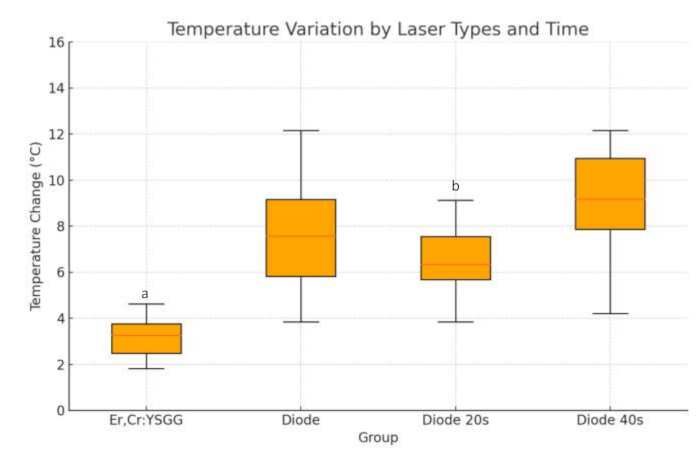
Abbildung 4: Temperaturvariation nach Lasertyp und Zeit für alle Proben. Die Zeilen, die vom Feld nach oben und unten verlaufen, zeigen die Minimal- und Maximalwerte der Daten an. Die horizontale Linie innerhalb des Feldes stellt den Median der Daten dar. Rundmarken sind Ausreißer.
a=Statistisch signifikanter Unterschied zur Diodengruppe. (S<0,05)
b= Statistisch signifikante Differenz zum Diodenlaser 40 s. (p<0,05)
Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die letzte statistische Auswertung der Temperaturänderung erfolgte auf Basis des Watt-Wertes. Signifikante Unterschiede wurden beobachtet, wenn nur die Parameter Wattwerte (p < 0,001) und Wattzeit (p < 0,001) in den Gruppen untersucht wurden, die den Er,Cr:YSGG-Laser verwendeten. Bei der Anwendung des Er,Cr:YSGG-Lasers wurde beobachtet, dass die Zeit allein keinen signifikanten Einfluss auf die Temperaturänderung hatte (p = 0,959). Bei der Auswertung der Temperaturänderung in allen Ti-Zylindern, die dem Diodenlaser ausgesetzt waren, unter Berücksichtigung von Watt-, Zeit- und Watt-Zeit-Variablen wurde ein statistisch signifikanter Unterschied beobachtet (p < 0,05). Der Temperaturbereich der Diodenlasergruppen mit 1,8 Watt, die an die Ti-Zylinderoberflächen angelegt wurden, war deutlich größer als der der Diodenlasergruppen mit 0,8 Watt (p = 0,006; Abbildung 5).

Abbildung 5: Kombinierte Temperaturanalyse. Die Analyse wurde für die Typen Er, Cr:YSGG und Diodenlaser nach Watt und Zeit durchgeführt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Bildgebende Analyse
In REM-Bildern wurde in allen Gruppen eine mikrometergroße poröse Struktur beobachtet, die dem erwarteten Aussehen von sandgestrahlten, säureangerauten Implantatoberflächen entspricht. Bei 5000-facher Vergrößerung zeigten laserbehandelte Titanoberflächen im Vergleich zur Kontrollgruppe (rote Kreise) eine sichtbare Vergrößerung der mikrometergroßen Poren. Bei 250- und 1000-facher Vergrößerung zeigten Titanoberflächen, die 40 s lang mit Er, Cr:YSGG und Diodenlasern behandelt wurden, mehr Schmelzen als solche, die 20 s lang behandelt wurden (Abbildung 6). In den AFM-Bildern war die Verteilung der Oberflächeneindrücke in der Kontrollgruppe homogener als in den laserbehandelten Gruppen (Abbildung 7, Abbildung 8). Da die AFM-Bilder nur einen sehr kleinen Bereich von 25μm2 der ebenen Oberfläche des Titanzylinders abbildeten, konnten wir kein detailliertes Ergebnis über die gesamte Oberfläche erhalten.

Abbildung 6: REM-Bilder aller Studiengruppen. Die 6 Diodenlasergruppen sind mit D1-D6 beschriftet, während die 6 Er,Cr:YSGG-Lasergruppen mit E1-E6 beschriftet sind. Die Bilder werden mit 250x, 1000x, 5000x Vergrößerung aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
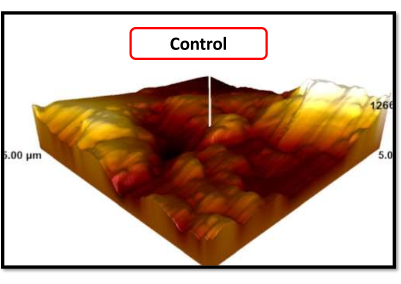
Abbildung 7: AFM-Bild der Kontrollgruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 8: AFM-Bilder aller Studiengruppen. Die 6 Diodenlasergruppen sind mit D1-D6 beschriftet, während die 6 Er,Cr:YSGG-Lasergruppen mit E1-E6 beschriftet sind. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse bei der Oberflächenrauheit
Der Parameter Rauheit zeigte keinen statistisch signifikanten Unterschied in den Variablen Lasertyp (p = 0,841), Watt (p = 0,900), Zeit (p = 0,399) und in der Auswertung der Variablen Lasertyp, Watt und Zeit zusammen (p = 0,924; Abbildung 9).
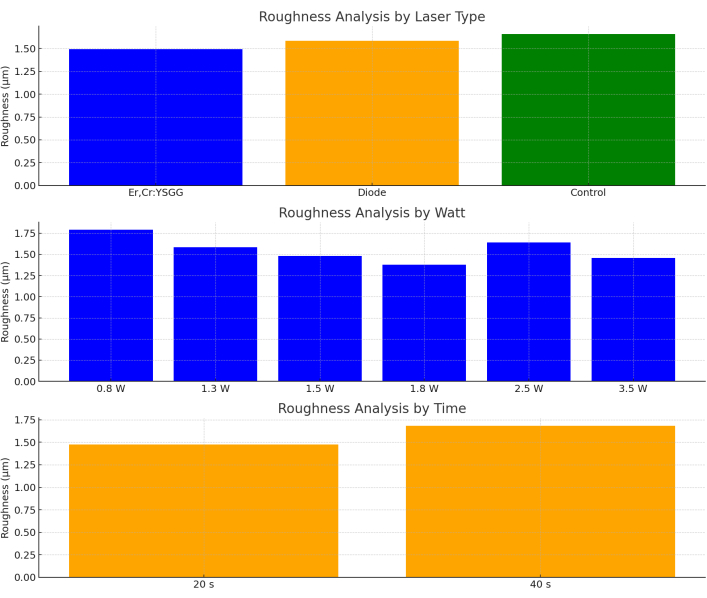
Abbildung 9: Rauheitsanalyse nach Lasertyp, Watt und Zeit. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Unter Berücksichtigung dieser Ergebnisse können wir den Schluss ziehen, dass Er,Cr:YSGG und Diodenlaser sicher für die Dekontamination der Titanoberfläche bei periimplantären Erkrankungen sind. Die Temperaturabweichung lag unter 10 °C, was darauf hindeutet, dass die Parameter im sicheren Bereich lagen. Gleichzeitig veränderte sich der Profilometer-Wert nicht wesentlich, was darauf hindeutet, dass es keine Nachteile in Bezug auf die Oberflächenrauheit gibt. In der bildgebenden Analyse wurden Gesichtsveränderungen festgestellt, die jedoch durch die Rauheitsanalyse nicht gestützt werden konnten. Die Ergebnisse der Studie belegen, dass die verwendeten Laserparameter im sicheren Bereich liegen.
a=Statistisch signifikanter Unterschied zur Diodengruppe. (S<0,05)
b= Statistisch signifikante Differenz zum Diodenlaser 40 s. (p<0,05)
Diskussion
Es wird eine bedeutende Diskussion über die optimale Methode zur Dekontamination von Implantatoberflächen bei der Behandlung von Periimplantitis geführt. In früheren Veröffentlichungen wurde die Verwendung lokaler oder systemischer Medikamente, die Laseranwendung, die mechanische und/oder chemische Reinigung und die Implantoplastik vorgeschlagen. Unsere Studienergebnisse zeigen, dass alle gemessenen Temperaturen unter die kritische Sicherheitsschwelle von 10 °C steigen13. Unter Berücksichtigung der Tatsache, dass es sich um eine In-vitro-Studie handelt und die klinischen Bedingungen nicht immer repliziert werden können, wurde beobachtet, dass die Verwendung des Er,Cr:YSGG-Lasers und des Diodenlasers Schmelzveränderungen und Mikroporen in der Implantattopographie verursachte, während sich die Oberflächenrauheit nicht änderte.
Die Verwendung von Ho:YAG- und Nd:YAG-33-Lasern zur Dekontamination wurde aufgrund von Oberflächeneffekten als unangemessen eingestuft. Es wurde jedoch befunden, dass die Er,Cr:YSGG-Laser34 und die Diodenlaser18 für diesen Zweck wirksam sind. Der Diodenlaser verbessert die Heilung im umgebenden Gewebe über die HBD-2-Expression, die durch die TGF-β1-Signalgebung stimuliert wird. Die Studie zeigte eine Verringerung der Oberflächenrauheit und der P. gingivalis-Besiedlung sowie eine Zunahme der Lebensfähigkeit von Fibroblasten und der Osteoblastendifferenzierung nach Anwendung des Er,Cr:YSGG-Lasers in einer Zickzackbewegung auf der Titanoberfläche35. Die Ergebnisse dieser Studie zeigten, dass der Er,Cr:YSGG-Laser bei Energieeinstellungen von bis zu 3,5 W bis zu 40 s keine thermische Schädigung der Titanoberflächen verursachte. Dieser Befund korreliert mit einer von Smeo et al.36 veröffentlichten Literaturrecherche, die feststellte, dass Erbiumlaser eine antibakterielle Wirkung ausüben können, ohne die kritische Temperaturschwelle zu überschreiten, wenn sie mit den richtigen Laserparametern verwendet werden.
Die Parameter des 940-nm-Diodenlasers in dieser Untersuchung betrugen 0,8 W, 1,3 W und 1,8 W, was unterschiedliche Leistungen und Bestrahlungszeiten von 20 s und 40 sumfasste 13. In zwei verschiedenen Studien, in denen der Einsatz von Diodenlasern auf Titanoberflächen evaluiert wurde, wurden 20 s37 und 40 s38 als Anwendungszeit verwendet. In ähnlicher Weise wurden Er,Cr:YSGG-Laser verwendet, die auf Titan- und Zahnoberflächen mit Anwendungszeiten von 20 s39 und 40 s40 aufgebracht wurden. In einer Studie überschritt ein Diodenlaser die kritische Temperatur in 18 Sekunden13. Bei Diodenlaseranwendungen wird empfohlen, eine längere Exposition gegenüber der Wurzeloberfläche zu vermeiden, um eine thermische Schädigung der Pulpa zu vermeiden (kritische Schwelle 5,6 °C)28,41. Eine Studie, in der die Auswirkungen des Einsatzes verschiedener Laser auf die Temperaturänderung von Titanoberflächen untersucht wurde, berichtete, dass Er:YAG-, CO2-, Nd:YAG- und Diodenlaser die kritische Temperaturänderung von 10 °C in einem Wassertank nicht überschritten42. In ähnlicher Weise erzeugten in dieser Studie die Gruppen von 940-nm-Diodenlasern einen signifikant schnelleren Temperaturanstieg; Die endgültigen Temperaturwerte lagen jedoch unter der kritischen Schwelle. Bei der Anwendung eines 940-nm-Diodenlasers kann der Temperaturanstieg verringert werden, indem eine reduzierte Ausgangsleistung gewählt und die Bestrahlungszeit minimiert wird. Diese Ergebnisse deuten auf einen positiven Zusammenhang zwischen erhöhter Leistungs-/Energiedichte 13,43,44 und erhöhter Temperatur in Abwesenheit von Wasserkühlung hin, was die Bedeutung der Wasserkühlung während der Bestrahlung wie beim Er,Cr:YSGG-Laser 16,45 unterstreicht.
Mechanische und 3D-optische (berührende und berührungslose) Profilometrie sind die beliebtesten In-vitro-Methoden zur quantitativen Messung der Nanotopographie von Dentalmaterial und der Oberflächenrauheit von Implantaten, während REM-Bilder der Goldstandard für die qualitative Bewertung sind31. Die Messung der Rauheit mit einem Kontaktprofilometer kann zu Schäden an der Oberfläche und zu ungenauen Messungen führen46. Während die REM-Bildgebung nicht in der Lage war, die quantitative und qualitative Analyse von Proben zu erleichtern, konnten AFM-Bilder quantitative Informationen in Bezug auf die Oberflächenrauheit und die 3D-Tiefe liefern47. Nach der Laserbehandlung wurden morphologische Veränderungen an den Implantatoberflächen festgestellt, die durch eine Zunahme des Mikroporendurchmessers, eine geschmolzene Morphologie und eine erhöhte Prävalenz von entkernten Mikroporen im Vergleich zur Kontrollgruppe gekennzeichnet waren. Unter diesen experimentellen Bedingungen zeigte die Oberfläche des Ti-Zylinders während der REM-Analyse Oberflächenveränderungen. Darüber hinaus wurden diese Veränderungen durch den Lasertyp, die verwendete Leistung und die für die Laserbestrahlung aufgewendete Zeit beeinflusst. Die Autoren stimmten mit der Schlussfolgerung überein, dass das Ausmaß der Oberflächenschädigung und die Zeit sowohl in den Lasern der Diode18 als auch der Er,Cr:YSGG 21,48 mit zunehmender Leistung korrelieren. In der weiteren Forschung sollte untersucht werden, ob diese Modifikationen therapeutische Implikationen haben.
Die Oberflächenrauheit von Zahnimplantaten, auch Mikrotopographie genannt, ist ein entscheidender Faktor, der die Osseointegration beeinflusst. In einer aktuellen Studie wurden Titanoberflächen mit vier verschiedenen Protokollen behandelt. Titanoberflächen- und mesenchymale Stammzellen wurden auf der laserbehandelten Oberfläche konserviert, und die Adhäsionsergebnisse der Stammzellen waren besser als bei anderen Techniken (Ti-Ni-Bürste, Air-Flow und Zahnbohrer)49. Alle Ra-Werte des untersuchten Ti-Zylinders waren während der Laserbestrahlung reduziert; Es wurden jedoch keine statistisch signifikanten Unterschiede vor und nach der Bestrahlung festgestellt. Die Diodenlaserbestrahlung reduzierte die Oberflächenrauheit, indem sie die Ti-Oberfläche schmolz, wenn höhere Leistungsstufen verwendet wurden. Diese Ergebnisse stehen im Einklang mit einer früheren Studie von Stübinger et al.50, in der ein 810-nm-Diodenlaser zur Dekontamination der Implantatoberfläche verwendet wurde und keine signifikante Wirkung auf die Oberfläche zeigte, während sie im Widerspruch zu den Ergebnissen der Studie von Kim et al.51 und Rezeka et al.17 standen, die eine Wellenlänge von 940 nm verwendeten, wenn sie mit 2 und 3 W Leistung behandelt wurde und eine erhöhte Oberflächenrauheit bei Laseranwendung beobachtete.
Diese Studie ist durch den Mangel an zellulären und mikrobiologischen Tests eingeschränkt. Die vorliegende Studie zielt darauf ab, die topographischen Veränderungen des Ti-Zylinders nach Dioden- und Er,Cr:YSGG-Laserbestrahlung zu bewerten; Dennoch bedürfen die biologischen Implikationen der verschiedenen Behandlungen weiterer in vitro und in vivo Untersuchungen. Eine weitere Einschränkung besteht darin, dass die statistische Analyse der Oberflächenrauheit, die in dieser Studie durchgeführt wird, nur Profilometerdaten umfasst. Der AFM-Ansatz erwies sich als effektiv bei der Bewertung der Wirksamkeit von zwei Lasertypen, die häufig in der Zahnmedizin eingesetzt werden.
Schlüsse
In unserer Untersuchung überschritt keiner der Temperaturanstiege die physiologische Schwelle von 10 °C. Folglich wurden statistisch signifikante Temperaturunterschiede als klinisch irrelevant angesehen. Der Lasertyp und die Laserleistung hatten keinen signifikanten Einfluss auf die RA; Daher kann die Bestrahlung mit einem 0,8-, 1,3- und 1,8-W-Diodenlaser und einem Er,Cr:YSGG-Laser mit 1,5 W, 2,5 W und 3,5 W für 20 s und 40 s die Ti-Oberfläche ohne Beschädigung reinigen. Nichtsdestotrotz wurden diese Ergebnisse in vitro durchgeführt, und klinische Studien werden erforderlich sein, um die Ergebnisse dieser Studie zu verifizieren. In der vorliegenden Studie wurden verschiedene Techniken untersucht, die ein klinisches Szenario des Implantat-Debridements simulieren.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Die in der Studie verwendeten Titanzylinder wurden von Naxis Implant hergestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Atomic Force Microscopy | ezAFM | Compact AFM Model | |
| Diode | Biolase | Epic 10, 940 nm Wavelength | |
| E3 Tip | Fiber Diameter: 300 µm, Fiber Length: 9 mm | ||
| Er,Cr:YSGG Laser | Iplus | 2780 nm Wavelength | |
| Profilometer | Mitutoyo | Surftest SJ-201 Model | |
| RFPT-14 Tip | Outer Tip Diameter: 580 µm, Tip Length: 14 mm | ||
| Scanning Electron Microscope | FEI | Quanta FEG 250 Model | |
| Stand | Custom Design | Rhinoceros application, Flamix PLA filament, Bambulab X1C Device | |
| Thermometer | Keithley | 2000 Series Model, K tip termokulp | |
| Titanium Cylinder | Naxis | 10 mm height, 5 mm diameter, SLA Surface, Titanium |
Referenzen
- Guillaume, B. Dental implants: A review. Morphologie. 100 (331), 189-198 (2016).
- Henry, P. J. Tooth loss and implant replacement. Aust Dent J. 45 (3), 150-172 (2000).
- Berglundh, T., Armitage, G., Araujo, M. G., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol. 89 (1), S313-S318 (2018).
- Herrera, D., Berglundh, T., Schwarz, F., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Guarnieri, R., Reda, R., Di Nardo, D., Pagnoni, F., Zanza, A., Testarelli, L. Prevalence of Peri-Implant Mucositis, Peri-Implantitis and Associated Risk Indicators of Implants with and without Laser-Microgrooved Collar Surface: A Long-Term (≥20 Years) Retrospective Study. J Pers Med. 14 (4), (2024).
- Figuero, E., Graziani, F., Sanz, I., Herrera, D., Sanz, M. Management of peri‐implant mucositis and peri‐implantitis. Periodontology 2000. 66 (1), 255-273 (2014).
- Tomasi, C., Wennström, J. L. Full-mouth treatment vs. the conventional staged approach for periodontal infection control. Periodontology 2000. 51 (1), 45-62 (2009).
- Baima, G., Citterio, F., Romandini, M., et al. Surface decontamination protocols for surgical treatment of peri‐implantitis: A systematic review with meta‐analysis. Clin Oral Implants Res. 33 (11), 1069-1086 (2022).
- Subramani, K., Wismeijer, D. Decontamination of titanium implant surface and re-osseointegration to treat peri-implantitis: a literature review. Int J Oral Maxillofac Implants. , Accessed August 4, 2024 (2012).
- Świder, K., Dominiak, M., Grzech-Leśniak, K., Matys, J. Effect of different laser wavelengths on periodontopathogens in peri-implantitis: A review of in vivo studies. Microorganisms. 7 (7), 189(2019).
- Mizutani, K., Aoki, A., Coluzzi, D., Yukna, R., Wang, C. Y., Pavlic, V., Izumi, Y. Lasers in minimally invasive periodontal and peri‐implant therapy. Periodontology 2000. 71 (1), 185-212 (2016).
- Eriksson, R. A., Albrektsson, T. The effect of heat on bone regeneration: An experimental study in the rabbit using the bone growth chamber. J Oral Maxillofac Surg. 42 (11), 705-711 (1984).
- Geminiani, A., Caton, J. G., Romanos, G. E. Temperature change during non-contact diode laser irradiation of implant surfaces. Lasers Med Sci. 27 (2), 339-342 (2012).
- Alpaslan Yayli, N. Z., Talmac, A. C., Keskin Tunc, S., Akbal, D., Altindal, D., Ertugrul, A. S. Erbium, chromium-doped: yttrium, scandium, gallium, garnet and diode lasers in the treatment of peri‐implantitis: Clinical and biochemical outcomes in a randomized-controlled clinical trial. Lasers Med Sci. 37 (1), 665-674 (2022).
- Peters, N., Tawse-Smith, A., Leichter, J., Tompkins, G. Laser therapy: The future of peri-implantitis management. J Periodontol. 22 (1), 1(2012).
- Alhaidary, D., Franzen, R., Hilgers, R. D., Gutknecht, N. First investigation of dual-wavelength lasers (2780 nm Er,Cr:YSGG and 940 nm diode) on implants in a simulating peri-implantitis situation regarding temperature changes in an in vitro pocket model. Photobiomodul Photomed Laser Surg. 37 (8), 508-514 (2019).
- Rezeka, M. A., Metwally, N. A., Abd El Rehim, S. S., Khamis, M. M. Evaluation of the effect of diode laser application on the hydrophilicity, surface topography, and chemical composition of titanium dental implant surface. J Prosthodont. 2024, 1-8 (2025).
- Khalil, M. I., Sakr, H. Implant surface topography following different laser treatments: An in vitro study. Cureus. 15 (5), e38731(2023).
- Tosun, E., Tasar, F., Strauss, R., Kivanc, D. G., Ungor, C. Comparative evaluation of antimicrobial effects of Er:YAG, diode, and CO2 on titanium discs: An experimental study. J Oral Maxillofac Surg. 70 (5), 1064-1069 (2012).
- Stübinger, S., Homann, F., Etter, C., Miskiewicz, M., Wieland, M., Sader, R. Effect of Er:YAG, CO and diode laser irradiation on surface properties of zirconia endosseous dental implants. Lasers Surg Med. 40 (3), 223-228 (2008).
- Park, J., Heo, S., Koak, J., Kim, S. K., Han, C. H., Lee, J. H. Effects of laser irradiation on machined and anodized titanium disks. Int J Oral Maxillofac Implants. 27 (6), Accessed September 22, 2024 1215-1221 (2012).
- Aoki, A., Mizutani, K., Schwarz, F., et al. Periodontal and peri-implant wound healing following laser therapy. Periodontol 2000. 68 (1), 217-269 (2015).
- Roncati, M., Lucchese, A., Carinci, F. Non-surgical treatment of peri-implantitis with the adjunctive use of an 810-nm diode laser. J Indian Soc Periodontol. 17 (6), 812-817 (2013).
- Romanos, G. E., Gutknecht, N., Dieter, S., Schwarz, F., Crespi, R., Sculean, A. Laser wavelengths and oral implantology. Lasers Med Sci. 24 (6), 961-970 (2009).
- Hauser-Gerspach, I., Stübinger, S., Meyer, J. Bactericidal effects of different laser systems on bacteria adhered to dental implant surfaces: An in vitro study comparing zirconia with titanium. Clin Oral Implants Res. 21 (3), 277-283 (2010).
- Hafeez, M., Calce, L., Hong, H., Hou, W., Romanos, G. E. Thermal effects of diode laser-irradiation on titanium implants in different room temperatures in vitro. Photobiomodul Photomed Laser Surg. 40 (8), 554-558 (2022).
- Koopaie, M., Kia Darbandsari, A., Hakimiha, N., Kolahdooz, S. Er,Cr:YSGG laser surface treatment of gamma titanium aluminide: Scanning electron microscopy-energy-dispersive X-ray spectrometer analysis, wettability and Eikenella corrodens and Aggregatibacter actinomycetemcomitans bacteria count - in vitro study. Proc Inst Mech Eng H. 234 (8), 769-783 (2020).
- Kayar, N. A., Hatipoǧlu, M. Could we set a convenient irradiation time to reduce the possibility of thermal pulp damage during diode laser as an adjunct to periodontal treatment? An in vitro analysis. Photobiomodul Photomed Laser Surg. 39 (7), 480-485 (2021).
- Barrak, H., Mahdi, S. S., Alkurtas, S. A., Size, P. Clinical applications of a 940 nm diode laser for laser troughing versus conventional method: A preliminary study. Iraqi J Laser. 23 (2), (2024).
- Beer, F., Körpert, W., Passow, H., et al. Reduction of collateral thermal impact of diode laser irradiation on soft tissue due to modified application parameters. Lasers Med Sci. 27 (5), 917-921 (2012).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an erbium, chromium-doped yttrium, scandium, gallium, and garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Al-Omari, W. M., Palamara, J. E. The effect of Nd:YAG and Er,Cr:YSGG lasers on the microhardness of human dentin. Lasers Med Sci. 28 (1), 151-156 (2013).
- Kreisler, M., Götz, H., Duschner, H., d’Hoedt, B. Effect of Nd:YAG, Ho:YAG, Er:YAG, CO2, and GaAlAs laser irradiation on surface properties of endosseous dental implants. Int J Oral Maxillofac Implants. 17 (5), 202-209 (2002).
- Kottmann, L., Franzen, R., Conrads, G., Wolfart, S., Marotti, J. Effect of Er,Cr:YSGG laser with a side-firing tip on decontamination of titanium disc surface: An in vitro and in vivo study. Int J Implant Dent. 9 (1), 7(2023).
- Yao, W. L., Lin, J. C. Y., Salamanca, E., et al. Er,Cr:YSGG laser performance improves biological response on titanium surfaces. Materials. 13 (3), 756(2020).
- Smeo, K., Nasher, R., Gutknecht, N. Antibacterial effect of Er,Cr:YSGG laser in the treatment of peri-implantitis and their effect on implant surfaces: A literature review. Lasers Dent Sci. 2 (2), 63-71 (2018).
- Fletcher, P., Linden, E., Cobb, C., Zhao, D., Rubin, J., Planzos, P. Efficacy of removal of residual dental cement by laser, ultrasonic scalers, and titanium curette: An in vitro study. Compend Contin Educ Dent. , (2025).
- Lollobrigida, M., Fortunato, L., Serafini, G., et al. The prevention of implant surface alterations in the treatment of peri-implantitis: Comparison of three different mechanical and physical treatments. Int J Environ Res Public Health. 17 (8), 2624(2020).
- Arora, S., Lamba, A. K., Faraz, F., Tandon, S., Ahad, A. Evaluation of the effects of Er,Cr:YSGG laser, ultrasonic scaler and curette on root surface profile using surface analyser and scanning electron microscope: An in vitro study. J Lasers Med Sci. 7 (4), 243-249 (2016).
- Jin, S. H., Lee, E. M., Park, J. B., Kim, K. K., Ko, Y. Decontamination methods to restore the biocompatibility of contaminated titanium surfaces. J Periodontal Implant Sci. 49 (3), 193-204 (2019).
- Kayar, N. A., Hatipoǧlu, M. Can we determine an appropriate timing to avoid thermal pulp hazard during gingivectomy procedure? An in vitro study with diode laser. Photobiomodul Photomed Laser Surg. 39 (2), 94-99 (2021).
- Monzavi, A., Fekrazad, R., Chinipardaz, Z., Shahabi, S., Behruzi, R., Chiniforush, N. Effect of various laser wavelengths on temperature changes during peri-implantitis treatment: An in vitro study. Implant Dent. 27 (3), 311-316 (2018).
- Valente, N. A., Calascibetta, A., Patianna, G., Mang, T., Hatton, M., Andreana, S. Thermodynamic effects of 3 different diode lasers on an implant-bone interface: An ex-vivo study with review of the literature. J Oral Implantol. 43 (2), 94-99 (2017).
- Leja, C., Geminiani, A., Caton, J., Romanos, G. E. Thermodynamic effects of laser irradiation of implants placed in bone: An in vitro study. Lasers Med Sci. 28 (6), 1435-1440 (2013).
- Strever, J. M., Lee, J., Ealick, W., et al. Erbium, chromium:yttrium-scandium-gallium-garnet laser effectively ablates single-species biofilms on titanium disks without detectable surface damage. J Periodontol. 88 (5), 484-492 (2017).
- Bourauel, C., Fries, T., Drescher, D., Plietsch, R. Surface roughness of orthodontic wires via atomic force microscope, laser specular reflectance, and profilometry. Eur J Orthod. 20 (1), Accessed February 13, 2025 79-92 (1998).
- Choi, S., Kim, J. H., Kim, N. J., et al. Morphological investigation of various orthodontic lingual bracket slots using scanning electron microscopy and atomic force microscopy. Microsc Res Tech. 79 (12), 1193-1199 (2016).
- Huang, H. H., Chuang, Y. C., Chen, Z. H., Lee, T. L., Chen, C. C. Improving the initial biocompatibility of a titanium surface using an Er,Cr:YSGG laser-powered hydrokinetic system. Dent Mater. 23 (4), 410-414 (2007).
- Furtsev, T. V., Koshmanova, A. A., Zeer, G. M., et al. Laser cleaning improves stem cell adhesion on the dental implant surface during peri-implantitis treatment. Dent J. 11 (2), 30(2023).
- Stübinger, S., Homann, F., Etter, C., Miskiewicz, M., Wieland, M., Sader, R. Effect of Er:YAG, CO and diode laser irradiation on surface properties of zirconia endosseous dental implants. Lasers Surg Med. 40 (3), 223-228 (2008).
- Kim, H. K., Park, S. Y., Son, K., et al. Alterations in surface roughness and chemical characteristics of sandblasted and acid-etched titanium implants after irradiation with different diode lasers. Appl Sci. 10 (12), 4167(2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten