Method Article
GC-MS: Analyse der Deuteriumanreicherung von Retinol im Serum und Abschätzung der Vitamin-A-Gesamtkörperspeicher
In diesem Artikel
Zusammenfassung
Bei dieser Methode wird Retinol aus Serum extrahiert, mittels HPLC getrennt und markierte und unmarkierte Retinol-Isotope mittels GC-MS bestimmt. Das Verhältnis von markiertem zu unmarkiertem Retinol wird verwendet, um die Gesamtkörperspeicher an Vitamin A zu schätzen.
Zusammenfassung
Diese Methode beschreibt die Bestimmung der Deuteriumanreicherung von Retinol im Serum und die Abschätzung der Vitamin-A-Speicher im Körper. Der Prozess umfasst die Extraktion von Retinol aus 0,4 ml Serum unter Verwendung von 0,5 ml 0,85%iger Kochsalzlösung, 100 μl interner Standardlösung und 5 ml Chloroform-Methanol-Lösung (2:1 v/v). Nach der Zentrifugation und Entfernung der unteren Chloroformschicht wird das Gemisch unter Stickstoff getrocknet und in 0,1 ml Ethanol resuspendiert, und die Retinolfraktion wird mit einem HPLC-System, das mit einer PE C18-Säule ausgestattet ist, von anderen Bestandteilen getrennt. Die Retinolfraktion kann manuell oder mit einem Fraktionssammler aufgefangen werden. Anschließend wird die Retinolfraktion unter Stickstoff getrocknet und mit O-Bis(trimethylsilyl)trifluoracetamid (BSTFA) derivatisiert, das 10% Trimethylchlorsilan enthält. Schließlich werden markierte und unmarkierte Retinol-Isotope unter Verwendung eines GC-MS-Systems quantifiziert, das mit einer 19091z-431 HP-1 Methylsiloxan-Kapillarsäule ausgestattet ist, wobei eine negative chemische Ionisation mit Elektroneneinfang mit Helium als Trägergas und Methan als Ionisationsmittel verwendet wird. Das Verhältnis von markiertem zu unmarkiertem Retinol wird dann in den Olson-, Green- oder Massenbilanzgleichungen verwendet, um die Vitamin-A-Speicher zu schätzen.
Einleitung
Vitamin A ist ein essentieller Nährstoff, der für das visuelle System und die Aufrechterhaltung der Zellfunktion für Wachstum, Epithelintegrität, Produktion roter Blutkörperchen, Immunität und Fortpflanzung benötigtwird 1. Vitamin-A-Mangel ist weltweit ein ernstes Problem für die öffentliche Gesundheit, von dem mehr als 100 Länder betroffen sind. Kleinkinder und schwangere Frauen in Ländern mit niedrigem Einkommen sind unverhältnismäßig stark betroffen. Weltweit leiden etwa 190 Millionen Kinder an Vitamin-A-Mangel, was ihn zu einem kritischen Thema für die öffentliche Gesundheit und die Entwicklung von Kindern macht2.
Als Reaktion auf diese Situation werden in vielen Ländern mit niedrigem Einkommen seit Jahrzehnten mehrere Programme umgesetzt, darunter eine Vitamin-A-Supplementierung mit halbjährlicher Verteilung hoher Vitamin-A-Dosen an Kinder unter 5 Jahren und die Vitamin-A-Anreicherung bestimmter Lebensmittel. Diese Interventionen überschneiden sich jedoch oft, so dass einige Bevölkerungsgruppen versehentlich chronisch übermäßig viel Vitamin A aufgenommen werdenkönnen 3,4. Dieses doppelte Risiko von Mangel und Überschuss unterstreicht die Notwendigkeit eines Biomarkers, der den Vitamin-A-Status über das gesamte Spektrum, von Mangel bis Toxizität, genau beurteilen kann, um die Programmbewertung zu leiten.
Vitamin-A-Biomarker sind entscheidend für die Beurteilung des Ernährungszustands. Die am häufigsten verwendeten Biomarker sind die Serumkonzentrationen von Retinol und Retinol-bindendem Protein (RBP). Es ist jedoch wichtig zu beachten, dass diese Biomarker vorübergehend durch Infektionen und Entzündungen unterdrückt werden können, was die Spezifität der Vitamin-A-Bewertung in bestimmten Populationen verringern kann 5,6,7.
Während Leberbiopsie- oder Autopsieproben als Goldstandard für die Beurteilung des Vitamin-A-Status gelten, ist der empfindlichste indirekte Indikator für die gesamten Vitamin-A-Reserven der Leber die Retinol-Isotopenverdünnungsmethode (RID)8. RID bietet eine quantitative Schätzung des Vitamin-A-Status über das gesamte Spektrum, das von mangelhaften bis zu übermäßigen Speichern reicht9. In den meisten Forschungsanwendungen beinhaltet die RID-Methode die Verabreichung einer oralen Dosis von Deuterium (2H) oder 13C-markiertem Retinylacetat, das sich dann über einen Zeitraum von 14 bis 21 Tagen mit den Körperspeichern vermischt. Nach dieser Zeit wird eine Blutprobe entnommen und das Serum bei -80 °C gelagert. Das Verhältnis von markiertem zu Gesamtretinol wird dann mittels Massenspektrometrie analysiert, um die Vitamin-A-Speicher10 unter Verwendung der Olson-Gleichung11, der Massenbilanzgleichung12 oder der grünen Gleichung13 zu schätzen. Das in dieser Arbeit vorgestellte Protokoll gilt für die Verabreichung von Deuterium (2H)- oder 13C-markiertem Retinylacetat und basiert auf der Arbeit von Tang et al.14. Das übergeordnete Ziel dieser Methode ist es, den Vitamin-A-Status im Körper genau zu beurteilen und zu überwachen11. Es handelt sich um eine leistungsstarke Methode, die eine quantitative Schätzung der Vitamin-A-Konzentrationen über ein breites Spektrum von Status ermöglicht, von einem Mangel bis zu einem Überschussvon 15. Sie ist genauer und präziser als andere Methoden, die sich oft auf indirekte Messungen stützen9.
Protokoll
Das Protokoll wurde von der Ethikkommission des Ministeriums für öffentliche Gesundheit (Nr. 2015/02/550/CE/CNERSH/SP) genehmigt und die Einverständniserklärung der Eltern/Erziehungsberechtigten eingeholt.
HINWEIS: Da Vitamin A lichtempfindlich ist, ist es wichtig, dass alle Eingriffe bei schwachem Licht oder unter goldener Leuchtstoffröhre durchgeführt werden16. Die verwendeten Materialien sind in der Materialtabelle aufgeführt.
1. Vorbereitung der Reagenzien
- Natriumchlorid (0,85 % w/v): 0,85 g NaCl werden in destilliertem Wasser in einem 100-ml-Messkolben gelöst. Bis zur Graduierung mit destilliertem Wasser auffüllen und verrühren.
- Chloroform-Methanol (2:1 v/v): 300 mL Chloroform mit einem Messzylinder in einen 500 mL Messkolben überführen. 150 mL Methanol zugeben und mischen.
- Mobile Phase A für die HPLC: Acetonitril/Tetrahydrofuran/Reinstwasser (50/20/30, v/v/v): 500 mL Acetonitril in einen 1000 mL Messkolben überführen. Fügen Sie 200 ml Tetrahydrofuran und 300 ml Wasser hinzu. Die Lösung wird gemischt, mit einem Membranfilter mit einer Porengröße von 0,45 μm filtriert und beschallt (Amplitude 100 %, Frequenz 40 kHz und Dauer 15 min).
- Mobile Phase B für HPLC: Acetonitril/Tetrahydrofuran/ Reinstwasser (50/44/6, v/v/v): 500 mL Acetonitril in einen 1000 mL Messkolben überführen. Fügen Sie 440 ml Tetrahydrofuran und 60 ml Wasser hinzu. Die Lösung mischen, mit einem Membranfilter mit einer Porengröße von 0,45 μm filtrieren und beschallen.
2. Erstellung von Standardlösungen
- Die Stammlösung wird hergestellt, indem 40 mg des Standards in Ethanol in einem 100-ml-Messkolben gelöst werden, wie in Tabelle 1 dargestellt. Bis zur Graduierungsmarke mit dem Lösungsmittel füllen und gründlich mischen.
- Verdünnte Stammlösungen: Die verdünnte Stammlösung wird durch Überführen von 1 ml der Stammlösung in einen 50-ml-Messkolben hergestellt, wie in Tabelle 2 dargestellt. Bis zur Graduierung mit dem entsprechenden Lösungsmittel füllen und gründlich mischen.
- Bestimmung der Konzentration von verdünnten Stammlösungen: Ein Aliquot (1 ml) der verdünnten Lösung wird in ein Quarzröhrchen gegeben und die Extinktion im Spektralphotometer bei der angegebenen Wellenlänge (Tabelle 3) unter Verwendung von Ethanol als Blindwert gemessen. Berechnen Sie das mit dem Lambert-Beer-Gesetz17. Stellen Sie sicher, dass das Spektralphotometer vor der Analyse kalibriert ist, indem Sie das Gerät 15-30 Minuten lang aufwärmen, die gewünschte Wellenlänge auswählen und das Gerät auf Null stellen, indem Sie den Rohling in den Probenhalter legen. Berechnen Sie die Konzentration mit der folgenden Formel:
Konzentration = (Absorptions-/Absorptionskoeffizient) x 106 (μg/dl)
HINWEIS: Um die Werte von herkömmlichen Einheiten (μg/dl) in SI-Einheiten (μmol/l) umzurechnen, multiplizieren Sie den konventionellen Wert mit den folgenden Umrechnungsfaktoren: 0,0304 für Retinylacetat und 0,0349 für Retinol18. - Vorbereitung der Arbeitsnormen: Mit einer volumetrischen Pipette werden 2 ml der verdünnten Stammlösungen in einen 100-ml-Konuskolben überführt. Den Kolben bis zur Graduierungsmarke mit Ethanol füllen, gründlich mischen und mit einem Stopfen verschließen.
- Um die genaue Konzentration jeder Lösung zu bestimmen, beurteilen Sie die Reinheit jeder Komponente mit Hilfe der HPLC, die mit einer C18-Säule und einem Diodenarray-Detektor auf 340 nm ausgestattet ist. Programmieren Sie die Pumpe so, dass sie die mobile Phase A und die mobile Phase B gemäß dem in Tabelle 4 gezeigten Zeitplan verwendet. Stellen Sie sicher, dass das HPLC-System vor der Analyse kalibriert ist, indem Sie verschiedene Komponenten wie Pumpe, Detektor, Autosampler und die Leistung des gesamten Systems validieren.
- Übertragen Sie 1 ml der verdünnten Stammlösungen in Bördelfläschchen und injizieren Sie die Proben gemäß dem normalen Verfahren in das HPLC-System. Bestimmen Sie die Reinheit mit der folgenden Gleichung:
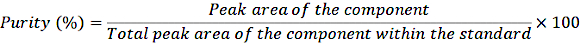
GLEICHUNG 1
Berechnen Sie mit dieser Reinheitskorrektur die exakte Konzentration der verschiedenen Komponenten in der Standardlösung.
- Vorbereitung des internen Standards (Retinylacetat OD ~ 0,2): Mit einer volumetrischen Pipette werden 30 mL des Retinylacetat-Arbeitsstandards in einen 100 mL Konuskolben überführt. Den Kolben bis zur Graduierungsmarke mit Ethanol füllen, gründlich mischen und mit einem Stopfen verschließen.
- Herstellung von Arbeitslösungen: Fügen Sie 20 μg unmarkiertes Retinol zu 10,00, 3,33, 1,00, 0,33 und 0,00 μg markiertem Retinol hinzu, um ein Verhältnis von markiertem und unmarkiertem Retinol von 0,500, 0,167, 0,050, 0,0167 und 0,00 zu erhalten.
3. Analyse der Probe
HINWEIS: Die in dieser Studie verwendeten Serumproben wurden am 14. Tag von Kindern entnommen, die im Rahmen einer Studie zur Überwachung und Beurteilung des Vitamin-A-Status von Kindern in Kamerun eine orale Dosis (2 mg Retinoläquivalente) von D8-Retinol erhielten.
- Extraktion von Retinoiden im Serum: Diese Extraktion basiert auf der Arbeit von Folch et al.19 , modifiziert von Tang et al.14. Führen Sie die unten beschriebenen Schritte aus.
- Lassen Sie gefrorene Serumproben vor der Analyse bei Raumtemperatur (20-25 °C) vorsichtig auftauen. Aliquotieren Sie 400 μl Serum in ein 16 x 100 mm großes Einweg-Kulturröhrchen. 500 μl 0,85 % Kochsalzlösung plus 100 μl Internal Standard und 5 mL Chloroform-Methanol (2:1 v/v) Lösung hinzufügen.
- 30 s Vortex ziehen und bei 1157 x g für 10 min bei 4 °C zentrifugieren. Entfernen Sie mit einer Pasteurpipette aus Glas vorsichtig die untere Schicht des Chloroforms in ein 13 x 100 mm großes Einweg-Kulturröhrchen. Unter Stickstoffgas im Wasserbad (40 °C) trocknen und den Rückstand in 100 μl Ethanol resuspendieren. 30 s lang vortexen und beschallen. Übertragen Sie die Probe in ein Bördelfläschchen mit einem Einsatz, schließen Sie die Vertiefung und beschriften Sie sie. Die Probe ist bereit für die HPLC-Retinol-Entnahme.
- Führen Sie die HPLC-Retinol-Entnahme wie unten beschrieben durch.
- Injizieren Sie 70 μl jeder Serumprobe in ein HPLC-System, das mit einer C18-Säule und einem auf 340 nm eingestellten Diodenarray-Detektor ausgestattet ist. Programmieren Sie die Pumpe so, dass sie die mobilen Phasen A und B mit einer konstanten Durchflussrate von 1 ml/min gemäß dem in Tabelle 4 gezeigten Zeitplan fördert.
- Vor der Injektion der Serumproben werden 70 μl der Retinol-Arbeitslösung in das HPLC-System injiziert und die Retentionszeit des Retinol-Peaks aufgezeichnet. Richten Sie dann den Fraktionssammler so ein, dass die eluierte Retinolfraktion innerhalb eines bestimmten Bereichs in einem 5-ml-Röhrchen mit einem Mattglasstopfen gesammelt wird. In diesem Fall wurde die Retinolfraktion über einen Zeitraum von 3 Minuten von 7,5 bis 10,5 Minuten gesammelt.
HINWEIS: Die Retinolkonzentration kann in diesem Schritt auch anhand einer Kalibrierkurve von Retinolstandards und der aus dem internen Standard erhaltenen Wiederfindungsrate berechnet werden.
- Führen Sie die Derivatisierung von Retinol wie unten beschrieben durch.
- Die aus der HPLC gewonnene Retinolfraktion wird unter Stickstoffgas in einem Wasserbad bei 40 °C für mindestens 3 h getrocknet. Fügen Sie Ethanol hinzu, um die Feuchtigkeitsverdunstung während des Trocknens zu erleichtern (die Proben sollten vollständig trocken sein, da die Derivatisierung feuchtigkeitsempfindlich ist). Geben Sie 20 μl BSTFA mit 10 % TMCS in das Röhrchen.
- Stellen Sie das Rohr in eine auf 70 °C eingestellte Blockheizung und inkubieren Sie es 30 Minuten lang. Übertragen Sie das Reaktionsgemisch mit einer Pasteurpipette aus Glas in ein Bördelfläschchen mit Einsatz, verschließen Sie es mit einer Bördelkappe mit einer Kappenpresse fest und beschriften Sie es. Die Probe ist nun bereit für die GC/MS-Analyse und kann bis zur Analyse in einem Exsikkator bei 4 °C gelagert werden.
- Trocknen Sie zusätzlich einen 100-μl-Satz funktionierender Standardlösungen und derivatisieren Sie wie oben beschrieben, um die GC/MS zu kalibrieren.
HINWEIS: Die Derivatisierung von Retinol unter Verwendung von BSTFA beinhaltet eine chemische Reaktion, bei der die Hydroxylgruppe (-OH) von Retinol durch die Trimethylsilylgruppe (-Si(CH3)3) ersetzt wird, wodurch Retinyltrimethylsilylether entsteht. Dieser Prozess erhöht die Flüchtigkeit und Stabilität von Retinol und eignet sich daher besser für die GC/MS-Analyse20.
- GC/MS-Analyse: Die GC/MS-Analyse wird nach dem von Tang et al.14 beschriebenen Verfahren durchgeführt. Führen Sie die unten beschriebenen Schritte aus.
- Injizieren Sie 3 μl der derivatisierten Retinolprobe mit einem Autosampler in den GC mit einem kühlen On-Column-Injektor, der über einen totvolumenfreien Anschluss mit einer 15 m x 0,25 mm großen Quarzglaskapillare verbunden ist, die mit einer stationären DB-1-Phase mit einer Schichtdicke von 0,25 μm beschichtet ist.
- Programmieren Sie die Temperaturen des Säulenofens und des Injektors an der Säule so, dass sie von 50 °C auf 285 °C bei einer Geschwindigkeit von 15 °C/min erhöht werden, und stellen Sie die Temperatur der GC/MS-Schnittstelle auf 285 °C ein. Verwenden Sie Helium als Trägergas, um das Trimethylsilylderivat von Retinol über ca. 12 min zu eluieren.
- Detektieren Sie das GC-Eluat mit einem Quadrupol-Massenspektrometer unter Verwendung einer chemischen Ionisation von 0,5 Torr Methan mit negativen Ionen, wobei die Temperatur der Ionenquelle auf 150 °C eingestellt ist. Stellen Sie das Massenspektrometer so ein, dass es zwischen 260 und 280 Dalton scannt.
4. Datenanalyse
- Verwenden Sie die GC/MS-Datenanalysesoftware.
- Extrahieren Sie alle gewünschten Ionen auf der Grundlage ihres Masse-zu-Ladungs-Verhältnisses (m/z), integrieren Sie die Fläche des Peaks (verwenden Sie die manuelle Integration, um die Start- und Endpunkte des Peaks anzupassen) und übertragen Sie die Ergebnisse in eine Tabellenkalkulationsdatei.
HINWEIS: Abhängig vom verwendeten Isotop sind die gewünschten Ionen wie folgt: 268-270 m/z für natives Retinol; 271-274 m/z für [2H4]-Retinol; 278-280 m/z für [13C]-Retinol; und 276-280 m/z für [2H8]-Retinol. - Berechnen Sie die Summe der Peaks für markiertes Retinol (ΣD), indem Sie die Peakfläche bei m/z 274, 275, 276, 277 und 278 addieren. Berechnen Sie die Summe der Peaks für unmarkiertes Retinol (ΣH), indem Sie die Peakfläche bei m/z 268, 269 und 270 addieren.
- Berechnen Sie die Anreicherung von markiertem Retinol (D) mit der folgenden Gleichung: D = ΣD/(ΣH + ΣD). Berechnen Sie die Menge an unmarkiertem Retinol (H) mit der folgenden Gleichung: H = 1 - D.
HINWEIS: Die Gaschromatographie-Massenspektrometrie zur negativen chemischen Ionisation durch Elektroneneinfang von Retinyltrimethylsilylether ergibt kein Molekülion, sondern ein Hauptfragmention bei m/z 268 bis 271 für unmarkiertes Retinol, bei m/z 272 bis 275 für D4-Retinol und bei m/z 276 bis 280 für D8-Retinol14. - Um das System zu steuern, berechnen Sie eine lineare Regressionsgleichung zwischen den Gewichtsverhältnissen der Kalibrierstandards und den integrierten Bereichen für markiertes Retinol und unmarkiertes Retinol.
5. Schätzung der Vitamin-A-Speicher
HINWEIS: Dieser Schritt ermöglicht die Beurteilung des Vitamin-A-Status einer Person.
- Berechnen Sie die gesamten Vitamin-A-Leberspeicher mit der Olson-Gleichung11
Vitamin A Gesamtleberspeicher = F x Dosis x [S x a x (H/D - 1)]
wobei F ein Faktor für die Effizienz der Absorption und Speicherung der oral verabreichten Dosis ist (F = 0,50), die Dosis die Menge an markiertem Vitamin A ist, die oral verabreicht wird (μmol), S ein Faktor ist, der die Ungleichheit des Plasma-zu-Leber-Verhältnisses von markiertem zu unmarkiertem Retinol korrigiert (S = 0,65), a ein Faktor ist, der den irreversiblen Verlust von markiertem Vitamin A während der Mischperiode korrigiert; Konkret ist a = e-kt, wobei k die geschätzte fraktionierte katabole Rate des Systems ist (k = LN 2/32 Tage für Kinder) und t die Zeit, ausgedrückt als Tage seit der Dosis; D/H ist das Serumisotopenverhältnis von markiertem zu unmarkiertem Retinol, -1 korrigiert den Beitrag der Dosis von markiertem Vitamin A zum Vitamin-A-Pool des gesamten Körpers. - Für die Berechnung der Vitamin-A-Gesamtkörperspeicher (TBS) verwenden Sie die grüne Gleichung13
TBS = Fa × S × (1/SAp)
wobei Fa der Anteil der oral markierten Dosis an VA ist, die zum Zeitpunkt t absorbiert und in den austauschbaren Speicherpools des Körpers gefunden wurde, und S das Verhältnis der Retinol-spezifischen Aktivität im Serum zu der in den Speichern zum Zeitpunkt t ist (für Kinder ist Fa × S = 0,642 nach 14 Tagen)21. SAp ist der Anteil der Dosis im Serum pro μmol-Dosis (d. h. [markiertes Retinol] / ([unmarkiertes + markiertes Retinol] im Serum) / orale Dosis von markiertem Retinol (μmol)).
Ergebnisse
Die Injektion von 3 μl einer derivatisierten Probe einer getrockneten Lösung, die etwa 50 pM/μl Kalibranten (Retinol und D 8-Retinol) enthielt, in die GC/MS zeigte kein molekulares Ionen, sondern ein Hauptfragmention bei m/z 268 für Retinol (Abbildung 1) und m/z 278 für D8-Retinol (Abbildung 2). Dies deutet darauf hin, dass die molekularen Ionen des Retinyltrimethylsilylethers, die bei der Derivatisierung von Retinol und D 8-Retinol gebildet werden, unter den bei der GC/MS verwendeten Ionisationsbedingungen nicht stabil sind. Sie zerfallen in kleinere Fragmente, vor allem durch die Alpha-Spaltung. Dieses übliche Fragmentierungsmuster beinhaltet das Aufbrechen der Bindung neben der Trimethylsilylethergruppe. Die Alpha-Spaltung führt zum Verlust der Trimethylsilylgruppe (TMS, die eine Masse von 73 Da hat) und eines Wasserstoffatoms, was zu einem Fragmention mit einer Masse von 268 Da für Retinol und 278 Da fürD-8-Retinol 22 führt. Dieser Mechanismus hilft bei der Identifizierung und Bestätigung des Vorhandenseins von Retinol und seinen Derivaten in der Probe, indem die spezifischen Fragmentionen analysiert werden, die während der Massenspektrometrie erzeugt werden. Die Injektion von Gemischen aus Retinol und D8-Retinol zeigte zwei Hauptfragmentionen bei m/z 268 für Retinol und m/z 276 für D8-Retinol (Abbildung 3), was auf das Vorhandensein dieser Verbindungen in der Probe hinweist. Die Kalibrierkurve wies eine ausgezeichnete Linearität auf, was durch einen hohen Korrelationskoeffizienten (Abbildung 4) angezeigt wird, was zeigt, dass die Beziehung zwischen Peak-Verhältnis und Gewichtsverhältnis ein sehr gerades und vorhersagbares Muster aufweist.
Das GC/MS-Ansprechen, das durch die Injektion von Serumproben erzielt wurde (Serum von Kindern, die eine orale Dosis von 2 mg Retinol-Äquivalenten von D8-Retinol erhielten; Abbildung 5) zeigt das Vorhandensein von Retinol und D8-Retinol, wobei die beiden Hauptfragmentionen bei m/z 268 und m/z 274 beobachtet wurden. Die Ergebnisse nach Extraktion von Ionen und Integration von Peakbereichen bei m/z 274, 275, 276, 277 und 278 für D8-Retinol und bei m/z 268, 269 und 270 für unmarkiertes Retinol sind in Tabelle 5 dargestellt. Diese Ergebnisse sollen in die Olson-Gleichung11 oder die Grüne Gleichung13 integriert werden, um die Vitamin-A-Speicher im Körper zu berechnen.
Die Technik der Verdünnung stabiler Isotope ermöglicht Messungen des Vitamin-A-Spiegels, die mit anderen Methoden nicht erreicht werden können, und ermöglicht so eine genaue Beurteilung des Vitamin-A-Status. Diese Methode ist wertvoll für Ernährungsstudien, klinische Diagnostik und epidemiologische Forschung.

Abbildung 1: Chromatogramm und Massenspektrum von Retinol. Die Abbildung zeigt das Gaschromatographie/Methanelektroneneinfang mit negativem chemischem Ionisations-Massenspektrometrie-Chromatogramm (oberes Bild) aus der Analyse des derivatisierten Retinol-Standards. Die untere Tafel ist ein Massenspektrum, das m/z 268 für Retinol zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
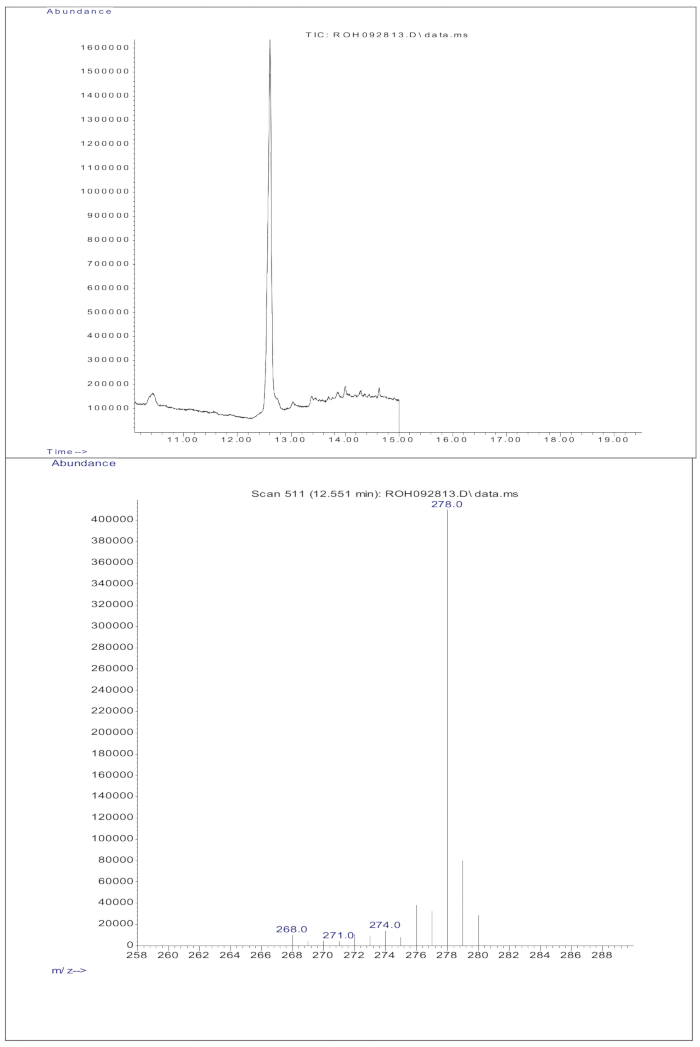
Abbildung 2: Chromatogramm und Massenspektrum von D8-Retinol. Die Abbildung zeigt das Gaschromatographie/Methanelektroneneinfang mit negativem chemischem Ionisations-Massenspektrometrie-Chromatogramm (oberes Bild) aus der Analyse des derivatisierten D8-Retinol-Standards. Die untere Tafel ist ein Massenspektrum, das m/z 278 für D8-Retinol zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Chromatogramm und Massenspektrum eines Retinol- und D8-Retinol-Gemisches. Die Abbildung zeigt das Gaschromatographie/Methanelektroneneinfang negatives chemisches Ionisations-Massenspektrometrie-Chromatogramm (oberes Bild) aus der Analyse eines derivatisierten Gemisches aus Retinol- und D8-Retinol-Standards. Die untere Tafel ist ein Massenspektrum, das m/z 268 für Retinol und m/z 276 für D8-Retinol zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
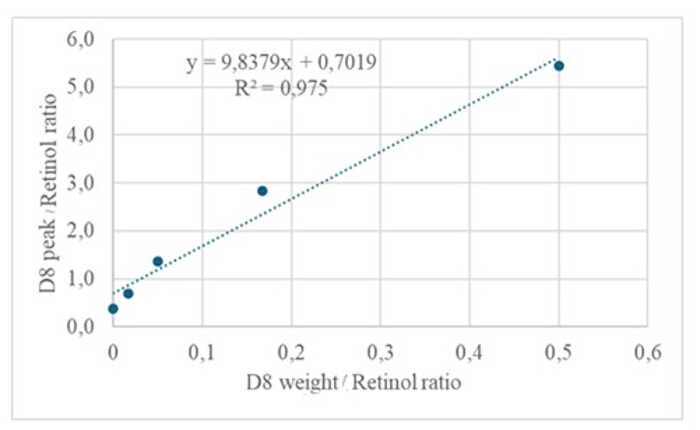
Abbildung 4: Kalibrierkurve. Diese Abbildung veranschaulicht die Beziehung zwischen der GC/MS-Reaktion und der Konzentration von unmarkiertem und markiertem Retinol. Sie wird durch die Gleichung y = 9,8379x + 0,7019 beschrieben, wobei y (die Flächenverhältnisse) die Reaktion des Instruments, 9,8379 die Empfindlichkeit, x (die Gewichtsverhältnisse) die Analytkonzentration und 0,7019 das Hintergrundsignal darstellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
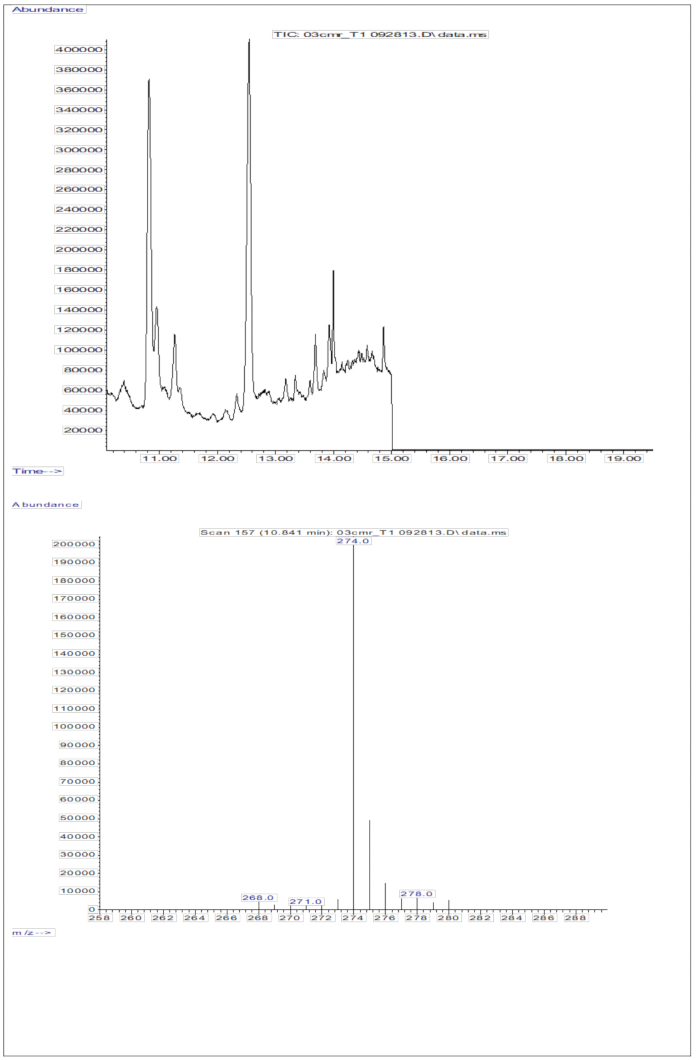
Abbildung 5: Chromatogramm und Massenspektrum der Serumprobe. Diese Abbildung veranschaulicht das Gaschromatographie/Methanelektroneneinfang mit negativem chemischem Ionisations-Massenspektrometrie-Chromatogramm (oberes Bild) aus der Analyse der derivatisierten Retinolfraktion des Serums. Die untere Tafel ist ein Massenspektrum, das m/z 274 für D8-Retinol zeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Norm | Gewicht (mg) | Messkolben (ml) | Lösungsmittel |
| Retinol | 40 | 100 | Ethanol |
| Retinylacetat | 40 | 100 | Ethanol |
| Deuterium-markiertes Retinylacetat | 40 | 100 | Ethanol |
Tabelle 1: Zubereitung der Stammlösung. Diese Tabelle zeigt, wie konzentrierte Lösungen von Retinol und Deuterium-markiertem Retinylacetat hergestellt werden, die dann für zukünftige Experimente auf niedrigere Konzentrationen verdünnt werden können.
| Norm | Stammlösung (ml) | Messkolben (ml) | Lösungsmittel |
| Retinol | 1 | 50 | Ethanol |
| Retinylacetat | 1 | 50 | Ethanol |
| Deuterium-markiertes Retinylacetat | 1 | 50 | Ethanol |
Tabelle 2: Herstellung von verdünnten Stammlösungen. Diese Tabelle zeigt, wie gebrauchsfertige Lösungen aus Retinol und Deuterium-markiertem Retinylacetat hergestellt werden.
| Norm | Wellenlänge (nm) | E1%1 cm |
| Retinol | 325 | 1850 |
| Retinylacetat | 326 | 1550 |
Tabelle 3: Wellenlänge und E1% 1 cm (Absorptionskoeffizient).
| Zeit (min) | Durchfluss (mL/min) | Mobile Phase A (%) | Mobile Phase B (%) |
| 0 – 6 | 1 | 100 | 0 |
| 6 – 13 | 1 | 100 → 50 | 0 → 50 |
| 13 - 18 | 1 | 50 | 50 |
| 18 - 20 | 1 | 50 → 0 | 50 → 100 |
| 20 - 28 | 1 | 0 | 100 |
| 28 - 29 | 1 | 0 → 100 | 100 → 0 |
Tabelle 4: Zeitplan für die mobilen HPLC-Phasen. Diese Tabelle zeigt die geplante Abfolge und Dauer der verschiedenen Phasen während des chromatographischen HPLC-Laufs.
| PST | SD | D | H | |
| Thema 1 | 64030809 | 566089.7 | 0.008763 | 0.991237 |
| Thema 2 | 194354 | 43861.39 | 0.184125 | 0.815875 |
| Thema 3 | 793490 | 80179.28 | 0.091773 | 0.908227 |
| Thema 4 | 2002063 | 45286.7 | 0.02212 | 0.97788 |
| Thema 5 | 80999193 | 355980.7 | 0.004376 | 0.995624 |
| Thema 6 | 32196717.7 | 216152.7 | 0.006669 | 0.993331 |
| Thema 7 | 40905724.5 | 334818.1 | 0.008119 | 0.991881 |
| Thema 8 | 28336711.5 | 218924.1 | 0.007667 | 0.992333 |
| Thema 9 | 8695135.5 | 542077 | 0.058684 | 0.941316 |
| Thema 10 | 103260212 | 1717728 | 0.016363 | 0.983637 |
| SH: Summe der Peakfläche bei m/z 268, 269 und 270 | ||||
| SD: Summe der Peakfläche bei m/z 274, 275, 276, 277 und 278 | ||||
| D: Anreicherung von markiertem Retinol | ||||
| H: Gehalt an unmarkiertem Retinol |
Tabelle 5: Ergebnisse der GC/MS der derivatisierten Retinolfraktion des Serums. Diese Tabelle zeigt die GC/MS-Outputs, die für die Berechnung des Vitamin-A-Gesamtkörperspeichers benötigt werden. H ist die Summe der Peakfläche bei m/z 268, 269 und 270; D ist die Summe der Peakfläche bei m/z 274, 275, 276, 277 und 278; D ist die Anreicherung von markiertem Retinol; H ist der Gehalt an unmarkiertem Retinol; TBS ist Vitamin A Total Body Store.
Diskussion
Die erfolgreiche Implementierung dieses Protokolls hängt von der effektiven Ausführung jedes Schritts ab. Die richtige Vorbereitung von Lösungen und Standards ist entscheidend, um sicherzustellen, dass die gesammelten Daten genau und zuverlässig sind. Die im Protokoll beschriebenen Verfahren wurden in verschiedenen Umgebungen getestet und eignen sich, um Lösungen und Standards zu erhalten, die den Zielen der Probenanalyse entsprechen.
Die Analyse der Proben beginnt mit der Extraktion und Trennung von Retinol im Serum. Die Lagerung der Serumproben bei -80 °C bis zur Analyse ist unerlässlich, um den Abbau von Vitamin A zu verhindern. Darüber hinaus ist das Arbeiten bei schwachem Licht erforderlich16. Das HPLC-Verfahren zur Sammlung der Retinolfraktion ist darauf ausgelegt, Retinol von anderen fettlöslichen Bestandteilen zu trennen, um Störungen im Derivatisierungsprozess zu vermeiden. Es ermöglicht auch die Durchführung von Hunderten von Proben, ohne die Säule zu spülen.
Die aus der HPLC gewonnene Retinolfraktion wird 30 min lang bei 70 °C mit BSTFA derivatisiert. Der Derivatisierungsschritt ist entscheidend für die Verbesserung der Flüchtigkeit von Retinol und seiner Nachweisbarkeit bei GC-MS. Da es wasserempfindlich ist, ist es wichtig, die Probe vor der Derivatisierung vollständig zu trocknen und genügend Zeit für die Derivatisierungsreaktion vor der GC-MS-Analyse zu haben. Es wurde festgestellt, dass der Derivatisierungsprozess mit BSTFA im Vergleich zu dem mit N-Methyl-N-(tert-butyldimethylsilyl)trifluoracetamid (MTBSTFA)23,24 sehr mild und effizient ist und einen sehr scharfen Peak für derivatisiertes Retinol liefert, ohne Tailing oder Hintergrundpeaks im gescannten Massenbereich14. Derivatisiertes Retinol in einer versiegelten Durchstechflasche kann in einem Exsikkator bei 4 °C 1 Monat lang ohne Abbau aufbewahrt werden14.
Für die GC-MS-Analyse ist es entscheidend, die ordnungsgemäße Kalibrierung und Wartung der Säule sicherzustellen und das Injektionsvolumen, die Temperatur und die Durchflussraten zu optimieren. Die hier verwendeten Bedingungen mit der Säuleninjektion zeigten gute und zuverlässige Ergebnisse14. Während der GC-MS-Analyse von deuteriertem und unmarkiertem Retinol beobachteten Tang et al.14 , dass die Peaks von deuteriertem Retinol sowohl in der verabreichten Dosis als auch im Serum von Probanden, die die Dosis erhielten, auftraten. Dieses Muster wurde bei unmarkiertem Retinol nicht beobachtet. Daher kamen sie zu dem Schluss, dass die Peaks von deuteriertem Retinol in der Dosis vorgebildet sind und nicht das Ergebnis der Fragmentierung im Massenspektrometer sind, was darauf hindeutet, dass das deuterierte Retinol seine Struktur während des Stoffwechselprozesses beibehält, was einen zuverlässigen Marker für die Verfolgung von Retinol in biologischen Studien darstellt. Die Anreicherung von deuteriertem Retinol im Serum nach Verabreichung von 2 mg D8-Retinol bei Kindern im Vorschulalter begann nach 7 Stunden zu steigen und erreichte ihren Höhepunkt nach 14 Tagen, was der kürzeren optimalen Probenahmezeitentspricht 25. In 200 μl humanem Serum beträgt die minimal nachweisbare prozentuale Anreicherung von Retinol 0,01 %, was zeigt, dass die Methode empfindlich genug ist, um Serumproben zu analysieren, die von Probanden mit einem breiten Spektrum an Vitamin-A-Status entnommen wurden14.
Während die hier vorgestellte Technik zur Verdünnung stabiler Isotope erhebliche Vorteile für die Beurteilung des Vitamin-A-Status bietet, sollte beachtet werden, dass diese Methode eine ausgeklügelte Ausrüstung und technisches Know-how erfordert, was sie teuer und für den routinemäßigen Einsatz in vielen Umgebungen weniger zugänglich macht26. Daher ist es wichtig, diese Einschränkung zu berücksichtigen, wenn Sie planen, diese Technik zu verwenden.
Offenlegungen
Dieses Manuskript ist Teil einer von der IAEO unterstützten Serie mit dem Titel "Using the Retinol Isotope Dilution Method for Assessing Vitamin A Body Stores and Liver Vitamin A Concentration".
Danksagungen
Wir lernten dieses Protokoll während eines Stipendiums am Carotinoids and Health Laboratory, Jean Mayer USDA Human Nutrition Research Center on Aging, Tufts University, Boston, USA, unter der Aufsicht von Guangwen Tang und mit finanzieller Unterstützung der Internationalen Atomenergiebehörde (IAEO).
Materialien
| Name | Company | Catalog Number | Comments |
| 13x100 mm disposable culture tubes | 99445-13 | PYREX Disposable Rimless Culture Tubes | |
| 16x100 mm disposable culture tubes | 99445-16 | PYREX Disposable Rimless Culture Tubes | |
| 24 Position N-EVAP Nitrogen Evaporator | Organomation Associates, Inc | 11250 | N-EVAP 112, Nitrogen Evaporator, with OA-SYS heating system |
| Acetonitrile | Sigma-Aldrich | 00687 | Acetonitrile, suitable for HPLC, gradient grade, ≥99.9% |
| Amber colored Crimp vials, 2 mL, | SU860033 | Short thread autosampler vial, amber vial 11.6 x 32 mm | |
| Analytical Balance | Mettler Toledo | 30133525 | Precision Balance MS303TS/00 |
| C18 column | Perkin-Elmer Inc | 2580195 | Brownlee Pecosphere RA C18 Cartridge Column - 33 mm x 4.6 mm I.D., Pkg. 5 |
| cap crimper | MilliporeSigma | Z114243 | Hand-operated aluminum cap crimper O.D. 20 mm |
| Capillary column | J & W Scientific | 122-1011 | 15 m × 0.25 mm i.d. fused silica capillary column coated with a DB-1 stationary phase of 0.25 mm film thickness |
| Centrifuge | Sigma 3-18KS | ||
| Chloroform | Sigma-Aldrich | 528730 | Chloroforme, HPLC grade, ≥ 99.9% |
| Conical Flasks: 100 mL, | 4980016 | Borosil Erlenmeyer Flasks Graduated Conical NM Borosilicate | |
| Crimp caps with PTFE seal | Supelco | 27455-U | Crimp seals with PTFE/silicone septa |
| D8-Retinyl acetate | Cambridge Isotope Laboratories Inc. | DLM-2244-PK | Vitamin A acetate 3-4% cis (10, 14, 19, 19, 19, 20, 20, 20-D8, 90%) |
| Dispenser for 1-10 mL | Gilson | F110103 | DISPENSMAN Bottle-top Dispenser |
| Dry Block Heater | Grant | Grant QBH2 High Performance Digital Dry Block Heater | |
| Ethanol | Sigma-Aldrich | 459844 | Ethyl alcohol, Pure, ≥ 99.5%, ACS reagent, 200 proof |
| GC-MS | Agilent | Agilent 7890 A Series Gas Chromatography with 5975C Mass Spectrometer System equipped with a 5975C inert XL EI/CI MSD/DS Turbo CI System, a 7693A Auto?injector Includes transfer turret and a 7693 sample Tray | |
| Glass stoppered volumetric Flasks: 2000 mL | 956854 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 100 mL | 956849 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 1000 mL | 956853 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 25 mL | 956841 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 50 mL | 956847 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 500 mL | 956852 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Helium (highest purity) | Air Liquide | UN 1046 Helium compressed, Class 2.2 | |
| HPLC | Varian | Varian 940LC HPLC with fraction collector | |
| Inserts for crimp vials, 5 mm, 175 μL, | AR0-4521-12 | Verex insert, 5 mm Dia, 175 µl, clear, conical bottom, w/bottom spring | |
| Measuring Cylinders: 100 mL | 213902402 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Measuring Cylinders: 250 mL | 213903604 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Methane (highest purity) | Air Liquide | UN1971 Methane compressed, Class 2.1 | |
| Methanol | Sigma-Aldrich | 34860 | Methanol, suitable for HPLC, ≥ 99.9% |
| N, O-bis(trmethylsilyi)trifluoroacetamide (BSTFA) with 10% Trimethylchlorosilane (TMCS) | Thermo Scientific | 043939.22 | |
| Nitrogen | Produced by Parker Balston NitroVap Generator | ||
| Pasteur Pipettes, glass, | 13-678-20A | Fisherbrand Disposable Borosilicate Glass Pasteur Pipets | |
| Quartz glass Cuvettes | EW-83301-12 | Cole-Parmer Standard Single Quartz Cuvettes | |
| Retinol | Sigma-Aldrich | 17772 | ≥95.0% (HPLC), ~2700 U/mg |
| Retinyl acetate | Sigma-Aldrich | R0635 | analytical standard grade |
| Sodium chloride | Sigma-Aldrich | S9888 | Chlorure de sodium, ACS reagent, ≥ 99.0% |
| Spectrophotometer | Shimadzu | Uvmini-1240 UV-Vis Spectrophotometer | |
| Tetrahydrofuran | Sigma-Aldrich | 439215 | Tetrahydrofurane, HPLC grade, ≥ 99.9%, inhibitor-free |
| Ultrasonic cleaner | Bransonic | CPX-952-339R | Branson CPX Bransonic Ultrasonic Bath |
| Volumetric Pipettes: 100-1000 µL | 3123000063 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.1 | |
| Volumetric Pipettes: 20-200 µL | 3123000055 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.0 | |
| Vortex mixer | Ika | Vortx Genius 3 |
Referenzen
- D'Ambrosio, D., Clugston, R., Blaner, W. Vitamin A metabolism: an update. Nutrients. 3 (1), 63-103 (2011).
- WHO. Global prevalence of vitamin A deficiency in populations at risk 1995-2005. WHO Global Database on Vitamin A Deficiency. , (2009).
- Kraemer, K., et al. Are low tolerable upper intake levels vitamin A undermining effective food fortification efforts. Nutr Rev. 66 (9), 517-525 (2008).
- Allen, L. H., Haskell, M. Estimating the potential for vitamin A toxicity in women and young children. J Nutr. 132 (9 Suppl), 2907S-2919S (2002).
- Filteau, S. M., et al. Influence of morbidity on serum retinol of children in a community-based study in northern Ghana. Am J Clin Nutr. 58 (2), 192-197 (1993).
- Rubin, L. P., Ross, A. C., Stephensen, C. B., Bohn, T., Tanumihardjo, S. A. Metabolic effects of inflammation on vitamin A and carotenoids in humans and animal models. Adv Nutr. 8 (2), 197-212 (2017).
- Suri, D. J., et al. Inflammation adjustments to serum retinol and retinol-binding protein improve specificity but reduce sensitivity when estimating vitamin A deficiency compared with the modified relative dose-response test in Ghanaian children. Curr Dev Nutr. 5 (8), nzab098 (2021).
- Tanumihardjo, S. A. Vitamin A: biomarkers of nutrition for development. Am J Clin Nutr. 94 (2), 658S-665S (2011).
- Furr, H. C., et al. Stable isotope dilution techniques for assessing vitamin A status and bioefficacy of provitamin A carotenoids in humans. Public Health Nutr. 8 (6), 596-607 (2005).
- Haskell, M. J., Ribaya-Mercado, J. D. the Vitamin A Tracer Task Force. Handbook on Vitamin A Tracer Dilution Methods to Assess Status and Evaluate Intervention Programs. Technical Monograph 5. , (2005).
- Furr, H. C., Amedee-Manesme, O., Bergen, H. R., Anderson, D. P., Olson, J. A. Vitamin A concentrations in liver determined by isotope dilution assay with tetradeuterated vitamin A and by biopsy in generally healthy adult humans. Am J Clin Nutr. 49 (4), 713-716 (1989).
- Gannon, B. M., Tanumihardjo, S. A. Comparisons among equations used for retinol isotope dilution in the assessment of total body stores and total liver reserves. J Nutr. 145 (5), 847-854 (2015).
- Green, M. H. Evaluation of the "Olson equation", an isotope dilution method for estimating vitamin A stores. Int J Vitam Nutr Res. 84 (Suppl 1), 9-15 (2014).
- Tang, G., Qin, J., Gregory, G., Dolnikowski, G. G. Deuterium enrichment of retinol in humans determined by gas chromatography electron capture negative chemical ionization mass spectrometry. J Nutr Biochem. 9 (7), 408-414 (1998).
- Tanumihardjo, S., et al. . Appropriate uses of vitamin A tracer (stable isotope) methodology. Vitamin A tracer task force. , (2004).
- Barua, A. B., Furr, H. C. Properties of retinoids: structure, handling, and preparation. Mol Biotechnol. 2 (2), 167-182 (1998).
- Swinehart, D. F. The Beer-Lambert Law. J Chem Edu. 39, 333-335 (1962).
- Barua, A. B., Furr, H. C. Properties of retinoids. Structure, handling, and preparation. Methods Mol Biol. 89, 3-28 (1998).
- Folch, J., Lees, M., Stanley, S. G. H. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Knapp, D. R. . Handbook of analytical derivatization reactions. , (1979).
- Green, M. H., Green, J. B. Use of model-based compartmental analysis and theoretical data to further explore choice of sampling time for assessing vitamin A status in groups and individual human subjects by the retinol isotope dilution method. J Nutr. 157 (7), 2068-2074 (2021).
- Todd, J. F. J. Recommendations for nomenclature and symbolism for mass spectroscopy (including an appendix of terms used in vacuum technology). (Recommendations 1991). Pure and Appl Chem. 63 (10), 1541-1566 (1991).
- Handelman, G. J., Haskell, M. J., Jones, A. D., Clifford, A. J. An improved protocol for determining ratios of retinol-d4 to retinol isolated from human plasma. Anal Chem. 65 (15), 2024-2028 (1993).
- Tang, G., Andrien, B. A., Dolnikowski, G., Russell, R. M. . Methods in Enzymology, Vitamins and Coenzymes. Part L. 282, 140-154 (1997).
- Haskell, M. J., et al. Population-based plasma kinetics of an oral dose of [2H4]retinyl acetate among preschool-age Peruvian children. Am J Clin Nutr. 77 (3), 681-686 (2003).
- Lopez-Teros, V., et al. International experiences in assessing vitamin A status and applying the vitamin A-labeled isotope dilution method. Int J Vitam Nutr Res. 84 (Suppl 1), 40-51 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten