Method Article
تحليل GC-MS لتخصيب الديوتيريوم للريتينول في المصل وتقدير إجمالي مخازن فيتامين أ في الجسم
In This Article
Summary
تتضمن هذه الطريقة استخراج الريتينول من المصل ، وفصله باستخدام HPLC ، وتحديد نظائر الريتينول المصنفة وغير المصنفة باستخدام GC-MS. تستخدم نسبة الريتينول الملصق إلى الريتينول غير الملصق لتقدير إجمالي مخازن الجسم من فيتامين أ.
Abstract
تصف هذه الطريقة تحديد إثراء الديوتيريوم للريتينول في المصل وتقدير مخازن فيتامين أ في الجسم. تتضمن العملية استخراج الريتينول من 0.4 مل من المصل باستخدام 0.5 مل من محلول ملحي 0.85٪ ، و 100 ميكرولتر من المحلول القياسي الداخلي ، و 5 مل من محلول الكلوروفورم والميثانول (2: 1 v / v). بعد الطرد المركزي وإزالة طبقة الكلوروفورم السفلية ، يتم تجفيف الخليط تحت النيتروجين وإعادة تعليقه في 0.1 مل من الإيثانول ، ويتم فصل جزء الريتينول عن المكونات الأخرى باستخدام نظام HPLC المجهز بعمود PE C18. يمكن جمع جزء الريتينول يدويا أو باستخدام مجمع الكسر. بعد ذلك ، يتم تجفيف جزء الريتينول تحت النيتروجين ومشتقه باستخدام O-bis (trimethylsilyl) trifluoroacetamide (BSTFA) الذي يحتوي على 10٪ ثلاثي ميثيل كلوروسيلان. أخيرا ، يتم قياس نظائر الريتينول المصنفة وغير المصنفة باستخدام نظام GC-MS المجهز بعمود شعري ميثيل سيلوكسان 19091z-431 HP-1 ، باستخدام التأين الكيميائي السالب لالتقاط الإلكترون مع الهيليوم كغاز ناقل والميثان كعامل تأين. ثم يتم استخدام نسبة الريتينول المسمى إلى غير المسمى في معادلات أولسون أو جرين أو توازن الكتلة لتقدير مخازن فيتامين أ.
Introduction
فيتامين أ هو عنصر غذائي أساسي ضروري للنظام البصري والحفاظ على وظيفة الخلية من أجل النمو والسلامة الظهارية وإنتاج خلايا الدم الحمراء والمناعة والتكاثر1. ويعد نقص فيتامين ألف مشكلة صحية عمومية خطيرة في جميع أنحاء العالم، ويؤثر على أكثر من 100 بلدان. ويؤثر بشكل غير متناسب على الأطفال الصغار والنساء الحوامل في البلدان المنخفضة الدخل. يعاني ما يقرب من 190 مليون طفل على مستوى العالم من نقص فيتامين ألف، مما يجعله قضية حاسمة للصحة العامة ونموالطفل 2.
واستجابة لهذا الوضع، نفذت عدة برامج منذ عقود في العديد من البلدان المنخفضة الدخل، بما في ذلك التكميل بفيتامين ألف مع توزيع جرعات عالية من فيتامين ألف نصف السنوي على الأطفال دون سن الخامسة وإغناء فيتامين ألف من بعض السلع الغذائية. ومع ذلك، فإن هذه التدخلات غالبا ما تتداخل، مما يعرض بعض السكان لتناول فيتامين A المفرط المزمن غير المقصود3،4. يسلط هذا الخطر المزدوج للنقص والفائض الضوء على الحاجة إلى مؤشر حيوي يمكنه تقييم حالة فيتامين أ بدقة عبر الطيف الكامل ، من النقص إلى السمية ، لتوجيه تقييم البرنامج.
تعتبر المؤشرات الحيوية لفيتامين أ ضرورية لتقييم الحالة التغذوية. المؤشرات الحيوية الأكثر استخداما هي تركيزات الريتينول والبروتين المرتبط بالريتينول في الدم (RBP). ومع ذلك ، من المهم ملاحظة أن هذه المؤشرات الحيوية يمكن قمعها مؤقتا عن طريق الالتهابات والالتهابات ، مما قد يقلل من خصوصية تقييمات فيتامين أ في بعض السكان5،6،7.
في حين أن عينات خزعة الكبد أو تشريح الجثة تعتبر المعيار الذهبي لتقييم حالة فيتامين أ ، فإن المؤشر غير المباشر الأكثر حساسية لإجمالي احتياطيات فيتامين أ في الكبد هو طريقة تخفيف نظائر الريتينول (RID)8. يوفر RID تقديرا كميا لحالة فيتامين A عبر الطيف الكامل ، بدءا من النقص إلى المخازنالمفرطة 9. في معظم التطبيقات البحثية ، تتضمن طريقة RID إعطاء جرعة عن طريق الفم من الديوتيريوم (2ساعة) أو 13أسيتات الريتينيل المسمى C ، والتي تختلط بعد ذلك مع مخازن الجسم على مدى 14 إلى 21 يوما. بعد هذه الفترة ، يتم جمع عينة دم ، ويتم تخزين المصل عند -80 درجة مئوية. ثم يتم تحليل نسبة الريتينول المسمى إلى إجمالي الريتينول باستخدام قياس الطيف الكتلي لتقدير مخازن فيتامين أ10 ، باستخدام معادلة أولسون11 ، أو معادلة توازن الكتلة12 ، أو المعادلة الخضراء13. البروتوكول المقدم في هذه الورقة صالح لإعطاء الديوتيريوم (2ساعة) - أو 13أسيتات الريتينيل المسمى C ويستند إلى عمل تانغ وآخرون 14. الهدف العام من هذه الطريقة هو تقييم ومراقبة حالة فيتامين أ بدقة فيالجسم 11. إنها طريقة قوية توفر تقديرا كميا لتركيزات فيتامين أ عبر مجموعة واسعة من الحالات ، من النقص إلىالزيادة في 15. إنه أكثر دقة ودقة من الطرق الأخرى ، والتي غالبا ما تعتمد على المقاييس غير المباشرة9.
Protocol
تمت الموافقة على البروتوكول من قبل لجنة الأخلاقيات التابعة لوزارة الصحة العامة (رقم 2015/02/550/CE/CNERSH/SP)، وتم الحصول على موافقة مستنيرة من الوالدين/الأوصياء.
ملاحظة: نظرا لأن فيتامين أ حساس للضوء ، فمن الأهمية بمكان أن يتم إجراء جميع الإجراءات في ضوء خافت أو تحت إضاءة الفلورسنت الذهبية16. المواد المستخدمة مفصلة في جدول المواد.
1. تحضير الكواشف
- كلوريد الصوديوم (0.85٪ وزن / حجم): قم بإذابة 0.85 جم كلوريد الصوديوم في ماء مقطر في قارورة حجمية سعة 100 مل. املأ حتى علامة التخرج بالماء المقطر واخلطها.
- الكلوروفورم الميثانول (2: 1 فولت / حجم): نقل 300 مل من الكلوروفورم إلى قارورة حجمية سعة 500 مل باستخدام أسطوانة قياس. أضف 150 مل من الميثانول واخلط.
- المرحلة المتنقلة A ل HPLC: أسيتونيتريل / رباعي هيدروفوران / ماء فائق النقاء (50/20/30 ، حجم / حجم / حجم): نقل 500 مل من الأسيتونيتريل إلى قارورة حجمية سعة 1000 مل. أضف 200 مل من رباعي هيدروفوران و 300 مل من الماء. امزج المحلول ، وقم بتصفيته باستخدام مرشح غشائي بحجم مسام 0.45 ميكرومتر ، وصوتنة (سعة 100٪ ، تردد 40 كيلو هرتز ومدة 15 دقيقة).
- المرحلة المتنقلة B ل HPLC: الأسيتونيتريل / رباعي هيدروفوران / الماء عالي النقاء (50/44/6 ، الحجم الحجمي / الحجم): نقل 500 مل من الأسيتونيتريل إلى قارورة حجمية سعة 1000 مل. أضف 440 مل من رباعي هيدروفوران و 60 مل من الماء. امزج المحلول ، وقم بتصفيته باستخدام مرشح غشائي بحجم مسام 0.45 ميكرومتر ، وصوتي.
2. إعداد الحلول القياسية
- قم بإعداد محلول المخزون عن طريق إذابة 40 مجم من المعيار في الإيثانول في قارورة حجمية سعة 100 مل ، كما هو موضح في الجدول 1. املأ حتى علامة التخرج بالمذيب واخلطه جيدا.
- محاليل المخزون المخفف: قم بإعداد محلول المخزون المخفف عن طريق نقل 1 مل من محلول المخزون إلى قارورة حجمية سعة 50 مل ، كما هو موضح في الجدول 2. املأ حتى علامة التخرج بالمذيب المناسب واخلطه جيدا.
- تحديد تركيز محاليل المخزون المخففة: ضع كمية (1 مل) من المحلول المخفف في أنبوب كوارتز وقم بقياس امتصاصه في مقياس الطيف الضوئي عند الطول الموجي المحدد (الجدول 3) باستخدام الإيثانول كفارغ. احسب باستخدام قانون لامبرتبير 17. تأكد من معايرة مقياس الطيف الضوئي قبل التحليل عن طريق تسخين الجهاز لمدة 15-30 دقيقة ، وتحديد الطول الموجي المطلوب ، وتصفير الجهاز عن طريق وضع الفراغ في حامل العينة. احسب التركيز باستخدام الصيغة التالية:
التركيز = (معامل الامتصاص / الامتصاص) × 106 (ميكروغرام / ديسيلتر)
ملاحظة: لتحويل القيم من الوحدات التقليدية (ميكروغرام / ديسيلتر) إلى وحدات SI (ميكرومول / لتر) ، اضرب القيمة التقليدية في عوامل التحويل التالية: 0.0304 لأسيتات الريتينيل و 0.0349 للريتينول18. - إعداد معايير العمل: باستخدام ماصة حجمية، انقل 2 مل من محاليل المخزون المخففة إلى قارورة مخروطية سعة 100 مل. املأ القارورة حتى علامة التخرج بالإيثانول ، واخلطها جيدا ، وأغلقها بسدادة.
- لتحديد التركيز الدقيق لكل محلول ، قم بتقييم نقاء كل مكون باستخدام HPLC المجهز بعمود C18 وكاشف مصفوفة الصمام الثنائي المضبوطة على 340 نانومتر. قم ببرمجة المضخة لاستخدام المرحلة المتنقلة A والمرحلة المتنقلة B وفقا للجدول الموضح في الجدول 4. تأكد من معايرة نظام HPLC قبل التحليل عن طريق التحقق من صحة المكونات المختلفة مثل المضخة والكاشف وجهاز أخذ العينات التلقائي وأداء النظام بأكمله.
- انقل 1 مل من محاليل المخزون المخففة إلى قوارير تجعيد وحقن العينات في نظام HPLC وفقا للإجراء العادي. حدد النقاء باستخدام المعادلة التالية:
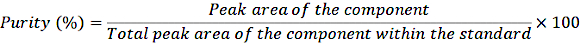
المعادلة 1
مع هذا التصحيح للنقاء ، احسب التركيز الدقيق للمكونات المختلفة في المحلول القياسي.
- تحضير المعيار الداخلي (أسيتات الريتينيل OD ~ 0.2): باستخدام ماصة حجمية، قم بنقل 30 مل من معيار عمل أسيتات الريتينيل إلى قارورة مخروطية سعة 100 مل. املأ القارورة حتى علامة التخرج بالإيثانول ، واخلطها جيدا ، وأغلقها بسدادة.
- تحضير حلول العمل: أضف 20 ميكروغرام من الريتينول غير الملصق إلى 10.00 و 3.33 و 1.00 و 0.33 و 0.00 ميكروغرام من الريتينول الملصق لتوفير نسب الريتينول الملصق وغير الملصق من 0.500 و 0.167 و 0.050 و 0.0167 و 0.00.
3. تحليل العينة
ملاحظة: تم جمع عينات المصل المستخدمة في هذه الدراسةفي اليوم الرابع عشر من الأطفال الذين تلقوا جرعة فموية (2 مجم مكافئ للريتينول) من D8-retinol كجزء من دراسة مصممة لمراقبة وتقييم حالة فيتامين A للأطفال في الكاميرون.
- استخراج الريتينويدات في المصل: يعتمد هذا الاستخراج على عمل Folch et al.19 كما تم تعديله بواسطة Tang et al.14. اتبع الخطوات الموضحة أدناه.
- اسمح لعينات المصل المجمدة بالذوبان برفق في درجة حرارة الغرفة (20-25 درجة مئوية) قبل التحليل. Aliquot 400 ميكرولتر من المصل في أنبوب استزراع يمكن التخلص منه مقاس 16 × 100 مم. أضف 500 ميكرولتر من محلول ملحي 0.85٪ بالإضافة إلى 100 ميكرولتر من المعيار الداخلي و 5 مل من محلول الكلوروفورم والميثانول (2: 1 فولت / حجم).
- دوامة لمدة 30 ثانية وأجهزة الطرد المركزي عند 1157 × جم لمدة 10 دقائق عند 4 درجات مئوية. باستخدام ماصة باستور زجاجية ، قم بإزالة الطبقة السفلية من الكلوروفورم بعناية إلى أنبوب استزراع يمكن التخلص منه مقاس 13 × 100 مم. يجف تحت غاز النيتروجين في حمام مائي (40 درجة مئوية) ويعيد تعليق البقايا في 100 ميكرولتر من الإيثانول. دوامة وسنيكات لمدة 30 ثانية. انقل العينة إلى قارورة تجعيد باستخدام ملحق ، وأغلق البئر ، وقم بتسميته. العينة جاهزة لجمع HPLC retinol.
- قم بإجراء جمع HPLC retinol كما هو موضح أدناه.
- حقن 70 ميكرولتر من كل عينة مصل في نظام HPLC المجهز بعمود C18 وكاشف مصفوفة الصمام الثنائي المضبوطة على 340 نانومتر. قم ببرمجة المضخة لتوصيل المرحلتين المتنقلتين A و B بمعدل تدفق ثابت يبلغ 1 مل / دقيقة ، وفقا للجدول الموضح في الجدول 4.
- قبل حقن عينات المصل ، قم بحقن 70 ميكرولتر من محلول عمل الريتينول في نظام HPLC وسجل وقت الاحتفاظ بذروة الريتينول. بعد ذلك ، قم بإعداد مجمع الكسور لجمع جزء الريتينول المغطى ضمن نطاق محدد في أنبوب سعة 5 مل باستخدام سدادة زجاجية أرضية. في هذه الحالة ، تم جمع جزء الريتينول على مدى 3 دقائق ، من 7.5-10.5 دقيقة.
ملاحظة: يمكن أيضا حساب تركيز الريتينول في هذه الخطوة باستخدام منحنى معايرة معايير الريتينول ومعدل الاسترداد الذي تم الحصول عليه من المعيار الداخلي.
- إجراء اشتقاق الريتينول كما هو موضح أدناه.
- جفف جزء الريتينول الذي تم جمعه من HPLC تحت غاز النيتروجين في حمام مائي عند 40 درجة مئوية لمدة 3 ساعات على الأقل. أضف الإيثانول لتسهيل تبخر الرطوبة أثناء التجفيف (يجب أن تكون العينات جافة تماما ، لأن الاشتقاق حساس للرطوبة). أضف 20 ميكرولتر من BSTFA مع 10٪ TMCS إلى الأنبوب.
- ضع الأنبوب في سخان كتلة جافة مضبوطة على 70 درجة مئوية واحتضنه لمدة 30 دقيقة. باستخدام ماصة باستور زجاجية ، انقل خليط التفاعل إلى قارورة تجعيد باستخدام ملحق ، وأغلقها بإحكام بغطاء تجعيد باستخدام غطاء مكشكش وملصق. العينة جاهزة الآن لتحليل GC / MS ، ويمكن تخزينها في مجفف عند 4 درجات مئوية حتى التحليل.
- بالإضافة إلى ذلك ، قم بتجفيف مجموعة 100 ميكرولتر من الحلول القياسية العاملة واشتقاقها كما هو موضح أعلاه لمعايرة GC / MS.
ملاحظة: يتضمن اشتقاق الريتينول باستخدام BSTFA تفاعلا كيميائيا حيث يتم استبدال مجموعة الهيدروكسيل (-OH) من الريتينول بمجموعة ثلاثي ميثيل سيليل (-Si (CH3) 3) ، لتشكيل إيثر ثلاثي ميثيل سيليل الريتينيل. تعزز هذه العملية تقلب الريتينول واستقراره ، مما يجعله أكثر ملاءمة لتحليل GC / MS20.
- تحليل GC / MS: يتم إجراء تحليل GC / MS باستخدام الإجراء الموصوف من قبل Tang et al.14. اتبع الخطوات الموضحة أدناه.
- قم بحقن 3 ميكرولتر من عينة الريتينول المشتقة باستخدام جهاز أخذ العينات الآلي في GC باستخدام حاقن بارد على العمود متصل من خلال موصل صفري الحجم الميت بعمود شعري من السيليكا المنصهر بقطر داخلي 15 م × 0.25 مم مطلي بطور ثابت DB-1 بسمك فيلم 0.25 ميكرومتر.
- قم ببرمجة فرن العمود ودرجات حرارة الحاقن على العمود لزيادة من 50 درجة مئوية إلى 285 درجة مئوية بمعدل 15 درجة مئوية / دقيقة ، واضبط درجة حرارة واجهة GC / MS على 285 درجة مئوية. استخدم الهيليوم كغاز ناقل لتصفية مشتق ثلاثي ميثيل سيليل من الريتينول على مدار 12 دقيقة تقريبا.
- اكتشف شطف GC باستخدام مطياف كتلة رباعي الأقطاب باستخدام التأين الكيميائي للأيون سالب الميثان 0.5 torr ، مع ضبط درجة حرارة مصدر الأيونات على 150 درجة مئوية. اضبط مطياف الكتلة على المسح الضوئي بين 260 و 280 دالتون.
4. تحليل البيانات
- استخدم برنامج تحليل بيانات GC/MS.
- استخرج جميع الأيونات المرغوبة بناء على نسب الكتلة إلى الشحنة (م / ز) ، ودمج منطقة الذروة (استخدم التكامل اليدوي لضبط نقطتي البداية والنهاية للذروة) ونقل النتائج إلى ملف جدول بيانات.
ملاحظة: اعتمادا على النظير المستخدم ، ستكون الأيونات المرغوبة على النحو التالي: 268-270 م / ز للريتينول الأصلي. 271-274 م / ز ل [2H4] -الريتينول ؛ 278-280 م / z ل [13درجة مئوية] - الريتينول ؛ و 276-280 م / ز ل [2H8] -الريتينول. - احسب مجموع القمم للريتينول المسمى (ΣD) بإضافة مساحة الذروة عند m / z 274 و 275 و 276 و 277 و 278. احسب مجموع القمم للريتينول غير المسمى (ΣH) بإضافة مساحة الذروة عند m / z 268 و 269 و 270.
- احسب تخصيب الريتينول المسمى (D) باستخدام المعادلة التالية: D = ΣD / (ΣH + ΣD). احسب كمية الريتينول غير المسمى (H) باستخدام المعادلة التالية: H = 1 - D.
ملاحظة: الكروماتوغرافيا الغازية التقاط الإلكترون مقياس الطيف الكتلي للتأين الكيميائي السلبي للإثير الريتينيل لا يعطي أي أيون جزيئي ولكن أيون شظية رئيسي عند m / z 268 إلى 271 للريتينول غير المسمى ، عند m / z 272 إلى 275 ل D4-retinol ، وفي m / z 276 إلى 280 ل D8-retinol14. - للتحكم في النظام ، احسب معادلة انحدار خطي بين نسب الوزن لمعايير المعايرة والمناطق المتكاملة للريتينول المسمى والريتينول غير المصنف.
5. تقدير مخازن فيتامين أ
ملاحظة: تسمح هذه الخطوة بتقييم حالة فيتامين أ لدى الفرد.
- احسب إجمالي مخزون الكبد من فيتامين أ باستخدام معادلة أولسون11
إجمالي مخازن الكبد بفيتامين أ = F × الجرعة × [S × a x (H / D - 1)]
حيث F هو عامل لكفاءة امتصاص وتخزين الجرعة المعطاة عن طريق الفم (F = 0.50) ، الجرعة هي كمية فيتامين A المسمى التي تعطى عن طريق الفم (μmol) ، S هو عامل يصحح عدم المساواة في نسبة البلازما إلى الكبد من الريتينول الموسوم إلى الريتينول غير المصنف (S = 0.65) ، A هو عامل يصحح الفقدان الذي لا رجعة فيه لفيتامين A المسمى خلال فترة الخلط ؛ على وجه التحديد, أ = e-kt, حيث K هو المعدل التقويضي الجزئي للنظام المقدر (K = ln 2/32 أيام للأطفال), و t هو الوقت, معبرا عنه كأيام منذ الجرعة; D / H هي نسبة نظائر المصل للريتينول المسمى إلى الريتينول غير المسمى ، -1 يصحح مساهمة جرعة فيتامين A المسمى في إجمالي مجموعة فيتامين A في الجسم. - لحساب إجمالي مخازن الجسم (TBS) ، استخدم المعادلة الخضراء13
TBS = Fa × S × (1 / SAp)
حيث Fa هو جزء من الجرعة المسماة عن طريق الفم من VA التي يتم امتصاصها والعثور عليها في أحواض التخزين القابلة للتبديل في الجسم في الوقت t ، و S هي نسبة النشاط الخاص بالريتينول في المصل إلى ذلك الموجود في المخازن في الوقت t (للأطفال ، Fa × S = 0.642 في 14 يوما)21. SAp هو جزء من الجرعة في المصل لكل جرعة ميكرومول (أي [الريتينول المسمى] / ([الريتينول غير المسمى + المسمى] في المصل) / الجرعة الفموية من الريتينول المسمى (ميكرومول)).
النتائج
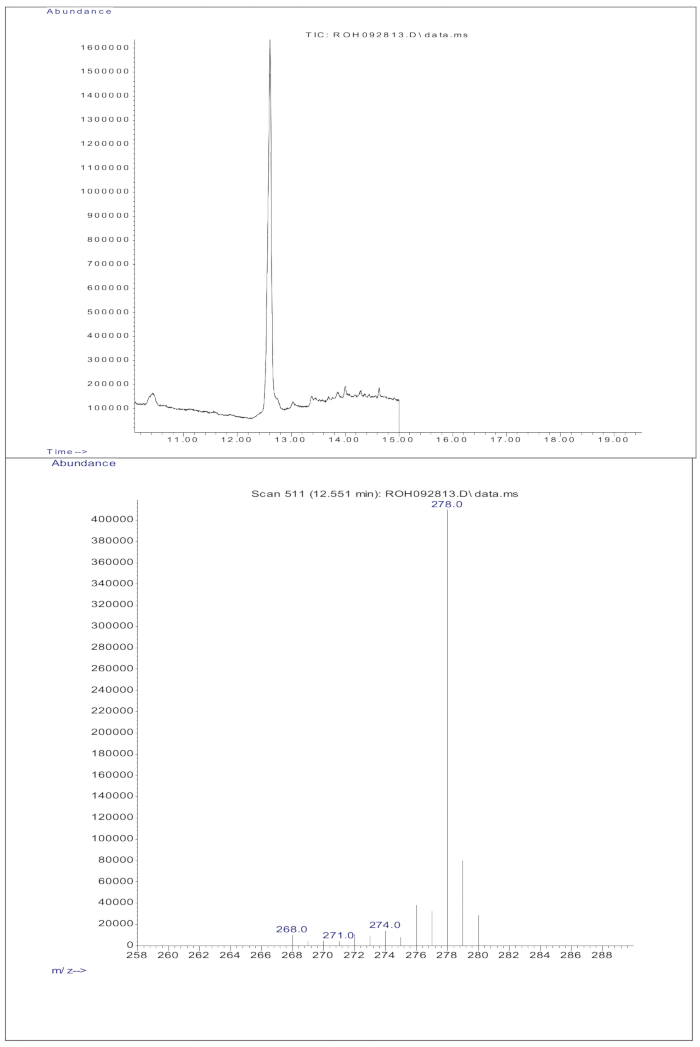
لم يظهر حقن 3 ميكرولتر من عينة مشتقة من محلول مجفف يحتوي على ما يقرب من 50 جزء من الميلي والأسود من العيار (الريتينول و D 8-الريتينول) في GC / MS عدم وجود أيون جزيئي ولكنه أظهر أيون شظية رئيسي عند m / z 268 للريتينول (الشكل 1) و m / z 278 ل D8-retinol (الشكل 2). يشير هذا إلى أن الأيونات الجزيئية لإثير الريتينيل ثلاثي ميثيل سيليل ، التي تشكلت أثناء اشتقاق الريتينول و D 8-الريتينول ، ليست مستقرة في ظل ظروف التأين المستخدمة في GC / MS. تتحلل إلى أجزاء أصغر ، في المقام الأول من خلال انقسام ألفا. يتضمن نمط التجزئة الشائع هذا كسر الرابطة المجاورة لمجموعة ثلاثي ميثيل سيليل الأثير. ينتج عن انقسام ألفا فقدان مجموعة ثلاثي ميثيل سيليل (TMS ، التي تبلغ كتلتها 73 Da) وذرة الهيدروجين ، مما يؤدي إلى أيون شظية كتلته 268 Da للريتينول و 278 Da ل D 8-retinol22. تساعد هذه الآلية في تحديد وتأكيد وجود الريتينول ومشتقاته في العينة من خلال تحليل أيونات الشظايا المحددة الناتجة أثناء قياس الطيف الكتلي. أظهر حقن مخاليط الريتينول و D8-الريتينول اثنين من الأيونات الشظية الرئيسية عند m / z 268 للريتينول و m / z 276 ل D8-retinol (الشكل 3) ، مما يشير إلى وجود هذه المركبات في العينة. أظهر منحنى المعايرة خطية ممتازة ، كما يتضح من معامل ارتباط مرتفع (الشكل 4) ، مما يدل على أن العلاقة بين نسبة الذروة ونسبة الوزن لها نمط مستقيم للغاية ويمكن التنبؤ به.
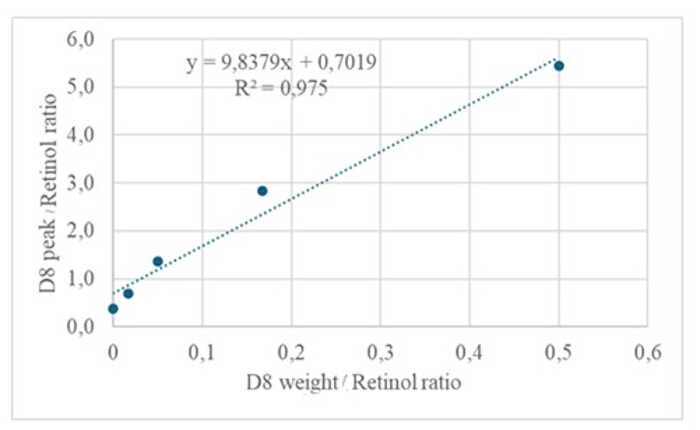
استجابة GC / MS التي تم الحصول عليها من حقن عينات المصل (مصل من الأطفال الذين تلقوا جرعة فموية من 2 مجم من الريتينول مكافئ D8-retinol; الشكل 5) يظهر وجود الريتينول و D8-الريتينول ، مع ملاحظة أيونات الشظايا الرئيسية عند M / Z 268 و m / z 274. النتائج التي تم الحصول عليها بعد استخراج الأيونات وتكامل مناطق الذروة عند m / z 274 و 275 و 276 و 277 و 278 ل D8-retinol وعند m / z 268 و 269 و 270 للريتينول غير المسمى معروضة في الجدول 5. يجب دمج هذه النتائج في معادلة أولسون11 أو المعادلة الخضراء13 لحساب مخازن فيتامين أ في الجسم.
توفر تقنية تخفيف النظائر المستقرة قياسات لمستويات فيتامين A التي لا يمكن الحصول عليها بطرق أخرى ، مما يتيح إجراء تقييمات دقيقة لحالة فيتامين A. هذه الطريقة ذات قيمة للدراسات الغذائية والتشخيص السريري والبحوث الوبائية.

الشكل 1: الكروماتوجرام والطيف الكتلي للريتينول. يوضح الشكل كروماتوغرافيا الغاز / إلكترون الميثان يلتقط كروماتوجرام التأين الكيميائي السالب - مطياف الكتلة (اللوحة العلوية) من تحليل معيار الريتينول المشتق. اللوحة السفلية عبارة عن طيف كتلي يظهر m / z 268 للريتينول. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 2: الكروماتوجرام والطيف الكتلي ل D8-الريتينول. يوضح الشكل كروماتوغرافيا الغاز / التقاط إلكترون الميثان ، مخطط كروماتوجرام التأين الكيميائي السلبي - قياس الطيف الكتلي (اللوحة العلوية) من تحليل معيار D8-retinol المشتق. اللوحة السفلية عبارة عن طيف كتلي يظهر m / z 278 ل D8-retinol. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: الكروماتوجرام والطيف الكتلي لخليط الريتينول و D8-الريتينول. يوضح الشكل كروماتوغرافيا الغاز / التقاط إلكترون الميثان التأين الكيميائي السالب - مخطط الطيف الكتلي (اللوحة العلوية) من تحليل خليط مشتق من معايير الريتينول و D8-الريتينول. اللوحة السفلية عبارة عن طيف كتلي يظهر m / z 268 للريتينول و m / z 276 ل D8-retinol. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 4: منحنى المعايرة. يوضح هذا الشكل العلاقة بين استجابة GC / MS وتركيز الريتينول غير المسمى والمصنف. يتم وصفها بالمعادلة y = 9.8379x + 0.7019 ، حيث يمثل y (نسب المساحة) استجابة الأداة ، و 9.8379 هي الحساسية ، و x (نسب الوزن) تمثل تركيز المادة المراد تحليلها ، و 0.7019 هي إشارة الخلفية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
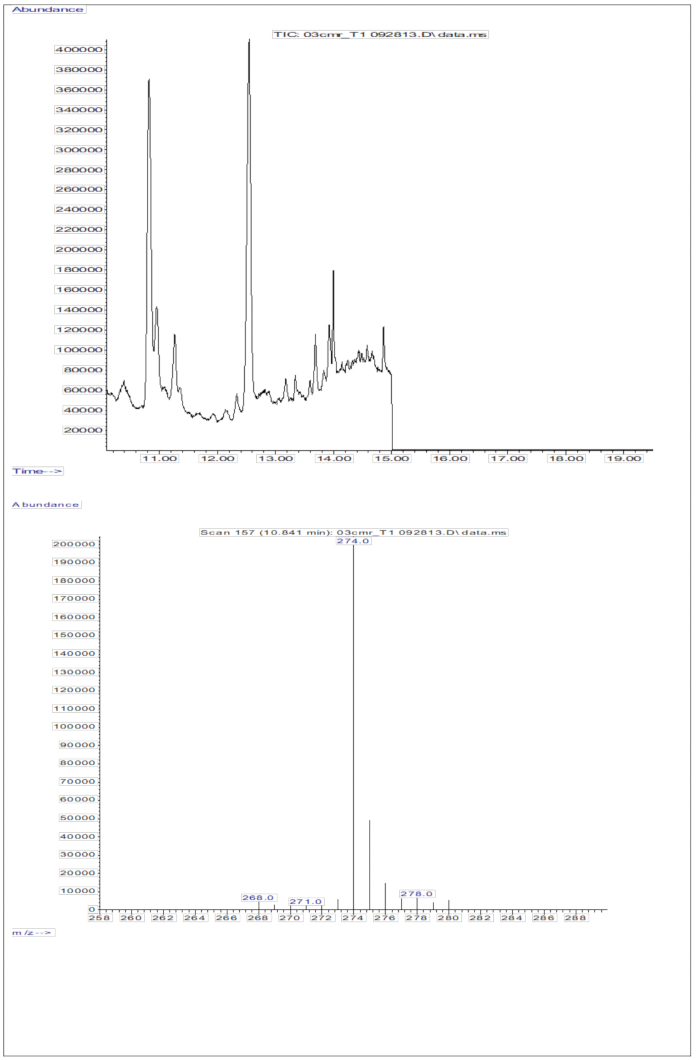
الشكل 5: الكروماتوجرام والطيف الكتلي لعينة المصل. يوضح هذا الشكل كروماتوغرافيا الغاز / إلكترون الميثان ، والتقاط كروماتوجرام التأين الكيميائي السالب - مطياف الكتلة (اللوحة العلوية) من تحليل جزء الريتينول المشتق من المصل. اللوحة السفلية عبارة عن طيف كتلي يظهر m / z 274 ل D8-retinol. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| معيار | الوزن (مجم) | قارورة حجمية (مل) | المذيبات |
| الريتينول | 40 | 100 | ايثانول |
| أسيتات الريتينيل | 40 | 100 | ايثانول |
| أسيتات الريتينيل المسمى بالديوتيريوم | 40 | 100 | ايثانول |
الجدول 1: تحضير محلول المخزون. يوضح هذا الجدول كيفية تحضير المحاليل المركزة من الريتينول وخلات الريتينيل المسمى بالديوتيريوم، والتي يمكن تخفيفها بعد ذلك إلى تركيزات أقل للتجارب المستقبلية.
| معيار | محلول المخزون (مل) | قارورة حجمية (مل) | المذيبات |
| الريتينول | 1 | 50 | ايثانول |
| أسيتات الريتينيل | 1 | 50 | ايثانول |
| أسيتات الريتينيل المسمى بالديوتيريوم | 1 | 50 | ايثانول |
الجدول 2: تحضير محاليل المخزون المخففة. يوضح هذا الجدول كيفية تحضير محاليل جاهزة للاستخدام من الريتينول وخلات الريتينيل المسمى بالديوتيريوم.
| معيار | الطول الموجي (نانومتر) | E1٪ 1 سم |
| الريتينول | 325 | 1850 |
| أسيتات الريتينيل | 326 | 1550 |
الجدول 3: الطول الموجي و E1٪ 1 سم (معامل الامتصاص).
| الوقت (دقيقة) | التدفق (مل / دقيقة) | المرحلة المتنقلة أ (٪) | المرحلة المتنقلة ب (٪) |
| 0 – 6 | 1 | 100 | 0 |
| 6 – 13 | 1 | 100 → 50 | 0 → 50 |
| 13 - 18 | 1 | 50 | 50 |
| 18 - 20 | 1 | 50 → 0 | 50 → 100 |
| 20 - 28 | 1 | 0 | 100 |
| 28 - 29 | 1 | 0 → 100 | 100 → 0 |
الجدول 4: الجدول الزمني لمراحل HPLC المتنقلة. يوضح هذا الجدول التسلسل المخطط ومدة المراحل المختلفة أثناء التشغيل الكروماتوغرافي HPLC.
| الشيخ | [سد] | D | H | |
| المادة 1 | 64030809 | 566089.7 | 0.008763 | 0.991237 |
| الموضوع 2 | 194354 | 43861.39 | 0.184125 | 0.815875 |
| الموضوع 3 | 793490 | 80179.28 | 0.091773 | 0.908227 |
| الموضوع 4 | 2002063 | 45286.7 | 0.02212 | 0.97788 |
| الموضوع 5 | 80999193 | 355980.7 | 0.004376 | 0.995624 |
| الموضوع 6 | 32196717.7 | 216152.7 | 0.006669 | 0.993331 |
| المادة 7 | 40905724.5 | 334818.1 | 0.008119 | 0.991881 |
| المادة 8 | 28336711.5 | 218924.1 | 0.007667 | 0.992333 |
| المادة 9 | 8695135.5 | 542077 | 0.058684 | 0.941316 |
| المادة 10 | 103260212 | 1717728 | 0.016363 | 0.983637 |
| SH: مجموع مساحة الذروة عند m/z 268 و 269 و 270 | ||||
| SD: مجموع مساحة الذروة عند m/z 274 و 275 و 276 و 277 و 278 | ||||
| د: إثراء الريتينول المسمى | ||||
| H: مستوى الريتينول غير المسمى |
الجدول 5: نتائج GC / MS لجزء الريتينول المشتق من المصل. يبين هذا الجدول مخرجات GC / MS اللازمة لحساب مخزن الجسم الكلي لفيتامين A. H هو مجموع مساحة الذروة عند m / z 268 و 269 و 270 ؛ D هو مجموع مساحة الذروة عند m / z 274 و 275 و 276 و 277 و 278. D هو إثراء الريتينول المسمى. H هو مستوى الريتينول غير المسمى. TBS هو فيتامين أ مخزن الجسم بالكامل.
Discussion
يعتمد التنفيذ الناجح لهذا البروتوكول على التنفيذ الفعال لكل خطوة. يعد الإعداد السليم للحلول والمعايير أمرا بالغ الأهمية لضمان دقة البيانات التي تم جمعها وموثوقيتها. تم اختبار الإجراءات الموضحة في البروتوكول في بيئات مختلفة وهي مناسبة للحصول على حلول ومعايير تلبي أهداف تحليل العينات.
يبدأ تحليل العينات باستخراج وفصل الريتينول في المصل. تخزين عينات المصل عند -80 درجة مئوية حتى يكون التحليل ضروريا لمنع تدهور فيتامين أ. بالإضافة إلى ذلك ، من الضروري العمل في الضوء الخافت16. تم تصميم إجراء HPLC المستخدم لجمع جزء الريتينول لفصل الريتينول عن المكونات الأخرى القابلة للذوبان في الدهون لتجنب التدخل في عملية الاشتقاق. كما يسمح بتشغيل مئات العينات دون مسح العمود.
يتم اشتقاق جزء الريتينول الذي تم جمعه من HPLC باستخدام BSTFA عند 70 درجة مئوية لمدة 30 دقيقة. تعد خطوة الاشتقاق أمرا بالغ الأهمية لتحسين تقلب الريتينول وقابليته للكشف عنه في GC-MS. نظرا لأنه حساس للماء ، فمن الضروري تجفيف العينة تماما قبل الاشتقاق وإتاحة الوقت الكافي لحدوث تفاعل الاشتقاق قبل تحليل GC-MS. لوحظ أن عملية الاشتقاق باستخدام BSTFA خفيفة وفعالة للغاية مقارنة بتلك التي تستخدم N-methyl-N- (tert-butyldimethylsilyl) trifluoroacetamide (MTBSTFA) 23،24 وتوفر ذروة حادة جدا للريتينول المشتق ، مع عدم وجود قمم مخلفات أو خلفية في نطاق الكتلة الممسوحة ضوئيا14. يمكن حفظ الريتينول المشتق في قارورة محكمة الغلق في مجفف عند 4 درجات مئوية لمدة شهر واحد دون تحلل14.
بالنسبة لتحليل GC-MS ، من الأهمية بمكان ضمان المعايرة والصيانة المناسبة للعمود ، وتحسين حجم الحقن ودرجة الحرارة ومعدلات التدفق. أظهرت الظروف المستخدمة هنا مع الحقن على العمود نتائج جيدةوموثوقة 14. أثناء تحليل GC-MS للريتينول المنزوع وغير المسمى ، لاحظ Tang et al.14 أن قمم الريتينول المنزوع ظهرت في كل من الجرعة المعطاة وفي مصل الأشخاص الذين تلقوا الجرعة. لم يشاهد هذا النمط مع الريتينول غير المسمى. لذلك ، خلصوا إلى أن قمم الريتينول المنزوع تشكلت مسبقا في الجرعة وليست نتيجة للتجزئة في مطياف الكتلة ، مما يشير إلى أن الريتينول المنزوع يحافظ على هيكله من خلال عملية التمثيل الغذائي ، مما يوفر علامة موثوقة لتتبع الريتينول في الدراسات البيولوجية. بدأ إثراء الريتينول المنزوع في المصل بعد إعطاء 2 مجم من D8-retinol في الأطفال في سن ما قبل المدرسة في الزيادة في 7 ساعات ووصل إلى ذروته في 14 يوما ، وهو أقصر وقت أخذ العيناتالأمثل 25. في 200 ميكرولتر من المصل البشري ، يبلغ الحد الأدنى من نسبة تخصيب الريتينول التي يمكن اكتشافها 0.01٪ ، مما يدل على أن الطريقة حساسة بما يكفي لتحليل عينات المصل التي تم جمعها من الأشخاص الذين لديهم مجموعة واسعة من حالات فيتامينأ 14.
في حين أن تقنية تخفيف النظائر المستقرة المعروضة هنا توفر مزايا كبيرة لتقييم حالة فيتامين A ، تجدر الإشارة إلى أن هذه الطريقة تتطلب معدات متطورة وخبرة فنية ، مما يجعلها باهظة الثمن وأقل سهولة للاستخدام الروتيني في العديد من الإعدادات26. لذلك ، من الضروري مراعاة هذا القيد عند التخطيط لاستخدام هذه التقنية.
Disclosures
هذه المخطوطة جزء من سلسلة بعنوان "استخدام طريقة تخفيف نظائر الريتينول لتقييم مخازن الجسم لفيتامين A وتركيز فيتامين A في الكبد بدعم من الوكالة الدولية للطاقة الذرية.
Acknowledgements
تعلمنا هذا البروتوكول خلال زمالة في مختبر الكاروتينات والصحة ، مركز جان ماير لأبحاث التغذية البشرية التابع لوزارة الزراعة الأمريكية حول الشيخوخة ، جامعة تافتس ، بوسطن ، الولايات المتحدة الأمريكية ، تحت إشراف قوانغوين تانغ وبدعم مالي من الوكالة الدولية للطاقة الذرية (IAEA).
Materials
| Name | Company | Catalog Number | Comments |
| 13x100 mm disposable culture tubes | 99445-13 | PYREX Disposable Rimless Culture Tubes | |
| 16x100 mm disposable culture tubes | 99445-16 | PYREX Disposable Rimless Culture Tubes | |
| 24 Position N-EVAP Nitrogen Evaporator | Organomation Associates, Inc | 11250 | N-EVAP 112, Nitrogen Evaporator, with OA-SYS heating system |
| Acetonitrile | Sigma-Aldrich | 00687 | Acetonitrile, suitable for HPLC, gradient grade, ≥99.9% |
| Amber colored Crimp vials, 2 mL, | SU860033 | Short thread autosampler vial, amber vial 11.6 x 32 mm | |
| Analytical Balance | Mettler Toledo | 30133525 | Precision Balance MS303TS/00 |
| C18 column | Perkin-Elmer Inc | 2580195 | Brownlee Pecosphere RA C18 Cartridge Column - 33 mm x 4.6 mm I.D., Pkg. 5 |
| cap crimper | MilliporeSigma | Z114243 | Hand-operated aluminum cap crimper O.D. 20 mm |
| Capillary column | J & W Scientific | 122-1011 | 15 m × 0.25 mm i.d. fused silica capillary column coated with a DB-1 stationary phase of 0.25 mm film thickness |
| Centrifuge | Sigma 3-18KS | ||
| Chloroform | Sigma-Aldrich | 528730 | Chloroforme, HPLC grade, ≥ 99.9% |
| Conical Flasks: 100 mL, | 4980016 | Borosil Erlenmeyer Flasks Graduated Conical NM Borosilicate | |
| Crimp caps with PTFE seal | Supelco | 27455-U | Crimp seals with PTFE/silicone septa |
| D8-Retinyl acetate | Cambridge Isotope Laboratories Inc. | DLM-2244-PK | Vitamin A acetate 3-4% cis (10, 14, 19, 19, 19, 20, 20, 20-D8, 90%) |
| Dispenser for 1-10 mL | Gilson | F110103 | DISPENSMAN Bottle-top Dispenser |
| Dry Block Heater | Grant | Grant QBH2 High Performance Digital Dry Block Heater | |
| Ethanol | Sigma-Aldrich | 459844 | Ethyl alcohol, Pure, ≥ 99.5%, ACS reagent, 200 proof |
| GC-MS | Agilent | Agilent 7890 A Series Gas Chromatography with 5975C Mass Spectrometer System equipped with a 5975C inert XL EI/CI MSD/DS Turbo CI System, a 7693A Auto?injector Includes transfer turret and a 7693 sample Tray | |
| Glass stoppered volumetric Flasks: 2000 mL | 956854 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 100 mL | 956849 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 1000 mL | 956853 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 25 mL | 956841 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 50 mL | 956847 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 500 mL | 956852 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Helium (highest purity) | Air Liquide | UN 1046 Helium compressed, Class 2.2 | |
| HPLC | Varian | Varian 940LC HPLC with fraction collector | |
| Inserts for crimp vials, 5 mm, 175 μL, | AR0-4521-12 | Verex insert, 5 mm Dia, 175 µl, clear, conical bottom, w/bottom spring | |
| Measuring Cylinders: 100 mL | 213902402 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Measuring Cylinders: 250 mL | 213903604 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Methane (highest purity) | Air Liquide | UN1971 Methane compressed, Class 2.1 | |
| Methanol | Sigma-Aldrich | 34860 | Methanol, suitable for HPLC, ≥ 99.9% |
| N, O-bis(trmethylsilyi)trifluoroacetamide (BSTFA) with 10% Trimethylchlorosilane (TMCS) | Thermo Scientific | 043939.22 | |
| Nitrogen | Produced by Parker Balston NitroVap Generator | ||
| Pasteur Pipettes, glass, | 13-678-20A | Fisherbrand Disposable Borosilicate Glass Pasteur Pipets | |
| Quartz glass Cuvettes | EW-83301-12 | Cole-Parmer Standard Single Quartz Cuvettes | |
| Retinol | Sigma-Aldrich | 17772 | ≥95.0% (HPLC), ~2700 U/mg |
| Retinyl acetate | Sigma-Aldrich | R0635 | analytical standard grade |
| Sodium chloride | Sigma-Aldrich | S9888 | Chlorure de sodium, ACS reagent, ≥ 99.0% |
| Spectrophotometer | Shimadzu | Uvmini-1240 UV-Vis Spectrophotometer | |
| Tetrahydrofuran | Sigma-Aldrich | 439215 | Tetrahydrofurane, HPLC grade, ≥ 99.9%, inhibitor-free |
| Ultrasonic cleaner | Bransonic | CPX-952-339R | Branson CPX Bransonic Ultrasonic Bath |
| Volumetric Pipettes: 100-1000 µL | 3123000063 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.1 | |
| Volumetric Pipettes: 20-200 µL | 3123000055 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.0 | |
| Vortex mixer | Ika | Vortx Genius 3 |
References
- D'Ambrosio, D., Clugston, R., Blaner, W. Vitamin A metabolism: an update. Nutrients. 3 (1), 63-103 (2011).
- WHO. Global prevalence of vitamin A deficiency in populations at risk 1995-2005. WHO Global Database on Vitamin A Deficiency. , (2009).
- Kraemer, K., et al. Are low tolerable upper intake levels vitamin A undermining effective food fortification efforts. Nutr Rev. 66 (9), 517-525 (2008).
- Allen, L. H., Haskell, M. Estimating the potential for vitamin A toxicity in women and young children. J Nutr. 132 (9 Suppl), 2907S-2919S (2002).
- Filteau, S. M., et al. Influence of morbidity on serum retinol of children in a community-based study in northern Ghana. Am J Clin Nutr. 58 (2), 192-197 (1993).
- Rubin, L. P., Ross, A. C., Stephensen, C. B., Bohn, T., Tanumihardjo, S. A. Metabolic effects of inflammation on vitamin A and carotenoids in humans and animal models. Adv Nutr. 8 (2), 197-212 (2017).
- Suri, D. J., et al. Inflammation adjustments to serum retinol and retinol-binding protein improve specificity but reduce sensitivity when estimating vitamin A deficiency compared with the modified relative dose-response test in Ghanaian children. Curr Dev Nutr. 5 (8), nzab098 (2021).
- Tanumihardjo, S. A. Vitamin A: biomarkers of nutrition for development. Am J Clin Nutr. 94 (2), 658S-665S (2011).
- Furr, H. C., et al. Stable isotope dilution techniques for assessing vitamin A status and bioefficacy of provitamin A carotenoids in humans. Public Health Nutr. 8 (6), 596-607 (2005).
- Haskell, M. J., Ribaya-Mercado, J. D. the Vitamin A Tracer Task Force. Handbook on Vitamin A Tracer Dilution Methods to Assess Status and Evaluate Intervention Programs. Technical Monograph 5. , (2005).
- Furr, H. C., Amedee-Manesme, O., Bergen, H. R., Anderson, D. P., Olson, J. A. Vitamin A concentrations in liver determined by isotope dilution assay with tetradeuterated vitamin A and by biopsy in generally healthy adult humans. Am J Clin Nutr. 49 (4), 713-716 (1989).
- Gannon, B. M., Tanumihardjo, S. A. Comparisons among equations used for retinol isotope dilution in the assessment of total body stores and total liver reserves. J Nutr. 145 (5), 847-854 (2015).
- Green, M. H. Evaluation of the "Olson equation", an isotope dilution method for estimating vitamin A stores. Int J Vitam Nutr Res. 84 (Suppl 1), 9-15 (2014).
- Tang, G., Qin, J., Gregory, G., Dolnikowski, G. G. Deuterium enrichment of retinol in humans determined by gas chromatography electron capture negative chemical ionization mass spectrometry. J Nutr Biochem. 9 (7), 408-414 (1998).
- Tanumihardjo, S., et al. . Appropriate uses of vitamin A tracer (stable isotope) methodology. Vitamin A tracer task force. , (2004).
- Barua, A. B., Furr, H. C. Properties of retinoids: structure, handling, and preparation. Mol Biotechnol. 2 (2), 167-182 (1998).
- Swinehart, D. F. The Beer-Lambert Law. J Chem Edu. 39, 333-335 (1962).
- Barua, A. B., Furr, H. C. Properties of retinoids. Structure, handling, and preparation. Methods Mol Biol. 89, 3-28 (1998).
- Folch, J., Lees, M., Stanley, S. G. H. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Knapp, D. R. . Handbook of analytical derivatization reactions. , (1979).
- Green, M. H., Green, J. B. Use of model-based compartmental analysis and theoretical data to further explore choice of sampling time for assessing vitamin A status in groups and individual human subjects by the retinol isotope dilution method. J Nutr. 157 (7), 2068-2074 (2021).
- Todd, J. F. J. Recommendations for nomenclature and symbolism for mass spectroscopy (including an appendix of terms used in vacuum technology). (Recommendations 1991). Pure and Appl Chem. 63 (10), 1541-1566 (1991).
- Handelman, G. J., Haskell, M. J., Jones, A. D., Clifford, A. J. An improved protocol for determining ratios of retinol-d4 to retinol isolated from human plasma. Anal Chem. 65 (15), 2024-2028 (1993).
- Tang, G., Andrien, B. A., Dolnikowski, G., Russell, R. M. . Methods in Enzymology, Vitamins and Coenzymes. Part L. 282, 140-154 (1997).
- Haskell, M. J., et al. Population-based plasma kinetics of an oral dose of [2H4]retinyl acetate among preschool-age Peruvian children. Am J Clin Nutr. 77 (3), 681-686 (2003).
- Lopez-Teros, V., et al. International experiences in assessing vitamin A status and applying the vitamin A-labeled isotope dilution method. Int J Vitam Nutr Res. 84 (Suppl 1), 40-51 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved