Method Article
Microsampling in der gezielten Massenspektrometrie-basierten Proteinanalyse von Proteinen mit geringer Abundanz
In diesem Artikel
Zusammenfassung
Es wird ein Protokoll zur Bestimmung von Biomarkern mit geringer Abundanz aus getrockneten Serumproben vorgestellt, das am Beispiel des Biomarkers Progastrin-freisetzendes Peptid (ProGRP) veranschaulicht wird. Antikörperbeschichtete magnetische Beads werden zur selektiven Aufreinigung und Anreicherung eines proteotypischen ProGRP-Peptids verwendet. Das eingefangene Peptid wird anschließend mittels Flüssigchromatographie-Tandem-Massenspektrometrie analysiert.
Zusammenfassung
In diesem Artikel wird ein Protokoll mit detaillierten Beschreibungen für die effiziente Probenreinigung von Proteinen mit geringer Häufigkeit aus getrockneten Proben vorgestellt. Dies wird unter Verwendung einer Bead-basierten Proteolyse vor der proteotypischen Peptidaffinitätserfassung und der Bestimmung der Flüssigchromatographie-Tandem-Massenspektrometrie (LC-MS/MS) durchgeführt. Das Verfahren kann sowohl auf konventionelle getrocknete Proben mit Papierkarten (z. B. getrocknete Blutflecken [DBS] und getrocknete Serumflecken [DSS]) als auch auf Proben angewendet werden, die mit neueren Probenahmemethoden wie der volumetrischen absorbierenden Mikroprobenahme (VAMS) entnommen wurden. Neben der Beschreibung dieses Verfahrens wird in dieser Arbeit Schritt für Schritt die Herstellung sowohl von Trypsin-Beads als auch von Antikörper-beschichteten Beads vorgestellt. Die Vorteile des vorgestellten Verfahrens sind die zeiteffiziente Proteolyse mit Beads und die selektive robuste Aufreinigung mittels Peptidaffinitäts-Capture. Das aktuelle Verfahren beschreibt die Bestimmung des Biomarkers für kleinzelliges Lungenkarzinom (SCLC) mit geringer Abundanz, Progastrin-Releasing-Peptid (ProGRP), in getrocknetem Serum (sowohl DSS als auch VAMS). Detaillierte Verfahren zur Perlenvorbereitung erleichtern die Implementierung des Workflows in neuen Anwendungen oder anderen Laboren. Es wird gezeigt, dass die Ergebnisse vom Probenahmematerial abhängen können; Für das vorliegende Projekt wurden höhere Signalintensitäten für Proben beobachtet, die mit VAMS im Vergleich zu DSS gesammelt wurden.
Einleitung
Microsampling gibt es seit mehr als 100 Jahren, seit Ivar Bang 1913 die Glukoseüberwachung von DBS beschrieb1. Nachdem Guthrie und Susi 1963 DBS zur Bestimmung von Phenylalanin bei Neugeborenen2 eingeführt hatten, hat sich die Technik zunehmend verbreitet. Die ersten Berichte über DBS für die Probenahme und Lagerung von Proteinen wurden in den frühen 1970er Jahrengemacht 3,4, und ein Jahrzehnt später, in den 1980er Jahren, fanden wir den ersten Bericht über Massenspektrometrie (MS) zur Bestimmung von Proteinen aus DBS5. Trotz dieser frühen Einführung setzte sich die MS-Bestimmung von Proteinen aus DBS und anderen Mikrosampling-Techniken erst nach der Jahrhundertwende durch.
Im klinischen Kontext ist es von Interesse, Proteine in der Diagnose und Nachsorge von Krankheiten sowie für die Therapieüberwachung und Dopingzwecke zu bestimmen. Diese gezielte Bestimmung von Proteinanalyten mittels MS aus kleinen Mengen getrockneter Proben ist nach wie vor eine Herausforderung und erfordert oft eine umfangreiche Probenvorbereitung vor der Analyse.
Die gezielte quantitative Bestimmung von Proteinen durch MS wird üblicherweise durch Anwendung des Bottom-up-Ansatzes durchgeführt, bei dem die Proteine vor der Analyse zu Peptiden verdaut werden. Dieses Verfahren erzeugt eine Vielzahl von Peptiden, was die direkte Analyse der verdauten biologischen Probe schwierig macht. Eine Möglichkeit, dies zu umgehen, besteht darin, vor der MS-Analyse entweder vor oder nach dem Aufschluss einen selektiven Affinitätsreinigungsschritt anzuwenden 6,7,8. Auf diese Weise wird das interessierende Protein (oder sein proteotypisches Peptid, wenn der Affinitätserfassungsschritt nach dem Aufschluss durchgeführt wird) vor der Analyse selektiv aus der Probenmatrix isoliert, wodurch niedrigere Nachweisgrenzen bereitgestellt werden9.
Die Mikroprobenahme mit DBS-Karten hat im Vergleich zu herkömmlichen Blutproben bestimmte Vorteile, darunter ein geringes Probenvolumen, eine weniger invasive Probenahme und eine erhöhte Lagerstabilität. Die Probenmatrix ist jedoch anders und kann andere Herausforderungen in der Analyse mit sich bringen (z. B. getrocknete vs. flüssige Probenmatrix und Kapillarblut vs. Serum oder Plasma)10,11. Eine weitere Herausforderung, die bei DBS beobachtet wird, ist der sogenannte Hämatokrit-Effekt, bei dem der Bluthämatokrit das für die Analyse weiterverarbeitete Probenvolumen beeinflusst und somit eine interindividuelle Variabilität in der Analyse einführt12. Neuere Mikroprobenahmeeinheiten, wie z. B. VAMS, die 2014 eingeführtwurden 13, lösen dieses Problem, indem sie ein festes Blutvolumen anstelle eines Blutstropfens sammeln.
Dieses Protokoll beschreibt einen Aufbau für die Analyse von Biomarkern mit geringer Abundanz aus getrockneten Mikroproben. Nach der Elution wird die getrocknete Probe verdaut und anschließend das proteotypische Peptid durch Peptidaffinitätserfassung isoliert. Der Modellanalyt ist der SCLC-Biomarker ProGRP. Da ProGRP nicht zuverlässig aus Vollblut bestimmt werden kann, wurde Serum als Probenmatrix verwendet. Repräsentative Ergebnisse sowohl von DSS als auch von Serumproben, die mit VAMS gesammelt wurden, werden gezeigt.
Protokoll
Für die Herstellung von Standardlösungen wurde Serum von gesunden Blutspendern verwendet. Die Verwendung von Serum von gesunden Blutspendern wurde in strikter Übereinstimmung mit norwegischem Recht durchgeführt. Von allen Probanden wurde eine Einverständniserklärung eingeholt. Die Analyse der Serumproben erfolgte mit Methoden gemäß den einschlägigen Richtlinien und Vorschriften. Bei dem beschriebenen Protokoll handelt es sich um eine modifizierte Version des in der vorangegangenen Arbeit14 beschriebenen Verfahrens. Einen Überblick über die Zusammensetzung von Puffern und Lösungen und deren Herstellung finden Sie in der ergänzenden Tabelle S1, während die Materialtabelle Materialien, Geräte und Reagenzien enthält, die in diesem Protokoll verwendet werden.
1. Herstellung von Antikörper-beschichteten Magnetkügelchen
- Berechnen Sie die Menge an Antikörpern, die erforderlich ist, um die gewünschte Anzahl von Kügelchen herzustellen. Verwenden Sie 1 mg Antikörper pro 50 mg magnetische Kügelchen.
ANMERKUNG: Typischerweise werden in nachfolgenden Experimenten 20 μl einer 20 mg/ml Perlensuspension pro Probe verwendet (siehe Schritt 5.1). - Berechnen Sie das Antikörpervolumen, das zur Herstellung der gewünschten Anzahl von Kügelchen erforderlich ist.
HINWEIS: Das Antikörpervolumen hängt von der Antikörperkonzentration ab und muss für jeden Antikörper berechnet werden. - Übertragen Sie das gewünschte Volumen der Antikörperlösung in ein 5-ml-Mikrozentrifugenröhrchen mit niedriger Proteinbindung. Wenn die Antikörperlösung beispielsweise 1 mg/ml Antikörper enthält, verwenden Sie 0,4 ml, um 1,0 ml Perlensuspension (20 mg Perlen/ml mit 1 mg Antikörper/50 mg Kügelchen) herzustellen.
HINWEIS: Die Antikörper sollten sich in einem aminfreien Puffer befinden. Verwenden Sie Mikrozentrifugenröhrchen mit niedriger Proteinbindung für alle Lösungen, die Proteine enthalten, um Analytverluste durch Adsorption zu vermeiden. - Geben Sie einen kleinen magnetischen Rührstab in die Antikörperlösung und stellen Sie den pH-Wert unter ständigem Rühren auf 2,5 ein. Verwenden Sie ein pH-Messgerät mit einer Mikroelektrode, um den pH-Wert zu messen, und stellen Sie den pH-Wert durch schrittweise Zugabe definierter Volumina von 1,0 M HCl ein (beginnen Sie mit der Zugabe von 10 μl-Portionen von 1,0 M HCl und reduzieren Sie das Volumen, wenn sich der pH-Wert 2,5 nähert). Notieren Sie das Gesamtvolumen von 1,0 M HCl, das erforderlich ist, um den pH-Wert auf 2,5 einzustellen.
- Entfernen Sie die Mikroelektrode und inkubieren Sie den angesäuerten Antikörper 1 h lang auf Eis auf einem Magnetrührer.
HINWEIS: Eine saure Behandlung des Antikörpers wird durchgeführt, um die korrekte Ausrichtung der Antikörper auf der Perle zu fördern. Die HCl-Konzentration kann je nach Pufferkonzentration in der Antikörperlösung auf 0,5 M oder 0,2 M HCl reduziert werden. - Neutralisieren Sie die Antikörperlösung. Verwenden Sie ein pH-Messgerät mit einer Mikroelektrode, um den pH-Wert zu messen, und stellen Sie den pH-Wert durch schrittweise Zugabe definierter Volumina von 1,0 M NaOH auf 7 ein (beginnen Sie mit einer 10-μl-Portion und reduzieren Sie das Volumen, wenn sich der pH-Wert 7 nähert). Erfassen Sie das Gesamtvolumen von 1,0 Mio. NaOH hinzugefügt.
ANMERKUNG: Die Konzentration von NaOH sollte mit der in Schritt 1.4 verwendeten HCl-Konzentration übereinstimmen. NaOH ist stark korrosiv; Verwenden Sie Schutzausrüstung, einschließlich Handschuhe und geeigneten Augenschutz. - Berechnen Sie das gewünschte Volumen der zu verwendenden Tosyl-aktivierten Magnetkügelchen.
HINWEIS: In der Regel wird empfohlen, 20 mg Kügelchen/ml zu verwenden, wenn eine Kopplung in kleinem Maßstab durchgeführt wird. Es sollten mindestens 5 mg Kügelchen verwendet werden. - Mischen Sie die magnetische Perlensuspension gründlich auf einem Wirbelmischer und entnehmen Sie ein Volumen mit der gewünschten Menge an Perlensuspension. Um beispielsweise 1 ml Perlensuspension herzustellen, wird ein Volumen mit 20 mg Kügelchen (667 μl bei einer Konzentration von 30 mg/ml Perlen) entnommen.
- Legen Sie die Perlenaufhängung für 1 Minute auf ein Magnetgestell und entfernen Sie den Überstand. Waschen Sie die Kügelchen 2x mit dem gleichen Volumen vom Typ 1H2O(667 μl, wenn eine 30 mg/ml-Perlenlösung zur Herstellung von 1 ml 20 mg/ml-Antikörper-beschichteten Kügelchen verwendet wird). Nach jeder Zugabe der Waschlösung mit einem Wirbelmischer mischen und 1 Minute lang auf das Magnetgestell legen, bevor der Überstand entfernt wird.
- Fügen Sie den magnetischen Kügelchen Folgendes hinzu: säurebehandelter Antikörper, 0,5 M Boratpuffer (pH 9,5) (1/5 des Gesamtvolumens, da die Endkonzentration 0,1 M betragen sollte; dies entspricht 0,2 ml zur Herstellung von 1 ml Perlensuspension) und Kopplungspuffer für die Antikörperkopplung (zur Herstellung von 1 ml Antikörper-beschichteten Magnetkügelchen sollte das Volumen des Kopplungspuffers 1 ml betragen - Volumen des säurebehandelten Antikörpers - 0,2 ml Boratpuffer). Mit einem Vortex-Mixer mischen.
HINWEIS: Das Volumen des säurebehandelten Antikörpers entspricht dem Volumen der Antikörperlösung (0,4 ml zur Herstellung von 1 ml Perlensuspension unter Verwendung einer 1 mg/ml-Antikörperlösung) + dem Volumen von 1,0 M HCl, das zur Einstellung des pH-Werts auf 2,5 verwendet wird, + dem Volumen von 1,0 M NaOH, das zur Einstellung des pH-Werts auf 7 verwendet wird).
ANMERKUNG: Die Zusammensetzung aus 0,5 M Boratpuffer (pH 9,5) und Kopplungspuffer für die Antikörperkopplung ist in der ergänzenden Tabelle S1 zu finden. - Drehen Sie über Nacht bei Umgebungstemperatur mit einem End-over-End-Probenmischer, vorzugsweise mit reziproker Rotation und Vibration.
- 10 min bei 239 × g zentrifugieren. Legen Sie das Röhrchen für 2 Minuten auf den Magneten und entfernen Sie den Überstand.
- Waschen Sie die Kügelchen 2 x 2 h und einmal über Nacht, indem Sie den Lagerpuffer für Antikörperkügelchen bei Umgebungstemperatur mit einem End-over-End-Probenmischer drehen. Verwenden Sie das gleiche Volume wie das Gesamtvolume in Schritt 1.10. Legen Sie den Schlauch für 1 Minute auf den Magneten und entfernen Sie den Überstand zwischen den einzelnen Wäschen.
HINWEIS: Die Zusammensetzung des Speicherpuffers für Antikörperkügelchen ist in der ergänzenden Tabelle S1 zu finden. - Im gewünschten Puffer (z. B. im gleichen Puffer wie in Schritt 1.13) unter Verwendung der gewünschten Stammkonzentration der Kügelchen (typischerweise 20 mg/ml) lagern. Im Kühlschrank aufbewahren.
2. Herstellung von 2 ml Trypsin-immobilisierten Kügelchen (20 mg/ml Kügelchen)
- Fügen Sie 20 ml 1 mM HCl zu 2 ml NHS-aktivierten Agarosekügelchen hinzu, um die Kügelchen zu waschen.
- Mischen und bei 2.655 × g 5 min zentrifugieren. Entfernen Sie den Überstand.
- 20 ml 0,1 M Phosphatpuffer (pH 7,8) zugeben. Mit einem Wirbelmischer mischen und bei 2.655 × g 5 min zentrifugieren. Entfernen Sie den Überstand.
ANMERKUNG: Die Zusammensetzung von 0,1 M Phosphatpuffer (pH 7,8) ist in der ergänzenden Tabelle S1 zu finden. - Fügen Sie 2 ml 20 mg/ml Trypsin hinzu (gelöst in kaltem Kopplungspuffer für die Trypsin-Kopplung).
HINWEIS: Die Zusammensetzung des Kupplungspuffers für die Trypsin-Kopplung ist in der ergänzenden Tabelle S1 zu finden. Bewahren Sie den Puffer im Kühlschrank auf. - 25 min bei 22 °C und 1.100 U/min mit einem temperaturgeregelten Mischer inkubieren. Bei 2.655 × g 5 min zentrifugieren. Entfernen Sie den Überstand.
- 2 ml Modifikationspuffer für die Herstellung von Trypsinkügelchen zugeben und 20 min bei 22 °C und 1.100 U/min mit einem temperaturgeregelten Mischer inkubieren. Bei 2.655 × g 5 min zentrifugieren. Entfernen Sie den Überstand.
HINWEIS: Die Zusammensetzung des Modifikationspuffers für die Herstellung von Trypsinkügelchen ist in der Ergänzungstabelle S1 zu finden. Bewahren Sie den Puffer im Kühlschrank auf. - 10 ml Blockpuffer für die Herstellung von Trypsinkügelchen zugeben und 10 min bei 22 °C und 1.100 U/min mit einem temperaturgesteuerten Mischer inkubieren. Bei 2.655 × g 5 min zentrifugieren. Entfernen Sie den Überstand.
HINWEIS: Die Zusammensetzung des Blockpuffers für die Herstellung von Trypsinkügelchen ist in der ergänzenden Tabelle S1 zu finden. Bewahren Sie den Puffer im Kühlschrank auf. - Fügen Sie 2 ml Speicherpuffer hinzu, mischen Sie es mit einem Wirbelmixer und lagern Sie es bis zur Verwendung im Kühlschrank.
HINWEIS: Die Zusammensetzung des Speicherpuffers für Trypsinkügelchen ist in der ergänzenden Tabelle S1 zu finden. Bewahren Sie den Puffer im Kühlschrank auf.
3. DSS/VAMS-Probenahme und anschließende Extraktion des getrockneten Serums
- Bereiten Sie Standards vor, indem Sie das Serum mit ProGRP (oder dem interessierenden Protein) in der entsprechenden Menge aufspießen. Halten Sie das Spitzenvolumen ≤ 1% des Gesamtvolumens.
HINWEIS: Hier wurde eine Stammlösung von 295 μg/ml ProGRP in Wasser zur Herstellung von Stachelserumstandards verwendet. - Mischen Sie die Standards auf einem Wirbelmischer.
- Tragen Sie 10 μl Serum (Stachelstandards) auf DBS-Karten auf oder lassen Sie 10 μl Serum gemäß den Richtlinien des Herstellers durch VAMS (10 μl) sammeln. Stellen Sie bei DSS sicher, dass sich der Punkt innerhalb des gepunkteten Kreises befindet.
- Bei Raumtemperatur mindestens 2 h an der Luft trocknen lassen.
- Schneiden Sie den gesamten Fleck aus und geben Sie ihn in ein 2-ml-Mikrozentrifugenröhrchen mit geringer Proteinbindung oder entfernen Sie das VAMS aus der Halterung und legen Sie es in ein 2-ml-Mikrozentrifugenröhrchen mit niedriger Proteinbindung.
- 1.000 μl 100 mM Ammoniumbicarbonat (ABC)-Lösung zugeben. Extraktion des getrockneten Serums aus dem Spot/VAMS für 1 h bei 22 °C mit einem temperaturgeregelten Mischer bei 1.000 U/min.
- Übertragen Sie den Extrakt in ein neues 1,5-ml-Mikrozentrifugenröhrchen mit niedriger Proteinbindung für die tryptische Proteolyse.
4. Verdauung von DSS/VAMS-Extrakten
- Verwenden Sie 30 μl Trypsinkügelchen (wie in Abschnitt 2 vorbereitet) pro Probe. Ein Volumen, das Trypsinkügelchen für alle Proben enthält, wird in ein neues 1,5-ml-Mikrozentrifugenröhrchen mit niedriger Proteinbindung überführt, 5 Minuten lang bei 2.655 × g zentrifugiert und der Überstand entfernt.
- Waschen Sie die Trypsinkügelchen 2x mit 1 ml kaltem 50 mM ABC, bevor Sie sie in der gleichen Menge, die herauspipettiert wurde, resuspendieren. Bei 2.655 × g 5 min zentrifugieren und den Überstand zwischen den Schritten entfernen.
- Fügen Sie 30 μl gewaschene Trypsinkügelchen zu jedem DSS/VAMS-Extrakt hinzu, um die Verdauung einzuleiten.
- Inkubation für 2 h bei 37 °C und 1.000 U/min mit einem temperierten Mischer o.ä. Zentrifugieren Sie es bei 2.655 × g für 5 min und überführen Sie den Überstand (keine Kügelchen) in ein neues 2,0-ml-Mikrozentrifugenröhrchen mit geringer Proteinbindung.
- 25 μl 14 ng/ml interne Standardlösung (IS) mit dem stabilisotopenmarkierten (SIL) Peptid ALGNQQPSWDSEDSSNF[K_13C6_15N2] werden in 100 mM ABC-Lösung gegeben.
5. Einfangen von proteotypischem ProGRP-Peptid unter Verwendung von Antikörper-beschichteten magnetischen Kügelchen
- Verwenden Sie 20 μl mit Antikörpern beschichtete Kügelchen (20 mg/ml wie in Abschnitt 1 vorbereitet) pro Extraktion. Übertragen Sie alle mit Antikörpern beschichteten Kügelchen in ein neues 1,5-ml-Mikrozentrifugenröhrchen mit geringer Proteinbindung, legen Sie es 1 Minute lang auf den Magneten und entfernen Sie den Speicherpuffer.
- Waschen Sie die mit magnetischen Antikörpern beschichteten Kügelchen mit 1 ml phosphatgepufferter Kochsalzlösung (PBS) mit einem pH-Wert von 7,4, die 0,05 % Polysorbat 20 enthält, und 2 x 1 ml PBS, bevor Sie sie in demselben Volumen resuspendieren, das herauspipettiert wurde. Auf einem Wirbelmischer mischen und zwischen den Pufferwechseln 1 Minute lang auf den Magneten legen.
ANMERKUNG: PBS enthält 137 mM NaCl, 2,7 mM KCl, 8 mMNa2HPO4 und 1,8 mM KH2PO4. Es wird empfohlen, die Lösung in einer 10-fachen Konzentration herzustellen, um die Stabilität zu erhöhen. Für die Zusammensetzung von 100 ml 10x PBS siehe Ergänzungstabelle S1. Durch die Verdünnung des 10x PBS 10x wird ein pH-Wert von ~7,4 erreicht. - Geben Sie 20 μl gewaschene magnetische Bead-Suspension in jedes proteinarme Mikrozentrifugenröhrchen, das einen verdauten DSS/VAMS-Extrakt und IS enthält. Führen Sie die Immunextraktion 1 h lang mit einem End-over-End-Probenmischer bei Umgebungstemperatur durch.
- Waschen Sie die Magnetkügelchen mit den folgenden Lösungen: 500 μl PBS mit 0,05 % (v/v) Polysorbat 20, 400 μl PBS, 300 μl 10 mM Tris HCl (pH 7,4) und 300 μl 100 mM ABC.
- Entfernen Sie nach der Zugabe jeder Waschlösung das proteinarme Mikrozentrifugenröhrchen mit Perlen und Waschlösung aus dem Magnetgestell und drehen Sie es vorsichtig um, bis es homogen ist. Legen Sie dann das Mikrozentrifugenröhrchen mit niedriger Proteinbindung für 30 s auf den Magneten, drehen Sie es für 30 s um und legen Sie es für 1 Minute auf den Magneten. Entfernen Sie die Waschlösung.
- Schleudern Sie die verbleibende Suspension mit einer Mikrozentrifuge. 1 Minute auf den Magneten legen und die restliche Waschlösung entfernen.
- 15 μl 2% (v/v) Ameisensäure vom Typ 1 H2O in jede Probe geben und 5 min bei22°C und 1.000 U/min mit einem temperaturgesteuerten Mischer oder ähnlichem inkubieren, um die eingefangenen Peptide zu eluieren. Legen Sie es für 1 Minute auf den Magneten und überführen Sie das Eluat in ein neues 1,5-ml-Mikrozentrifugenröhrchen mit geringer Proteinbindung. Wiederholen Sie den Vorgang einmal und geben Sie das zweite Eluat in dasselbe Mikrozentrifugenröhrchen mit niedriger Proteinbindung wie das erste Eluat.
- Fügen Sie jedem Eluat 20 μl 100 mM ABC hinzu (Gesamtvolumen von 50 μl).
- Zentrifugieren (Mikrozentrifuge) und 40 μl des Eluats in Mikroeinsätze für Hochleistungsflüssigkeitschromatographie (HPLC)-Fläschchen überführen.
6. Analyse mittels LC-MS/MS
- Verwenden Sie ein Mikro-LC-Triple-Quadrupol-MS mit Elektrospray-Ionisation für eine hohe Robustheit.
- Bereiten Sie das LC-MS/MS-System für die Analyse vor, indem Sie die Pumpen mit den mobilen Phasen A (20 mM FA in H2O und MeCN, 95:5 v/v) und B (20 mM FA inH2Ound MeCN,5:95 v/v) spülen.
- Setzen Sie die analytische Säule (C18, 50 mm x 1 mm Innendurchmesser [ID], 3 μm Partikel) ein.
- Bereiten Sie das Gerät weiterhin für die Analyse vor, indem Sie die Startverfahren für das jeweilige Instrument befolgen.
- Stellen Sie in der Gerätesoftware die Temperatur des Säulenofens auf 25 °C und die Durchflussrate auf 50 μl/min (100 % mobile Phase A) ein.
- Äquilibrieren Sie die Säule mindestens 15 Minuten lang mit der mobilen Phase A.
- Legen Sie die Proben in den Autosampler.
- Bereiten Sie die Instrumentenmethode für die Analyse des ProGRP-spezifischen, tryptischen Peptids ALGNQQPSWDSEDSSNFK und seiner IS vor.
HINWEIS: Einige Methodenparameter sind gerätespezifisch und müssen für das verwendete Gerät optimiert werden. Details zu den hier verwendeten Verfahrensparametern sind in den Schritten 6.9 bis 6.11 beschrieben. - Verwenden Sie für das Gradientenprogramm in LC die folgenden Einstellungen: Durchflussrate: 50 μL/min; von 0,0 bis 3,0 min: 100% mobile Phase A; von Zeit 3,0 bis 18,0 min: Führen Sie einen linearen Gradienten von 0% bis 50% der mobilen Phase B durch; von Zeit 18,0 bis 18,1 min: Erhöhung der mobilen Phase B von 50% auf 100%; von Zeit 18,1 bis 20,0 min: 100% mobile Phase B; von Zeit 20,0 bis 20,1 min: Verringerung der mobilen Phase B von 100% auf 0%; von Zeit 20,1 bis 30 min: 100% mobile Phase A, um die Säule wieder ins Gleichgewicht zu bringen (mindestens 10 Säulenvolumina verwenden).
- Führen Sie MS/MS für MS/MS-Einstellungen im positiven Modus aus, indem Sie Geräteeinstellungen verwenden, die eine effiziente Ionisation gewährleisten. Um diesem Protokoll zu folgen, verwenden Sie eine Sprühspannung von +4.000 V, eine erhitzte Kapillartemperatur von 270 °C, Stickstoff als Schichtgas (5 beliebige Einheiten) und Argon (2 mTorr) für die kollisionsinduzierte Dissoziationsfragmentierung (CID). Wenn das Gerät es zulässt, richten Sie den LC-Durchfluss so aus, dass er die ersten 2 Minuten (0-2 Minuten) und die letzten 1 Minuten (29-30 Minuten) des Laufs verschwendet, anstatt in den MS.
- Verwenden Sie ausgewählte SRM-Übergänge (Reaktionsüberwachung) für (A) das Signaturpeptid (ALGNQQPSWDSEDSSNFK): 1.005,45→913,3, 1.005,45→1.028,3 und 1.005,45→1.398,5 und (B) das IS-SIL-Peptid (ALGNQQPSWDSEDSSNF[K_13C6_15N2]): 1.009,45→921,3, 1.009,45→1.036,3 und 1.009,45→1.406,5. Verwenden Sie optimierte Kollisionsenergie (35 V in diesem Protokoll) für alle überwachten Übergänge.
- Bereiten Sie eine Sequenz mit den Proben vor, die mit der für Ihr LC-MS/MS-System verfügbaren Software ausgeführt werden sollen. Stellen Sie das Injektionsvolumen auf 10 μl ein.
HINWEIS: Stellen Sie sicher, dass Sie bei Bedarf Leerproben und Qualitätskontrollproben hinzufügen. - Drücken Sie in der Gerätesoftware auf "Sequenz ausführen", um die Sequenz zu starten.
- Überwachen Sie den Peakbereich des affinitätserfassten, ProGRP-spezifischen, tryptischen Peptids ALGNQQPSWDSEDSSNFK und seines IS-SIL-Peptids.
ANMERKUNG: Die Auswahl und Bestätigung des Signaturpeptids ALGNQQPSWDSEDSSNFK wird an anderer Stelle14 beschrieben.
Ergebnisse
Abbildung 1 zeigt einen Überblick über den analytischen Arbeitsablauf, der sowohl DSS-Probenahme als auch VAMS verwendet. Abgesehen von den Unterschieden in der Probenahmemethode sind die Verfahren identisch. Bilder des Serums, das mit den beiden Probenahmemethoden entnommen wurde, sind in Abbildung 2 zu sehen.
Beide Probenahmeformen (VAMS und DSS) eignen sich für die Probenahme von ProGRP-haltigem Serum. Dies ist aus Abbildung 3 ersichtlich, in der MS-Chromatogramme des proteotypischen Peptids und des IS-SIL-Peptids aus DSS- und VAMS-Probenahmen gezeigt werden. Zusätzlich ist das MS-Chromatogramm nach der Analyse einer Kontrollprobe enthalten, die aus 10 μl mit Spikes versehener flüssiger Serumprobe besteht, die auf die gleiche Weise wie die getrockneten Proben verarbeitet wurde. Letzteres wurde im gleichen Volumen wie das Volumen der DSS/VAMS-Extraktionslösung verdünnt, mit Trypsinkügelchen aufgeschlossen und mittels Peptidaffinitätserfassung gereinigt.
Beim Vergleich der VAMS- und DSS-Probenahme (Abbildung 4) liefert VAMS ein höheres proteotypisches Peptid/IS-Flächenverhältnis als DSS. Dies deutet darauf hin, dass es zu einem Verlust des Zielproteins ProGRP an das für DSS (reine Zellulose) verwendete Papier kommen könnte. Beim Vergleich mit einer Kontrollprobe, bei der das Serum vor der weiteren Verarbeitung und Analyse nicht getrocknet wird (Abbildung 4), zeigt sich, dass VAMS ähnliche Flächenverhältnisse wie die Kontrollprobe liefert (zweiseitiger t-Test, p≤ 0,65), was auf keinen Verlust des Probenahmematerials hinweist, während DSS ein signifikant niedrigeres Flächenverhältnis liefert (zweiseitiger t-Test, S≤ 0,005), was auf einen Verlust des Probenahmematerials hinweist.
Eine kurze Evaluierung wurde mit VAMS durchgeführt. Es wurde eine Linearität von 10 bis 1.000 ng/ml (R2 = 0,9996) mit einer Nachweisgrenze (LOD, S / N = 3) von 6,7 ng / ml gezeigt. Die LOD wird als zufriedenstellend angesehen, da die Analyse an einem ziemlich alten Triple-Quadrupol (2008) mit einer 1-mm-ID-Säule durchgeführt wurde. Die Wiederholbarkeit aller Stufen mit einem S/N > 10 wurde auch mit einem RSD zwischen 7% und 17% (n = 3) unter Verwendung der IS-Korrektur als zufriedenstellend angesehen.
Die Affinitätserfassung kann sowohl vor als auch nach dem Verdauungsschritt durchgeführt werden, indem entweder das interessierende Protein oder sein proteotypisches Peptid erfasst wird. Das aktuelle Verfahren beschreibt die Erfassung der Peptidaffinität. Ein Vorteil dieses Ansatzes gegenüber der Proteinerfassung besteht darin, dass nur das interessierende Peptid eingefangen wird und eine noch effizientere Probenreinigung erreicht wird. Dies ist in Abbildung 5 dargestellt, die ein komplexeres Full-Scan-Chromatogramm mit mehr Rauschen nach dem Proteineinfang im Vergleich zum Peptideinfang zeigt. Die in Abbildung 5 analysierten Proben werden nicht mittels DSS-Probenahme oder VAMS beprobt. Serum ist jedoch auch die Probenmatrix, und die Affinitätserfassung wird unter Verwendung desselben Antikörpers durchgeführt, der für die Peptiderfassung in dem beschriebenen Verfahren verwendet wird.

Abbildung 1: Überblick über den analytischen Arbeitsablauf unter Verwendung von DSS- und VAMS-Probenahme. Abkürzungen: DSS = getrockneter Serumfleck; VAMS = volumetrische absorbierende Mikroprobenahme; LC-MS/MS = Flüssigkeitschromatographie-Tandem-Massenspektrometrie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Bilder von Serum, die mit verschiedenen Methoden entnommen wurden . (A) DBS-Zellulosekarte und (B) VAMS. Abkürzungen: DBS = getrockneter Blutfleck; VAMS = volumetrische absorbierende Mikroprobenahme. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 3: Repräsentative MS-Chromatogramme des proteotypischen Peptids und des IS-SIL-Peptids nach DSS- und VAMS-Probenahme sowie für eine mit Stacheln versehene Serumprobe, die direkt in die Extraktionslösung gegeben wurde. Das MS-Chromatogramm zeigt 10 μl Serumproben, die mit 1,5 μg/ml ProGRP versetzt und auf (A) VAMS, (B) die Zellulose-Probenahmekarte (für DSS) oder (C) direkt auf den Extraktionspuffer (Kontrollprobe) aufgetragen wurden. Fünfundzwanzig Mikroliter 14 ng/ml SIL-Peptid werden allen Proben vor der Erfassung der Peptidaffinität zugesetzt. Abkürzungen: DSS = getrockneter Serumfleck; VAMS = volumetrische absorbierende Mikroprobenahme; MS = Massenspektrometrie; ProGRP = Progastrin-freisetzendes Peptid; IS = interner Standard; SIL = stabilisotopenmarkiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
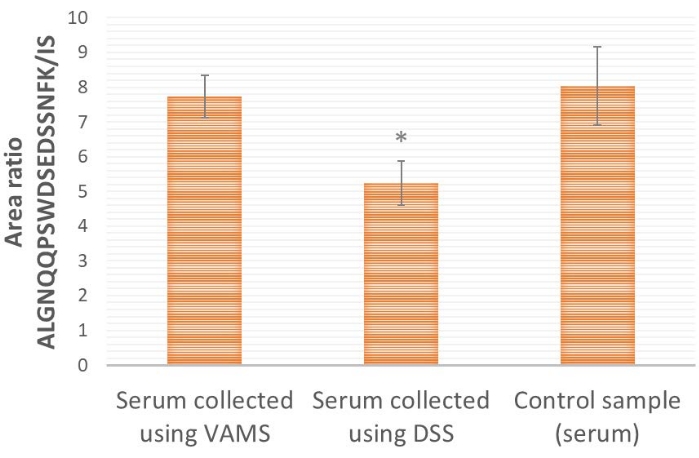
Abbildung 4: Repräsentative Ergebnisse des ALGNQQPSWDSEDSSNFK/IS-Flächenverhältnisses für Serumproben, die mit ProGRP versetzt und (10 μl) auf VAMS, DSS oder direkt auf Extraktionslösung (Kontrollprobe) aufgetragen wurden. Die ProGRP-Konzentration beträgt 1,5 μg/ml, n = 4 für jede Bedingung; 25 μl 14 ng/mL IS SIL-Peptid werden allen Proben vor der Erfassung der Peptidaffinität zugesetzt. *zeigt an, dass sich das Flächenverhältnis signifikant von den Proben unterscheidet, die auf VAMS angewendet werden (zweiseitiger t-Test, S≤ 0,005). Fehlerbalken sind ± Standardabweichung. Abkürzungen: DSS = getrockneter Serumfleck; VAMS = volumetrische absorbierende Mikroprobenahme; ProGRP = Progastrin-freisetzendes Peptid; IS = interner Standard; SIL = stabilisotopenmarkiert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
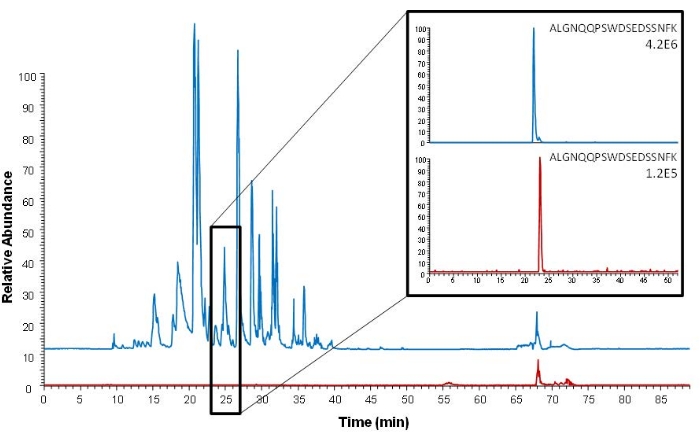
Abbildung 5: Vergleich der Basenpeak-Chromatogramme (Full-Scan-Orbitrap-Analyse) nach intakter Proteinextraktion (blau) und proteotypischer Epitoppeptidextraktion (rot). Auf der rechten Seite sind extrahierte Ionenchromatogramme des proteotypischen Epitoppeptids (ALGNQQPSWDSEDSSNFK, m/z 1005.45) dargestellt. Als Probe wurde ein Serum verwendet, das mit 150 ng mL−1 ProGRP versetzt war. Diese Abbildung ist nachgedruckt von Levernæs et al.14. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergänzende Tabelle S1: Ein Überblick über die Zusammensetzung von Puffern und Lösungen und deren Herstellung. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Das beschriebene Protokoll enthält Informationen darüber, wie mehrere wichtige Schritte bei der Analyse von Biomarkern mit geringer Abundanz aus getrockneten Mikroproben (DSS und VAMS) durchgeführt werden können, einschließlich der Herstellung von Trypsinkügelchen und Antikörper-beschichteten Magnetkügelchen. Aufgrund früherer Erfahrungen behandeln wir den Antikörper vor der Bead-Immobilisierung immer mit Säure, um die Orientierung der Antikörper zu verbessern15.
Einer der entscheidenden Schritte in diesem Verfahren ist die Auswahl des am besten geeigneten Microsampling-Formats. Zunächst muss man überlegen, ob der betreffende Analyt aus Vollblut bestimmt werden kann oder ob die Konzentration von den Blutzellen beeinflusst wird und im Serum oder Plasma bestimmt werden muss (wie beim Modellanalyten ProGRP).
Sowohl papier- als auch polymerbasierte Ansätze haben Vor- und Nachteile; Für ProGRP bietet VAMS einen klaren Vorteil in Bezug auf die Analytrückgewinnung nach der Extraktion aus dem Probenehmer. Dies kann jedoch wahrscheinlich mit einer anderen Extraktionslösung für die DSS-Proben optimiert werden. Nichtsdestotrotz ist es wichtig, diese potenzielle Wechselwirkung zwischen dem Analyten und dem Probenahmematerial zu berücksichtigen, da sie zu einer erhöhten analytischen Variation und höheren Nachweisgrenzen führen kann. Da es sich bei dem verwendeten IS um ein SIL-Peptid handelt, das erst nach dem Aufschluss zugesetzt wird, korrigiert IS die Schritte nach dem Aufschluss (z. B. Affinitätsextraktion und LC-MS/MS-Analyse). Eine IS-Korrektur ist für die Extraktion aus DSS/VAMS und den Aufschlussschritt nicht möglich.
Bei dem Verfahren werden zwei Arten von Kügelchen verwendet: Trypsinkügelchen für die Verdauung nach Extraktion der Serumprobe aus dem Probenehmer und Antikörper-beschichtete Magnetkügelchen für die Erfassung des proteotypischen Peptids nach der Verdauung. Ein Hauptgrund für die Verwendung von Trypsin-Kügelchen ist neben der Beschleunigung des Aufschlusses die Minimierung der verbleibenden Trypsinaktivität in der Probe während der Affinitätserfassung. Dies ist wichtig, um eine tryptische Proteolyse des mAb während der Affinitätserfassung zu vermeiden.
Agarosekügelchen wurden zur Herstellung der Trypsinkügelchen verwendet, während magnetische Kügelchen zur Herstellung der mit Antikörpern beschichteten Kügelchen verwendet wurden. Agarosekügelchen sind kostengünstiger als magnetische Kügelchen, haben jedoch die Einschränkung, dass die Trennung der Kügelchen von der Lösung eine Zentrifugation erfordert. Dies macht die Trennung von Perlen und Überstand weniger effizient als bei der Verwendung von magnetischen Perlen. Darüber hinaus ist die Automatisierung des Arbeitsablaufs mit Agaroseperlen schwierig. Magnetische NHS-aktivierte Kügelchen sind jedoch verfügbar und können für einen optimierten und automatisierbaren Probenvorbereitungsablauf verwendet werden.
Microsampling ist ein wichtiger Trend in der Bioanalytik von Medikamenten und Biomarkern. Eine Herausforderung beim derzeitigen Ansatz ist die begrenzte Menge an Probenvolumen (10 μl), die bei der Bestimmung von Analyten mit sehr geringer Abundanz wie ProGRP (pg/ml-niedriger ng/ml-Spiegel) von besonderer Bedeutung sein kann. Diese Herausforderung kann jedoch mit modernsten Analysegeräten umgangen werden. Für diese Analyten mit geringer Abundanz ist die Wahl der Probenvorbereitung entscheidend, und eine selektive Probenreinigung durch antikörperbasierte Affinitätserfassung ist am häufigsten erforderlich. Da gezeigt wurde, dass die Peptiderfassung sauberere Extrakte und niedrigere Nachweisgrenzen liefert als die Proteineinfangung (unter Verwendung desselben Antikörpers)14, konzentriert sich die vorliegende Methode auf diesen Ansatz in Kombination mit Mikroprobenahme. Ein weiterer Vorteil des Peptid-Capture-Ansatzes besteht darin, dass das IS-SIL-Peptid auch den Affinitäts-Capture-Schritt korrigiert.
In dieser Arbeit wurde ein Antikörper, der auf ein Protein abzielt, für den Peptideinfang verwendet. Dies ist ein Vorteil, da die Verfügbarkeit von Standard-Antikörpern, die auf Proteine abzielen, höher ist als die von Standard-Antikörpern, die auf proteotypische Peptide abzielen. Damit ein Anti-Protein-Antikörper jedoch ein proteotypisches Peptid effizient einfangen kann, muss das Epitop nach der Proteinverdauung intakt sein. Hinzu kommt, dass bei vielen Antikörpern das genaue Epitop nicht bekannt ist, was die Suche nach einem Anti-Protein-Antikörper mühsam macht. Dies begrenzt die Anzahl der verfügbaren Anti-Protein-Antikörper, die für den Peptideinfang geeignet sind. Das beschriebene Verfahren wird unter Verwendung von Serum als Matrix und ProGRP als Zielanalyt demonstriert. Das Verfahren soll auf andere Matrizen und andere Zielanalyten anwendbar sein. Anstatt einen kommerziell erhältlichen Anti-Protein-Antikörper für die Affinitätserfassung des proteotypischen Peptids zu verwenden, ist es möglich, auch maßgeschneiderte Anti-Peptid-Antikörper zu verwenden. Die Aufreinigungseffizienz der Peptiderfassung im Vergleich zur Proteineinfang ist in Abbildung 5 dargestellt. Durch den Austausch der Agarosekügelchen, die für die Herstellung von Trypsinkügelchen verwendet werden, gegen magnetische Kügelchen soll das Verfahren auch mit robotergestützten Probenvorbereitungsarbeitsplätzen auf dem Markt kompatibel sein.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Wir danken Prof. Elisabeth Paus vom Norwegian Radium Hospital (Oslo University Hospital, Oslo, Norwegen) für die Bereitstellung des ProGRP-Standards und des monoklonalen Anti-ProGRP-Antikörpers M18. Die Publikationsgebühr wurde durch ein Stipendium des Apotekers Harald Conrad Thaulows legat gedeckt. Trine Grønhaug Halvorsen und Léon Reubsaet sind Partner im Konsortium National Network of Advanced Proteomics Infrastructure (NAPI), das vom norwegischen Forschungsrat INFRASTRUKTUR-Programm finanziert wird (Projektnummer: 295910).
Materialien
| Name | Company | Catalog Number | Comments |
| Acetic acid N-hydroxysuccinimide ester | Carbosynt (Staad, Switzerland) | FA33719 | Store in freezer below -20 °C |
| ALGNQQPSWDSEDSSNF[K_13C6 _15N2] (≥ 95%) | Innovagen (Lund, Sweden) | Not applicable | Store in freezer below -20 °C |
| Ammonium bicarbonate BioUltra (≥ 99.5% ) | Sigma Aldrich (St. Louis, MO, USA) | 09830-500G | |
| Aquasil C18 column, 3 µm, 50 mm x 1 mm | Thermo scientific (Waltham, MA, USA) | 77503-051030 | Analytical column compatible with 100% aqueous mobile phase |
| Benzamidine (≥ 95.0% ) | Sigma Aldrich (St. Louis, MO, USA) | 12072 | Store in fridge at 2-6 °C |
| Calsium chloride dihydrate (≥ 99% ) | Sigma Aldrich (St. Louis, MO, USA) | 223506-500G | |
| Centrifuge 5804 | Eppendorf (Hamburg, Tyskland) | 5804000010 | |
| Cloned ProGRP isoform 1 | Radium hospital, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in freezer below -20 °C |
| Disodium hydrogenphosphate dihydrate (pro analysis) | Sigma Aldrich (St. Louis, MO, USA) | 30435-500G | |
| Disodium hydrogenphosphate dodecahydrate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.06579.0500 | |
| Dynabeads M-280 tosylactivated 10 mL | Invitrogen (Carlsbad, USA) | 14204 | Store in fridge at 2-6 °C |
| DynaMag-2 | Invitrogen (Carlsbad, USA) | 123-21D | |
| Ethanolamine (pro analysis, ≥ 99%) | Sigma Aldrich (St. Louis, MO, USA) | #02400 | |
| Formic acid (≥ 99% ) for LC-MS | VWR International (Radnor, PA, USA) | 84865.260 | |
| FTA DMPK-C cellulose card | Whatman (Kent, UK) | WB129243 | DBS card |
| HPLC vials, clear glass, 1.5 mL, 32 x 11.6 mm, Clean Pack | Nerliens Meszansky (Oslo, Norge) | LPP 11 09 0519 | |
| Hulamixer sample mixer | Invitrogen (Carlsbad, USA) | 101561503016 | Sample mixer with end-over-end mixing and reciprocal rotation and vibration |
| Human serum from healty blood donors | Bloodbank, Ullevål, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in freezer below -20 °C |
| Hydrochloric acid fuming 37% (Emsure for analysis) | Merck (Darmstadt, Tyskland) | 1.00317.1000 | |
| LC-MS/MS system: Ultimate 3000 system (Autosampler, WPS-3000TRS; Micropump, LPG-3400M; Flow manager, FLM-3300, MIC, 1X2P-10P) and TSQ Quantum access. Controlled by Xcalibur 2.2 SP1.48 | Thermo scientific (Waltham, MA, USA) | Not applicable | |
| LiChrosolv Acetonitrile hypergrade for LC-MS | Merck (Darmstadt, Tyskland) | 1.00029.2500 | |
| LL Biotrode, Combined glass electrode | Metrohm (Herisau, Sveits) | 6.0224.100 | |
| Magnetic stirrer, Type M10 | Franz Morat KG (Eisenbach, Germany) | 10236 | |
| Micro inserts, glass (31 x 6 mm, 0.1 mL) | VWR International (Radnor, PA, USA) | 548-0006 | |
| MilliQ integral 3 with Q-POD | Merck Millipore (Molsheim, France) | ZRXQ003T0 | For production of Type 1 water |
| monoclonal antibody M18 | Radium hospital, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in fridge at 2-6 °C |
| Neoteryx Mitra microsampler (10 μL) 4 sampler Clamshell | Fisher Scientific (Waltham, MA, USA) | NC1382947 | |
| NHS-activated sepharose beads 4 fast flow | Sigma Aldrich (St. Louis, MO, USA) | GE17-0906-01 | Agarose beads, store in fridge at 2-6 °C |
| Optifit, Refill pipet tips, 10 mL | Sartorius Biohit (Helsinki, Finland) | 613-2911 | |
| Optifit, Refill pipet tips, 10 μL | Sartorius Biohit (Helsinki, Finland) | 790012 | |
| Optifit, Refill pipet tips, 1,000 μL | Sartorius Biohit (Helsinki, Finland) | 791002 | |
| Optifit, Refill pipet tips, 200 μL | Sartorius Biohit (Helsinki, Finland) | 790202 | |
| pH glass electrode | Metrohm (Herisau, Sveits) | 6.0233.100 | |
| pH meter 744 | Metrohm (Herisau, Sveits) | 8.744.1003 | |
| Pipet 10 mL | Sartorius Biohit (Helsinki, Finland) | 725090 | |
| Pipet m10 µL | Sartorius Biohit (Helsinki, Finland) | 725020 | |
| Pipet m100 µL | Sartorius Biohit (Helsinki, Finland) | 725050 | |
| Pipet m1,000 µL | Sartorius Biohit (Helsinki, Finland) | 725070 | |
| Pipet m20 µL | Sartorius Biohit (Helsinki, Finland) | 725030 | |
| Potassium chloride (KCl ≥ 99.9%) | Sigma Aldrich (St. Louis, MO, USA) | P-3911 | |
| Potassium dihydrogenphosphate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.04873.0250 | |
| Protein LoBind Eppendorf tube 0.5 mL | Eppendorf (Hamburg, Tyskland) | 525-0133 (0030 108.094) | |
| Protein LoBind Eppendorf tube 1.5 mL | Eppendorf (Hamburg, Tyskland) | 525-0132 (0030 108.116) | |
| Protein LoBind Eppendorf tube 2.0 mL | Eppendorf (Hamburg, Tyskland) | 525-0134 (0030 108.450) | |
| Protein LoBind Eppendorf tube 5.0 mL | Eppendorf (Hamburg, Tyskland) | 525-0792 (0030108.302) | |
| Scissors | Sigma Aldrich (St. Louis, MO, USA) | Z186716-1EA | |
| Sodium azide (BioUltra; ≥ 99.5% ) | Sigma Aldrich (St. Louis, MO, USA) | 71289-5G | |
| Sodium chloride (for analysis) | Merck (Darmstadt, Tyskland) | 1.06404.1000 | |
| Sodium dihydrogenphosphate monohydrate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.06346.0500 | |
| Sodium hydroxide (AnalaR NORMAPUR) | VWR International (Radnor, PA, USA) | 28244.295 | |
| Sodium tetraborate decahydrate (≥ 99. %) | Sigma Aldrich (St. Louis, MO, USA) | S9640-500G | |
| Spectrafuge Mini Centrifuge | LABNET International (Edison, NJ, USA) | C1301 | |
| Stirring magnet, 25 mm x 6 mm Ø, circular | Leybold (Cologne, Germany) | 666 851 | |
| Stuart Scientific SA8 vortex mixer | Stuart (Staffordshire, UK) | Z648531-1EA | |
| SuperClear centrifuge tubes (15 mL) | VWR International (Radnor, PA, USA) | 525-0150 | |
| SuperClear centrifuge tubes (50 mL) | VWR International (Radnor, PA, USA) | 525-0155 | |
| Thermomixer comfort 1.5 mL | Eppendorf (Hamburg, Tyskland) | 53,55,27,831 | Temperature controlled mixer |
| Trizma base (reagent grade, ≥ 99.0 %) | Sigma Aldrich (St. Louis, MO, USA) | T6066 | Tris(hydroxymethyl)aminometan (tris) |
| Trizma HCl (reagent grade, ≥ 99.0%) | Sigma Aldrich (St. Louis, MO, USA) | T3253-100G | Tris(hydroxymethyl)aminometan HCl (tris HCl) |
| Trypsin (TCPK-treated from bovine pancreas, 10,000-15,000 BAEE units/mg Protein) | Sigma Aldrich (St. Louis, MO, USA) | T8802 | Store in freezer below -20 °C |
| Tween 20 | Sigma Aldrich (St. Louis, MO, USA) | P7949-500ML | polysorbate 20 |
| Tweezers | Sigma Aldrich (St. Louis, MO, USA) | TEM-78511-27 | |
| Vial caps, white, 9 mm | Nerliens Meszansky (Oslo, Norge) | LPP 09 15 0981 | |
| Mitra microsampler with VAMS (Volumetric adsorptive microsampling) technology, 10 µL, 4-sampler clamshell | Neoteryx (Torrance, CA, USA) |
Referenzen
- Bang, I. B. Fresenius. Zeitschrift für analytische Chemie. 52 (7), 521-523 (1913).
- Guthrie, R., Susi, A. A simple phenylalanine method for detecting phenylketonuria in large populations of newborn infants. Pediatrics. 32 (3), 338-343 (1963).
- Laurell, C. B. A screening test for α1-antitrypsin deficiency. Scandinavian Journal of Clinical and Laboratory Investigation. 29 (3), 247-248 (1972).
- Thielmann, K., Aquino, A. M. Whole blood samples dried and stored on filter paper as substrate for the electrophoretic separation on hemoglobin S from hemoglobin A. A screening procedure. Clinica Chimica Acta. 35 (1), 237-238 (1971).
- Wada, Y., Fujita, T., Kidoguchi, K., Hayashi, A. Fetal hemoglobin variants in 80,000 Japanese neonates: High prevalence of Hb F Yamaguchi (AγT 80 Asp→Asn). Human Genetics. 72 (3), 196-202 (1986).
- Halvorsen, T. G., McKitterick, N., Kish, M., Reubsaet, L. Affinity capture in bottom-up protein analysis-overview of current status of proteolytic peptide capture using antibodies and molecularly imprinted polymers. Analytica Chimica Acta. 1182, 338714 (2021).
- Halvorsen, T. G., Reubsaet, L. Antibody based affinity capture LC-MS/MS in quantitative determination of proteins in biological matrices. TrAC Trends in Analytical Chemistry. 95, 132-139 (2017).
- Neubert, H., et al. Protein biomarker quantification by immunoaffinity liquid chromatography-tandem mass spectrometry: Current state and future vision. Clinical Chemistry. 66 (2), 282-301 (2020).
- Pan, S., et al. Mass spectrometry based targeted protein quantification: methods and applications. Journal of Proteome Research. 8 (2), 787-797 (2008).
- Enderle, Y., Foerster, K., Burhenne, J. Clinical feasibility of dried blood spots: Analytics, validation, and applications. Journal of Pharmaceutical and Biomedical Analysis. 130, 231-243 (2016).
- Londhe, V., Rajadhyaksha, M. Opportunities and obstacles for microsampling techniques in bioanalysis: Special focus on DBS and VAMS. Journal of Pharmaceutical and Biomedical Analysis. 182, 113102 (2020).
- Denniff, P., Spooner, N. The effect of hematocrit on assay bias when using dbs samples for the quantitative bioanalysis of drugs. Bioanalysis. 2 (8), 1385-1395 (2010).
- Denniff, P., Spooner, N. Volumetric absorptive microsampling: A dried sample collection technique for quantitative bioanalysis. Analytical Chemistry. 86 (16), 8489-8495 (2014).
- Levernæs, M. C. S., et al. Immunocapture sample clean-up in determination of low abundant protein biomarkers-a feasibility study of peptide capture by anti-protein antibodies. RSC Advances. 9 (60), 34902-34911 (2019).
- Conradie, J. D., Govender, M., Visser, L. Elisa solid phase: Partial denaturation of coating antibody yields a more efficient solid phase. Journal of Immunological Methods. 59 (3), 289-299 (1983).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten