Method Article
أخذ العينات المجهرية في تحليل البروتين القائم على قياس الطيف الكتلي المستهدف للبروتينات منخفضة الوفرة
In This Article
Summary
يتم تقديم بروتوكول لتحديد المؤشرات الحيوية منخفضة الوفرة من عينات المصل المجففة المتمثلة في الببتيد المطلق للبروغاسترين (ProGRP). تستخدم الخرزات المغناطيسية المغلفة بالأجسام المضادة للتنظيف الانتقائي وإثراء ببتيد ProGRP البروتيني. يتم تحليل الببتيد الذي تم التقاطه لاحقا بواسطة مطياف الكتلة اللوني الترادفي السائل.
Abstract
تقدم هذه الورقة بروتوكولا يحتوي على أوصاف مفصلة لتنظيف العينات بكفاءة من البروتينات منخفضة الوفرة من العينات المجففة. يتم إجراء ذلك باستخدام التحلل البروتيني القائم على الخرز قبل تحديد تقارب الببتيد البروتيني وقياس الطيف الكتلي الترادفي للكروماتوغرافيا السائلة (LC-MS / MS). يمكن تطبيق الإجراء على كل من العينات المجففة التقليدية باستخدام البطاقات الورقية (على سبيل المثال ، بقع الدم المجففة [DBSs] وبقع المصل المجففة [DSSs]) ، وكذلك العينات التي تم جمعها باستخدام طرق أخذ العينات الأحدث مثل أخذ العينات المجهرية الامتصاصية الحجمية (VAMS). بالإضافة إلى وصف هذا الإجراء ، يتم تقديم إعداد كل من حبات التربسين والخرز المغلفة بالأجسام المضادة بطريقة خطوة بخطوة في هذا العمل. مزايا الإجراء المقدم هي تحلل البروتين الفعال من حيث الوقت باستخدام الخرز والتنظيف القوي الانتقائي باستخدام التقاط تقارب الببتيد. يصف الإجراء الحالي تحديد العلامة الحيوية لسرطان الرئة ذو الخلايا الصغيرة (SCLC) منخفض الوفرة ، الببتيد المطلق للبروجاسترين (ProGRP) ، في المصل المجفف (كل من DSSs و VAMS). تسهل الإجراءات التفصيلية لإعداد الخرزة تنفيذ سير العمل في التطبيقات الجديدة أو المختبرات الأخرى. وتبين أن النتائج قد تعتمد على مواد أخذ العينات؛ وبالنسبة للمشروع الحالي، شوهدت كثافة إشارة أعلى للعينات المجمعة باستخدام نظام VAMS مقارنة بأنظمة الترصد الديموغرافي.
Introduction
أخذ العينات المجهرية موجود منذ أكثر من 100 عام منذ أن وصف Ivar Bang مراقبة الجلوكوز من DBSs في عام 19131. بعد أن قدم Guthrie و Susi DBSs في عام 1963 لتحديد الفينيل ألانين في الأطفال حديثي الولادة2 ، أصبحت هذه التقنية منتشرة بشكل متزايد. تم تقديم التقارير الأولى من DBSs لأخذ العينات وتخزين البروتينات في أوائل سبعينيات القرن العشرين3،4 ، وبعد عقد من الزمان ، في ثمانينيات القرن العشرين ، وجدنا أول تقرير لقياس الطيف الكتلي (MS) لتحديد البروتينات من DBSs5. على الرغم من هذا الإدخال المبكر ، لم يكن تحديد مرض التصلب العصبي المتعدد للبروتينات من DBSs وتقنيات أخذ العينات المجهرية الأخرى أكثر انتشارا إلا بعد مطلع القرن.
في السياق السريري ، من المهم تحديد البروتينات في تشخيص ومتابعة الأمراض ، وكذلك لأغراض مراقبة العلاج والمنشطات. لا يزال هذا التحديد المستهدف لتحليلات البروتين بواسطة MS من كميات صغيرة من العينات المجففة يمثل تحديا ، وغالبا ما يتطلب إعدادا مكثفا للعينة قبل التحليل.
عادة ما يتم إجراء التحديد الكمي المستهدف للبروتينات بواسطة مرض التصلب العصبي المتعدد من خلال تطبيق النهج التصاعدي ، وهضم البروتينات إلى الببتيدات قبل التحليل. ينتج عن هذا الإجراء عدد لا يحصى من الببتيدات ، مما يجعل التحليل المباشر للعينة البيولوجية المهضومة أمرا صعبا. تتمثل إحدى طرق التحايل على ذلك في تطبيق خطوة تنظيف التقارب الانتقائي مقدما لتحليل مرض التصلب العصبي المتعدد إما قبل أو بعد الهضم6،7،8. وبهذه الطريقة ، يتم عزل البروتين محل الاهتمام (أو الببتيد البروتيني ، إذا تم تنفيذ خطوة التقاط التقارب بعد الهضم) بشكل انتقائي من مصفوفة العينة قبل التحليل ، مما يوفر حدود اكتشاف أقل9.
يتميز أخذ العينات المجهرية باستخدام بطاقات DBS بمزايا معينة مقارنة بعينات الدم التقليدية ، بما في ذلك انخفاض حجم العينة ، وأخذ العينات الأقل توغلا ، وزيادة استقرار التخزين. ومع ذلك ، فإن مصفوفة العينة مختلفة ويمكن أن تقدم تحديات أخرى في التحليل (على سبيل المثال ، مصفوفة العينة المجففة مقابل السائلة والدم الشعري مقابل المصل أو البلازما)10,11. التحدي الآخر الذي لوحظ مع DBSs هو ما يسمى تأثير الهيماتوكريت ، حيث يؤثر الهيماتوكريت في الدم على حجم العينة الذي تمت معالجته بشكل أكبر للتحليل ، وبالتالي يقدم التباين بين الأفراد في التحليل12. تعالج وحدات أخذ العينات المجهرية الأحدث ، مثل VAMS التي تم تقديمها في 201413 ، هذه المشكلة من خلال جمع كمية ثابتة من الدم بدلا من قطرة الدم.
يصف هذا البروتوكول إعدادا لتحليل المؤشرات الحيوية منخفضة الوفرة من العينات الدقيقة المجففة. بعد الشطف ، يتم هضم العينة المجففة ، وبعد ذلك ، يتم عزل الببتيد البروتيني عن طريق التقاط تقارب الببتيد. تحليل النموذج هو العلامة الحيوية SCLC ProGRP. نظرا لأنه لا يمكن تحديد ProGRP بشكل موثوق من الدم الكامل ، فقد تم استخدام المصل كمصفوفة عينة. يتم عرض النتائج التمثيلية من كل من DSSs وعينات المصل التي تم جمعها باستخدام VAMS.
Protocol
تم استخدام المصل من المتبرعين بالدم الأصحاء لإعداد الحلول القياسية. تم استخدام المصل من المتبرعين بالدم الأصحاء بما يتفق بدقة مع القانون النرويجي. تم الحصول على موافقة مستنيرة من جميع الأشخاص. تم تحليل عينات المصل باستخدام طرق وفقا للإرشادات واللوائح ذات الصلة. البروتوكول الموصوف هو نسخة معدلة من الطريقة الموضحة في العمل السابق14. يمكن العثور على نظرة عامة على تكوين المخازن المؤقتة والحلول وكيفية تحضيرها في الجدول التكميلي S1 ، بينما يحتوي جدول المواد على المواد والمعدات والكواشف المستخدمة في هذا البروتوكول.
1. إعداد الخرز المغناطيسي المغلفة بالأجسام المضادة
- احسب كمية الأجسام المضادة اللازمة لإعداد العدد المطلوب من الخرز. استخدم 1 ملغ من الأجسام المضادة لكل 50 ملغ من الخرز المغناطيسي.
ملاحظة: عادة ، يتم استخدام 20 ميكرولتر من معلق حبة 20 مجم / مل لكل عينة في التجارب اللاحقة (انظر الخطوة 5.1). - احسب حجم الأجسام المضادة اللازمة لإعداد العدد المطلوب من الخرز.
ملاحظة: يعتمد حجم الجسم المضاد على تركيز الأجسام المضادة ويجب حسابه لكل جسم مضاد. - انقل الحجم المطلوب من محلول الأجسام المضادة إلى أنبوب طرد مركزي منخفض البروتين منخفض البروتين سعة 5 مل. على سبيل المثال ، إذا كان محلول الجسم المضاد يحتوي على 1 مجم / مل من الجسم المضاد ، فاستخدم 0.4 مل لتحضير 1.0 مل من معلق الخرزة (20 مجم خرز / مل مع 1 مجم جسم مضاد / 50 مجم خرز).
ملاحظة: يجب أن تكون الأجسام المضادة في مخزن مؤقت خال من الأمينات. استخدم أنابيب الطرد المركزي الدقيقة منخفضة الارتباط بالبروتين لجميع المحاليل التي تحتوي على البروتينات لتجنب فقدان المادة المراد تحليلها بسبب الامتزاز. - أضف قضيب تحريك مغناطيسي صغير إلى محلول الأجسام المضادة واضبط الرقم الهيدروجيني على 2.5 تحت التحريك المستمر. استخدم مقياس الأس الهيدروجيني مع قطب كهربائي دقيق لقياس الأس الهيدروجيني وضبط الأس الهيدروجيني عن طريق الجمع التدريجي لأحجام محددة من 1.0 M HCl (ابدأ بإضافة 10 ميكرولتر أجزاء من 1.0 M HCl وتقليل الحجم مع اقتراب الرقم الهيدروجيني من 2.5). سجل الحجم الكلي ل 1.0 M HCl اللازم لضبط الرقم الهيدروجيني إلى 2.5.
- قم بإزالة القطب الصغير واحتضان الجسم المضاد المحمض على الجليد على محرك مغناطيسي لمدة 1 ساعة.
ملاحظة: يتم إجراء المعالجة الحمضية للجسم المضاد لتعزيز الاتجاه الصحيح للأجسام المضادة على الخرزة. يمكن تقليل تركيز حمض الهيدروكلوريك إلى 0.5 M أو 0.2 M HCl ، اعتمادا على تركيز المخزن المؤقت في محلول الجسم المضاد. - تحييد محلول الأجسام المضادة. استخدم مقياس الأس الهيدروجيني مع قطب كهربائي دقيق لقياس الأس الهيدروجيني وضبط الأس الهيدروجيني إلى 7 عن طريق الجمع التدريجي لأحجام محددة تبلغ 1.0 M NaOH (ابدأ بجزء 10 ميكرولتر وقم بتقليل الحجم مع اقتراب الأس الهيدروجيني من 7). سجل الحجم الإجمالي 1.0 مليون هيدروكسيد الصوديوم المضافة.
ملاحظة: يجب أن يكون تركيز هيدروكسيد الصوديوم هو نفسه تركيز حمض الهيدروكلوريك المستخدم في الخطوة 1.4. هيدروكسيد الصوديوم شديد التآكل. استخدم معدات الحماية ، بما في ذلك القفازات وحماية العين المناسبة. - احسب الحجم المطلوب من حبات التوسيل المغناطيسية المنشطة المراد استخدامها.
ملاحظة: عادة ، يوصى باستخدام حبات 20 مجم / مل عند إجراء اقتران صغير الحجم. يجب استخدام ما لا يقل عن 5 ملغ من الخرز. - امزج تعليق الخرزة المغناطيسية جيدا على خلاط دوامة واسحب حجما يحتوي على الكمية المطلوبة من تعليق الخرزة. على سبيل المثال ، لتحضير 1 مل من معلق الخرزة ، اسحب حجما يحتوي على 20 مجم من الخرز (667 ميكرولتر إذا كان تركيز الخرزات 30 مجم / مل).
- ضع تعليق الخرزة على رف مغناطيسي لمدة 1 دقيقة وقم بإزالة المادة الطافية. اغسل الخرزات 2x بحجم متساو من النوع 1 H2O (667 ميكرولتر إذا تم استخدام محلول حبة 30 مجم / مل لتحضير 1 مل من 20 مجم / مل من الخرز المغلف بالأجسام المضادة). تخلط باستخدام خلاط دوامة بعد كل إضافة من محلول الغسيل ووضعها على الرف المغناطيسي لمدة 1 دقيقة قبل إزالة المادة الطافية.
- أضف ما يلي إلى الخرزات المغناطيسية: الجسم المضاد المعالج بالحمض ، 0.5 M بورات عازلة (درجة الحموضة 9.5) (1/5 من الحجم الكلي حيث يجب أن يكون التركيز النهائي 0.1 M ؛ وهذا يساوي 0.2 مل لتحضير 1 مل من تعليق الخرزة) ، ومخزن اقتران لاقتران الأجسام المضادة (لإعداد 1 مل من الخرز المغناطيسي المغلف بالأجسام المضادة ، يجب أن يساوي حجم المخزن المؤقت للاقتران 1 مل - حجم الجسم المضاد المعالج بالحمض - 0.2 مل من محلول بورات). تخلط باستخدام خلاط دوامة.
ملاحظة: حجم الجسم المضاد المعالج بالحمض يساوي حجم محلول الأجسام المضادة (0.4 مل في تحضير 1 مل من معلق الخرزة باستخدام محلول جسم مضاد 1 مجم / مل) + حجم 1.0 M HCl المستخدم لضبط الرقم الهيدروجيني إلى 2.5 + حجم 1.0 M NaOH المستخدم لضبط الرقم الهيدروجيني إلى 7).
ملاحظة: يمكن العثور على تركيبة المخزن المؤقت للبورات 0.5 متر (الرقم الهيدروجيني 9.5) ومخزن الاقتران لاقتران الأجسام المضادة في الجدول التكميلي S1. - قم بالتدوير في درجة الحرارة المحيطة طوال الليل باستخدام خلاط عينات من طرف إلى طرف ، ويفضل أن يكون ذلك مع الدوران المتبادل والاهتزاز.
- أجهزة الطرد المركزي لمدة 10 دقائق في 239 × غرام. ضع الأنبوب على المغناطيس لمدة 2 دقيقة وقم بإزالة المادة الطافية.
- اغسل الخرزات 2 × 2 ساعة ومرة واحدة طوال الليل عن طريق الدوران في مخزن مؤقت للتخزين لخرز الأجسام المضادة في درجة الحرارة المحيطة باستخدام خلاط عينات من طرف إلى طرف. استخدم نفس وحدة التخزين مثل الحجم الإجمالي في الخطوة 1.10. ضع الأنبوب على المغناطيس لمدة 1 دقيقة وقم بإزالة المادة الطافية بين كل غسلة.
ملاحظة: يمكن العثور على تركيبة مخزن التخزين المؤقت لخرز الأجسام المضادة في الجدول التكميلي S1. - يخزن في المخزن المؤقت المطلوب (على سبيل المثال ، نفس المخزن المؤقت كما في الخطوة 1.13) باستخدام تركيز المخزون المطلوب من الخرز (عادة 20 مجم / مل). تخزينها في الثلاجة.
2. تحضير 2 مل من حبات التربسين المجمدة (حبات 20 مجم / مل)
- أضف 20 مل من 1 ملليمتر هيدروكلورايد إلى 2 مل من حبات الأغاروز المنشطة بواسطة NHS لغسل الخرز.
- الخلط وأجهزة الطرد المركزي عند 2655 × جم لمدة 5 دقائق. إزالة الطاف.
- أضف 20 مل من 0.1 M فوسفات عازلة (درجة الحموضة 7.8). امزج باستخدام خلاط دوامة وأجهزة طرد مركزي على حرارة 2655 × جم لمدة 5 دقائق. إزالة الطاف.
ملاحظة: يمكن العثور على تكوين 0.1 M فوسفات عازلة (الرقم الهيدروجيني 7.8) في الجدول التكميلي S1. - أضف 2 مل من 20 ملغ/مل من التربسين (يذوب في محلول التوصيل البارد لاقتران التربسين).
ملاحظة: يمكن العثور على تركيبة المخزن المؤقت للاقتران لاقتران التربسين في الجدول التكميلي S1. قم بتخزين المخزن المؤقت في الثلاجة. - احتضانها لمدة 25 دقيقة عند 22 درجة مئوية و 1100 دورة في الدقيقة باستخدام خلاط يتم التحكم في درجة حرارته. جهاز طرد مركزي عند 2655 × جم لمدة 5 دقائق. إزالة الطاف.
- أضف 2 مل من محلول التعديل لتحضير حبات التربسين واحتضانها لمدة 20 دقيقة عند 22 درجة مئوية و 1100 دورة في الدقيقة باستخدام خلاط يتم التحكم في درجة حرارته. جهاز طرد مركزي عند 2655 × جم لمدة 5 دقائق. إزالة الطاف.
ملاحظة: يمكن العثور على تركيبة المخزن المؤقت للتعديل لإعداد حبات التربسين في الجدول التكميلي S1. قم بتخزين المخزن المؤقت في الثلاجة. - أضف 10 مل من المخزن المؤقت المانع لتحضير حبات التربسين واحتضانها لمدة 10 دقائق عند 22 درجة مئوية و 1100 دورة في الدقيقة باستخدام خلاط يتم التحكم في درجة حرارته. أجهزة الطرد المركزي عند 2655 × جم لمدة 5 دقائق. إزالة الطاف.
ملاحظة: يمكن العثور على تركيبة المخزن المؤقت المانع لإعداد حبات التربسين في الجدول التكميلي S1. قم بتخزين المخزن المؤقت في الثلاجة. - أضف 2 مل من المخزن المؤقت للتخزين ، واخلطه باستخدام خلاط دوامة ، واحفظه في الثلاجة حتى الاستخدام.
ملاحظة: يمكن العثور على تركيبة المخزن المؤقت للتخزين لخرز التربسين في الجدول التكميلي S1. قم بتخزين المخزن المؤقت في الثلاجة.
3. أخذ عينات DSS / VAMS والاستخراج اللاحق للمصل المجفف
- قم بإعداد المعايير عن طريق زيادة المصل باستخدام ProGRP (أو البروتين محل الاهتمام) على المستوى المناسب. حافظ على ارتفاع مستوى الصوت ≤ 1٪ من الحجم الكلي.
ملاحظة: هنا ، تم استخدام محلول مخزون 295 ميكروغرام / مل ProGRP في الماء لإعداد معايير المصل المسننة. - خلط المعايير على خلاط دوامة.
- ضع 10 ميكرولتر من المصل (المعايير المسننة) على بطاقات DBS أو اترك 10 ميكرولتر من المصل يتم جمعها بواسطة VAMS (10 ميكرولتر) باستخدام إرشادات الشركة المصنعة. بالنسبة إلى DSS ، تأكد من أن البقعة داخل الدائرة المنقطة.
- اتركيه يجف في الهواء في درجة الحرارة المحيطة لمدة 2 ساعة على الأقل.
- اقطع البقعة بأكملها وانقلها إلى أنبوب طرد مركزي دقيق منخفض البروتين سعة 2 مل أو قم بإزالة VAMS من الحامل وضعه في أنبوب طرد مركزي منخفض البروتين سعة 2 مل.
- أضف 1000 ميكرولتر من محلول بيكربونات الأمونيوم (ABC) 100 mM. استخرج المصل المجفف من البقعة / VAMS لمدة 1 ساعة عند 22 درجة مئوية باستخدام خلاط يتم التحكم في درجة حرارته عند 1000 دورة في الدقيقة.
- انقل المستخلص إلى أنبوب طرد مركزي جديد منخفض البروتين سعة 1.5 مل للتحلل البروتيني التربتي.
4. هضم مستخلصات DSS / VAMS
- استخدم 30 ميكرولتر من حبات التربسين (كما هو محضر في القسم 2) لكل عينة. انقل حجما يحتوي على حبات التربسين لجميع العينات إلى أنبوب طرد مركزي دقيق جديد منخفض البروتين سعة 1.5 مل ، وأجهزة طرد مركزي عند 2655 × جم لمدة 5 دقائق ، وقم بإزالة المادة الطافية.
- اغسل حبات التربسين 2x ب 1 مل من 50 مللي متر ABC البارد ، قبل تعليقها بنفس الحجم الذي تم سحبه. جهاز طرد مركزي عند 2655 × جم لمدة 5 دقائق وإزالة المادة الطافية بين الخطوات.
- أضف 30 ميكرولتر من حبات التربسين المغسولة إلى كل مستخلص DSS / VAMS لبدء عملية الهضم.
- احتضان لمدة 2 ساعة عند 37 درجة مئوية و 1000 دورة في الدقيقة باستخدام خلاط يتم التحكم في درجة حرارته أو ما شابه ذلك. جهاز طرد مركزي عند 2655 × جم لمدة 5 دقائق ونقل المادة الطافية (وليس الخرزات) إلى أنبوب طرد مركزي جديد منخفض البروتين سعة 2.0 مل.
- أضف 25 ميكرولتر من محلول المعيار الداخلي (IS) 14 نانوغرام / مل يحتوي على الببتيد الموسوم بالنظائر المستقرة (SIL) ALGNQQPSWDSEDSSNF [K_13C6_15 N2] في محلول ABC 100mM.
5. التقاط الببتيد ProGRP البروتيني باستخدام حبات مغناطيسية مغلفة بالأجسام المضادة
- استخدم 20 ميكرولتر من الخرزات المغلفة بالأجسام المضادة (20 مجم / مل كما هو محضر في القسم 1) لكل استخراج. انقل جميع الخرزات المغلفة بالأجسام المضادة إلى أنبوب طرد مركزي جديد منخفض البروتين سعة 1.5 مل ، وضعه على المغناطيس لمدة دقيقة واحدة ، وقم بإزالة المخزن المؤقت للتخزين.
- اغسل الخرزات المغلفة بالأجسام المضادة المغناطيسية ب 1 مل من محلول ملحي مخزن بالفوسفات (PBS) ، ودرجة حموضة 7.4 ، تحتوي على 0.05٪ بوليسوربات 20 ، و 2 × 1 مل من PBS قبل تعليقها بنفس الحجم الذي تم سحبه. تخلط على خلاط دوامة وتوضع على المغناطيس لمدة 1 دقيقة بين التبادلات العازلة.
ملاحظة: يحتوي PBS على 137 مللي مول كلوريد الصوديوم ، 2.7 مللي مول KCl ، 8 مللي متر Na 2 HPO 4، و 1.8 مللي متر KH2PO4. يوصى بإعداد المحلول بتركيز 10x لزيادة الاستقرار. لتكوين 100 مل من 10x PBS ، انظر الجدول التكميلي S1. التخفيف من 10x PBS 10x سيحقق درجة حموضة ~ 7.4. - أضف 20 ميكرولتر من معلق الخرزة المغناطيسية المغسولة إلى كل أنبوب طرد مركزي دقيق منخفض الارتباط بالبروتين يحتوي على مستخلص DSS / VAMS المهضوم و IS. قم بإجراء الاستخراج المناعي لمدة 1 ساعة باستخدام خلاط عينات من طرف إلى طرف في درجة الحرارة المحيطة.
- اغسل الخرزات المغناطيسية باستخدام المحاليل التالية: 500 ميكرولتر من PBS مع 0.05٪ (v / v) بوليسوربات 20 ، 400 ميكرولتر من PBS ، 300 ميكرولتر من 10 mM Tris HCl (درجة الحموضة 7.4) ، و 300 ميكرولتر من 100 mM ABC.
- بعد إضافة كل محلول غسيل ، قم بإزالة أنبوب الطرد المركزي الدقيق منخفض الارتباط بالبروتين مع الخرز ومحلول الغسيل من رف المغناطيس واقلبه بعناية حتى يصبح متجانسا. بعد ذلك ، ضع أنبوب الطرد المركزي الدقيق منخفض البروتين على المغناطيس لمدة 30 ثانية ، واقلب لمدة 30 ثانية ، وضعه على المغناطيس لمدة 1 دقيقة. قم بإزالة محلول الغسيل.
- قم بتدوير التعليق المتبقي باستخدام جهاز طرد مركزي دقيق. ضع على المغناطيس لمدة 1 دقيقة وقم بإزالة محلول الغسيل المتبقي.
- أضف 15 ميكرولتر من حمض الفورميك 2٪ (v / v) في النوع 1 H2O إلى كل عينة واحتضانها لمدة 5 دقائق عند 22 درجة مئوية و 1000 دورة في الدقيقة باستخدام خلاط يتم التحكم في درجة حرارته ، أو ما شابه ذلك ، للتخلص من الببتيدات الملتقطة. ضعه على المغناطيس لمدة دقيقة واحدة وانقل الشطف إلى أنبوب طرد مركزي جديد منخفض البروتين سعة 1.5 مل. كرر مرة واحدة وانقل الشطف الثاني إلى نفس أنبوب الطرد المركزي الدقيق منخفض الارتباط بالبروتين مثل الشطف الأول.
- أضف 20 ميكرولتر من 100 mM ABC إلى كل شطف (الحجم الإجمالي 50 ميكرولتر).
- أجهزة الطرد المركزي (أجهزة الطرد المركزي الدقيقة) ونقل 40 ميكرولتر من الشطف إلى إدخالات دقيقة لقوارير كروماتوغرافيا سائلة عالية الأداء (HPLC).
6. التحليل بواسطة LC-MS / MS
- استخدم micro LC ثلاثي القطب رباعي MS مع تأين الرش الكهربائي للحصول على متانة عالية.
- قم بإعداد نظام LC-MS / MS للتحليل عن طريق تطهير المضخات بالمرحلة المتنقلة A (20 mM FA في H 2 O و MeCN ، 95: 5 فولت / فولت) و B (20 مللي متر FA في H2O و MeCN ، 5:95 فولت / فولت).
- أدخل العمود التحليلي (C18 ، القطر الداخلي 50 مم × 1 مم [ID] ، جسيمات 3 ميكرومتر).
- الاستمرار في إعداد الأداة للتحليل باتباع إجراءات بدء التشغيل للأداة المحددة.
- في برنامج الجهاز ، اضبط درجة حرارة فرن العمود على 25 درجة مئوية ومعدل التدفق على 50 ميكرولتر / دقيقة (المرحلة المتنقلة 100٪ A).
- وازن العمود مع المرحلة A المتنقلة لمدة 15 دقيقة على الأقل.
- ضع العينات في جهاز أخذ العينات التلقائي.
- إعداد طريقة الجهاز لتحليل الببتيد التربتي الخاص ب ProGRP ALGNQQPSWDSEDSSNFK ، و IS.
ملاحظة: العديد من معلمات الطريقة خاصة بالأداة ويجب تحسينها على الأداة المحددة المستخدمة. يتم وصف تفاصيل معلمات الأسلوب المستخدمة هنا في الخطوات من 6.9 إلى 6.11. - بالنسبة لبرنامج التدرج في LC ، استخدم الإعدادات التالية: معدل التدفق: 50 ميكرولتر / دقيقة ؛ من وقت 0.0 إلى 3.0 دقيقة: 100٪ المرحلة المتنقلة A ؛ من وقت 3.0 إلى 18.0 دقيقة: تشغيل تدرج خطي من 0٪ إلى 50٪ المرحلة المتنقلة B ؛ من وقت 18.0 إلى 18.1 دقيقة: زيادة المرحلة المتنقلة B من ٪50 إلى ٪100؛ من الوقت 18.1 إلى 20.0 دقيقة: المرحلة B المتنقلة بنسبة 100٪ ؛ من الوقت 20.0 إلى 20.1 دقيقة: خفض المرحلة المتنقلة B من 100٪ إلى 0٪ ؛ من الوقت 20.1 إلى 30 دقيقة: المرحلة A المتنقلة بنسبة 100٪ لإعادة توازن العمود (استخدم 10 أحجام أعمدة على الأقل).
- بالنسبة لإعدادات MS / MS ، قم بتشغيل MS / MS في الوضع الإيجابي باستخدام إعدادات الأداة التي تضمن التأين الفعال. لاتباع هذا البروتوكول ، استخدم جهد رش +4000 فولت ، ودرجة حرارة شعرية ساخنة تبلغ 270 درجة مئوية ، والنيتروجين كغاز صفائح (5 وحدات تعسفية) ، والأرجون (2 mTorr) لتجزئة التفكك الناجم عن الاصطدام (CID). إذا سمحت الأداة ، فقم بتوجيه تدفق LC لإهدار أول دقيقتين (0-2 دقيقة) وآخر 1 دقيقة (29-30 دقيقة) من الجري ، بدلا من MS.
- استخدم انتقالات مراقبة التفاعل المحددة (SRM) ل (أ) الببتيد المميز (ALGNQQPSWDSEDSSNFK): 1,005.45→913.3 و 1,005.45→1,028.3 و 1,005.45→1,398.5 و (ب) ببتيد IS SIL (ALGNQQPSWDSEDSSNF [K_13 C6_15N2]): 1,009.45→921.3 و 1,009.45→1,036.3 و 1,009.45→1,406.5. استخدم طاقة الاصطدام المحسنة (35 فولت في هذا البروتوكول) لجميع الانتقالات المراقبة.
- قم بإعداد تسلسل يحتوي على العينات المراد تشغيلها باستخدام البرنامج المتاح لنظام LC-MS / MS الخاص بك. اضبط حجم الحقن على 10 ميكرولتر.
ملاحظة: تأكد من إضافة عينات فارغة وعينات مراقبة الجودة حسب الحاجة. - اضغط على "تشغيل التسلسل" في برنامج الجهاز لبدء التسلسل.
- راقب منطقة الذروة للببتيد التربتي ALGNQQPSWDSEDSSNFK الذي تم التقاطه ، وببتيد IS SIL الخاص به.
ملاحظة: تم وصف اختيار وتأكيد الببتيد المميز ، ALGNQQPSWDSEDSSNFK ، في مكان آخر14.
النتائج
يتم عرض نظرة عامة على سير العمل التحليلي باستخدام كل من أخذ عينات DSS و VAMS في الشكل 1. باستثناء الاختلافات في طريقة أخذ العينات ، فإن الإجراءات متطابقة. يمكن رؤية صور المصل الذي تم أخذ عينات منه باستخدام طريقتي أخذ العينات في الشكل 2.
كلا شكلي أخذ العينات (VAMS و DSS) مناسبان لأخذ عينات من المصل المحتوي على ProGRP. يمكن ملاحظة ذلك من الشكل 3 حيث يتم عرض كروماتوجرام MS للببتيد البروتيني والببتيد IS SIL من أخذ عينات DSS و VAMS. بالإضافة إلى ذلك ، يتم تضمين مخطط كروماتوجرام MS بعد تحليل عينة تحكم تتكون من 10 ميكرولتر من عينة مصل السائل المسنن المعالجة بنفس طريقة العينات المجففة. تم تخفيف هذا الأخير بنفس حجم حجم محلول استخراج DSS / VAMS ، وتعرض للهضم باستخدام حبات التربسين وتنظيفها باستخدام التقاط تقارب الببتيد.
بمقارنة أخذ عينات VAMS و DSS (الشكل 4) ، يوفر VAMS نسبة منطقة ببتيد / IS أعلى من DSS. يشير هذا إلى أنه قد يكون هناك فقدان للبروتين المستهدف ProGRP للورق المستخدم في DSS (السليلوز النقي). عند المقارنة بعينة التحكم ، حيث لا يتم تجفيف المصل قبل إجراء مزيد من المعالجة والتحليل (الشكل 4) ، يتبين أن VAMS يوفر نسب مساحة مماثلة لعينة التحكم (اختبار t ثنائي الطرف ، p≤ 0.65) ، مما يشير إلى عدم وجود خسارة لمواد أخذ العينات ، بينما يوفر DSS نسبة مساحة أقل بكثير (اختبار t ثنائي الطرف ، p≤ 0.005) ، مما يشير إلى فقدان مادة أخذ العينات.
تم إجراء تقييم موجز باستخدام VAMS. وتبين أن الخطية تتراوح من 10 إلى 1000 نانوغرام/مل (R2 = 0.9996)، مع حد للكشف (LOD، S/N = 3) يبلغ 6.7 نانوغرام/مل. يعتبر LOD مرضيا حيث تم إجراء التحليل على رباعي ثلاثي قديم إلى حد ما (2008) مع عمود معرف 1 مم. كما اعتبرت قابلية التكرار لجميع المستويات مع S / N > 10 مرضية مع تحديد وضع اللاجئ بين 7٪ و 17٪ (ن = 3) ، باستخدام تصحيح IS.
يمكن إجراء التقاط التقارب قبل وبعد خطوة الهضم إما عن طريق التقاط البروتين محل الاهتمام أو الببتيد البروتيني. يصف الإجراء الحالي التقاط تقارب الببتيد. تتمثل ميزة هذا النهج مقارنة بالتقاط البروتين في أنه يتم التقاط الببتيد محل الاهتمام فقط ، ويتم تحقيق تنظيف أكثر كفاءة للعينة. يوضح الشكل 5 ذلك ، حيث يوضح مخططا كروماتوجرا كاملا أكثر تعقيدا مع مزيد من الضوضاء بعد التقاط البروتين مقارنة بعد التقاط الببتيد. لا يتم أخذ عينات من العينات التي تم تحليلها في الشكل 5 باستخدام أخذ عينات DSS أو VAMS ؛ ومع ذلك ، فإن المصل هو أيضا مصفوفة العينة ، ويتم إجراء التقاط التقارب باستخدام نفس الجسم المضاد المستخدم لالتقاط الببتيد في الإجراء الموصوف.

الشكل 1: نظرة عامة على سير العمل التحليلي باستخدام كل من أخذ عينات DSS و VAMS. الاختصارات: DSS = بقعة مصل مجففة. VAMS = أخذ العينات المجهرية الامتصاصية الحجمية ؛ LC-MS / MS = كروماتوغرافيا سائلة - مطياف الكتلة الترادفية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: صور مصل الدم أخذت عينات باستخدام طرق مختلفة . (أ) بطاقة السليلوز DBS، و(ب) VAMS. الاختصارات: DBS = بقعة دم مجففة. VAMS = أخذ العينات المجهرية الامتصاصية الحجمية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: كروماتوجرام MS التمثيلي للببتيد البروتيني وببتيد IS SIL بعد أخذ عينات DSS و VAMS ، وكذلك لعينة مصل مسننة تضاف مباشرة إلى محلول الاستخراج. تظهر كروماتوجرام MS عينات مصل 10 ميكرولتر ارتفعت مع 1.5 ميكروغرام / مل من ProGRP وتطبيقها على (A) VAMS ، (B) بطاقة أخذ عينات السليلوز (ل DSS) ، أو (C) مباشرة إلى المخزن المؤقت للاستخراج (عينة التحكم). خمسة وعشرون ميكرولترا من 14 نانوغرام / مل هو ببتيد سيل يضاف إلى جميع العينات قبل التقاط تقارب الببتيد. الاختصارات: DSS = بقعة مصل مجففة. VAMS = أخذ العينات المجهرية الامتصاصية الحجمية ؛ MS = مطياف الكتلة ؛ ProGRP = الببتيد الذي يطلق البروغاسترين ؛ IS = المعيار الداخلي ؛ SIL = نظير مستقر مسمى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
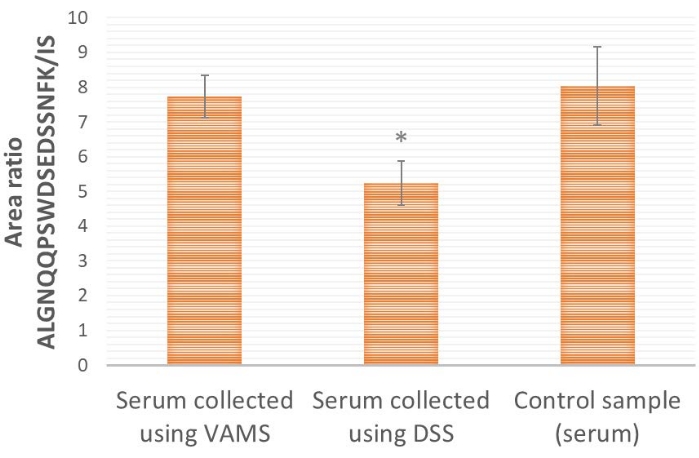
الشكل 4: النتائج التمثيلية لنسبة منطقة ALGNQQPSWDSEDSSNFK / IS لعينات المصل المتصاعدة باستخدام ProGRP وتطبيقها (10 ميكرولتر) على VAMS أو DSS أو مباشرة على محلول الاستخلاص (عينة التحكم). تركيز ProGRP هو 1.5 ميكروغرام / مل ، n = 4 لكل حالة ؛ 25 ميكرولتر من 14 نانوغرام / مل يضاف ببتيد سيل إلى جميع العينات قبل التقاط تقارب الببتيد. * يشير إلى أن نسبة المساحة تختلف اختلافا كبيرا عن العينات المطبقة على VAMS (اختبار t ثنائي الطرف ، p≤ 0.005). أشرطة الخطأ هي ± الانحراف المعياري. الاختصارات: DSS = بقعة مصل مجففة. VAMS = أخذ العينات المجهرية الامتصاصية الحجمية ؛ ProGRP = الببتيد الذي يطلق البروغاسترين ؛ IS = المعيار الداخلي ؛ SIL = نظير مستقر مسمى. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
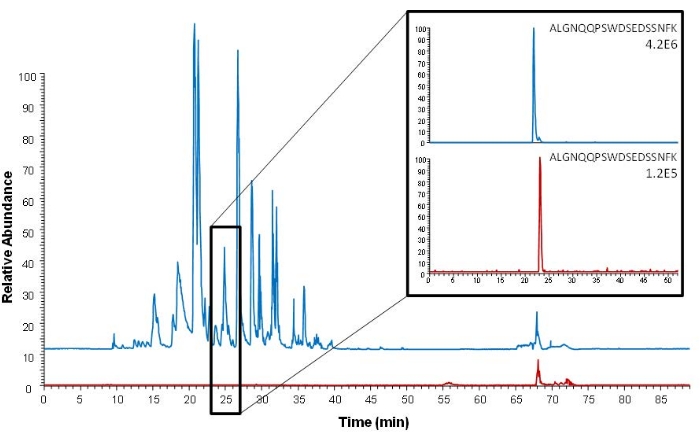
الشكل 5: مقارنة بين مخططات كروماتوجرام الذروة الأساسية (تحليل Orbitrap للمسح الكامل) بعد استخراج البروتين السليم (الأزرق) واستخراج الببتيد الببتيد البروتيني (الأحمر). تظهر الكروماتوجرام الأيوني المستخرج من الببتيد الحلقي البروتيني (ALGNQQPSWDSEDSSNFK، m / z 1005.45) على اليمين. تم استخدام المصل الذي ارتفع مع 150 نانوغرام مل −1 ProGRP كعينة. أعيد طبع هذا الرقم من Levernæs et al.14. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الجدول التكميلي S1: نظرة عامة على تكوين المخازن المؤقتة والحلول وكيفية إعدادها. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
يحتوي البروتوكول الموصوف على معلومات حول كيفية إجراء العديد من الخطوات المهمة في تحليل المؤشرات الحيوية منخفضة الوفرة من العينات الدقيقة المجففة (DSS و VAMS) ، بما في ذلك تحضير حبات التربسين والخرز المغناطيسي المغلف بالأجسام المضادة. بناء على الخبرة السابقة ، نتعامل دائما مع الجسم المضاد بالحمض قبل تجميد حبة الخرز لتحسين اتجاه الأجسام المضادة15.
تتمثل إحدى الخطوات الحاسمة في هذا الإجراء في اختيار تنسيق أخذ العينات المجهرية الأنسب. أولا ، يجب على المرء أن يفكر فيما إذا كان يمكن تحديد المادة المراد تحليلها من الدم الكامل ، أو إذا كان التركيز يتأثر بخلايا الدم ويجب تحديده في المصل أو البلازما (كما هو الحال بالنسبة للنموذج المراد تحليله ، ProGRP).
لكل من النهج القائمة على الورق والبوليمر مزايا وقيود. بالنسبة لبرنامج ProGRP ، يوفر VAMS ميزة واضحة فيما يتعلق باستعادة التحليل بعد الاستخراج من جهاز أخذ العينات. ومع ذلك ، يمكن تحسين ذلك باستخدام حل استخراج مختلف لعينات DSS. ومع ذلك، من المهم أخذ هذا التفاعل المحتمل بين المادة المراد تحليلها وأخذ العينات في الاعتبار؛ لأنه قد يؤدي إلى زيادة التباين التحليلي وارتفاع حدود الكشف. نظرا لأن IS المستخدم هو ببتيد SIL ويضاف لأول مرة بعد الهضم ، فإن IS يصحح الخطوات التالية للهضم (على سبيل المثال ، استخراج التقارب وتحليل LC-MS / MS). تصحيح IS غير ممكن للاستخراج من DSS / VAMS وخطوة الهضم.
يتم استخدام نوعين من الخرز في الإجراء: حبات التربسين للهضم بعد استخراج عينة المصل من جهاز أخذ العينات ، والخرز المغناطيسي المغلف بالأجسام المضادة لالتقاط الببتيد البروتيني بعد الهضم. أحد الأسباب الرئيسية لاستخدام حبات التربسين ، بالإضافة إلى تسريع عملية الهضم ، هو تقليل نشاط التربسين المتبقي في العينة أثناء التقاط التقارب. هذا مهم لتجنب التحلل البروتيني التربتي ل mAb أثناء التقاط التقارب.
تم استخدام حبات الأغاروز لتحضير حبات التربسين ، بينما تم استخدام الخرز المغناطيسي لإعداد الخرزات المغلفة بالأجسام المضادة. حبات الأغاروز أقل تكلفة من الخرز المغناطيسي ولكن لها قيود على أن فصل الخرز عن المحلول يتطلب الطرد المركزي. هذا يجعل فصل الخرز والمادة الطافية أقل كفاءة من استخدام الخرز المغناطيسي. بالإضافة إلى ذلك ، من الصعب أتمتة سير العمل باستخدام حبات الأغاروز. ومع ذلك ، تتوفر حبات مغناطيسية يتم تنشيطها بواسطة NHS ويمكن استخدامها لسير عمل إعداد العينات بشكل أكثر بساطة وآلية.
أخذ العينات المجهرية هو اتجاه مهم في التحليل الحيوي لكل من الأدوية والمؤشرات الحيوية. يتمثل أحد التحديات في النهج الحالي في الكمية المحدودة من حجم العينة (10 ميكرولتر) ، والتي قد تكون ذات أهمية خاصة في تحديد التحليلات منخفضة الوفرة للغاية مثل ProGRP (مستوى pg / mL-low ng / mL). ومع ذلك ، يمكن التحايل على هذا التحدي باستخدام أحدث المعدات التحليلية. بالنسبة لهذه التحليلات منخفضة الوفرة ، يعد اختيار تحضير العينة أمرا بالغ الأهمية ، وغالبا ما تكون هناك حاجة إلى تنظيف انتقائي للعينة من خلال التقاط التقارب القائم على الأجسام المضادة. وبما أنه ثبت أن التقاط الببتيد يوفر مستخلصات أنظف وحدود كشف أقل من التقاط البروتين (باستخدام نفس الجسم المضاد)14، فإن الطريقة الحالية تركز على هذا النهج بالاقتران مع أخذ العينات المجهرية. ميزة أخرى لنهج التقاط الببتيد هي أن الببتيد IS SIL يصحح أيضا خطوة التقاط التقارب.
في هذا العمل ، تم استخدام جسم مضاد يستهدف البروتين لالتقاط الببتيد. هذه ميزة لأن توافر الأجسام المضادة الجاهزة التي تستهدف البروتينات أعلى من الأجسام المضادة الجاهزة التي تستهدف الببتيدات البروتينية. ومع ذلك ، لكي يلتقط الجسم المضاد للبروتين الببتيد البروتيني بكفاءة ، يجب أن يكون الحاتم سليما بعد هضم البروتين. بالإضافة إلى ذلك ، بالنسبة للعديد من الأجسام المضادة ، فإن الخاتمة الدقيقة غير معروفة ، مما يجعل البحث عن جسم مضاد مضاد للبروتين مملا. هذا يحد من عدد الأجسام المضادة المضادة للبروتين المتاحة المطبقة على التقاط الببتيد. تم توضيح الإجراء الموصوف باستخدام المصل كمصفوفة و ProGRP كتحليل الهدف. الغرض من الإجراء هو أن يكون قابلا للتطبيق على المصفوفات الأخرى والتحليلات المستهدفة الأخرى. بدلا من استخدام جسم مضاد مضاد للبروتين متاح تجاريا لالتقاط تقارب الببتيد البروتيني ، من الممكن أيضا استخدام الأجسام المضادة المضادة للببتيد المصنوعة خصيصا. يوضح الشكل 5 كفاءة تنظيف التقاط الببتيد مقارنة بالتقاط البروتين. من خلال تبادل حبات الأغاروز المستخدمة لإعداد حبات التربسين مع الخرز المغناطيسي ، يجب أن يكون الإجراء متوافقا أيضا مع محطات عمل تحضير العينات الروبوتية في السوق.
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
نحن نقدر كثيرا البروفيسور إليزابيث باوس في مستشفى الراديوم النرويجي (مستشفى جامعة أوسلو ، أوسلو ، النرويج) لتوفير معيار ProGRP والجسم المضاد أحادي النسيلة المضاد ProGRP ، M18. تمت تغطية رسوم النشر بمنحة من Apoteker Harald Conrad Thaulows legat. Trine Grønhaug Halvorsen و Léon Reubsaet شريكان في اتحاد الشبكة الوطنية للبنية التحتية للبروتينات المتقدمة (NAPI) ، الذي يموله برنامج INFRASTRUKTUR التابع لمجلس البحوث النرويجي (رقم المشروع: 295910).
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid N-hydroxysuccinimide ester | Carbosynt (Staad, Switzerland) | FA33719 | Store in freezer below -20 °C |
| ALGNQQPSWDSEDSSNF[K_13C6 _15N2] (≥ 95%) | Innovagen (Lund, Sweden) | Not applicable | Store in freezer below -20 °C |
| Ammonium bicarbonate BioUltra (≥ 99.5% ) | Sigma Aldrich (St. Louis, MO, USA) | 09830-500G | |
| Aquasil C18 column, 3 µm, 50 mm x 1 mm | Thermo scientific (Waltham, MA, USA) | 77503-051030 | Analytical column compatible with 100% aqueous mobile phase |
| Benzamidine (≥ 95.0% ) | Sigma Aldrich (St. Louis, MO, USA) | 12072 | Store in fridge at 2-6 °C |
| Calsium chloride dihydrate (≥ 99% ) | Sigma Aldrich (St. Louis, MO, USA) | 223506-500G | |
| Centrifuge 5804 | Eppendorf (Hamburg, Tyskland) | 5804000010 | |
| Cloned ProGRP isoform 1 | Radium hospital, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in freezer below -20 °C |
| Disodium hydrogenphosphate dihydrate (pro analysis) | Sigma Aldrich (St. Louis, MO, USA) | 30435-500G | |
| Disodium hydrogenphosphate dodecahydrate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.06579.0500 | |
| Dynabeads M-280 tosylactivated 10 mL | Invitrogen (Carlsbad, USA) | 14204 | Store in fridge at 2-6 °C |
| DynaMag-2 | Invitrogen (Carlsbad, USA) | 123-21D | |
| Ethanolamine (pro analysis, ≥ 99%) | Sigma Aldrich (St. Louis, MO, USA) | #02400 | |
| Formic acid (≥ 99% ) for LC-MS | VWR International (Radnor, PA, USA) | 84865.260 | |
| FTA DMPK-C cellulose card | Whatman (Kent, UK) | WB129243 | DBS card |
| HPLC vials, clear glass, 1.5 mL, 32 x 11.6 mm, Clean Pack | Nerliens Meszansky (Oslo, Norge) | LPP 11 09 0519 | |
| Hulamixer sample mixer | Invitrogen (Carlsbad, USA) | 101561503016 | Sample mixer with end-over-end mixing and reciprocal rotation and vibration |
| Human serum from healty blood donors | Bloodbank, Ullevål, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in freezer below -20 °C |
| Hydrochloric acid fuming 37% (Emsure for analysis) | Merck (Darmstadt, Tyskland) | 1.00317.1000 | |
| LC-MS/MS system: Ultimate 3000 system (Autosampler, WPS-3000TRS; Micropump, LPG-3400M; Flow manager, FLM-3300, MIC, 1X2P-10P) and TSQ Quantum access. Controlled by Xcalibur 2.2 SP1.48 | Thermo scientific (Waltham, MA, USA) | Not applicable | |
| LiChrosolv Acetonitrile hypergrade for LC-MS | Merck (Darmstadt, Tyskland) | 1.00029.2500 | |
| LL Biotrode, Combined glass electrode | Metrohm (Herisau, Sveits) | 6.0224.100 | |
| Magnetic stirrer, Type M10 | Franz Morat KG (Eisenbach, Germany) | 10236 | |
| Micro inserts, glass (31 x 6 mm, 0.1 mL) | VWR International (Radnor, PA, USA) | 548-0006 | |
| MilliQ integral 3 with Q-POD | Merck Millipore (Molsheim, France) | ZRXQ003T0 | For production of Type 1 water |
| monoclonal antibody M18 | Radium hospital, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in fridge at 2-6 °C |
| Neoteryx Mitra microsampler (10 μL) 4 sampler Clamshell | Fisher Scientific (Waltham, MA, USA) | NC1382947 | |
| NHS-activated sepharose beads 4 fast flow | Sigma Aldrich (St. Louis, MO, USA) | GE17-0906-01 | Agarose beads, store in fridge at 2-6 °C |
| Optifit, Refill pipet tips, 10 mL | Sartorius Biohit (Helsinki, Finland) | 613-2911 | |
| Optifit, Refill pipet tips, 10 μL | Sartorius Biohit (Helsinki, Finland) | 790012 | |
| Optifit, Refill pipet tips, 1,000 μL | Sartorius Biohit (Helsinki, Finland) | 791002 | |
| Optifit, Refill pipet tips, 200 μL | Sartorius Biohit (Helsinki, Finland) | 790202 | |
| pH glass electrode | Metrohm (Herisau, Sveits) | 6.0233.100 | |
| pH meter 744 | Metrohm (Herisau, Sveits) | 8.744.1003 | |
| Pipet 10 mL | Sartorius Biohit (Helsinki, Finland) | 725090 | |
| Pipet m10 µL | Sartorius Biohit (Helsinki, Finland) | 725020 | |
| Pipet m100 µL | Sartorius Biohit (Helsinki, Finland) | 725050 | |
| Pipet m1,000 µL | Sartorius Biohit (Helsinki, Finland) | 725070 | |
| Pipet m20 µL | Sartorius Biohit (Helsinki, Finland) | 725030 | |
| Potassium chloride (KCl ≥ 99.9%) | Sigma Aldrich (St. Louis, MO, USA) | P-3911 | |
| Potassium dihydrogenphosphate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.04873.0250 | |
| Protein LoBind Eppendorf tube 0.5 mL | Eppendorf (Hamburg, Tyskland) | 525-0133 (0030 108.094) | |
| Protein LoBind Eppendorf tube 1.5 mL | Eppendorf (Hamburg, Tyskland) | 525-0132 (0030 108.116) | |
| Protein LoBind Eppendorf tube 2.0 mL | Eppendorf (Hamburg, Tyskland) | 525-0134 (0030 108.450) | |
| Protein LoBind Eppendorf tube 5.0 mL | Eppendorf (Hamburg, Tyskland) | 525-0792 (0030108.302) | |
| Scissors | Sigma Aldrich (St. Louis, MO, USA) | Z186716-1EA | |
| Sodium azide (BioUltra; ≥ 99.5% ) | Sigma Aldrich (St. Louis, MO, USA) | 71289-5G | |
| Sodium chloride (for analysis) | Merck (Darmstadt, Tyskland) | 1.06404.1000 | |
| Sodium dihydrogenphosphate monohydrate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.06346.0500 | |
| Sodium hydroxide (AnalaR NORMAPUR) | VWR International (Radnor, PA, USA) | 28244.295 | |
| Sodium tetraborate decahydrate (≥ 99. %) | Sigma Aldrich (St. Louis, MO, USA) | S9640-500G | |
| Spectrafuge Mini Centrifuge | LABNET International (Edison, NJ, USA) | C1301 | |
| Stirring magnet, 25 mm x 6 mm Ø, circular | Leybold (Cologne, Germany) | 666 851 | |
| Stuart Scientific SA8 vortex mixer | Stuart (Staffordshire, UK) | Z648531-1EA | |
| SuperClear centrifuge tubes (15 mL) | VWR International (Radnor, PA, USA) | 525-0150 | |
| SuperClear centrifuge tubes (50 mL) | VWR International (Radnor, PA, USA) | 525-0155 | |
| Thermomixer comfort 1.5 mL | Eppendorf (Hamburg, Tyskland) | 53,55,27,831 | Temperature controlled mixer |
| Trizma base (reagent grade, ≥ 99.0 %) | Sigma Aldrich (St. Louis, MO, USA) | T6066 | Tris(hydroxymethyl)aminometan (tris) |
| Trizma HCl (reagent grade, ≥ 99.0%) | Sigma Aldrich (St. Louis, MO, USA) | T3253-100G | Tris(hydroxymethyl)aminometan HCl (tris HCl) |
| Trypsin (TCPK-treated from bovine pancreas, 10,000-15,000 BAEE units/mg Protein) | Sigma Aldrich (St. Louis, MO, USA) | T8802 | Store in freezer below -20 °C |
| Tween 20 | Sigma Aldrich (St. Louis, MO, USA) | P7949-500ML | polysorbate 20 |
| Tweezers | Sigma Aldrich (St. Louis, MO, USA) | TEM-78511-27 | |
| Vial caps, white, 9 mm | Nerliens Meszansky (Oslo, Norge) | LPP 09 15 0981 | |
| Mitra microsampler with VAMS (Volumetric adsorptive microsampling) technology, 10 µL, 4-sampler clamshell | Neoteryx (Torrance, CA, USA) |
References
- Bang, I. B. Fresenius. Zeitschrift für analytische Chemie. 52 (7), 521-523 (1913).
- Guthrie, R., Susi, A. A simple phenylalanine method for detecting phenylketonuria in large populations of newborn infants. Pediatrics. 32 (3), 338-343 (1963).
- Laurell, C. B. A screening test for α1-antitrypsin deficiency. Scandinavian Journal of Clinical and Laboratory Investigation. 29 (3), 247-248 (1972).
- Thielmann, K., Aquino, A. M. Whole blood samples dried and stored on filter paper as substrate for the electrophoretic separation on hemoglobin S from hemoglobin A. A screening procedure. Clinica Chimica Acta. 35 (1), 237-238 (1971).
- Wada, Y., Fujita, T., Kidoguchi, K., Hayashi, A. Fetal hemoglobin variants in 80,000 Japanese neonates: High prevalence of Hb F Yamaguchi (AγT 80 Asp→Asn). Human Genetics. 72 (3), 196-202 (1986).
- Halvorsen, T. G., McKitterick, N., Kish, M., Reubsaet, L. Affinity capture in bottom-up protein analysis-overview of current status of proteolytic peptide capture using antibodies and molecularly imprinted polymers. Analytica Chimica Acta. 1182, 338714 (2021).
- Halvorsen, T. G., Reubsaet, L. Antibody based affinity capture LC-MS/MS in quantitative determination of proteins in biological matrices. TrAC Trends in Analytical Chemistry. 95, 132-139 (2017).
- Neubert, H., et al. Protein biomarker quantification by immunoaffinity liquid chromatography-tandem mass spectrometry: Current state and future vision. Clinical Chemistry. 66 (2), 282-301 (2020).
- Pan, S., et al. Mass spectrometry based targeted protein quantification: methods and applications. Journal of Proteome Research. 8 (2), 787-797 (2008).
- Enderle, Y., Foerster, K., Burhenne, J. Clinical feasibility of dried blood spots: Analytics, validation, and applications. Journal of Pharmaceutical and Biomedical Analysis. 130, 231-243 (2016).
- Londhe, V., Rajadhyaksha, M. Opportunities and obstacles for microsampling techniques in bioanalysis: Special focus on DBS and VAMS. Journal of Pharmaceutical and Biomedical Analysis. 182, 113102 (2020).
- Denniff, P., Spooner, N. The effect of hematocrit on assay bias when using dbs samples for the quantitative bioanalysis of drugs. Bioanalysis. 2 (8), 1385-1395 (2010).
- Denniff, P., Spooner, N. Volumetric absorptive microsampling: A dried sample collection technique for quantitative bioanalysis. Analytical Chemistry. 86 (16), 8489-8495 (2014).
- Levernæs, M. C. S., et al. Immunocapture sample clean-up in determination of low abundant protein biomarkers-a feasibility study of peptide capture by anti-protein antibodies. RSC Advances. 9 (60), 34902-34911 (2019).
- Conradie, J. D., Govender, M., Visser, L. Elisa solid phase: Partial denaturation of coating antibody yields a more efficient solid phase. Journal of Immunological Methods. 59 (3), 289-299 (1983).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved