Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Peri-implantitis tedavisinde kullanılan mekanik yöntemlerin implant yüzey dekontaminasyonu ve pürüzlülüğü üzerine etkileri
Bu Makalede
Özet
Mevcut protokol, klinik karar vermeye katkıda bulunmak için in vitro implant yüzey dekontaminasyonu ve pürüzlülük araştırmaları için kullanılabilecek mürekkep boyamaya dayalı deneysel bir modeli tanımlamaktadır.
Özet
Dental implant yüzeylerinin dekontamine edilmesi için çeşitli mekanik yöntemler çeşitli başarılarla önerilmiştir. Bu in vitro çalışma, eritritol tozu, bir polieter-eter-keton (PEEK) ultrasonik uç ve titanyum küretler (TIT) ile bir hava aşındırma (AA) sisteminin dekontaminasyon verimliliğini ve bunların taramalı elektron mikroskobu (SEM) kullanılarak implant yüzey topografisi üzerindeki etkilerini değerlendirdi. Toplam 60 implant kalıcı kırmızı mürekkeple boyandı ve 3D baskılı Sınıf 1A ve Sınıf 1B peri-implantitis defektlerine yerleştirildi, defekt tipine ve tedavi protokolüne göre altı grup (grup başına n = 10) oluşturuldu. Ek olarak, bir pozitif ve bir negatif kontrol implantı kullanıldı. Eritritol tozu, PEEK ultrasonik uçlar ve titanyum küretler Class 1A defektlerde 2 dk, Class 1B defektlerde 3 dakika süreyle uygulandı. Kalıntı kırmızı mürekkep alanları dijital yazılımlarla ölçüldü ve implant yüzey değişiklikleri SEM ve EDS kullanılarak analiz edildi. Yöntemlerin hiçbiri tam dekontaminasyon sağlamadı. Bununla birlikte, eritritol tozu önemli ölçüde en etkili olanıydı ve %24 ± %6'lık bir kalıntı mürekkep oranı bıraktı (p < 0.001). PEEK ultrasonik uçlar %41 ± %4 mürekkep kalıntısı ile sonuçlanırken, titanyum küretler %55 ± %3 bıraktı. Tüm yöntemler arasında anlamlı farklılıklar gözlendi. Sınıf 1A ve Sınıf 1B defektler arasında dekontaminasyon etkinliği açısından anlamlı bir fark bulunmadı. SEM analizi, eritritol tozu ve PEEK uçları ile minimum yüzey hasarı gösterirken, titanyum küretler orta ila ciddi hasara neden oldu. Hem dekontaminasyon verimliliğine hem de yüzey korumasına dayalı olarak, eritritol tozu ve PEEK uçlar peri-implantitis tedavisi için güvenli ve etkili seçeneklerdir, titanyum küretler ise daha az etkilidir ve önemli yüzey hasarına neden olur. Bu bulgular peri-implantitis tedavi planlamasında klinisyenlere yardımcı olabilir.
Giriş
Dental implant tedavisi, dünya çapında eksik dişlerin yerine konması için en yaygın ve tercih edilen protokoldür. Uzun süreli takip çalışmaları, tam veya kısmi dişsizlik tedavisinde implant destekli restorasyonların kullanılmasının sağkalım açısından öngörülebilir sonuçlar ve yüksek başarı oranları sağladığını göstermiştir. Bununla birlikte, implantların cerrahi olarak yerleştirilmesi ve restorasyonunu takiben sert ve yumuşak dokuları etkileyen çeşitli komplikasyonlar ortaya çıkabilir1. 2017 yılında, Periodontal ve Peri-implant Hastalıkların ve Durumların Sınıflandırılması Dünya Çalıştayı, peri-implant dokuları etkileyen hastalıklar için tanımlar ve ayırıcı tanılar getirmiştir2. Bu tanıma göre, peri-implantitis, sondalama ve/veya süpürasyon sırasında kanama, artmış sondalama derinlikleri ve/veya peri-implant mukozadaki mukozal kenarın durgunluğu ve destekleyici kemiğin radyografik kaybı dahil olmak üzere klinik inflamasyon belirtileri ile karakterize geri dönüşümsüz bir patolojik durumdur2. Peri-implant hastalıkların etiyolojisi çok faktörlüdür ve bazı bireyler bu duruma diğerlerinden daha duyarlıdır. Bireylerin spesifik yatkınlıkları, implant çevresi hastalık gelişme riskini artırabilir ve bu da implant kaybına yol açabilir. Peri-implant hastalıkların etiyolojisinde rol oynayan diğer faktörler ise hastaya bağlı faktörler (sigara, sistemik hastalıklar, periodontal hastalık öyküsü, ağız hijyeni); keratinize mukozanın durumu, implant bölgesindeki kemik ve yumuşak dokuların miktarı ve kalitesi; implant ve çevresindeki dokular üzerindeki kuvvetler; implant yerleştirilmesi sırasında karşılaşılan komplikasyonlar; cerrahi ve protetik tedavileri yapan hekimin deneyim ve becerisi2. Buna ek olarak, yakın zamanda yeni bir risk değerlendirmesi ve tedavi konsepti olan İmplant Hastalığı Risk Değerlendirme Aracı (IDRA)3 tanıtılmıştır. Bu araç, her biri peri-implantitis ile belgelenmiş bir ilişkiye sahip sekiz parametreden oluşan fonksiyonel bir diyagram olarak geliştirilmiştir. Sekizgenin vektörleri, periodontitis öyküsü, sondalamada kanama olan implant ve diş bölgelerinin yüzdesi (BoP), sondalama cebi derinliği 5 mm'≥ olan diş/implant sayısı, periodontal kemik kaybı oranı (hastanın yaşına göre radyografiler), periodontite yatkınlık, destekleyici periodontal tedavi (SPT) sıklığı ve protezin tasarımıdır.
Son sistematik derlemeler, peri-implantitis prevalansının hasta düzeyinde %19.53 ve implant düzeyinde %12.53 olduğunu göstermiştir3. Dünya çapında her yıl yaklaşık 5 milyondan fazla implant yerleştirildiği ve pazar büyüklüğünün 4 milyar USD'yi aştığı göz önüne alındığında, peri-implantitis popülasyon için önemli bir sağlık sorununu temsil etmektedir. Tedavi edilmezse, peri-implantitis, etkilenen implantın ve implant destekli protezin kaybıyla sonuçlanır ve hem diş hekimi hem de hasta için büyük bir sıkıntıya neden olur.
Peri-implant hastalıkların tedavisi cerrahi olmayan ve cerrahi yaklaşımlar olarak ikiye ayrılabilir. Periodontitis4'ün tedavisinde uç noktaların başarısı için makul bir beklenti olmasına rağmen, peri-implantitis tedavisi için karşılaştırılabilir kanıtlar hala azdır. Bu nedenle, peri-implantitisin aşamalı bir yaklaşım ve cerrahi olmayan tedavisinin mantığı, tedavi invazivliğini artırmadan önce nispeten basit yaklaşımlarla biyofilm ve inflamasyon kontrolünün denenmesi ve daha iyi biyofilm ve risk faktörü kontrolü sağlandığında cerrahi adımın gerçekleştirilmesidir. Bu, OH talimatları ve motivasyonu, risk faktörü kontrolü, biyofilm tutucu faktörlerin kontrolü ve protez bileşenlerinin değerlendirilmesi, supramarjinal ve submarjinal enstrümantasyon ve gerektiğinde eşlik eden periodontal tedavi dahil olmak üzere protez temizliği/çıkarılması/modifikasyonunu içerir. Bu nedenle, cerrahi olmayan tedavi her zaman ilk adım olmalıdır5. Erken peri-implantitis için risk faktörlerinin azaltılması ve cerrahi olmayan tedavi yeterli olabilir, ancak kemik kaybından sonra derin ceplerde biyofilmin tamamen çıkarılması genellikle zordur. Cerrahi olmayan tedaviden sonra yeniden değerlendirme aşamasında, kalıcı cep derinlikleri (≥ 6 mm) ve sondalama kanaması (BoP) peri-implantitisin potansiyel ilerlemesini gösterir. Bu belirtiler varsa cerrahi girişimler önerilir6. Peri-implantitisin cerrahi tedavisi (i) açık flep debridmanını, (ii) rezektif flep cerrahisini, (iii) implant çevresi kemik defektlerinin rekonstrüktif yaklaşımlarla tedavisini, (iv) implant yüzeyi dekontaminasyonu için ek yöntemleri ve (v) lokal/sistemik antibiyotiklerin yardımcı kullanımınıiçerir 7.
Peri-implantitisin en önemli etiyolojik faktörü implant yüzeyinde kolonize olan patojenik biyofilmdir6. Bu biyofilmin uzaklaştırılması, mekanik, kimyasal ve lazer dekontaminasyon yöntemlerini içeren tüm tedavi protokollerinin ana prensibi ve hedefidir7.
Mekanik debridmanda plastik, karbon ve titanyum küretler, plastik ve metal uçlu ultrasonik cihazlar, titanyum fırçalar ve çeşitli tozlara sahip hava aşındırıcı (AA) sistemler kullanılır. Biyofilmin tamamen ortadan kaldırılması zor olsa da, bu tedaviler klinik faydalar sağlar. Antiseptikler 8,antibiyotikler 9 ve rezektif ve rejeneratif cerrahi10 ile veya antiseptiklerolmadan mekanik debridman protokolleri dahil olmak üzere çeşitli klinik müdahaleler, değişen derecelerde klinik başarı ile kullanılmıştır. Bununla birlikte, implant yüzeyinin kimyasal ve fiziksel özelliklerinde de değişikliklere neden olurlar ve muhtemelen yeni kemik oluşumunu ve yeniden osseointegrasyonu zorlaştırırlar.
Mekanik yöntemler arasında, farklı toz bileşimleri kullanan AA prosedürleri en iyi temizleme etkinliğini göstermiştir 11,12,13. Bununla birlikte, artık parçacıkların varlığı yüzey topografyasını değiştirebilir ve biyouyumluluğu azaltabilir14. Glisin, ardından sodyum bikarbonat, AA sistemlerinde en çok kullanılan tozdur8. Son zamanlarda, eritritol (14 μm) gibi daha küçük hava aşındırıcı partiküller, azaltılmış yüzey hasarı ile etkili dekontaminasyon için ilgi görmeye başlamıştır9. Çelik uçlara göre daha az yüzey hasarına neden olan titanyum ve plastik küretler biyofilm dekontaminasyonunda etkilidir15. Poli-eter-eter-ketondan (PEEK) yapılan ultrasonik kazıyıcı uçlar ayrıca minimum yüzey hasarı ile bakteri yükünü azaltır10. Dekontaminasyon yöntemleri, implant yüzeylerinin yüksek pürüzlülüğünü dikkate almalı ve önemli yüzey hasarına neden olmadan bakteriyel biyofilmi uzaklaştırmayı amaçlamalıdır. Kapsamlı in vitro, in vivo ve klinik araştırmalar yapılmış olmasına rağmen, bugüne kadar peri-implantitis tedavisi için hala bir fikir birliği ve altın standart bir protokol yoktur. Çok sayıda dental implanta bağlı olarak peri-implant hastalıklarının artan prevalansı, kontamine yüzeylerin tedavisinde kanıta dayalı, öngörülebilir bir yaklaşım gerektirmektedir. Bu çalışmanın amacı, hava aşındırıcı (AA) sistemler, PEEK ultrasonik uçlar ve titanyum küretler gibi farklı dekontaminasyon yöntemlerinin implant yüzeyi dekontaminasyonundaki etkinliğini değerlendirmek ve SEM analizi ile implant yüzey pürüzlülüğü üzerindeki etkilerini değerlendirmektir.
Protokol
Çalışma protokolü, Akdeniz Üniversitesi, Antalya, Türkiye etik kurulu (TBAEK-363) tarafından onaylanmıştır. Bu çalışma Akdeniz Üniversitesi Araştırma Fonu tarafından desteklenmiştir (Proje no: TDH-2024-6676). Çalışmada, 4,2 mm x 11 mm boyutlarında, yaka üzerinde 1,7 mm ölçülerinde bir mikro diş tasarımına sahip vida şeklinde bir diş implantı (PrimeTaper EV İmplant) kullanıldı. İyi tanımlanmış OsseoSpeed yüzeyini elde etmek için kumlama ve seyreltilmiş hidroflorik asit ile asitle aşındırma ile yüzey hazırlığı.
1. Deneysel peri-implantitis modellerinin hazırlanması
NOT: Üç dekontaminasyon mekanik arıtma yöntemi (hava aşındırıcı (AA), polietereterketon (PEEK) ultrasonik ve titanyum küretler; Malzeme Tablosu) iki farklı peri-implantitis defektinde tip11 (Sınıf 1A ve Sınıf 1B) analiz edildi. Bu nedenle, altı deney grubu vardı (Şekil 1). Biri pozitif diğeri negatif kontrol implantı olmak üzere toplam 62 implant kullanıldı. İlk olarak Sharhmann ve ark.16 tarafından geliştirilen bu in vitro çalışma deseni, literatürde çeşitli araştırmacılar 12,13,14,15,16,17,18 tarafından değiştirilmiştir (Şekil 2). Gruplar arasında biyofilm giderme etkinliğinde %10'luk bir fark olduğu varsayılarak örneklem büyüklüğü G*power, etki büyüklüğü 0.50, tip I hata %5 ve %80 güce sahip altı grup için 60 (her grup için 10) olarak belirlenmiştir.
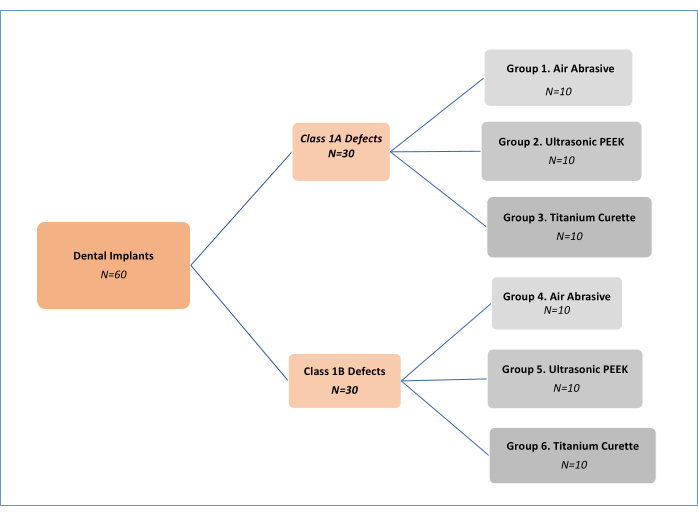
Şekil 1: Deney gruplarının akış şeması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
- Eğitim mandibular fantom modelinden bir birinci azı dişini çıkarın. Plastik dişler bu fantom modele vidalarla sabitlenir. İlk azı dişi sökün ve ipliği soketten çıkarın. Düz bir alveolar sırt oluşturmak için soketi kaplayacak şekilde yumuşak silikon malzemeyi kalıplayarak soketi doldurun.
NOT: Tam dişsiz bir bölgeye yerleştirilen bir implantın simülasyonu oluşturulmuştur. - Dijital bir tasarım oluşturmak için hazırlanan modeli bir laboratuvar tarayıcısında tarayın.
- Dijital olarak 3D Sınıf 1A ve Sınıf 1B11 peri-implantitis kemik defektleri oluşturun. Exocad yazılım programını açın. Taranan model dosyasını yükleyin. Ardından Tasarım'a tıklayın ve Uzman Modu'nu seçin. Ağı Düzenle seçeneğiyle düzensiz alanları kaldırın. Ardından sağ tıklayın ve bilgisayardaki ilgili klasör üzerinde Taramayı Dosya Olarak Kaydet'i seçin.
- Mesh Ekle/Kaldır seçeneğini > Araçlar'ı seçin, Wax Taraması> Dosya Yükle'yi seçin ve klasöre yeni kaydedilen dosyayı seçin. Bundan sonra, sağdaki Sihirbaz Modu'nu tıklayın.
- Ortaya çıkan yeni STL modelinde, diş soketinde bir kusur simülasyonu oluşturun. Bunu yapmak için sol taraftaki Ekle/Kaldır'a tıklayın. Oval Şekil Fırça Boyutu'nu seçin. Daha sonra, shift ve sol tıklamayı aynı anda kullanarak model üzerinde kusuru oluşturun. İmplantın bukkal yüzeyinde Class 1A defektler için defektin uzunluğunu 5 mm ve genişliğini 4,2 mm (implantın çapına karşılık gelir) ve Class 1B defektler için 5-5-5 mm olarak ayarlayınız.
- Kusurun yatay genişliğini daraltmak için, sol taraftaki Anatomi'ye tıklayarak ve defektin vestibüler genişliğini içe doğru daraltarak Cusps'u seçin. Ardından, sahneyi sağ tıklayın ve bir dosya olarak kaydedin.
- Son bir model oluşturmak için programı yeniden başlatın ve kaydedilen klasörü yeniden yükleyin. Ardından sağdaki Sihirbaz Modu ve Model Hizalama seçeneğini seçin. Sol tarafta bulunan model türünü Digital Waxup Model (Dijital Waxup Modeli) olarak seçin. Soldaki model tasarımı bölümüne ulaşana kadar birkaç kez İleri'ye tıklayın. Tam Model seçeneğini belirleyin ve iki kez İleri'ye tıklayın. Model dosyası tamamlandıktan sonra Explorer ile açın ve yazdırmaya hazırdır.
- Tasarlanan modelin STL dosyalarını 3D yazıcıya iletin. Oluşturulan dijital modelleri bir model reçinesi kullanarak yazdırın.
- Deneysel modelleri %96 etanolde 5-10 dakika durulayın. Temizleme işleminden sonra modelleri ışık yayan kürleme cihazına yerleştirin ve üreticinin talimatlarına uygun olarak doz ayarında 5 dakika boyunca ışıkla kürleyin.
NOT: İmplant delme için uygun, yüksek çekme, eğilme ve basınç dayanımına sahip bir reçine modeli kullanın. Basılı modeli, üreticinin talimatlarına göre alkol bazlı solüsyonlarla temizleyin ve yeterince ışıkla sertleştirildiğinden emin olun.
2. İmplantların boyanması
- Test implantlarını viskoz suya dayanıklı kırmızı mürekkebe batırın. 15 saniye boyunca implant yüzeyinin tüm parçalarının tamamen ve homojen bir şekilde mürekkeple kaplandığından emin olun. El teması olmadan sürücü el aletlerini veya baskı direklerini kullanarak implantları steril kaptan çıkarın.
NOT: Bu boyama, fotoğraf analizi için optik olarak görünür bir biyofilm vekilini simüle edecektir. - Mürekkebin eşit bir şekilde dağılmasını sağlamak için lekeli implantları bir diş ünitesi hava şırıngası ile havayla kurutun. Lekeli implantları oda sıcaklığında 24 saat daha kurutun. İmplantları el teması olmadan el aletleriyle izole bir şekilde kurutun.
3. Lekeli implantların yerleştirilmesi
- Bir dental fizyoloji dispenserinin ayarlarını aşağıdaki gibi yapın: 800 rpm, tuzlu sulama olmadan 40 N tork.
- 11 mm uzunluğunda ve 4,2 mm genişliğindeki implantları yerleştirmek için deneysel modeller üzerinde cerrahi implant matkapları ile implant yuvasını oluşturun. Her iki tip kusuru olan modeller için aynı implant soketini hazırlayın (Sınıf 1A ve 1B kusurlu modeller).
- Birincil stabiliteyi elde etmek için implant matkaplarını üreticinin talimatlarına göre sırayla kullanın. Delindikten sonra kalan kalıntıları hava-su şırıngasıyla temizleyin, ardından implantları yerleştirin. İmplantların mikro hareketini önlemek ve modellerde mikro çatlakları önlemek için deneysel peri-implantitis modellerini çalışma platformunda bir kelepçe ile stabilize edin.
- İmplantları bir taşıyıcı el aleti ile yuvalara yerleştirin. Bukkal yüzeyde 5 mm açıkta kalan alan bırakın. İmplantların, modelin lingual kemik tepesi üzerinde aynı seviyede daldırıldığından emin olun. Lekeli implant yüzeyine dokunmaktan kaçının.
4. İmplantların dekontaminasyonu
- İmplantları deneysel 1A ve 1B kusur modellerinden çıkarmadan gruplar halinde dekontamine etmeye başlayın.
- Hava aşındırıcı sistem: Cihazı 14 μm eritritol tozu ile su sulama ile tam güce ayarlayın. Cihazın ucunu implant yüzeyinden 2-3 mm uzakta tutun ve tozu açıkta kalan peri-implantitis defektine eşit şekilde uygulayın. Çalışma süresini 2A kusurlar için 1 dakika ve 3B kusurlar için 1 dakika ile sınırlayın.
- Polietereterketon (PEEK) ultrasonik uç: Cihazı maksimum su sulaması ile 8 güce (%80) ayarlayın. PEEK el aletini ultrasonik kullanıma uygun bir şekilde tutun. İmplant yüzeyinde doğrusal ve paralel hareketlerle dekontaminasyon gerçekleştirin. PEEK ucunu tasarımının izin verdiği kadar iplikler arasına uygulayın. Çalışma süresini 2A kusurlar için 1 dakika ve 3B kusurlar için 1 dakika ile sınırlayın.
- Titanyum küretler: 1A defektler için 2 dk ve 1B defektler için 3 dk boyunca 5 mm açıkta kalan implant yüzeyine yaklaşık 0,75 N'luk bir kuvvetle implant yüzeyine 60°-90°'de sabit basınçla ardışık kontaklar uygulayın.
- Dekontaminasyondan sonra, el teması olmadan sürücü parçasını kullanarak implantı çıkarın. Dekontaminasyondan sonra modeller deforme olursa, yedek modellere geçin. Deneysel peri-implantitis modellerini çalışma platformunda bir kelepçe ile stabilize edin.
NOT: Tüm yöntemler tek bir araştırmacı tarafından kalibre edilmeli ve uygulanmalıdır.
5. Fotoğrafik görüntüleme
- Uyumlu bir implant sürücü parçası ile implantları modelden çıkarın. Yüzeydeki gevşemiş parçacıkları/kalıntıları gidermek için implantları 20 saniye havayla kurutun.
- İmplant yüzeyindeki ipliklerin apikal ve koronal kısımlarını değerlendirmek için düz görünümler, 30° apikal görünümler ve 30° koronal görünümler çekmek için implantları özel olarak tasarlanmış akrilik fotoğraf modellerine yerleştirin.
- Fotoğraf makinesini bir tripoda yerleştirin ve fotoğraf makinesi ayarlarını standart hale getirin (mesafe 15 cm, ISO 160, diyafram f/16, pozlama süresi 1/250 sn). Odanın yeterince aydınlatıldığından emin olun. Kamerayı bir tripod ile sabitlemek gerekir.
- Dijital fotoğrafları bir flaşla RAW formatında çekin. Sınıf 1A kusurları için toplam 90 bukkal fotoğraf (bir düz, bir 30° apikal ve her implant yüzeyi için bir 30°koronal) ve Sınıf 1B kusurları için 270 fotoğraf (düz, 30° apikal ve her implant için her bukkal, mesiyal ve distal yüzeyden 30°koronal) elde edin. Daha fazla görüntü analizi için tüm dijital fotoğraf dosyalarını bir sabit diske kaydedin.
6. Görüntü analizi
- Tüm analizleri dijital görüntü yazılımı (ImageJ) üzerinde gerçekleştirin. Analizden önce, görüntüde sadece implantın göründüğünden emin olmak için bir Photoshop programı (Photoroom) kullanarak fotoğrafların arka planını siyah yapın. Uygulamayı açın ve ardından galerideki her bir resmi ekleyin. Görüntüden arka planı kaldırın ve seçeneklerden Siyah Arka Plan'ı seçin.
- Görüntüyü ImageJ'ye sürükleyip bırakın. İmplantın 5 mm koronal kısmını kaplayacak şekilde görüntüye bir kare çizin. Ardından standardizasyon için Görüntü > Kırp'ı tıklayın. Her görüntü için aynı işlemi tekrarlayın.
- Görüntü ˃ Tür ˃ 8 bit'e tıklayarak görüntüleri 8 bit formatına dönüştürün ve alan hesaplamaları için Görüntü ˃ Ayarla ˃ Eşik'e tıklayarak eşikleri ayarlayın.
- Analiz Et ˃ Ölç ˃ Alanı'na tıklayarak tüm implant yüzey alanını ve kırmızı renk kalıntı alanını hesaplayın.
- Elde edilen piksel alanını bir elektronik tablo dosyasına kaydedin. Ham görüntü verilerini kaydetmek için ayrı bir elektronik tablo dosyası oluşturun.
- Kırmızı renk kalıntılarının yüzdesini elde etmek için, kırmızı görüntülenen alanı 100 ile çarpın ve toplam implant yüzey alanına bölün.
7. SEM analizi
- Analiz gününe kadar tüm implantları steril kutularında saklayınız.
- SEM analizinden önce, her tedavi grubundan rastgele bir temsili numune seçin. Her gruptan seçilen örneklere ek olarak, bir steril implant ekleyin ve sadece implant tamamen mürekkeple kaplıdır. Böylece SEM analizi için toplam sekiz implant numunesi hazırlayın.
- SEM analizinden önce implant yüzeyindeki mikro tozu çıkarmak için bir gaz tabancası kullanarak 20 saniye boyunca nitrojen gazı püskürtün.
NOT: Cihazın ileri teknolojiye sahip olması nedeniyle ek bir altın kaplama uygulanmamıştır. - Her bir implantı, bukkal düz yüzeyin el dekontaminasyonu olmadan analizine izin verecek şekilde iletken karbon yapışkan disklerle SEM saplamalarına monte edin. Grupların karışıklığını önlemek için bunları numaraya göre sıralayın.
- Alete yerleştirilen implantlardan bir alan seçin ve farklı büyütme oranlarında görüntüler yakalayın. İmplant yüzeylerinin farklı bölgeleri (mesial veya distal) için aynı işlemi tekrarlayın. Ortalama 12 mm çalışma mesafesi ile 10-30 kV'da çalışan bir SEM cihazı kullanan görüntüler için 100x, 1000x ve 5000x büyütme kullanın.
NOT: SEM analizi sırasında standardizasyonu sağlamak için her implant için yaka bölgesinden ikinci mikro iplikçik ve vücuttan ikinci makro iplikçik seçilmiştir. Bazı görüntüler için, karşılaştırma için görüntüleme sırasında element analizi (EDS) yapılması önerilir.

Şekil 2: Çalışmanın akış şeması. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
8. İstatistiksel analiz
- Kategorik değişkenleri sayılar ve yüzdeler ve sürekli değişkenleri ortalama ve standart sapma olarak ifade edin. Shapiro-Wilk testi ile sürekli değişkenler için dağılımın normalliğini onaylayın.
- Kusur grupları arasındaki sürekli değişkenlerin karşılaştırılması için Student t-testini kullanın. İkiden fazla grubun karşılaştırılması için, istatistiksel hipotezlerin gerçekleşip gerçekleşmediğine bağlı olarak tek yönlü varyans analizi veya Kruskal Wallis testi kullanın.
- Normal dağılımlı veriler için, varyansların homojenliği ile ilgili olarak, grupların çoklu karşılaştırmaları için Tukey testlerini kullanın. Normal olmayan dağılımlı veriler için, grupların çoklu karşılaştırmaları için Bonferroni tarafından ayarlanmış Mann-Whitney U testini kullanın. Tüm istatistiksel analizler IBM SPSS 20 programı kullanılarak yapılmıştır. Tüm testler için istatistiksel anlamlılık düzeyi 0.05 olarak kabul edildi.
Sonuçlar
İmplant yüzeylerinin dekontaminasyonunu analiz etmek için burada açıklanan deneysel protokol, çeşitli tedavi prosedürleri arasında önemli farklılıklar ortaya koymuştur. Ek olarak, tedavi sonrası SEM protokolü de implant yüzeylerinde çalışma grupları arasında değişen derecelerde önemli değişiklikler gösterdi.
Dekontaminasyon sonrası implant düzeyinde karşılaştırmalar (Toplam implant ortalamaları)
İmplant d?...
Tartışmalar
Peri-implant hastalığından etkilenen dental implantların in vitro yüzey analizi metodolojisi, implantın pürüzlü yüzeylerinde meydana gelen patojenik mekanizmaların enflamatuar ve bakteriyel doğası nedeniyle her zaman zor olmuştur. Numune materyali seçimi, yüzeydeki biyofilmi taklit etme, peri-implantitis defekt tipinin seçilmesi, in vitro prosedürler sırasında klinik koşulların temsil edilmesi, dekontaminasyon prosedürlerinin varyasyonları ve dekontaminas...
Açıklamalar
Yazarların açıklanacak herhangi bir çıkar çatışması yoktur.
Teşekkürler
Çalışmada kullanılan implantlar Dentsply Sirona tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 3D Printer | DentaFab, Istanbul, Turkey | To produce experimental periimplantitis defects | |
| 3D Printing Resin | Alias, Istanbul,Turkey | To produce experimental periimplantitis models | |
| 3D Scanner | DOF Inc. EDGE, Seoul ,Republic of Korea | Used to scan the dental phantom model | |
| Air Abrasive system | AIRFLOW Plus PowderE.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface | |
| CAD/CAM Software | Exocad 3.2 Elefsina | To produce experimental periimplantitis defects | |
| Camera | Canon EOS 70D, Japan | In order to obtain photographic records of implants | |
| Dental implant | DS PrimeTaper, Dentsply Sirona, Hanau, Germany | ||
| Light-Curing Unit | Solidilite V, Japan | Used to curing experimental models in laboratory | |
| Permanent ink | Edding, Germany | Used to stain the implant surface for mimicking biofilm | |
| Physiodispenser | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| SEM Device | FEI QUANTA FEG 250 FEI Technologies Inc. (Oregon, United States | Used to analyze topograhic changes on the implant surface | |
| Surgical implant set | Dentsply Sirona, Hanau, Germany | To place the implants in the experimental models | |
| Titanium Currette | Langer ½ Titanium Currette, Hu-Friedy, Chicago, IL, USA | Used to decontaminate implant surface | |
| Ultrasonic PEEK Tip | PI-MAX Implant Scaler, E.M.S., Electro Medical Systems S.A., Nyon, Switzerland | Used to decontaminate implant surface |
Referanslar
- Buser, D., et al. 10-year survival and success rates of 511 titanium implants with a sandblasted and acid-etched surface: A retrospective study in 303 partially edentulous patients. Clin Implant Dent Relat Res. 14 (6), 839-851 (2012).
- Berglundh, T., et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World workshop on the classification of periodontal and peri-implant diseases and conditions. J Clin Periodontol. 45, S286-S291 (2018).
- Diaz, P., Gonzalo, E., Villagra, L. J. G., Miegimolle, B., Suarez, M. J. What is the prevalence of peri-implantitis? A systematic review and meta-analysis. BMC Oral Health. 22 (1), 1-13 (2022).
- Herrera, D., et al. Prevention and treatment of peri-implant diseases—The EFP S3 level clinical practice guideline. J Clin Periodontol. 50 (S26), 4-76 (2023).
- Heitz-Mayfield, L., Mombelli, A. The therapy of peri-implantitis: a systematic review. Int J Oral Maxillofac Implants. 29 Suppl, 325-345 (2014).
- Heitz-Mayfield, L. J. A., Heitz, F., Lang, N. P. Implant disease risk assessment IDRA–a tool for preventing peri-implant disease. Clin Oral Implants Res. 31 (4), 397-403 (2020).
- Monje, A., Cha, J. K. Strategies for implant surface decontamination in peri-implantitis therapy. Int J Oral Implantol. 15 (3), 213-248 (2022).
- Francis, S., Iaculli, F., Perrotti, V., Piattelli, A., Quaranta, A. Titanium surface decontamination: A systematic review of in vitro comparative studies. Int J Oral Maxillofac Implants. 37 (1), 76-84 (2022).
- Pujarern, P., et al. Efficacy of biofilm removal on the dental implant surface by sodium bicarbonate and erythritol powder airflow system. Eur J Dent. 18 (4), 1022-1029 (2024).
- Polizzi, E., D’orto, B., Tomasi, S., Tetè, G. A micromorphological/microbiological pilot study assessing three methods for the maintenance of the implant patient. Clin Exp Dent Res. 7 (2), 156-162 (2021).
- Monje, A., et al. Morphology and severity of peri-implantitis bone defects. Clin Implant Dent Relat Res. 21 (4), 635-643 (2019).
- Khan, S. N., Koldsland, O. C., Tiainen, H., Hjortsjö, C. Anatomical three-dimensional model with peri-implant defect for in vitro assessment of dental implant decontamination. Clin Exp Dent Res. 10 (1), e841-e848 (2024).
- Matsubara, V. H., et al. Cleaning potential of different air abrasive powders and their impact on implant surface roughness. Clin Implant Dent Relat Res. 22 (1), 96-104 (2020).
- Ronay, V., Merlini, A., Attin, T., Schmidlin, P. R., Sahrmann, P. In vitro cleaning potential of three implant debridement methods. Simulation of the non-surgical approach. Clin Oral Implants Res. 28 (2), 151-155 (2017).
- Sahrmann, P., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Implants Res. 26 (3), 314-319 (2015).
- Hart, I., Wells, C., Tsigarida, A., Bezerra, B. Effectiveness of mechanical and chemical decontamination methods for the treatment of dental implant surfaces affected by peri-implantitis: A systematic review and meta-analysis. Clin Exp Dent Res. 10 (1), e839-e844 (2024).
- Korello, K., Eickholz, P., Zuhr, O., Ratka, C., Petsos, H. In vitro efficacy of non-surgical and surgical implant surface decontamination methods in three different defect configurations in the presence or absence of a suprastructure. Clin Implant Dent Relat Res. 25 (3), 549-563 (2023).
- Luengo, F., et al. In vitro effect of different implant decontamination methods in three intraosseous defect configurations. Clin Oral Implants Res. 33 (11), 1087-1097 (2022).
- Keim, D., et al. In vitro efficacy of three different implant surface decontamination methods in three different defect configurations. Clin Oral Implants Res. 30 (6), 550-558 (2019).
- Al-Hashedi, A. A., Laurenti, M., Benhamou, V., Tamimi, F. Decontamination of titanium implants using physical methods. Clin Oral Implants Res. 28 (8), 1013-1021 (2017).
- Sanz-Martín, I., et al. Significance of implant design on the efficacy of different peri-implantitis decontamination protocols. Clin Oral Investig. 25 (6), 3589-3597 (2021).
- Mensi, M. Comparison between four different implant surface debridement methods: an in vitro experimental study. Minerva Stomatol. 69 (5), 286-294 (2020).
- Sirinirund, B., Garaicoa-Pazmino, C., Wang, H. L. Effects of mechanical instrumentation with commercially available instruments used in supportive peri-implant therapy: An in vitro study. Int J Oral Maxillofac Implants. 34 (6), 1370-1378 (2019).
- Wiessner, A., et al. In vivo biofilm formation on novel PEEK, titanium, and zirconia implant abutment materials. Int J Mol Sci. 24 (2), 1779 (2023).
- Cai, Z., et al. Disinfect Porphyromonas gingivalis biofilm on titanium surface with combined application of chlorhexidine and antimicrobial photodynamic therapy. Photochem Photobiol. 95 (3), 839-845 (2019).
- Azizi, B., et al. Antimicrobial efficacy of photodynamic therapy and light-activated disinfection on contaminated zirconia implants: An in vitro study. Photodiagnosis Photodyn Ther. 21, 328-333 (2018).
- Sahrmann, V., et al. In vitro cleaning potential of three different implant debridement methods. Clin Oral Impl Res. 26 (3), 314-319 (2015).
- Tuchscheerer, V., et al. In vitro surgical and non-surgical air-polishing efficacy for implant surface decontamination in three different defect configurations. Clin Oral Investig. 25 (4), 1743-1754 (2021).
- Iatrou, P., et al. In vitro efficacy of three different nonsurgical implant surface decontamination methods in three different defect configurations. Int J Oral Maxillofac Implants. 36 (2), 271-280 (2021).
- Petersilka, G. J. Subgingival air-polishing in the treatment of periodontal biofilm infections. Periodontol 2000. 55 (1), 124-142 (2011).
- Giffi, R., et al. The efficacy of different implant surface decontamination methods using spectrophotometric analysis: an in vitro study. J Periodontal Implant Sci. 53 (4), 295 (2023).
- Laleman, I., et al. Subgingival debridement: end point, methods and how often. Periodontol 2000. 75 (1), 189-204 (2017).
- Regidor, E., Derks, J., Ortiz-Vigón, A. The use of air abrasive devices for implant surface decontamination. Perio Clinica. 27 (2), 23-38 (2023).
- Khan, S. N., et al. The decontamination effect of an oscillating chitosan brush compared with an ultrasonic PEEK-tip: An in study using a dynamic biofilm model. Clin Oral Implants Res. 36 (1), 73-81 (2025).
- Louropoulou, A., Slot, D. E., van der Weijden, F. The effects of mechanical instruments on contaminated titanium dental implant surfaces: a systematic review. Clin Oral Implants Res. 25 (10), 1149-1160 (2014).
- Lang, M. S., Cerutis, R., Miyamoto, T., Nunn, E. Cell attachment following instrumentation with titanium and plastic instruments, diode laser, and titanium brush on titanium, titanium-zirconium, and zirconia surfaces. Int J Oral M axillofac Implants. 31, 799-806 (2016).
- Harrel, S. K., Wilson, T. G., Pandya, M., Diekwisch, T. G. H. Titanium particles generated during ultrasonic scaling of implants. J Periodontol. 90 (3), 241-246 (2019).
- Schwarz, F., Nuesry, E., Bieling, K., Herten, M., Becker, J. Influence of an Erbium, Chromium-Doped Yttrium, Scandium, Gallium, and Garnet (Er,Cr:YSGG) laser on the reestablishment of the biocompatibility of contaminated Titanium implant surfaces. J Periodontol. 77 (11), 1820-1827 (2006).
- Hakki, S. S., Tatar, G., Dundar, N., Demiralp, B. The effect of different cleaning methods on the surface and temperature of failed titanium implants: an in vitro study. Lasers Med Sci. 32 (3), 563-571 (2017).
- Chegeni, E., Espanã-Tost, A., Figueiredo, R., Valmaseda-Castellón, E., Arnabat-Domínguez, J. Effect of an Er,Cr:YSGG laser on the surface of implants: A descriptive comparative study of 3 different tips and pulse energies. Dent J. 8 (4), 109-118 (2020).
- Mei, L., Guan, G. Profilometry and atomic force microscopy for surface characterization. Nano TransMed. 2 (1), e9130017-e9130024 (2023).
- Martelo, J. B., Andersson, M., Liguori, C., Lundgren, J. Three-dimensional scanning electron microscopy used as a profilometer for the surface characterization of polyethylene-coated paperboard. Nord Pulp Paper Res J. 36 (2), 276-283 (2021).
- Kimoto, K., et al. Unsupervised machine learning combined with 4D scanning transmission electron microscopy for bimodal nanostructural analysis. Sci Rep. 14 (1), 2901-2909 (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır