Method Article
Dağılabilir Taohong Siwu Tabletlerinin Oluşumu
Bu Makalede
Özet
Bu makalede, geleneksel bir Çin tıbbı olan Taohong Siwu'yu dağılabilir bir tablet olarak formüle etmek ve hazırlamak için kullanılan süreç tartışılmaktadır. Reçeteli yardımcı maddeleri taramak, formülasyon sürecini optimize etmek ve dağılabilir Taohong Siwu tabletleri üretmek için tek faktörlü ve ortogonal deneyler gerçekleştirdik.
Özet
Burada, dağılabilir Taohong Siwu tabletlerini formüle etmek ve hazırlamak için kullanılan süreci optimize ediyoruz ve klinik uygulamalarını genişletmek için bir temel sağlıyoruz. Araştırma için endeksler olarak dağılım homojenliği ve parçalanma süresini alarak, Taohong Siwu tabletleri için eksipiyan kategorilerini eşleştirmek ve filtrelemek için tek faktörlü bir test kullandık. Formülasyon, ortogonal bir test tasarımı ile optimize edilmiştir. Optimize edilmiş reçetelerle hazırlandığında dağılabilir Taohong Siwu tabletlerindeki etkili maddelerin içeriği ve çözünme oranları, ultra yüksek performanslı sıvı kromatografisi (UPLC) ile belirlendi ve optimum hazırlama süreci belirlendi.
Dağılabilir Taohong Siwu tabletleri için en uygun bileşim% 17 Taohong Siwu özü tozu,% 1 magnezyum stearat,% 49 mikrokristalin selüloz,% 20 çapraz bağlı polivinilpirolidon ve% 13 sodyum karboksimetil nişasta idi. Dağılabilir Taohong Siwu tabletleri doğrudan sıkıştırma ile hazırlandığında ve optimize edilmiş reçeteli toz 3 dakika içinde eşit olarak dağıldığında, çözünme oranı 50 dakika içinde% 90'dan fazla ulaştı. Optimize edilmiş yöntemlere göre hazırlandığında, dağılabilir Taohong Siwu tabletleri, iyi dağılım homojenliği ve kontrol edilebilir kalite ile suda hızla parçalanır.
Giriş
Taohong Siwu kaynatma, şeftali çekirdeği, aspir, angelica, beyaz şakayık, ligusticum chuanxiong ve rehmannia 1,2'den oluşan ve kan akışını teşvik etmek ve detumescence ve ağrıyı azaltmak için kullanılabilecek bir reçetedir 3,4. Önceki araştırmalar, Taohong Siwu Tang'ın korunmasının zor olduğunu ve küf ve diğer faktörlerden kolayca etkilendiğini bulmuştur. Ayrıca, yaygın olarak kullanılan klinik kaynatma işleminin taşınması elverişsizdir, kaynatma prosedürü zahmetlidir ve kalitedeki değişikliklere tabidir. Bu nedenle, Taohong Siwu tabletleri için yeni bir formülasyon geliştirmeye acil bir ihtiyaç vardır.
Dağılabilir tabletler, suda hızla parçalanabilen ve düzgün süspansiyonlarda dağıtılabilen tabletlerdir5. Geleneksel Çin tıbbında (TCM), dağılabilir tabletlerdeki ana ilaç normalde TCM tozunun, ekstraktların ve diğer uygun yardımcı maddelerin hammaddelerinden hazırlanır6. Geleneksel sıvı preparatlar ve sıradan tabletlerle karşılaştırıldığında, dağılabilir tabletler, yeni bir dozaj formu olarak, insan vücudunda daha hızlı emilir, daha iyi stabilite sergiler, alınması ve taşınması kolaydır ve hızlı parçalanma, yüksek biyoyararlanım ve iyi dağılım homojenliği gibi bir dizi faydalı özellik sergiler 7,8.
Ortogonal test tasarım yöntemi, test koşullarını bilimsel olarak seçmek, makul bir test planı düzenlemek ve daha sonra test sonuçlarını analiz etmek ve optimal bir plan oluşturmak için aralık ve varyansın matematiksel kavramlarını kullanmak için ortogonal bir tablo kullanır 9,10. Bu çalışmada, özellikle bazı temel özelliklerle ilgileniyoruz: dağılımın homojenliği, düzenlilik ve karşılaştırılabilirlik. Ortogonal deneysel tasarımlar, kesirli ve faktöriyel bir tasarım içerecek şekilde de uyarlanabilir. Bu çalışmada, dağılabilir Taohong Siwu tabletleri için eksipiyan tiplerini, eksipiyan oranlarını ve ilaç yükleme verilerini taramak ve optimize etmek için ortogonal bir deneysel tasarım kullanıyoruz. Çin tıbbının geleneksel kaynatma maddeleri ile karşılaştırıldığında, burada açıklanan metodoloji ile hazırlanan dağılabilir Taohong Siwu tabletlerinin alınması kolaydır, korunması kolaydır ve küflenmeye karşı oldukça dirençlidir.
Protokol
1. Taohong ekstraktının hazırlanması
- 39.6 g hazırlanmış rehmannia kökü ölçün (Rehmannia glutinosa [Gaetn.] Libosch. eski Fisch. vd.), 29.7 g şeftali çekirdeği (Prunus persica [L.] Batsch), 19.8 g aspir (Carthamus tinctorius L.), 29.7 g angelica (Angelica sinensis [Oliv.] Diels), 29.7 g beyaz şakayık kökü (Cynanchum otophyllum Schneid) ve 19.8 g ligusticum chuanxiong (Ligusticum chuanxiong hort), toplam 168.3 g tıbbi malzeme11 ve bu bileşenleri bir kaynatma güvecine yerleştirin.
- Üç kez kaynatma yapın.
- Her tur için 1.683 mL su ekleyin ve malzemeleri 1,5 saat kaynatın.
- Filtratı birleştirin ve elde edilen sıvıyı gazlı bezle filtreleyin. Sıvıyı döner bir evaporatörde 400 mL'lik nihai bir hacme kadar yoğunlaştırın.
- Konsantreyi eşit şekilde bir buharlaşma kabına dökün ve fazla suyu kurutmak için 90 ° C'de bir su banyosuna yerleştirin.
- Kalınlaştırılmış ekstraktı 85 ° C'de vakumlu bir kurutma fırınına koyun ve kuru bir ekstrakt elde etmek için 8 saat kurutun.
- Daha sonra, kurutulmuş ekstraktı bir harçta toz haline getirin ve ardından 80 ağlı bir elek ile eleyin.
NOT: Elde edilen kuru ekstrakt, dört tıbbi bileşeni içeren pembe bir bitkisel toz şeklindeydi.
2. Dolgu maddelerinin taranması
- Dolgu maddesi olarak laktoz, önceden jelatinleştirilmiş nişasta ve mikrokristalin selüloz kullanın.
- Parçalayıcı olarak çapraz bağlı polivinil pirolidon (PVPP) ve yağlayıcı olarak magnezyum stearat kullanın.
NOT: Test için reçete oluşturmak üzere üç formül kullanılmıştır. - Formül 1'i hazırlayın: Dolgu maddesini üretmek için 0.5 g tıbbi toz ve 3.4 g mikrokristalin selüloz (MCC) ve yağlayıcıyı üretmek için 1 g PVPP ve 0.1 g magnezyum stearat.
- Formül 2'yi hazırlayın: 0.5 g tıbbi toz, dolgu maddesi olarak 3.4 g önceden jelatinize nişasta, parçalayıcı olarak 1 g PVPP ve yağlayıcı olarak 0.1 g magnezyum stearat.
- Formül 3'ü hazırlayın: 0.5 g tıbbi toz, dolgu maddesi olarak 3.4 g laktoz, parçalayıcı olarak 1 g PVPP ve yağlayıcı olarak 0.1 g magnezyum stearat.
- Her reçeteyi iyice karıştırın ve 80 örgülü bir ekrandan geçirin. Eşit şekilde karıştırılmış tozu tek bir zımba tablet makinesine yerleştirin ve bir tableti delin.
- Her tableti ayrı ayrı test edin. Tableti 1 L 37 °C damıtılmış su içeren bir beher içine yerleştirin.
- Beheri bir çözünme test cihazına yerleştirin (Malzeme Tablosu).
- Çözünme test cihazını başlatın ve reaksiyonu zamanlayın. Tabletler tamamen parçalandığında, zamanlayıcıyı durdurun ve tabletlerin eşit şekilde dağılıp dağılmadığını gözlemleyin.
NOT: Parçalanma süresini ve dağılım homojenliğini sonraki deneylerde göstergeler olarak ele aldık. Her reçeteden kaynaklanan veriler Tablo 1'de verilmiştir.
3. Parçalayıcı seçimi
- Üç farklı reçete oluşturmak için üç yardımcı maddeyi çiftler halinde karıştırın ve kombinasyonları test edin.
- PVPP ve düşük ikame edilmiş hidroksipropil selüloz (L-HPC) (1:1) ile formülasyon 1'i hazırlayın.
- L-HPC ve karboksimetil nişasta sodyum (CMS-NA) (1:1) ile formülasyon 2'yi hazırlayın.
- PVPP ve CMS-Na (1:1) ile formülasyon 3'ü hazırlayın.
- Her reçeteyi iyice karıştırın ve 80 örgülü bir ekrandan geçirin. Eşit şekilde karıştırılmış tozu tek bir zımba tablet makinesine yerleştirin.
- Tabletlerin görünümünü ve şeklini araştırın. Tabletleri beyaz bir arka plan üzerine yerleştirin ve rengin görünümünün tek tip olup olmadığını gözlemleyin. Parçalanma süresini 2.7-2.9 adımlarına göre ölçün.
NOT: Sonuçlar Tablo 2'de gösterilmiştir.
4. Dolgu maddesi ve parçalayıcı dozajın optimizasyonu
- Faktör A olarak mikrokristalin selüloz dozajını, faktör B olarak çapraz bağlı polivinilpirolidon dozajını, faktör C olarak sodyum karboksimetil selüloz dozajını ve faktör D olarak boş hatayı kullanarak ortogonal bir deney yaparak dolgu maddelerinin (adım 2) ve parçalayıcıların (adım 4) spesifik dozajını optimize edin.
- Yardımcı maddeleri Tablo 3'e göre hazırlayın. Eksipiyanları ayrı ayrı tartın ve üç formülasyonu eşit şekilde karıştırın.
- Formülasyonları 0,18 mm elek çapına sahip bir elek içinden geçirin.
- Formülasyonları tabletlere bastırın. Parçalanma süresini 2.7-2.9 adımlarına göre ölçün.
NOT: Tablo 3 ve Tablo 4 , faktör düzeyindeki düzenlemeyi ve ortogonal deney düzenlemesini göstermektedir. - Veri analizi için elde edilen verileri elektronik tablo yazılımına aktarın.
NOT: Tablo 5 varyans analizinin sonuçlarını gösterir ve Şekil 1 her test dizini için eğilimleri gösterir.
5. İlaç yüklemesinin taranması
NOT: Dolgu ve parçalayıcı testlerini takiben, mikrokristalin selüloz, çapraz bağlı polivinilpirolidon, sodyum karboksimetil nişasta ve magnezyum stearatın optimal içeriği sırasıyla 4.4 g, 1.8 g, 1.2 g ve 0.1 g olarak belirlenmiştir.
- Dolgu, parçalayıcı ve yağlayıcının nispi içeriğini sabit tutarken, reçete 1'i 1 g tıbbi toz, reçete 2'yi 1.5 g tıbbi toz, reçete 3'ü 2 g tıbbi toz ve reçete 4'ü 2.5 g tıbbi toz ile hazırlayın.
- Her reçetede kullanılan toz, dolgu maddesi, parçalayıcı ve yağlayıcıyı iyice karıştırın ve 80 örgülü bir elek içinden geçirin.
- Tabletlere basın ve parçalanma süresi test cihazına bir tablet yerleştirin.
- Enstrümanı ve zamanı başlatın; Tablet tamamen parçalandıktan sonra zamanlayıcıyı durdurun.
NOT: Reçete çizelgesi Tablo 6'da gösterilmiştir.
6. Taohong Siwu dağılabilir tabletlerin kalite değerlendirmesi
- Görünüm değerlendirmesi
NOT: Çin Farmakopesi Genel Kuralı 010112'nin 2020 baskısının gerekliliklerine göre, tabletin görünümü eksiksiz ve pürüzsüz olmalı ve renk tek tip olmalıdır.- Dağılabilir tabakanın yüzeyinin pürüzsüz olup olmadığını ve rengin düzgün olup olmadığını gözlemlemek için üç partinin her birinden rastgele altı parça seçin.
- Ağırlık değişimi
- Islak ağırlığın değerlendirilmesi için, her partiden 20 tablet alın ve toplam ağırlığı doğru bir şekilde belirleyin. Ortalama tablet ağırlığını belirleyin.
- Her tableti ayrı ayrı tartın.
- Her tabletin ağırlığını ortalama ağırlıkla karşılaştırın.
NOT: Bir tabletin ortalama ağırlığı ile ağırlığı arasındaki fark 0,30 g ± %7,5'i geçmemelidir. Ağırlıktaki fark iki tabletinkini geçmemeli ve tek bir tabletin ağırlığı sınırı bir kat aşmamalıdır.
- Parçalanma ve dağılım homojenliği testleri
NOT: Çin Farmakopesi12'nin 0921 sayılı Genel Kuralı hükümlerine göre, her bir tablet grubu için parçalanma süresini belirledik.- Üst ucunda paslanmaz çelik şaft bulunan bir braket üzerine bir gondol asın. Aparatı 1 L'lik bir behere daldırın ve gondolun konumunu, ekranın en düşük noktasına düştüğünde beherin altından 25 mm uzakta olacak şekilde ayarlayın.
- Beheri 37 °C ± 1 °C sıcaklıkta suyla doldurun ve su seviyesinin yüksekliğini, gondol en yüksek noktasına yükseldiğinde elek su yüzeyinin 15 mm altında olacak şekilde ayarlayın. Teleferiğin üst kısmının herhangi bir noktada çözeltiye batırılmadığından emin olun.
- Her test partisinden altı tablet alın ve bunları gondoldaki bir cam tüpe yerleştirin.
- Çözünme test cihazını etkinleştirin.
NOT: Her tabletin 15 dakika içinde tamamen parçalanması gerekir. - Bir tablet tamamen parçalanmamışsa, yeniden test için altı tablet daha alın. Tüm tabletler gerekli düzenlemeleri karşılamalıdır.
7. Karakterizasyon
- Kromatografik koşullar
- 2,1 mm x 100 mm sütunlu kromatografik bir sütun kullanın (örneğin, ACQUITY UPLC BEH C18 1,7 μm).
- % 100 asetonitril (A) ve% 0.5 fosforik asit sulu çözelti (B) mobil faz kullanın.
- Degrade elüsyonu için aşağıdaki elüsyon programını kullanın: 0-4 dakika (%10-%30), 4-10 dakika (%30-%60), 10-15 dakika (%60-%85), 15-17 dk (%85-%50), 17-20 dk (%50-%110), 20-22 dk (%10-%10).
- 0,2 mL/dak akış hızı, 260 nm algılama dalga boyu, 30 °C sütun sıcaklığı ve 2 μL enjeksiyon hacmi kullanın.
- Çözelti hazırlama
- Bir amigdalin referans çözeltisi hazırlayın. Amigdalini metanol içinde 0.2 mg · mL−1 konsantrasyonunda çözün.
- Bir test çözümü hazırlayın.
- Her numune için, beş tableti bir harçla ezin ve 25 mL% 80 metanol içeren 25 mL'lik hacimsel bir şişeye yerleştirin.
- Her numuneyi 150 W ve 40 kHz'de 30 dakika boyunca çözünmesi için ultrasonikatın.
- Her numuneyi oda sıcaklığına soğutun ve ardından toplam 25 mL'lik hacme %80 metanol ekleyin.
- Son olarak, numuneyi mikro gözenekli bir membranla (0,22 μm) filtreleyin. Alt tabakayı test için ürün olarak kullanın.
- Doğrusal ilişki analizi
- Referans çözeltiden 1 mL alın ve mikro gözenekli bir filtre membranı (0,22 μm) ile filtreleyin.
- Referans çözeltisinin 0,5 μL, 1 μL, 1,5 μL, 2 μL, 2,5 μL ve 3 μL'sini kromatografi sütununa aktarın ve bölüm 7.1'de açıklandığı gibi kromatografi yapın.
- Numuneyi enjekte edin ve tepe bölgesini kaydedin.
- Değişkenler olarak tepe alanını (y) ve enjeksiyon hacmini (x) kullanarak doğrusal regresyon gerçekleştirin.
NOT: Elde edilen regresyon denklemi y = 18115x − 2386.6 (R² = 0.9993) idi, böylece amigdalinin 0.0492-0.3101 mg aralığında iyi bir doğrusal ilişki sergilediğini gösterdi. Şekil 2'de standart eğri görülmektedir.
- Hassas test
- Referans çözeltisinden 2 μL (bölüm 5.2.1'de açıklandığı şekilde hazırlanmış) kromatografa art arda altı kez enjekte edin.
- Tepe alanını kaydedin ve göreli standart sapma (RSD) değerini hesaplayın.
NOT: Amigdalinin tepe alanı için ölçülen RSD değeri% 2.7 idi, bu da cihazın iyi hassasiyet sergilediğini gösteriyordu.
- Tekrarlanabilirlik deneyleri
- Tekrarlanabilirliği değerlendirmek için, 30 dağılabilir tableti ince bir toz halinde öğütün ve elde edilen tozları birlikte karıştırın.
- Toplanan tozu her biri yaklaşık 1 g ağırlığında altı partiye bölün.
- Test çözeltisini bölüm 7.2.2'de açıklandığı şekilde hazırlayın.
- Her numuneden 2 μL enjekte edin, tepe alanını kaydedin ve RSD değerini hesaplayın.
NOT: Ölçülen tepe alanı RSD değeri% 1.8 idi, bu da yöntemin iyi tekrarlanabilirlik sergilediğini gösteriyordu.
- Kararlılık deneyleri
- Aynı test çözeltisini kullanarak, 0 saat, 2 saat, 4 saat, 6 saat, 8 saat, 12 saat ve 14 saatte 2 μL çözelti enjekte edin.
- Tepe alanını kaydedin ve RSD değerini hesaplayın.
NOT: Amigdalinin tepe alanının ölçülen RSD değeri% 2.8 idi, bu nedenle test çözeltisinin oda sıcaklığında 24 saat boyunca kararlı olduğunu gösterdi.
- Numune kurtarma testi
- Altı adet dağılabilir tablet örneği alın ve bölüm 7.2.2'de açıklanan yönteme göre test çözeltileri hazırlayın.
- Aynı enjeksiyon şişesine 1 mL kontrol maddesi ekleyin, numune içeriğini bölüm 7.1'de açıklanan koşullara göre ölçün ve geri kazanım oranını hesaplayın.
NOT: Analiz, amigdalinin (n = 6) ortalama iyileşme oranının% 101 ve RSD değerinin% 2.8 olduğunu ve böylece yöntemin iyi doğruluk gösterdiğini göstermiştir.
- Numune içeriğinin belirlenmesi
- Bölüm 7.2.2'de verilen yönteme uygun olarak test çözeltileri hazırlamak için üç grup dağılabilir tablet kullanın.
- Bölüm 7.1'de açıklanan kromatografik koşullar altında her numuneden 2 μL enjekte edin.
- Tepe alanını kaydedin ve içeriği ölçün.
NOT: Üç grup dağılabilir tabletteki ortalama amigdalin içeriği 0.257 mg / tablet idi.
- Çözünme tayini
- Altı parti dağılabilir tablet alın ve çözünme oranını, Çin Farmakopesi12'nin 2020 baskısında açıklanan çözünme tayini için küçük fincan yöntemine göre ölçün.
- Çözünme ortamı olarak 0,1 M hidroklorik asit (250 mL) kullanın ve testi 37 ° C'de 0,5 ° C'± ve 50 dakika boyunca 100 rpm'de gerçekleştirin.
- Numuneleri derhal mikro gözenekli bir membrandan (0,22 μm) geçirin.
- Bölüm 7.1'de açıklanan kromatografik koşullara göre enjekte edin ve test edin.
- Tepe alanını ve çözünme oranını kaydedin.
NOT: Altı grup numunenin çözünme oranları sırasıyla %98, %99, %96, %97, %97 ve %98 idi.
Sonuçlar
Bu çalışmada, Taohong Siwu kaynatma sıvı ekstraktlarını hazırlamak için geleneksel bir yöntem kullandık ve konsantrasyon ve kurutma yoluyla bitkisel bir toz hazırladık. Bitkisel toz, parçalanma ve yağlayıcıyı değişmeden tutarak, parçalanma süresini belirlemek için r-laktoz, prejelatinize nişasta ve mikrokristalin selülozu dolgu maddeleri olarak taradık. Parçalanan olarak laktoz ile parçalanma süresi, prejelatinize nişasta ve mikrokristalin selülozdan daha iyi olmasına rağmen, sertlik ve yüzey kalitesi gerekli standartları karşılamadı; Böylece, dolgu maddesi olarak mikrokristalin selüloz seçildi.
Uygun bir parçalayıcı seçmek için, aynı bitkisel toz, dolgu maddesi ve yağlayıcı ile üç reçete oluşturduk: reçete 1 (çapraz bağlı polivinilpirolidon ve düşük ikame edilmiş hidroksipropil selüloz), reçete 2 (düşük ikame edilmiş hidroksipropil selüloz ve sodyum karboksimetil nişasta) ve reçete 3 (çapraz bağlı polivinilpirolidon ve sodyum karboksimetil nişasta); oran her durumda 1: 1 idi. Görünüm, parçalanma süresi ve dağılım homojenliğini muayene göstergeleri olarak alarak, çapraz bağlı polivinilpirolidon ve sodyumun birleşik parçalanma süresi ve dağılım homojenliğinin optimal olduğunu gördük. Daha sonra, optimum dolgu maddesi ve parçalayıcı içeriğini belirlemek için ortogonal testler yaptık. En iyi sonuçlar 4.4 g mikrokristalin selüloz (MCC, Faktör A), 1.8 g çapraz bağlı polivinilpirolidon (PVPP, Faktör B) ve 1.2 g sodyum karboksimetil nişasta (CMS-Na, Faktör C) ile elde edildi. Dolgu maddesi ve parçalayıcının optimal dozajını ve oranlarını belirledikten sonra, parçalanma süresini, dağılım homojenliğini ve farklı oranların sertliğini araştırarak optimal bitkisel toz miktarını belirledik. Şekil 3 , dört reçetenin dağılım homojenliği değerlendirmesini geçtiğini göstermektedir. Bununla birlikte, daha büyük bir ilaç yüküyle, daha uzun bir parçalanma süresi ve koşumda bir azalma gözlemledik. Son reçete 1.5 g tıbbi toz, 4.4 g mikrokristalin selüloz, 1.8 g çapraz bağlı polivinilpirolidon, 1.2 g sodyum karboksimetil nişasta ve 0.1 g magnezyum stearat olarak tanımlandı. Son spesifikasyon, tablet başına 0.30 g ve uygulama başına dört tablet (günde üç kez) idi; Bu, 1.068 g ham ilaca eşdeğerdi.
İçerik belirleme ve çözünme testleri, her bir dağılabilir tabletteki amigdalin içeriğinin 0.257 mg olduğunu göstermiştir. Çözünme testinde, dağılabilir tabletlerin altı partisinin 50 dakikada çözünme oranları sırasıyla% 98,% 99,% 96,% 97,% 97 ve% 98 idi, böylece dağılabilir Taohong Siwu tabletlerinin çözünme oranının iyi olduğunu gösterdi.
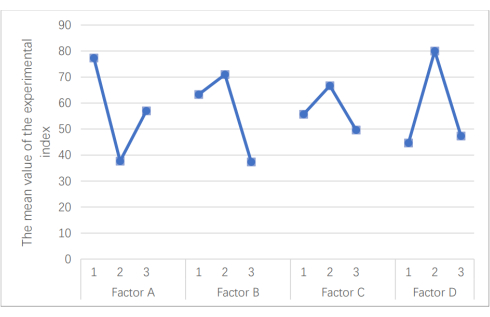
Şekil 1: Test endeksleri için ortalama eğilim. Test göstergeleri için ortalama eğilim grafiği. Şekildeki faktör A, Taohong Siwu ilaç tozunun içeriğidir, faktör B, PVPP'nin içeriğidir, faktör C, CMS-Na'nın içeriğidir ve faktör D, boş hata grubudur. Her faktördeki sayılar farklı içerikleri temsil eder (ayrıntılar için Tablo 3'e bakın). Y eksenindeki değer K değerini temsil eder ve daha düşük K değerleri daha iyi sonuçları gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
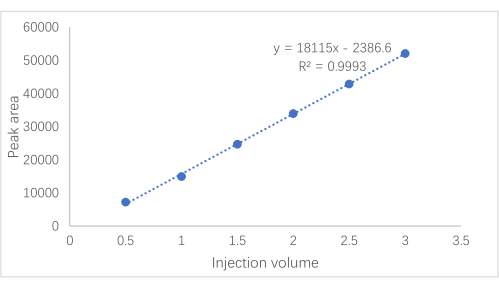
Resim 2: Laetril standart eğrisi. Amigdalinin standart eğrisi, enjeksiyon hacmini temsil eden x ekseni ve tepe alanını temsil eden y ekseni. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
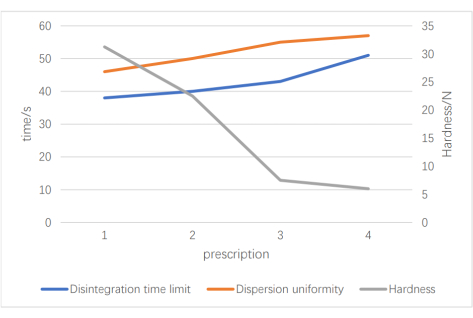
Şekil 3: İlaç yükü tarama sonuçları. Bu şekil ilaç yükü sonuçlarını göstermektedir; Sol y ekseni zamandır, sağ y ekseni sertliktir ve x eksenindeki dört reçete farklı ilaç yükü hacimlerini temsil eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| seri numarası | Tıbbi toz (g) | PVPP (g) | MM (g) | Prejelatinize nişasta (g) | laktoz (g) | Parçalanma süresi sınır(lar)ı | Dış |
| 1 | 0.5 | 1 | 3.4 | 26 | temiz | ||
| 2 | 0.5 | 1 | 3.4 | 54 | temiz | ||
| 3 | 0.5 | 1 | 3.4 | 16 | meydan |
Tablo 1: Dolgu seçim sonuçları. Üç reçetedeki ana ilaç içeriği ve PVPP dozu değişmeden kaldı; Reçete 1'de doldurucu olarak MCC, reçete 2'de dolgu maddesi olarak prejelatinize nişasta ve reçete 3'te dolgu maddesi olarak laktoz kullanılmıştır. Bunlardan, dolgu maddesi olarak laktoz en kısa parçalanma süresine sahipti, ancak parlaklık standartlara uygun değildi.
| Disintegrant reçetesi | Dış | Parçalanma süresi sınır(lar)ı | Dağılım homojenliği (s) |
| PVPP+L-HPC | temiz | 39 | 39 |
| L-HPC+CMS-Na | temiz | 40 | 52 |
| PVPP+CMS-Na | temiz | 42 | 40 |
Tablo 2: Parçalayıcı kombinasyon taraması. Ana ilaç ve dolgu maddesinin değişmeden kaldığı koşullar altında, parçalanma süresi sınırı ve dağılım homojenliği açısından farklı ayrıştırıcı kombinasyonları test edilmiştir. Reçete 1, PVPP + L-HPC, reçete 2, L-HPC + CMS-Na ve reçete 3, PVPP + CMS-Na kombinasyonunun en kısa parçalanma süresi sınırına sahip olduğu PVPP + CMS-Na idi.
| Düzey | A (g) | B (g) | C (g) | D (g) |
| 1 | 3.4 | 0.6 | 0.4 | boş |
| 2 | 4.4 | 1.2 | 0.8 | boş |
| 3 | 5.4 | 1.8 | 1.2 | boş |
Tablo 3: Ortogonal tasarımlar için faktör seviyeleri. Her reçetenin ana ilacının dozu değişmeden kaldı. Faktör A, dolgu MCC'nin dozajıdır, faktör B, PVPP'nin dozajıdır, faktör C, CMS-Na'nın dozajıdır ve faktör D, boş hatadır.
| Numaralama | A (g) | B (g) | C (g) | D (boş) | Parçalanma süresi sınır(lar)ı |
| 1 | 1 | 1 | 1 | 1 | 69 |
| 2 | 1 | 2 | 2 | 2 | 123 |
| 3 | 1 | 3 | 3 | 3 | 40 |
| 4 | 2 | 1 | 2 | 3 | 43 |
| 5 | 2 | 2 | 3 | 1 | 31 |
| 6 | 2 | 3 | 1 | 2 | 39 |
| 7 | 3 | 1 | 3 | 2 | 78 |
| 8 | 3 | 2 | 1 | 3 | 59 |
| 9 | 3 | 3 | 2 | 1 | 34 |
| K1 | 232 | 190 | 167 | 134 | |
| K2 | 113 | 213 | 200 | 240 | |
| K3 | 171 | 113 | 149 | 142 | |
| K1 | 77.333 | 66.333 | 55.667 | 44.667 | |
| K2 | 37.667 | 71 | 66.667 | 80 | |
| K3 | 57 | 37.667 | 49.667 | 47.333 | |
| R | 39.667 | 33.333 | 17 | 35.333 | |
| birincil ve ikincil | RA>RD>RB>RC |
Tablo 4: Ortogonal deney düzenlemesi ve deneysel sonuçlar.
| Varyans kaynağı | karesel sapmaların toplamı | Serbestlik dereceleri | ortalama kare | F değeri | dikkati çekme |
| A | 236.667 | 2 | 1180.333 | 1.016 | >0,05 |
| B | 1828.667 | 2 | 914.333 | 0.787 | >0,05 |
| C | 446 | 2 | 223 | 0.192 | >0,05 |
| D (hata) | 2322.667 | 2 | 1161.333 |
Tablo 5: Varyans analizi sonuçları.
| Reçete | Tıbbi toz (g) | MM (g) | PVPP (g) | CMS-Na (g) | Magnezyum stearat (g) |
| 1 | 1 | 4.4 | 1.8 | 1.2 | 0.1 |
| 2 | 1.5 | 4.4 | 1.8 | 1.2 | 0.1 |
| 3 | 2 | 4.4 | 1.8 | 1.2 | 0.1 |
| 4 | 2.5 | 4.4 | 1.8 | 1.2 | 0.1 |
Tablo 6: İlaç yükü formülasyonları. Her reçete için MCC, PVPP ve CMS-Na dozu değişmeden kalmıştır. Reçete 1'deki ana ilacın dozu 1 g, reçete 2'de 1.5 g, reçete 3'te 2 g ve reçete 4'te 2.5 g idi.
| Parti numarası | Dış | Ortalama sac ağırlığı (g) | Ağırlık farkı (g) | Ortalama sertlik (N) | Parçalanma süresi sınır(lar)ı | Dağılım homojenliği (s) |
| 20220710 | temiz | 0.1978 | kalifiye | 22 | 39 | 43 |
| 20220711 | temiz | 0.186 | kalifiye | 21 | 35 | 41 |
| 20220712 | temiz | 0.1948 | kalifiye | 18 | 29 | 32 |
Tablo 7: Dağılabilir Taohong Siwu tabletleri için kalite değerlendirmesi. Üç parti numune için görünüm analizi, ortalama ağırlık analizi, ağırlık farkı kontrolü, sertlik kontrolü, parçalanma süresi sınırı kontrolü ve dağılım homojenliği kontrolü yapılmıştır.
Tartışmalar
Bu çalışmada, dolgu, parçalanma maddesi ve tıbbi toz dozajının, dağılabilir tabletlerin parçalanma süresi ve dağılım homojenliği üzerindeki etkisini ortogonal bir tasarım kullanarak test ettik. Tercih edilen formülasyonun hızla parçalandığını gördük. En uygun dolgu maddesini seçerken, laktozun en kısa parçalanma süresini göstermesine rağmen, bu tabletlerin sertliğinin yeterli olmadığını gördük. Ayrıca, tabletlerin yüzeyi yeterince pürüzsüz değildi ve toz kaybı ve gevşek tabletler olduğuna dair kanıtlar vardı. Bu nedenle, laktoz uygun bir dolgu maddesinin gereksinimlerini karşılamadı; Bu nedenle, en uygun dolgu maddesi olarak mikrokristalin selülozu seçtik. Mikrokristalin selüloz, güçlü akışkanlığa sahip ve lifli bir yapıya sahip olmayan toz veya kısa çubuklar şeklinde bir polimerdir13. Dahası, mikrokristalin selüloz kokusuzdur, toksik değildir, parçalanması kolaydır ve ilaçlarla reaktif değildir. Bu polimer, farmasötik endüstrisinde önemli bir yardımcı maddedir ve ilaç kalıplamasını teşvik etmek için ilaç bileşenlerini verimli bir şekilde bağlayabilir14. Ayrıca, bu polimer, ilaç gücünü arttırırken ilaç bileşenlerinin ayrışmasını kolaylaştırabilir ve esas olarak ilaç tabletlerinin, ilaç granüllerinin ve ilaç kapsüllerinin hazırlanması için bir yardımcı madde, dolgu maddesi veya ilaç salınım değiştiricisi olarak kullanılır15,16.
Disintegrantlar iyi su emme ve şişme özelliklerine sahiptir ve dağılabilir tabletlerin suda eşit dağılımını teşvik edebilir. Şu anda, dağılabilir tabletlerde en sık kullanılan parçalayıcılar L-HPC, çapraz bağlı PVPP ve CMS-Na17'dir. Bu deneyde, çapraz bağlı PVPP ve CMS-Na kombinasyonu en kısa parçalanma süresini sergiledi. Çoğu dağılabilir tablet iki veya daha fazla parçalanıcı kullanır. Parçalayıcıların kombinasyonları parçalanma etkisini artırabilir ve maliyetleri azaltabilir18. İlaç yüklemesini tararken, ilaç yükü arttıkça tabletlerin sertliğinin azaldığını; Bu etki, tıbbi malzeme tozunun doğası ile ilgili olabilir19. Son olarak, dağılabilir tabletleri (dört bileşen içeren) hazırlamak için kullanılan proses, formülasyonla optimize edilmiştir. Bunu parçalanma zamanının ve dağılım homojenliğinin endekslenmesi izledi. Nihai bileşenler tıbbi toz (% 17), mikrokristalin selüloz (% 49), çapraz bağlı polivinilpirolidon (% 20), sodyum karboksimetil nişasta (% 13) ve magnezyum stearat muhasebesi (% 1) idi.
Geleneksel Çin tıbbı kaynatmalarıyla karşılaştırıldığında, dağılabilir tabletler, özellikle kaynatma almayı zor bulan ve yutma güçlüğü çeken hastalar için yüksek biyoyararlanım, iyi stabilite ve kolay taşınabilirlik ile iyi terapötik etkiler gösterebilir20,21. Geleneksel Çin tıbbında, dağılabilir tabletlerdeki ana ilaç genellikle tek bir bileşik değildir; aksine, ilaç karmaşık bir bileşen karışımından oluşur. Ayrıca, bu tür tozlar nispeten yüksek bir viskoziteye sahiptir ve genellikle nemi emebilir. Ana ilaç olarak Çin bitkisel ilaç tozu içeren sıradan tabletler, iyileştirici etkiyi etkileyen uzun bir parçalanma süresi ve zayıf dağılım homojenliği de dahil olmak üzere çok çeşitli problemlerle ilişkilidir. Bu nedenle, bu araştırmada, Taohong Siwu kaynatma işleminin geleneksel kaynatmalarla ilgili sorunları çözmesi için yeni bir formülasyon, dağılabilir tabletler tasarladık, böylece uygulama yelpazesini genişlettik ve vücutta emilimi teşvik ettik22. Bu araştırmada su ekstraksiyon yöntemini uygulayarak tıbbi malzemelerden kuru bir toz çıkardık. Geleneksel kaynatma yöntemleri, etkili bileşenlere ve aktif bileşenlerin özelliklerine göre ekstrakte edilebilen karmaşık bileşenleri içerir. Ayrıca, aktif bileşenlerin içeriği dağılabilir tabletlerde arttırılabilir. Tıbbi malzemelerdeki safsızlıkların ayrılması ve aktif bileşenlerinin korunması, hazırlık sırasında dikkatlice düşünülmesi gereken bir sorundur. Daha sonra dağılabilir tabletlerin hazırlanması için uygun koşulların sağlanması da önemlidir. Taohong Siwu kaynatma gibi geleneksel kaynatmalar genellikle yüksek şeker içeriğine sahiptir. Bitkisel tozlar, nemi emecek şekilde kolayca hazırlanabilir. Bu nedenle, hazırlık sırasında kururken önlem almak önemlidir. Ayrıca, bitmiş tabletler neme karşı dayanıklı olmalıdır.
Bu çalışmanın içerik belirleme deneylerinde sadece bir indeks bileşenini araştırdığı belirtilmelidir; Bu, bu çalışma için dikkate değer bir sınırlamayı temsil etse de, çalışmamız daha sonraki derinlemesine araştırmalar için önemli bir temel oluşturmaktadır. Taohong Siwu'nun bir kaynatma işleminin hastalar için uygun, daha pratik ve daha uygulanabilir olan dağılabilir bir tablete dönüştürülmesi, geleneksel Çin tıbbı preparatlarındaki gelişen eğilimlerle de uyumludur.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu araştırma, Çin Ulusal Doğa Bilimleri Vakfı (Hibe No. 82074059), Xin'an Tıp Eğitim Bakanlığı Anahtar Laboratuvarı Açık Fonu, Anhui Geleneksel Çin Tıbbı Üniversitesi (No.2022XAYX07), Geleneksel Çin Tıbbı Bileşik Açık Fonu tarafından finanse edilen Anhui İl Anahtar Laboratuvarı (No.2019AKLCMF03), Anhui Eyaleti Akademik Lider Yedek Aday Finansman Projesi (No. 2022H287), ve Anhui İl Sağlık Araştırmaları Anahtar Projesi (AHWJ2022a013)
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetonitrile | OCEANPAK | A22T0218 | |
| Carboxymethyl starch sodium | Maclean | C12976293 | |
| Crosslinked Polyvinylpyrrolidone | Maclean | C12976293 | |
| Disintegration time limit tester | Tianjin Guoming Pharmaceutical Equipment Co., Ltd. | BJ-2 | |
| Electric heating constant temperature drying oven | Shanghai Sanfa Scientific Instrument Co., Ltd. | DHG-9202·2 | |
| Electric thermostatic water bath | Shanghai Sanfa Scientific Instrument Co., Ltd. | DK-S24 | |
| Electronic Balance | Sartorius Scientific Instruments (Beijing) Co., Ltd. | SQP | |
| Intelligent Dissolution Tester | Tianda Tianfa Technology Co., Ltd. | ZRS-8L | |
| Lactose | Maclean | C12942141 | |
| Low-Substituted Hydroxypropyl Cellulose | Anhui Shanhe Pharmaceutical Excipients Co., Ltd. | 190219 | |
| Magnesium stearate | Maclean | C12894996 | |
| Methyl Alcohol | TEDIA High Purity Solvents | 22075365 | |
| Microcrystalline cellulose | Maclean | 13028716 | |
| Single punch tablet machine | Nantong Shengkaia Machinery Co., Ltd. | TDP-2A | |
| Tablet hardness tester | Shanghai Huanghai Drug Testing Instrument Co., Ltd. | YPJ-200B | |
| Taohong Siwu Soup Extract | self made | ||
| Taoren, Honghua, etc. traditional Chinese medicine | The First Affiliated Hospital of Anhui University of Chinese Medicine | ||
| Waters Acquity H-Class Ultra High Liquid Chromatography |
Referanslar
- Wang, J. Y., et al. Effects of Erchen decoction and Taohong Siwu decoction on Nox4/NF-κB/HIF-1αsignaling pathway in aorta of ApoE~(-/-) atherosclerosis mice. China Journal of Traditional Chinese Medicine and Pharmacy. , (2019).
- Aslani, A., Ghasemi, A., Esfahani, S. K. Design, formulation and physicochemical evaluation of dimenhydrinate orally disintegrating tablets. Galen Medical Journal. 7, 936 (2018).
- Chen, K. X., Jiang, H. L., Luo, X. M., Shen, J. H. Drug discovery in post-genome era: Trend and practice. Chinese Journal of Natural Medicines. 2, 257-260 (2004).
- Wang, M., Liu, Z., Hu, S., Duan, X., Han, L. Taohong Siwu decoction ameliorates ischemic stroke injury via suppressing pyroptosis. Frontiers in Pharmacology. 11, 590453 (2020).
- Xin, R. H., Liang, G., Zheng, J. F. Design and content determination of Genhuang dispersible tablet herbal formulation. Pakistan Journal of Pharmaceutical Sciences. 30, 655-661 (2017).
- Yulin, D., Junxue, P., Rong, L., Jianlin, Y. Comparison of oral preparations of Chinese medicine dispersible tablets and traditional Chinese medicine. Chinese Journal of Ethnomedicine and Ethnopharmacy. 26 (8), 63-65 (2017).
- Yinghua, X., et al. Study on albendazole dispersible tablets based on solubilization effect. Journal of Hebei University of Science and Technology. 42 (6), 619-626 (2021).
- Mengzhu, Y., Kai, Y., Yi, H. Study on the prescription optimization and dissolution of Baicalin Dispersible Tablets. China Medical Herald. 10 (1), 122-123 (2013).
- Zhongan, X., et al. Introduction to the orthogonal experimental design method. Sci-Tech Information Development & Economy. (5), 1005 (2002).
- Liu Ruijiang, Z. Y., Chongwei, W., Jian, T. Study on the design and analysis methods of orthogonal experiment. Experimental Technology and Management. 27 (9), 4 (2010).
- Xianchun, D. Based on network pharmacology and transcriptomics to explore the main material basis and mechanism of ThaoHongSiWu Decoction in treating ischemic stroke. Anhui University of Chinese Medicine. , (2019).
- Pharmacopoeia Commission of the Ministry of Health of the People's Republic of China. . Pharmacopoeia of the People's Republic of China. , (2020).
- Jiaqiang, Y., et al. Research progress on preparation and application of microcrystalline cellulose. China Pulp & Paper Industry. 42 (10), 8-13 (2021).
- Nakamura, S., Tanaka, C., Yuasa, H., Sakamoto, T. Utility of microcrystalline cellulose for improving drug content uniformity in tablet manufacturing using direct powder compression. AAPS PharmSciTech. 20 (4), 151 (2019).
- Jinbao, L., et al. Effect of alkali pretreatment on preparation of microcrystalline cellulose. China Pulp & Paper. 39 (01), 26-32 (2020).
- Nsor-Atindana, J., et al. Functionality and nutritional aspects of microcrystalline cellulose in food. Carbohydrate Polymers. 172, 159-174 (2017).
- Wang, C., et al. Formulation and evaluation of nanocrystalline cellulose as a potential disintegrant. Carbohydrate Polymers. 130, 275-279 (2015).
- Huba, K., István, A. Drug excipients. Current Medicinal Chemistry. 13 (21), 2535-2563 (2006).
- Ping, Z., Jie, G. Talking about some problems of hardness and disintegration in traditional Chinese medicine tablets. Science and Wealth. 6 (181), 181 (2020).
- Pabari, R. M., McDermott, C., Barlow, J., Ramtoola, Z. Stability of an alternative extemporaneous captopril fast-dispersing tablet formulation versus an extemporaneous oral liquid formulation. Clinical Therapeutics. 34 (11), 2221-2229 (2012).
- Fini, A., Bergamante, V., Ceschel, G. C., Ronchi, C., de Moraes, C. A. F. Fast dispersible/slow releasing ibuprofen tablets. European Journal of Pharmaceutics and Biopharmaceutics. 69 (1), 335-341 (2008).
- Meidan, W. Study on compound Rhodiola relieving physical fatigue dispersible tablets. Jilin University. , (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır