Method Article
Быстрая визуализация сосудистой сети мелких животных с высоким разрешением для количественных исследований
В этой статье
Резюме
Этот протокол представляет собой быстрый метод количественной трехмерной визуализации сосудов с использованием флуоресцентной микроскопии световых листов. Эффективность метода продемонстрирована на примере системы артерий глоточной дуги модели куриного эмбриона, при этом гемодинамические силы количественно оцениваются с помощью вычислительной гидродинамики.
Аннотация
В моделях развития сердечно-сосудистой системы и заболеваний у мелких животных предметно-ориентированное компьютерное моделирование кровотока позволяет количественно оценить гемодинамические показатели, которые трудно измерить экспериментально. Вычислительное гидродинамическое моделирование проливает свет на важнейшую роль механики в развитии сердечно-сосудистой системы и прогрессировании заболеваний. Получение высококачественных объемных изображений интересующих сосудов имеет решающее значение для точности и воспроизводимости результатов морфологических измерений и количественного определения потока. В этом исследовании предлагается быстрый, экономически эффективный и доступный метод визуализации сосудистой сети мелких животных с высоким разрешением с использованием световой флуоресцентной микроскопии. Модифицированный протокол подготовки образцов iDISCO+ (трехмерная визуализация органов, очищенных растворителем) включает в себя (1) мечение сосудистой сети флуоресцентным агентом, (2) сохранение образца и (3) придание образцу прозрачности. В отличие от классического iDISCO+, в котором используется иммуногистохимическое окрашивание, авторы маркируют сосудистый эндотелий фил-L-лизином, меченным FITC, доступным неспецифическим флуоресцентным красителем, обладающим высокой устойчивостью к фотообесцвечиванию, в процессе, называемом «эндоокрашиванием». Быстрая маркировка сокращает время подготовки образцов примерно с четырех недель до менее чем 3 дней. Кроме того, использование минимально опасного растворителя этилциннамата (ECi) в качестве очищающего агента и решения для визуализации делает образцы более безопасными в обращении и совместимыми с более широким спектром средств визуализации. Предложенный протокол применяется для получения стеков изображений сердечно-сосудистой системы в период с 3-м (HH18) по 8-й день (HH34) в световой флуоресцентной микроскопии с высоким разрешением. Это исследование еще раз демонстрирует пригодность этого метода для количественного определения сосудов с помощью 3D-реконструкции и компьютерного гемодинамического моделирования эмбриона цыпленка на 5-й день (HH 26).
Введение
Объемная визуализация необходима для точных исследований физиологии и заболеваний сердечно-сосудистой системы. Количественная визуализация позволяет получать стеки изображений с высоким разрешением и неповрежденными объемными размерами. Образцы должны быть сохранены для сохранения их морфологии in vivo и объема люмена, а также визуализированы с равномерным высоким разрешением. С помощью стеков изображений с высоким разрешением пользователь может создавать трехмерные визуализации сосудов с высокой точностью, которые позволяют полностью отобразить формы, структуру и связность сосудов1.
Сердечно-сосудистые структуры обладают сложными трехмерными анатомическими особенностями, которые не могут быть точно зафиксированы при их рассмотрении через двухмерную, разрозненную линзу. Широкоугольная морфологическая визуализация и гистологические срезы стереоскопа недостаточны для фиксации сложных трехмерных вариаций 1,2,3. Изображения микро- и нанокомпьютерной томографии являются золотым стандартом для количественной объемнойвизуализации мелких животных, но не являются широко доступными или принятыми в биологическом сообществе. Последние инновации в области очищения тканей и микроскопии всего органа/мелких животных позволили количественно применять методы очистки всего массива и мечения сосудов 5,6,7. Очистка тканей работает над гомогенизацией рассеяния света в образцах тканей, тем самым уменьшая задержки в распространении света через среду за счет снижения вероятности рассеяния или поглощения света. Высокая прозрачность требует строгой обработки тканей, которая может повлиять на антигенность или яркость мечения флуоресцентного сигнала8. Световая листовая микроскопия стала быстрым и мощным инструментом визуализации, широко используемым биологами9 и обеспечивающим прирост скорости на несколько порядков по сравнению со сканирующими микроскопами и возможность получения изображений образцов размером более 1 см. С помощью световой флуоресцентной микроскопии (LSFM) лазер освещает поперечное сечение образца с большей скоростью и глубиной по сравнению с конфокальной микроскопией; По этой причине метод требует высокой прозрачности образца.
Здесь авторы адаптируют новейшие методы очистки iDISCO+, сочетая их с эндорисписью10 на животной модели куриного эмбриона, чтобы продемонстрировать эффективность метода от раннего до позднего сердечно-сосудистого развития. iDISCO (трехмерная визуализация органов, очищенных растворителем) — это метод очищения на основе органических растворителей, который, в отличие от методов, основанных на водном очищении, не подвержен артефактам визуализации, вызванным испарением растворителя. iDISCO отличается от iDISCO+ тем, что стадия дегидратации тетрагидрофурана (iDISCO) заменяется более мягкой дегидратацией метанола с последующей стадией экстракции липидов (iDISCO+). К преимуществам метода очистки iDISCO+ относятся иммуномаркировка крупных взрослых образцов и эмбрионов, низкая усадка тканей и высокая прозрачность 8,11. Важно отметить, что iDISCO+ позволяет создавать стеки изображений с высоким разрешением, расширяя традиционные методы иммуномаркировки в биологии для получения информации о больших образцах органов или всего эмбриона, а не ограничиваться выборкой небольших областей, в которых отсутствует информация об организации на уровне всей ткани, как в традиционной гистологии. К недостаткам iDISCO+ можно отнести тот факт, что генетически кодируемые флуоресцентные белки не сохраняются11. Метод эндопокраски тканей был впервые представлен в качестве высокопроизводительного скрининга сердечно-сосудистых пороков с использованием сердец эмбрионов цыплят HH31-HH36, которые были перфузированы 0,5 мг/мл FITC-поли-L-лизина в верхушке левого желудочка. Красителю давали скрепиться в течение 4 мин перед фиксацией и хранением10.
Настоящее исследование показало, что одна и та же концентрация FITC-поли-L-лизина может быть использована для более широкого круга эмбрионов (HH18 - HH34), но было обнаружено, что идеальное время фиксации варьируется (от 5-10 минут) для обеспечения ярко помеченных сосудов. Пользователи данной методики эндо-ДИСКО могут захотеть скорректировать концентрацию красителя (уменьшаясь на 0,1 мг/мл за один раз), если раствор окажется слишком вязким для маркировки всех желаемых сосудов, но рекомендуется сначала отрегулировать время фиксации и оптимизировать мышечное сокращение левого желудочка, прежде чем регулировать концентрацию красителя. Авторы попытались провести эндоокрашивание с концентрацией 0,1 мг/мл и обнаружили, что, хотя краситель легче распространяется по мелким сосудам, он легче смывается при перфузии PFA. Авторы показывают, что стеки изображений с высоким разрешением, созданные с помощью настоящего метода, имеют достаточное качество для компьютерного гемодинамического моделирования. Пути кровотока и соответствующие гемодинамические силы, включая распределение напряжений давления и сдвига стенки, протекают в сложных локализованных структурах, которые могут быть разрешены только с помощью вычислительного моделирования потока 1,12. Эти биомеханические силы влияют на поведение прилегающих сердечно-сосудистых тканей и запускают сосудистую адаптацию, рост и ремоделирование13. Понимание значений локальной гемодинамической силы проливает критический свет на механистические регуляторы сердечно-сосудистой функции и инициации или прогрессирования заболевания2.
протокол
Управление по защите лабораторных животных интерпретирует политику Службы общественного здравоохранения как применимую к модели цыпленка как к «позвоночному животному» только после вылупления. Эти эмбрионы также освобождены от юрисдикции Комитета по институциональному уходу за животными и их использованию (IACUC). С наиболее часто задаваемыми вопросами Национальных институтов здравоохранения можно ознакомиться по адресу: http://grants.nih.gov/grants/olaw/faqs.htm#ApplicabilityofthePHSPolicy.
1. Сбор, маркировка и фиксация эмбрионов
- Мод вытягивал стеклянные капиллярные стержни внутреннего диаметра 0,75 в срезанные микроиглы с помощью микрокузнечного станка 1,12.
ПРИМЕЧАНИЕ: Размер необходимого наконечника зависит от возраста животного / желаемой скорости потока. В качестве альтернативы микроиглу можно разрезать с помощью микродиссекционных щипцов или ножниц со значительно меньшей точностью. - Нагрейте раствор Tyrode примерно до 38°C.
- Растворите твердое вещество поли-L-лизина FITC в растворе Tyrode для получения исходного раствора в концентрации 0,5 мг/мл.
ПРИМЕЧАНИЕ: Эта концентрация оптимизирована для маркировки артерий куриных эмбрионов. Оптимальная концентрация для других типов тканей может варьироваться. Дополнительный исходный раствор следует хранить при температуре -20 °C. - Отделите эмбрион птицы (от HH18 (день 3) до HH34 (день 8) для настоящего исследования сердца цыпленка) от яичного желтка, разрезав эмбрион ножницами с изогнутым концом и с помощью пипетки или шпателя перенесите эмбрион в чашку Петри диаметром 35 мм, заполненную теплым раствором Тирода.
- Осторожно удалите хорионическую и аллантоисную мембраны, обволакивающие эмбрион и перикардовую мембрану вокруг сердца, с помощью щипцов с тонким наконечником, сделав крошечные (~0,1 мм) разрезы в мембранах и оттянув их от эмбриона.
- Перенесите эмбрион в новую, чистую чашку Петри, наполненную теплым раствором Тирода, чтобы сердце продолжало биться.
- Наполните пластиковый шприц объемом 5 мл теплым раствором Tyrode's. Обрежьте широкий конец пластикового наконечника для дозатора объемом 0-20 мкл и прикрепите его к плоскому кончику шприца. Теперь шприц удлинен до тонкого диаметра наконечника пипетки.
- Постройте «линию для инъекций», прикрепив сегмент силиконовой трубки внутреннего диаметра 0,03 дюйма к вновь закрепленному аппарату для шприца с наконечником пипетки (шаг 1,7). Прикрепите стеклянную капиллярную микроиглу к противоположному концу трубки.
- Установите микроиглу на держатель микроинъекций, прикрепленный к микроманипулятору. Очистите силиконовую трубку и микроиглу от пузырьков воздуха.
- С помощью микроманипулятора ввести иглу в верхушку сердца и перфузировать эмбрион 1,12 путем медленного введения раствора Тироде в сердце. Продолжайте перфузию эмбриона до тех пор, пока он в значительной степени не очистится от крови.
- С помощью микроманипулятора оттяните иглу и инъекционную линию назад от места введения и сориентируйте иглу так, чтобы она не была нарушена во время подготовки следующей инъекционной линии. Снимите силиконовую трубку с иглы и шприца.
ПРИМЕЧАНИЕ: Некоторые пользователи могут счесть оптимальным держать иглу прикрепленной к сердцу, и в этом случае пользователь должен удалить силиконовую трубку между иглой и шприцем, сохраняя при этом иглу на месте. - Выполните эндоокрашивание для маркировки эндотелия сосудов зеленым флуоресцентным цветом.
- С помощью микропипетки загрузите 20-40 мкл исходного раствора поли-L-лизина FITC в силиконовую трубку, стараясь не создавать пузырьков воздуха перед жидким барьером FITC.
- Снова прикрепите шприц, наполненный раствором Тирода, и с помощью микроманипулятора медленно введите иглу в верхушку сердца, при необходимости снова вставляя иглу. Извлеките иглу после того, как поли-L-лизин FITC будет диффузирован и до того, как пузырьки воздуха попадут в сердце.
- Оставьте поли-L-лизин FITC в организме эмбриона на 5-10 минут.
ПРИМЕЧАНИЕ: (дополнительная проверка качества) Чтобы проверить флуоресценцию, сделайте снимок с помощью флуоресцентного стерео или макроскопа. Изображение может быть использовано для определения фактора обезвоживания после завершения очистки эмбрионов.
- Наполните шприц объемом 5 мл 4% параформальдегида (PFA) и прикрепите его к силиконовой инъекционной трубке для третьего этапа инъекции.
- Перфузируйте эмбрион 1,12 с 4% PFA до тех пор, пока все сердечно-сосудистые структуры не будут полностью заполнены и ткань не начнет становиться более непрозрачной.
- Аккуратно загрузите эмбрион во флакон объемом 2-5 мл, наполненный достаточным количеством 4% PFA, чтобы покрыть образец. Следите за тем, чтобы не деформировать эмбрион чрезмерно.
ПРИМЕЧАНИЕ: Выберите достаточно большой флакон для интересующего образца, чтобы избежать раздавливания или деформации образца. - Инкубируйте эмбрион в течение ночи при температуре 4 °C с помощью шейкера.
2. Обезвоживание и выведение эмбрионов
- Осторожно издайте пипеткой 4% PFA.
ПРИМЕЧАНИЕ: С этого момента избегайте прямого контакта с эмбрионом, чтобы предотвратить повреждение или деформацию тканей. - Чтобы промыть эмбрион, инкубируйте эмбрион в свежем фосфатном буферном растворе (PBS) при комнатной температуре в течение 30 минут, осторожно встряхивая. Повторите еще два раза, всего 3 стирки.
- Начните обезвоживание эмбриона в вытяжном шкафу. Тщательно отпижите PBS и инкубируйте эмбрион в поэтапной серии из 5 инкубаций метанола при комнатной температуре в течение 1 ч каждая: 20%, 40%, 60%, 80% и 100% концентрации метанола.
- Оставьте эмбрион в свежем 100% метаноле при комнатной температуре на ночь.
ПРИМЕЧАНИЕ: (Необязательная точка остановки). Эмбрионы могут храниться при температуре -20 °C в 100% метаноле для последующего использования до 6 месяцев. - В вытяжном шкафу начните процедуру удаления липидов. Инкубировать эмбрион в соотношении 2:1 (объем к объему) DCM: раствор метанола при комнатной температуре в течение 3 ч, осторожно встряхивая.
ВНИМАНИЕ: DCM токсичен и должен обрабатываться в вытяжном шкафу. Примите дополнительные меры предосторожности при работе с DCM. Двойные перчатки могут помочь обеспечить дополнительный барьер. - Возьмите этилциннамат (ECi) при температуре 4 °C и оставьте его при комнатной температуре для оттаивания.
- Промойте эмбрионы в свежем 100% DCM при комнатной температуре в течение 15 минут, встряхивая. Повторите 100% стирку DCM, чтобы получить в общей сложности 2 стирки.
- Выведите пипетку из ДКМП и инкубируйте эмбрион в 100% ЭКи. Оставьте эмбрион в ЭКи до тех пор, пока он не исчезнет примерно через 1 ч. При необходимости осторожно встряхните тюбик.
- (Необязательный шаг проверки) Проверьте качество очистки и окрашивания сосудов с помощью флуоресцентного стерео или макроскопа. Сфотографируйте эмбрион, чтобы определить фактор масштабирования обезвоживания в зависимости от стадии/возраста.
- Храните очищенный эмбрион при температуре 4 °C до 6 месяцев до тех пор, пока он не будет готов к визуализации, сохраняя эмбрион защищенным от света.
3. Получение данных
- Для визуализации эмбрионов используйте флуоресцентный микроскоп со световым листом. Прикрепите головку оптически очищенного эмбриона к стеклянному капилляру с помощью суперклеевого геля.
- Установите стеклянный капилляр на держатель образца, заполните камеру визуализации ЭКи опустите эмбрион в камеру визуализации.
- Настройте параметры и выполните визуализацию.
4. Количественное применение: 3D-реконструкция и вычислительное гидродинамическое моделирование
ПРИМЕЧАНИЕ: На этих этапах стеки изображений высокого разрешения, сгенерированные световым листом, загружаются в программное обеспечение с открытым исходным кодом SimVascular14 для 3D-анатомической реконструкции и вычислительного гидродинамического моделирования. Подробные учебные пособия доступны на веб-сайте SimVascular (см. Таблицу материалов). Реконструкция состоит из создания линий траекторий в интересующих сосудах, создания 2D-сегментации вдоль линий траекторий и объединения лофтированных сегментов в 3D-твердотельную модель. Вычислительное моделирование состоит из подготовки геометрии сетки, определения граничных условий и выполнения моделирования.
- Создайте новый SVProject в разделе «Файл» и загрузите стек изображений с высоким разрешением, щелкнув правой кнопкой мыши по «Изображениям », а затем нажав на «Добавить/заменить изображение».
- Следуйте инструкциям в учебном пособии по программному обеспечению, чтобы реконструировать сосудистую анатомию in silico.
- Создайте контур, щелкнув правой кнопкой мыши по Контурам и выбрав Создать контур. Разместите указатели пути вдоль интересующего вас судна. Повторите для каждого интересующего вас сосуда.
- Для каждой созданной линии пути проведите трассировку поперечных сечений 2D-сосудов, щелкнув правой кнопкой мыши « Сегментации » и выбрав « Создать группу контуров». Выберите путь к судну и дважды щелкните по названию судна в разделе «Сегментация », чтобы начать ручную сегментацию.
- После того, как все суда будут сегментированы, создайте модель, щелкнув правой кнопкой мыши « Модели», а затем выбрав «Создать модель». Выберите тип PolyData , введите имя модели, нажмите кнопку «Создать твердотельную модель» и выберите все сегментации, которые должны быть частью модели.
- Настройте сетку геометрии, запустив мешер Tetgen, встроенный в SimVascular SVMesher. Определите максимальный размер кромки и выполните создание сетки как на поверхности, так и по объему.
ПРИМЕЧАНИЕ: Выберите размер сетки, который может разрешать мелкие геометрические детали и локализованные гемодинамические изменения в сосуде. Начните с кнопки Оценить глобальный размер сетки . Исследование сходимости сетки может потребоваться при завершении моделирования. - Настройте вычислительное моделирование кровотока с помощью решателя SimVascular Solver. Создайте файлы моделирования, щелкнув правой кнопкой мыши « Моделирование» и выбрав «Создать задание моделирования». Настройте основные параметры и выберите входные и выходные BC для конкретных граничных условий.
- Настройте параметры решателя, перейдите на вкладку Create Files and Run simulation, выберите файл сетки, нажмите Create Data Files for Simulation.
- Запустите симуляцию с помощью высокопроизводительной вычислительной рабочей станции или суперкомпьютера.
Результаты
Представленный здесь протокол быстрой визуализации с высоким разрешением (Рисунок 1, Таблица 1) позволяет получить четко очерченные просветы сосудов, как показано на Рисунках 2, Рисунках 3 и Рисунках 4, где эндотелий сосудистой сети куриного эмбриона является флуоресцентным GFP и, следовательно, обведен зеленым цветом на всех стадиях эмбриона от раннего до зрелого развития сердца (Рисунок 4). Важно найти правильную комбинацию концентрации поли-L-лизина, времени фиксации красителя и использования желудочковых сокращений (когда это применимо), если сосудистая сеть образца не выглядит четко помеченной (см. Рисунок 2 для того, как эмбрионы должны выглядеть под флуоресцентным стереоскопом или макроскопом перед визуализацией LSFM). Поддержание бьющегося сердца с помощью теплого раствора Tyrode и быстрое вскрытие эмбриона вдали от желточного мешка способствует диффузии раствора по всему образцу/модели мелкого животного. Вязкость поли-L-лизина можно контролировать с помощью концентрации исходного раствора. Менее вязкий раствор может способствовать флуоресцентной пенетрантности по всему образцу, хотя надежность мечения должна быть проверена после перфузии PFA. Пользователь может захотеть компенсировать более низкую концентрацию поли-L-лизинового исходного раствора за счет увеличения вводимого объема и увеличения времени инкубации перед фиксацией эмбриона с помощью PFA.
На рисунке 5 показана пригодность представленного метода для 3D-анатомической реконструкции и компьютерного моделирования. Значения напряжения сдвига стенки согласуются с предыдущими исследованиями авторов, основанными на реконструкциях нанокомпьютерной томографии1.

Рисунок 1: Установка для мечения и фиксации эмбрионов (вверху) и установка для сбора данных световой микроскопии (внизу). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Эмбрионы до и после процедур очищения. Репрезентативные светлые и освещенные каналы GFP эмбрионы для образцов, которые прошли этапы 1 (до очистки) и 2 (после очистки) протокола, как видно с помощью флуоресцентного макроскопа. Обратите внимание, как весь эмбрион светится в канале GFP перед очищением, особенно в сердце, для которого были удалены внешние мембраны. Вся желаемая сосудистая сеть четко обозначена в эмбрионе, очищенном от GFP. Масштабные линейки = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Трехмерное изображение системы сердечного оттока и соответствующих срезов через это изображение, полученное с помощью LSFM. PAA - артерия дуги глотки, OFT - выходной тракт, DoA - дорсальная аорта. Масштабные линейки = 0,5 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой фигуры.
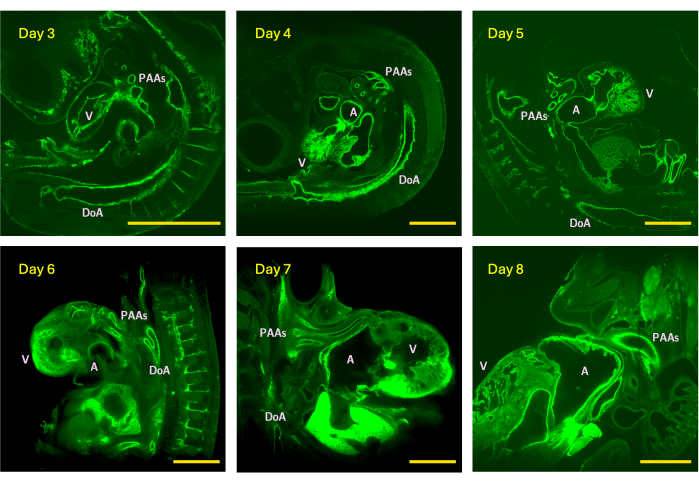
Рисунок 4: Примеры z-срезов из стеков изображений LSFM, полученных в день 3 (стадия HH18), 4 (HH24), 5 (HH26), 6 (HH29), 7 (HH31) и 8 (HH34) эмбрионов цыплят. Размер изображения представляет собой максимальное (без тайлинга) поле зрения прицела, оснащенного 5-кратным объективом обнаружения. V - желудочек; А - атриум; DoA - дорсальная аорта; ПАА – артерии дуги глотки. Масштабные линейки = 1 мм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
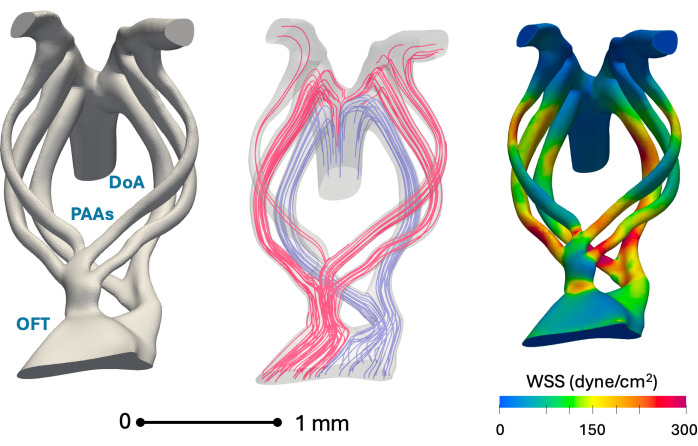
Рисунок 5: Репрезентативные in silico анатомические реконструкции дуги аорты на 5-й день (стадия HH26) и ключевые результаты гемодинамического моделирования. Слева: Реконструированная модель анатомии сосудов, показывающая выходной тракт (OFT), артерии дуги глотки (PAA) и дорсальную аорту (DoA). В центре: Линии кровотока на пике систолы, полученные с помощью моделирования кровотока. Красные линии тока в основном обслуживают черепные области, в то время как синие — каудальные. Справа: Распределение пикового напряжения сдвига систолической стенки (WSS) по стенке сосуда, полученное с помощью моделирования кровотока Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Дни недели | Стремянка | Время | Температура |
| День 1 | Забор эмбрионов | 5-10 мин/эмбрион | RT (настольный) |
| FITC Эндо-краска | 10-30 мин/эмбрион | RT (настольный) | |
| Фиксация перфузии PFA | Перфузия: 5-15 мин/эмбрион | Перфузия: RT (настольная) Инкубация: 4 °C | |
| Инкубация: Н/Н | |||
| День 2 | Мойка PBS | 90 мин | RT (настольный) |
| Обезвоживание | 5 ч + О/Н | RT (вытяжной шкаф) | |
| День 3 | Удаление липидов | 3,5 ч | RT (вытяжной шкаф) |
| Очистка | ≥1 ч | RT (настольный) |
Таблица 1: Обзор подготовки образцов для быстрой количественной визуализации световых листов.
Обсуждение
Способность изучать биологию в 3D имеет решающее значение для точного понимания морфологической сложности, структуры внутренних органов и сосудистых связей. Точные и надежные 3D-изображения сосудов также занимают центральное место в предметно-ориентированном вычислительном гемодинамическом моделировании, которое часто является единственным надежным средством количественной оценки ключевых параметров гемодинамики, таких как напряжение сдвига стенки и распределение давления. Здесь авторы представляют быстрый и доступный метод подготовки образцов для 3D-визуализации сосудов высокого разрешения у мелких животных с использованием LSFM. Этот метод надежно позволяет получить стеки изображений с высоким разрешением эмбрионов цыплят от HH18 (день 3) до HH34 (день 8), которые представляют собой критический период развития сердца. С HH24 (день 4) по HH34 (день 8) общий размер эмбриона увеличивается с ~30-550мм3, в среднем в 2 раза за 24-часовой период, при этом размер миокарда сердца увеличивается с ~1мм3 (день 4) до ~17мм3 (день 8)15. В связи с быстрым ростом эмбриона и сердечно-сосудистой системы, изображения для настоящего исследования были получены с разрешением в плоскости, которое варьировалось от 0,61 мкм в HH18 (день 3) до 2,28 мкм в HH34 (день 8) с диапазоном z-шага 1,92-2,4 мкм при фокусировке на артериальной системе дуги глотки и от 1,22 мкм (HH18) до 2,53 мкм (HH34) с диапазоном z-шага 1,94-3,5 мкм при захвате всего эмбриона (рис. 4). Полученные стеки изображений с высоким разрешением подходят для анатомической реконструкции сосудов in silico и гемодинамического моделирования, как показано на моделях HH26 (день 5), которые были визуализированы с разрешением в плоскости 1,30 мкм и размером z-шага 1,92мкм16. Как и в случае с другими методами цельного монтирования, предложенный метод может быть использован на животных моделях, особенно при выполнении визуализации всего органа 5,6,7. Методика iDISCO+ была применена к сердцам новорожденных и взрослых мышей5.
Основное преимущество предложенного метода заключается в использовании фил-L-лизина, меченного FITC, для флуоресцентного мечения и ЭКi для осветления. Поли-L-лизин положительно заряжен при физиологическом pH, поэтому он неспецифически связывается с эндотелием сосудов во время перфузии через образец. Этот процесс быстро и надежно прикрепляет FITC к стенкам сосудов, маркируя их яркой, стабильной флуоресценцией, обладающей высокой устойчивостью к фотоотбеливанию. Традиционно, объемная микроскопическая визуализация полного монтирования, включая LSFM, требует, чтобы образцы были помечены иммуногистохимическим окрашиванием. Эта процедура требует использования дорогостоящих антител и продлевает время подготовки образца до 4 недель 1,8,9. Ранние эмбрионы не экспрессируют традиционные сосудистые маркеры, такие как эластин или сосудистые гладкомышечные клетки, и, следовательно, их труднее нацелить на специфические антитела. Кроме того, очищенные образцы часто визуализируются во время погружения в раствор для очистки. Классическая процедура очистки iDISCO+ требует использования опасного соединения дибензилового эфира, которое часто не допускается в центрах визуализации8. ECi — это минимально опасное соединение, которое безопасно использовать вне лабораторных условий и с меньшей вероятностью повредит оптическое оборудование. При желании предложенный метод может быть комбинирован или мультиплексирован с иммуноокрашиванием при условии, что выбранные свойства спектрального излучения позволяют проводить эксперименты по совместной экспрессии. Мультиплексирование может увеличить время маркировки образцов и их подготовки.
Предлагаемый протокол имеет некоторые ограничения. Процедура применима только к принесенным в жертву эмбрионам и иссеченным тканям, исключая возможность лонгитюдных исследований. Эндоокрашивание поли-L-лизина FITC, хотя и быстрое и экономичное, требует высокого уровня ловкости и точности. Кроме того, поскольку краситель не проникает через ткань, он будет помечать только стенки сосудов, до которых он может добраться, что создает проблемы для изучения небольших капиллярных сетей. С такими проблемами можно справиться, поддерживая сердцебиение при введении поли-L-лизина и регулируя вязкость/концентрацию вводимого раствора. Неспецифичность красителя затрудняет различение типов сосудов1. Чрезмерное количество поли-L-лизина FITC, которое вытекает из сосудистой сети в процессе инъекции, также может связываться с несосудистыми тканями, такими как поверхностная кожа и мембрана, что может мешать освещению светового слоя во время визуализации и снижать качество визуализации. Пользователь должен проявлять бдительность при введении поли-L-лизина, чтобы избежать утечки. Текущий протокол широко валидирован с использованием эмбрионов цыплят на ранних стадиях для визуализации основных системных артерий. Концентрация, объем и время фиксации инъекции поли-L-лизина FITC могут нуждаться в дальнейшей оптимизации для различных случаев использования.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана премией Американской кардиологической ассоциации за развитие карьеры, премией Burroughs Wellcome Fund Career Award от Scientific Interface, Фондом исследования одного желудочка Additional Ventures и Центром микроскопии Медицинской школы UCSD (грант P30 NS047101). Авторы благодарят доктора Бобби Томпсона за его введение в эндоживопись, Центр микроскопии Медицинской школы Калифорнийского университета в Сан-Франциско и Роберта Портера (UCSD) за экспериментальную поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| #5 forceps | Fine Science Tools | 11252-30 | |
| #55-forceps | Fine Science Tools | 11295-51 | |
| 0.03 inch inner diameter silicone tubing | VWR | 32829-182 | |
| 20 μL pipette tips | VWR | 76322-134 | |
| 35 mm Petri dish | VWR | 10799-192 | |
| 5 mL plastic syringe | VWR | BD 309646 | |
| Dichloromethane (DCM) | Sigma-Aldrich | 270997 | Refer to MSDS. Stored in side cabinet under fume hood |
| Ethyl cinnamate (ECi) | Sigma-Aldrich | 112372 | Stored at 4 °C |
| Fine Curved scissors | Fine Science Tools | 14061-09 | |
| FITC-poly-L-lysine | Sigma-Aldrich | P3069 | Store at -20 °C (powder, stock solution), 4ºC (working solution) |
| Fluoresent microscope | EVIDENT SCIENTIFIC | MVX10 | |
| Glass capillary tubes (0.75 mm ID) | Sutter Instrument | FG-GB100-75-10 | |
| Lightsheet microscope | Zeiss | Z.1 system | |
| Methanol | Sigma-Aldrich | M1775 | Refer to MSDS. Stored in flammable cabinet under fume hood |
| Microforge | Narishige International USA, Inc. | MF2 | |
| Micromanipulator | World Percision Instrrument | M3301R | |
| Paraformaldehyde (PFA) 4% | Thermo Scientific | J19943.K2 | Refer to MSDS. Stored at -20 °C (powder), 4 °C (4% working solution) |
| Phosphate buffered saline (PBS) | Cytiva | SH30256.01 | Stored on benchtop |
| SimVascular | open source software www.simvascular.org | ||
| Tyrode’s Solution | Made in-house |
Ссылки
- Lindsey, S. E., Butcher, J. T., Vignon-Clementel, I. E. Cohort-based multiscale analysis of hemodynamic-driven growth and remodeling of the embryonic pharyngeal arch arteries. Development. 145 (20), dev162578(2018).
- Lindsey, S. E., Vignon-Clementel, I. E., Butcher, J. T. Assessing early cardiac outflow tract adaptive responses through combined experimental-computational manipulations. Ann Biomed Eng. 49 (12), 3227-3242 (2021).
- Salman, H. E., et al. Effect of left atrial ligation-driven altered inflow hemodynamics on embryonic heart development: Clues for prenatal progression of hypoplastic left heart syndrome. Biomech Model Mechanobiol. 20 (2), 733-750 (2021).
- Henning, A. L., Jiang, M. X., Yalcin, H. C., Butcher, J. T. Quantitative three-dimensional imaging of live avian embryonic morphogenesis via micro-computed tomography. Dev Dyn. 240 (8), 1949-1957 (2011).
- Anbazhakan, S., et al. Blood flow modeling reveals improved collateral artery performance during the regenerative period in mammalian hearts. Nat Cardiovasc Res. 1 (8), 775-790 (2022).
- Pan, C., et al. Shrinkage-mediated imaging of entire organs and organisms using uDISCO. Nat Methods. 13 (10), 859-867 (2016).
- Renier, N., et al. iDISCO: a simple, rapid method to immunolabel large tissue samples for volume imaging. Cell. 159 (4), 896-910 (2016).
- Vieites-Prado, A., Renier, N. Tissue clearing and 3D imaging in developmental biology. Development. 148 (18), dev199369(2021).
- Rios Coronado, P. E., Red-Horse, K. Enhancing cardiovascular research with whole-organ imaging. Curr Opin Hematol. 28 (3), 214-220 (2021).
- Miller, C. E., et al. Confocal imaging of the embryonic heart: How deep. Microsc Microanal. 11 (3), 216-223 (2005).
- Renier, N., et al. Mapping of brain activity by automated volume analysis of immediate early genes. Cell. 165 (7), 1789-1802 (2016).
- Lindsey, S. E., et al. Growth and hemodynamics after early embryonic aortic arch occlusion. Biomech Model Mechanobiol. 14 (4), 735-751 (2015).
- Humphrey, J. D. Constrained mixture models of soft tissue growth and remodeling-twenty years after. J Elast. 145 (1), 49-75 (2021).
- Updegrove, A., et al. SimVascular: An open-source pipeline for cardiovascular simulation. Ann Biomed Eng. 45 (3), 525-541 (2017).
- Kim, J. S., Min, J., Recknagel, A. K., Riccio, M., Butcher, J. T. Quantitative three-dimensional analysis of embryonic chick morphogenesis via microcomputed tomography. Anat Rec. 294 (1), 1-10 (2011).
- Zhang, D., Lindsey, S. Evaluation of high-resolution image accuracy for small animal vascular flow quantitation. Bull Am Phys Soc. , https://meetings.aps.org/Meeting/DFD24/Session/X03.8 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены