Method Article
Количественная оценка агрегации нерастворимых белков у Caenorhabditis elegans во время старения с помощью нового независимого от данных рабочего процесса сбора данных
В этой статье
Резюме
Этот новый рабочий процесс эффективно извлекает и изолирует нерастворимые в SDS белки (insolublome) из Caenorhabditis elegans с минимальным исходным материалом для количественного дифференциального протеомного анализа. Протокол использует комплексный независимый от данных масс-спектрометрический анализ для количественной оценки нерастворимости и биоинформатический анализ для получения биологического представления о механизмах старения и патологиях.
Аннотация
Мы и другие показали, что процесс старения приводит к накоплению нерастворимых белков по всему протеому. Сбивание генов, кодирующих нерастворимые белки в течение 40% времени, приводит к увеличению продолжительности жизни у C. elegans, что позволяет предположить, что многие из этих белков являются ключевыми детерминантами процесса старения. Выделение и количественная идентификация этих нерастворимых белков имеют решающее значение для понимания ключевых биологических процессов, происходящих во время старения. В этой статье мы представляем модифицированный и улучшенный протокол, в котором подробно описано, как более эффективно извлекать и выделять нерастворимые в SDS белки (нерастворимые) из C. elegans для оптимизации масс-спектрометрических рабочих процессов с помощью нового количественного протеомного анализа без меток. В этом усовершенствованном протоколе используется высокоэффективный ультразвуковой аппарат для лизиса червей, который значительно повышает эффективность экстракции белка и позволяет нам использовать значительно меньше исходного материала (примерно 3000 червей), чем в предыдущих протоколах (обычно используя не менее 40 000 червей). Последующий количественный протеомный анализ инзолома был выполнен с использованием данных-зависимого сбора данных (DDA) для обнаружения и идентификации белка и независимого от данных сбора (DIA) для всестороннего и более точного количественного определения белка. Биоинформатический анализ количественно определенных белков позволяет получить потенциальных кандидатов, которые могут быть легко прослежены с помощью других молекулярных методов у C. elegans. С помощью этого рабочего процесса мы регулярно идентифицируем более 1000 белков и количественно оцениваем более 500 белков. Этот новый протокол обеспечивает эффективный скрининг соединений с помощью C. elegans. В данной работе мы проверили и применили этот усовершенствованный протокол к дикому типу штамма N2-Bristol C. elegans и подтвердили, что у старых червей N2 10-го дня наблюдалось большее накопление insolblome, чем у молодых червей на 2-й день.
Введение
Белковый гомеостаз прогрессивно снижается с возрастом и приводит к увеличению агрегации белка 1,2,3. Агрегация белков связана с несколькими нейродегенеративными заболеваниями, включая болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона и боковой амиотрофический склероз4. Старение считается основным фактором риска возникновения нейродегенеративных заболеваний, связанных с агрегацией белков. Белки, склонные к образованию нерастворимых агрегатов, часто связаны с клеточной токсичностью и дисфункцией тканей, что может еще больше ускорить агрегацию других белков 5,6,7. В качестве альтернативы, нерастворимые белковые агрегаты могут активировать клеточные защитные механизмы для удаления токсичных олигомерных форм белка из системы. Сбивание выбранных генов, кодирующих нерастворимые белки, модулирует продолжительность жизни Caenorhabditis elegans (C. elegans) в контексте как возрастных заболеваний, так и нормального старения 5,8,9. Таким образом, изучение клеточных и молекулярных механизмов агрегации белков имеет решающее значение для понимания старения и в конечном итоге может привести к подходам к лечению нейродегенеративных заболеваний.
Нематода C. elegans стала одним из наиболее широко используемых модельных организмов для изучения агрегации белков при старении и возрастных заболеваниях благодаря своим уникальным характеристикам, таким как относительно короткая продолжительность жизни (около 2 недель), простота культивирования и генетических манипуляций.
Способность извлекать и характеризовать нерастворимые белки сыграла решающую роль в определении возрастных изменений, связанных с агрегацией белков в моделях C. elegans. Чтобы исследовать вклад агрегации белков в нормальные процессы старения, мы5 и другие2 ранее экстрагировали и протеолитически экстрагировали нерастворимый материал молодых и старых C. elegans, химически маркированный с помощью реагентов iTRAQ («изобарическое мечение для относительной и абсолютной количественной оценки»), а затем количественно определенный с помощью методов на основе МС. Используя метод изобарического мечения и 120 мг влажных червей (около 40 000 червей), мы смогли получить значительную глубину и охват нерастворимого белка5. Количественный анализ показал, что 203 из 1200 идентифицированных белков были значительно обогащены в нерастворимом у старых C. elegans по сравнению с аналогичными фракциями нерастворимых белков у молодых червей. Независимо друг от друга, Дэвид и др. также использовали рабочий процесс iTRAQ LC-MS/MS для изучения изменений в белковых агрегатах при нормальномстарении2. Начав примерно с 300 мг червей, они идентифицировали ~1000 нерастворимых белков с помощью двух биологических репликатов и определили, что ~700 из примерно 1000 белков накапливаются в 1,5 раза или более с возрастом по сравнению смолодыми червями. В целом, эти независимые результаты указывают на то, что широко распространенная нерастворимость и агрегация белков являются неотъемлемой частью нормального старения и могут влиять как на продолжительность жизни, так и на частоту нейродегенеративныхзаболеваний.
Изучение нерастворимости позволило нам определить, как воздействие окружающей среды может ускорить или замедлить процесс старения. Klang et al. создали безметочные протеомные рабочие процессы у C. elegans для изучения роли металлостаза в долголетии10. В этом исследовании для извлечения insoblome10 использовалось не менее 40 000 червей. Данные показали, что уровни железа, меди, кальция и марганца увеличиваются с возрастом и что кормление червей диетой с повышенным содержанием железа значительно ускоряет возрастное накопление нерастворимыхбелков. Используя тот же рабочий процесс для изучения влияния витамина D на нерастворимость C. elegans, было количественно определено 38 белков у молодых червей (день 2) и 721 белок у старых червей (день 8). Кормление витамином D значительно снизило нерастворимость старых червей с 721 до 371 белка11. Дальнейшие исследования показали, что кормление витамином D подавляет нерастворимость белка с возрастом, способствует гомеостазу белка и увеличивает продолжительность жизни червей дикого типа C.elegans N211. Таким образом, изучение нерастворимого может помочь выявить новые модуляторы старения и возрастных заболеваний.
В то время как изучение нерастворимого материала было неоценимым для понимания процесса старения, оно было затруднено необходимостью сбора большого количества исходного материала образца. Groh et al. недавно представили безмаркерный процесс протеомного количественного определения для изучения внутренних изменений агрегации белков у C. elegans с возрастом; Однако для этого требовалось большое количество исходного материала (350 мг молотых червей)12. В настоящем отчете мы разработали новый улучшенный протокол экстракции и изоляции (рис. 1). Использование высокоэффективного ультразвукового аппарата во время лизиса червей значительно повысило эффективность экстракции и, как следствие, снизило количество необходимого исходного материала с 40 000 до 3 000 червей. Сочетание этого нового протокола нерастворимого выделения с масс-спектрометрическим рабочим процессом без меток и независимым от данных сбором данных (DIA) значительно улучшило глубину и охват белка. Представленный здесь протокол является экономически эффективным и легко модифицируется для выполнения нерастворимого анализа в других модельных системах.
протокол
ПРИМЕЧАНИЕ: Для лучшего понимания экспериментальной процедуры см. схему рабочего процесса на рисунке 1 .
1. Массовая культура синхронизированного старения C. elegans
- Подготовка тарелок
- Налейте 30 мл NGM агара с 50 мМ фтордезоксиуридином (FUdR) или без него в каждую пластину диаметром 90 мм и дайте пластинам высохнуть в течение 2 дней в культуральных колпаках.
- За день до посева агаровой пластины NGM инокулируйте 50 мкл аликвоты замороженного глицерина бактериального штамма OP50 в 1 л предварительно автоклавированной среды LB в колбе объемом 2 л.
- Выращивайте бактерии при температуре 37 °C в встряхивающем инкубаторе при 250 об/мин в течение 16 часов.
- Через 16 часов центрифугируйте бактериальные культуры со скоростью 5000 x g в течение 10 минут.
- Выбросьте надосадочную жидкость и полностью повторно суспендируйте бактериальную гранулу в 40 мл автоклавированного S-базального раствора (содержащего 50 мМ K3PO4, 100 мМ NaCl в воде) для получения 25-кратной концентрированной культуры OP50 E. coli .
- Нанесите 2 мл 25-кратной концентрированной бактериальной культуры на каждую чашку с агаром NGM и равномерно распределите так, чтобы бактериальная культура покрыла всю поверхность агара.
- Снимите крышки с пластин в колпаке для бактериальной культуры на 2–3 ч, пока пластины не высохнут должным образом.
ПРИМЕЧАНИЕ: Убедитесь, что бактерии равномерно распределены, переворачивая пластины каждые 15 минут. Это важно, поскольку бактерии имеют тенденцию концентрироваться на одной стороне пластины, что приводит к образованию областей с низкой бактериальной плотностью. - После того, как тарелки высохнут, закройте крышки и оставьте тарелки при комнатной температуре на 48 часов, чтобы обеспечить полное высыхание пищевого источника OP50 E. coli.
ПРИМЕЧАНИЕ: Тарелки можно подготовить за 2 недели и хранить при температуре 4 °C перед использованием.
- Ведение и подготовка синхронизированных когорт C. elegans
- Для получения требуемого ввода лизата белка (1,0–1,5 мг) для выделения нерастворимой в SDS фракции используют примерно 3000 синхронизированных червей на образец.
- Перенесите ~100 взрослых червей дикого типа N2 в тарелку NGM 25x OP50 E. coli, засеянную кишечной палочкой, и поддерживайте червей при температуре 20 °C в течение ~72 часов, пока пластина не заполнится взрослыми червями.
- Нанесите пипеткой ~10 мл S-базального раствора на каждую пластину и соберите всех червей в пробирку объемом 15 мл.
ПРИМЕЧАНИЕ: Важно использовать наконечники с низким удержанием или пипетки Пастера во время этого и всех последующих этапов, связанных со сбором червей, чтобы предотвратить потерю червей из-за прикрепления к поверхностям наконечников. - Вращайте образец при давлении 520 x g в течение 30 с. Удалите надосадочную жидкость после отжима. Чтобы удалить любую кишечную палочку OP50, добавьте 10 мл S-базального раствора в гранулу и снова отжмите с последующим удалением надосадочной жидкости. Повторите этот шаг.
- Добавьте 10 мл раствора отбеливателя гипохлорита натрия (содержащего 0,5 М KOH и 0,48% гипохлорита натрия в воде) в гранулу червя в конической пробирке объемом 15 мл и энергично перемешайте в течение 2 мин при комнатной температуре.
- Центрифугируйте при давлении 520 x g в течение 30 с при комнатной температуре, чтобы раскрутить все неполностью растворившиеся тела червей и яйца. Затем удалите надосадочную жидкость.
- Повторите шаги 1.2.5 и 1.2.6, чтобы обеспечить полное удаление всех тел червей и выход яиц (для этого просмотрите пробирку под микроскопом).
- Промойте яичную гранулу не менее 4 раз 10 мл S-базального раствора, чтобы обеспечить полное удаление раствора отбеливателя.
ПРИМЕЧАНИЕ: Важно полностью удалить отбеливатель, так как оставшийся отбеливатель может помешать вылуплению яиц. - Оставьте яйца суспендированными в 5 мл S-базальной среды в пробирке объемом 15 мл и поместите в ротор при температуре 20 °C на 24 часа, чтобы яйца вылупились.
- Через 24 ч возьмите 10 мкл раствора S-базальных личинок, чтобы подсчитать количество червей в нем. Используйте не менее трех отдельных аликвот по 10 мкл раствора S-базальных личинок для репликации количества червей. Рассчитайте среднее значение трех концентраций личинок. Исходя из средней концентрации, разбавьте раствор червя до получения ~3 000 личинок на 200 мкл раствора.
ПРИМЕЧАНИЕ: Обязательно осторожно встряхивайте трубку, переворачивая, так как личинки имеют тенденцию оседать, если их не беспокоить, и это может повлиять на количество личинок. - Хорошо перемешайте и добавьте 200 мкл раствора S-базальных личинок на каждую из 90-мм пластин NGM, засеянных бактериями.
ПРИМЕЧАНИЕ: Добавьте капли раствора S-базальных личинок по всей пластине для равномерного распределения личинок, чтобы избежать истощения бактерий из определенных мест. - Дайте раствору S-базала высохнуть, а затем поместите перевернутые планшеты в инкубатор при температуре 20 °C на 48 часов.
- Через 48 ч соберите червей из планшета в S-базальном растворе и перенесите их в свежую тарелку, засеянную NGM, содержащую 50 мМ FUDR, и инкубируйте планшеты при 20 °C.
ПРИМЕЧАНИЕ: Важно пересаживать червей на ранней стадии L4, чтобы обеспечить эффективность FUDR. - Соберите образцы для молодых людей на 2-й день через 48 ч, добавив 10 мл S-базального раствора на планшет и перенеся раствор в пробирку объемом 15 мл. Дайте червям поселиться под действием силы тяжести и удалите S-базальный раствор после того, как он станет прозрачным.
- Промойте гранулу от червя 2-3 раза в 5 мл S-базального раствора, чтобы удалить все прикрепленные бактерии. Удалите как можно больше S-базального раствора и заморозьте гранулы червя (в пробирках объемом 15 мл) в ванне с сухим льдом и этанолом. Замороженные образцы хранятся при температуре -80 °C.
- Переносите образцы червей в свежую пластину NGM OP50 E. coli, содержащую FUDR, каждый день через день до 10-го дня. Соберите и заморозьте червей, как описано в шагах 1.2.14 и 1.2.15.
ПРИМЕЧАНИЕ: Начните с большего количества червей для образцов на 10-й день, чтобы учесть любую потерю количества червей из-за переноса и рытья нор.
2. Экстракция нерастворимой фракции SDS из червей
- Разморозьте замороженную гранулу червя на льду в присутствии 900 мкл буферного коктейля ледяного холодного червя, содержащего 20 мМ трис-основание, pH 7,4, 100 мМ NaCl, 1 мМ MgCl2 и ингибитор протеазы, не содержащий ЭДТА. Кратковременно вихревые образцы обеспечивают полную ресуспендию гранул червя в буфере для лизиса.
- Поместите пробирки объемом 15 мл в ванну с ультразвуком и установите на 10 циклов ультразвука (30 с включено и 30 с выключено для каждого цикла) с высокой интенсивностью. Повторяйте до пяти циклов (убедитесь, что черви полностью лизированы).
- Вращайте лизат при давлении 3 000 x g в течение 4 минут в холодильной камере. После центрифугирования выбросьте гранулы, содержащие любые остатки червей, и осторожно перенесите надосадочную жидкость в свежие предварительно охлажденные центрифуги объемом 1,5 мл на льду.
- Количественно оцените концентрацию белка с помощью анализа BCA. Переложите аликвоты лизата, обычно содержащие около 1 мг белка, в свежие предварительно охлажденные центрифужные пробирки объемом 1,5 мл.
- Центрифугируйте лизат белка в течение 15 минут при концентрации 20 000 x g в холодильной камере.
- Не повреждая гранулу, переложите надосадочную жидкость в свежую центрифужную пробирку объемом 1,5 мл и сохраните его в виде водно-растворимой белковой фракции.
- Промойте гранулу с предыдущего этапа в 500 μл буфера для лизиса червя, содержащего 1% SDS, при комнатной температуре и центрифугируйте при 20 000 x g в течение 15 минут при комнатной температуре. Удалите надосадочную жидкость и сохраните как растворимую в SDS фракцию. Повторите этот шаг промывки два раза, чтобы удалить любую растворимую в SDS фракцию. Оставшаяся гранула после третьего раунда стирки определяется как 1% нерастворимая в SDS белковая фракция.
- Ресуспендируйте нерастворимую в SDS белковую гранулу в 60 μл 70% муравьиной кислоты и энергично переборщите для растворения белков. Повторяйте энергичный вортекс столько раз, сколько необходимо, чтобы растворить гранулу.
- Обработать гранулу ультразвуком в течение 30 минут на ультразвуковой водяной бане при комнатной температуре.
ПРИМЕЧАНИЕ: Нерастворимые гранулы SDS обычно трудно растворяются в буфере. Однако в конечном итоге вся гранула должна быть растворена на этом этапе. - Высушите образцы в вакуумном концентраторе в течение 1 ч для полного удаления раствора муравьиной кислоты.
- Добавьте 40 мкл 1x гелевого буфера LDS в высушенную гранулу и нагрейте образец до 95 °C в течение 10 минут. Кратковременно закрутите образцы и раскрутите их вниз. Загрузите 13 μL на 4-12% гель NUPAGE Bis-Tris и запустите гель. Окрасьте гель флуоресцентным белковым красителем для визуализации. Сохраните оставшуюся часть образца для масс-спектрометрического анализа (МС).
- Загрузите оставшийся образец в 4-12% гель Bis-Tris и подождите около 20 минут для разложения MS в геле.
3. Расщепление в геле с трипсиновой протеазой для выделения белков для анализа на РС
- Приготовьте следующие растворы (свежие): 25 мМ NH4HCO3 (pH 7–8), 25 мМ NH4HCO3 в 50% ацетонитриле (ACN, pH 7–8) и 50% ACN в 5% муравьиной кислоте.
- Нарежьте каждый гелевый ломтик небольшими кусочками (обычно <1 мм2) и поместите их в силиконизированные пробирки объемом 0,65 мл.
- Добавьте около 100 мкл (или достаточно, чтобы покрыть) 25 мМ раствор NH4HCO3/50% ACN и взбейте при комнатной температуре в течение 10 минут. Извлеките надосадочную жидкость и переложите в отдельную пробирку (для утилизации). Повторите этот шаг еще два раза.
- Полностью высушите кусочки геля в вакуумном концентраторе (~20 минут).
- Приготовьте свежие растворы и добавьте ~100 мкл (или достаточно, чтобы покрыть) 10 мМ DTT в 25 мМ NH4HCO3 к высушенным кусочкам геля (используйте свежеприготовленный NH4HCO3). Закрутите вихрь и кратковременно раскрутите. Дайте реакции протекать при температуре 56 °C в течение 1 ч и встряхивая при 1400 об/мин на смесителе.
- Удалите надосадочную жидкость и добавьте 100 мкл 55 мМ йодоацетамида (IAA) в 25 мМ NH4HCO3 к кусочкам геля. Закрутите вихрь и кратковременно раскрутите. Дайте реакции протекать в темноте в течение 45 минут на RT.
- Удалите надосадочную жидкость и выбросьте. Промойте кусочки геля, добавив ~100 μL 25mM NH4HCO3 и взбейте в течение 10 минут. Коротко закрутите и удалите надосадочную жидкость, отбросив последнюю.
- Обезвожьте кусочки геля, добавив ~100 мкл (или достаточно, чтобы покрыть) 25 мМ NH4HCO3 в 50% ACN к кусочкам геля и перемешайте в течение 10 минут. Затем коротко вращайте, чтобы удалить и отбросить надосадочную жидкость. Повторите этот шаг дважды или даже в третий раз, если кусочки геля не совсем сухие, о чем свидетельствует меньший размер кусочков геля и мутно-белый цвет.
- Полностью высушите кусочки геля в вакуумном концентраторе (~20 минут).
- Первоначально добавьте 15 мкл раствора трипсина (250 нг трипсина) в каждый образец, а затем добавьте 25 мМ NH4HCO3 , чтобы покрыть кусочки геля (~100 мкл). Вортекс в течение 10 мин. Затем кратковременно отжмите и выдержите при температуре 4 °C в холодильной камере в течение 30 минут без перемешивания.
- Добавьте 25 mM NH4HCO3 по мере необходимости, чтобы полностью покрыть кусочки геля. Отжим и инкубируй при 37 °C в течение ночи в течение 16–20 ч при 1400 об/мин на миксере.
- На следующий день ненадолго закрутите и раскрутите пищеварительную систему. Добавьте около 100 μл воды для ВЭЖХ, отжмите, парапленьте трубку и непрерывно обрабатывайте ультразвуком в течение 10 минут. Коротко отжимайте после ультразвуковой обработки.
- Перелейте раствор для сбраживания, представляющий собой водную экстракцию, в чистую силиконизированную пробирку объемом 0,65 мл.
- Добавьте ~100 μL 50% ACN/5% муравьиной кислоты к кусочкам геля (достаточно, чтобы покрыть их), сделайте вихрь 10 минут при комнатной температуре, коротко отжмите и соберите раствор, и повторите один раз. Объедините все растворы, содержащие экстрагированные пептиды, полученные на этом этапе и на предыдущем шаге 3.13, в одну пробирку.
- Вихревыми усилиями подвергаются экстрагированные пищеварения. Полностью высушите пептиды в вакуумном концентраторе (~2 ч).
- Добавьте 30 мкл 0,2% муравьиной кислоты для ресуспендирования пептидов на смесителе в холодном помещении на 10 минут.
- Отжим образцы при температуре 1850 x g при комнатной температуре в течение 5 минут. Отсадите пептидный раствор и переместите его в новую чистую силиконизированную пробирку объемом 0,65 мл. Затем обессолите раствор пептидов с помощью наконечников для обессоливания C18 (см. ниже).
4. Обессоливание переваренных пептидов с помощью обессоливающего наконечника C18
- Установите дозатор на 10 μл и прикрепите наконечник для обессоливания C18. Намочите обессоливающий наконечник, набрав пипетированием 10 μL 100% ACN и затем выбросив его. Повторите этот шаг 2 раза.
- Промойте обессоливающий наконечник C18, набрав пипетирование 10 μL 50% ACN, 49,8% воды и 0,2% FA, а затем выбросьте его. Повторите этот шаг 2 раза.
- Уравновесьте обессоливающий наконечник C18, погрузив в воду 10 μл 0,2% FA и затем выбросив его. Повторите этот шаг 2 раза.
- Установите дозатор на 10 мкл и загрузите пептиды из раствора в смолу, дозируя переваренные пептиды через смолу вверх и вниз в 15 раз.
ПРИМЕЧАНИЕ: Повторное действие обеспечит связывание всех пептидов со смолой обессоливающих наконечников. - Обессолите переваренные пептиды, связанные со смолой, путем дозирования 10 мкл 0,2% FA в воде и последующего выброса. Повторите этот шаг 4 раза, чтобы завершить этап обессоления.
- В новой пробирке элюируйте пептиды 10 мкл 50% ACN, 49,8% воды и 0,2% FA путем пипетирования вверх и вниз 10 раз. Повторите этот шаг один раз, чтобы случиться во второй раз в той же пробирке.
- Полностью высушите обессоленные пептиды в вакуумном концентраторе (~20 мин).
- Ресуспендируйте пептиды в 15 мкл 0,2% FA + 1 мкл пептидов iRT (индексированное время удержания). Вокстекс в течение 10 минут, центрифугирование при 12 000 x g в течение 2 минут, а затем пересадка во флакон автосамплера для анализа МС (см. ниже).
5. Масс-спектрометрический анализ расщепленных пептидов с использованием DDA и DIA
ПРИМЕЧАНИЕ: Образцы могут быть проанализированы с использованием методов DDA или DIA LC-MS/MS. В данном исследовании образцы были проанализированы с использованием системы nano-LC 2D HPLC, подключенной к масс-спектрометру высокого разрешения.
- Используйте систему ВЭЖХ в сочетании с системой ВЭЖХ на основе чипа, напрямую подключенной к квадрупольному времяпролетному масс-спектрометру (также можно использовать другие конфигурации и системы LC-MS).
- Анализируйте образцы с помощью обратнофазных ВЭЖХ-ЭСИ-МС/МС.
- Постройте протокол хроматографии для загрузки образца пептидов на предколоночный чип C18. Промыть и обессолить загруженные пептиды загрузочным растворителем (0,1% муравьиной кислоты) в течение 10 мин со скоростью потока 2 мкл/мин.
- Перенести пептиды в аналитическую колонку С18 чип и элюировать со скоростью потока 300 нл/мин с 3-часовым градиентом с использованием подвижной фазы А (2% ацетонитрила, 0,1% муравьиной кислоты) и В (98% ацетонитрила, 0,1% муравьиной кислоты). Первая стадия элюирования состоит из линейного градиента от 5% B до 35% B в течение периода 80 мин.
- Увеличьте подвижную фазу B до 80% в течение 5 минут, а затем поддерживайте подвижную фазу B на уровне 80% в течение 8 минут, прежде чем перейти на 5% B для восстановления баланса колонны в течение 25 минут.
- Настройте метод инструмента MS для DDA и определите параметры инструмента следующим образом.
- Для сканирования ионов прекурсора в эксперименте 1:MS1 с м/з 400–1500 (время накопления 250 мс) используйте следующие параметры; установить порог интенсивности для запуска МС/МС сканирования для ионов заряженных состояний от 2–5 до 200 отсчетов; установите динамическое исключение ионов-предшественников равным 60 с).
- Для эксперимента 2 используйте следующие параметры: сканирование ионов продукта MS/MS со сканированием MS2 находится в диапазоне m/z 100–1500 (время накопления 100 мс на каждое из 30 сканирований ионов продукта за цикл); установите разброс энергии столкновения на CES=5 и отметьте галочкой 'Режим ионного сканирования высокочувствительного продукта'.
ПРИМЕЧАНИЕ: Метод сбора данных DDA используется для создания спектральных библиотек, как описано в шаге 6.3 (см. ниже). Здесь он будет получать спектры MS/MS для 30 наиболее распространенных ионов-предшественников после каждого сканирования MS1 за цикл; Общее время цикла составляет около 3,3 с.
- Получите DIA. Настройте метод инструмента MS для DIA и определите инструментальные параметры следующим образом.
- Для эксперимента 1 используйте следующие параметры: сканирование ионов прекурсора MS1 с м/з 400-1250 (время накопления 250 мс).
- Используйте следующие параметры для эксперимента 2: сканирование ионов продукта MS/MS для 64 переменных сегментов полосы обзора с диапазоном сканирования MS2 от 100 до 1500 м/з (время накопления 45 мс на каждое из 64 сканирований ионов продукта за цикл); установите разброс энергии столкновения на CES=10, отметьте галочкой 'режим ионного сканирования высокочувствительного продукта'.
ПРИМЕЧАНИЕ: Используйте метод сбора данных DIA/SWATH с 64 переменными, описанный Schilling et al.13 , для выполнения количественного определения без меток с общим временем цикла около 3,2 с. Для получения данных DDA вместо использования квадруполя Q1 для передачи прекурсора в узком диапазоне масс в ячейку столкновения используется диапазон переменной ширины окна (например, m/z 5–90) для постепенного пересечения полного диапазона m/z (m/z 400–1250) с 64 сегментами SWATH, время накопления 45 мс для каждого сегмента. в результате время цикла составляет 3,2 секунды, включая одно сканирование MS1 с временем накопления 250 мс. Переменная ширина окна корректируется в соответствии со сложностью типичного ионного тока MS1, наблюдаемого в определенном диапазоне m/z с использованием алгоритма SCIEX «калькулятор переменных окон»13 (более узкие окна применяются к «занятым» диапазонам m/z, более широкие окна применяются к диапазонам m/z с небольшим количеством элюирующих ионов-предшественников). На других платформах MS также могут быть реализованы альтернативные стратегии выбора окна DIA.
6. Анализ данных
ПРИМЕЧАНИЕ: Некоторые настройки анализа данных должны быть адаптированы к конкретным экспериментальным условиям. Например, выбранная база данных белков (fasta file) будет зависеть от вида, из которого был приготовлен образец (в этом протоколе мы использовали C. elegans).
- Используйте поисковую систему базы данных MS для анализа полученных DDA и идентификации белков. Сгенерируйте метод поисковой системы darabase следующим образом:
- В опции Параметры описания образца выберите Идентификация; в разделе «Тип образца» выберите «Йодоуксусная кислота»; в разделе Цистеиновое алкилирование выберите Трипсин; в разделе Digestion (предполагая С-концевое расщепление лизина и аргинина) выберите название масс-спектрометра в разделе Instrument; и выберите Caenorhabditis elegans в разделе «Виды».
- Для специальных параметров обработки отметьте Биологические модификации; в разделе ID Focus выберите SwissProt; в разделе «База данных» отметьте «Подробный идентификатор»; в разделе Усилия поиска выберите 0,05 (10%) в разделе Пороговое значение обнаруженного белка; и отметьте галочкой Run False Discovery Rate Analysis в разделе Качество результатов. Сохраните метод поисковой системы и отправьте необработанные файлы MS в поисковую систему базы данных для обработки, используя сгенерированный метод.
ПРИМЕЧАНИЕ: В ходе итеративного процесса все сканирования MS и MS/MS были автоматически откалиброваны поисковой системой на основе первоначальных аннотаций и результатов.
- По завершении поиска нажмите на кнопку «Экспорт сводки пептидов » и отфильтруйте все результаты идентификации пептидов по порогу достоверности 99 в Excel (процент ложных обнаружений (FDR) = 1%).
- Создание спектральных библиотек MS/MS для дальнейшей обработки файла исходных данных DIA и для дальнейшей количественной оценки относительных данных.
- Откройте программное обеспечение для количественного анализа DIA. Выберите вкладку «Библиотека », а затем (внизу страницы) нажмите «Создать спектральную библиотеку» из «Database Search Engine» и откройте отчет FDR «Database Search Engine» (файл таблицы *FDR.xlsx), который был автоматически сгенерирован в рамках процесса поиска базы данных DDA.
- Нажмите «Далее», выберите схему настроек библиотеки и нажмите «Далее». Выберите Uniprot_Caenorhabditis elegans _proteome в качестве базы данных, затем нажмите Finish, спектральная библиотека будет сгенерирована.
- Используйте программное обеспечение для количественного анализа DIA для анализа полученных данных DIA для всестороннего количественного определения относительных белков. Конвейер анализа данных DIA описывается следующим образом.
- Чтобы проанализировать и количественно оценить пептиды, откройте программное обеспечение для количественного анализа DIA , чтобы настроить схему анализа с помощью шаблонной схемы. Схема шаблона доступна в программном обеспечении, нажав « Настройки», затем «Анализ DIA» и, наконец, «Заводские настройки BGS».
- Настройте параметры в схеме шаблона следующим образом:
1) в разделе идентификация выбираем локализацию ПТМ (отсечка вероятности = 0,75).
2) В разделе Количественная оценка выберите Количество основной группы как Сумма пептидных количеств, установите Основную группу N как Max 7 и Min 1, выберите Minor Group Quantity как Sum precursor amount и настройте Minor Group N как Max 10 и Min 1, а также выберите Фильтрация данных как Qvalue sparse и не выбирайте Cross Run Normalization.
- Выполните анализ относительной количественной оценки.
- Выберите вкладку «Конвейер », нажмите «Настроить анализ DIA из файла», откройте интересующие вас необработанные файлы MS DIA (например, образец и контроль), нажмите «Назначить спектральную библиотеку», выберите библиотеку, которая была создана в версии 6.3, нажмите «Загрузить» и, наконец, нажмите «Далее».
- Выберите схему анализа, настроенную в версии 6.5.1, и нажмите кнопку Далее. Выберите соответствующий fasta файл базы данных (в этом протоколе: Uniprot_Caenorhabditis elegans_proteome) и нажмите кнопку Далее. Определите настройку условий, назначьте различные условия в соответствии с образцами и нажмите кнопку Далее.
- Просмотрите обзор анализа (сводку по настройке эксперимента), перейдите в каталог вывода и нажмите кнопку Готово. Наконец, нажмите Run Pipeline , чтобы выполнить количественный анализ без меток.
ПРИМЕЧАНИЕ: Статистические модули в программном обеспечении для количественного анализа DIA автоматически выполняют анализ FDR, генерируют тепловые карты и графики вулканов, сравнивая различные условия, генерируют списки идентифицированных и количественно определенных пептидов и белков и предоставляют Q-значения вместе с относительными изменениями кратности, сравнивая различные условия. Здесь были созданы условия отбора образцов для червей в возрасте 10-го дня с двумя биологическими репликами и молодых червей из 2-го дня с двумя биологическими репликами в качестве контроля.
Результаты
Традиционные методы лизиса от червей имеют различные недостатки. Например, методы ультразвуковой обработки на основе зондов и бисеробития производят чрезмерное тепло, позволяя металлическому наконечнику или бусинам контактировать непосредственно с образцами, что приводит к переменному восстановлению белка и денатуризации белка. Измельчение жидкого азота с последующей ультразвуком в буфере для лизиса может быть трудоемким и требует большого количества червей. Из-за ограничений традиционных методов лизиса червей предыдущие рабочие процессы РС, такие как методы маркировки iTRAQ или методы без меток, которые исторически использовались в модельной системе C. elegans для получения количественной информации о нерастворимости, требуют большого количества исходного материала (не менее 40 000 червей). Для получения такого количества червей требуется кропотливая работа по культивированию червей. Кроме того, методы маркировки требуют дорогостоящих изобарических химических этикеток. Методы количественного определения без меток являются экономически эффективными и имеют более простые и понятные методы подготовки образцов и мечения, но требуют значительного количества червей для достижения достаточного охвата анализа МС.
Ультразвуковой аппарат, который мы использовали, значительно повышает эффективность и воспроизводимость лизиса червей за счет одновременного лизисования нескольких образцов червей в ультразвуковике с регулируемой температурой воды без перекрестного загрязнения14, тем самым значительно уменьшая количество необходимого исходного материала червя. Сочетая высокоэффективный метод ультразвуковой обработки и количественный подход DIA к МС без меток, мы смогли надежно количественно оценить нерастворимость старых и молодых червей с использованием ~3000 червей. Здесь мы протестировали и подтвердили эффективность протокола и сравнили нерастворимость старых и молодых червей из штамма червей дикого типа, N2-Bristol C. elegans. Мы применили этот протокол для извлечения и изоляции инсолома из ~3000 старых и молодых N2 C. elegans (по две биологические репликации для каждого состояния), с последующим анализом РС с помощью квадрупольного времяпролетного масс-спектрометра или других систем МС с использованием комбинации данных-зависимых сборов (DDA) и данных-независимых сборов (DIA/SWATH) для идентификации и количественной оценки белков. Нерастворимые белки сначала анализировали на геле с градиентом Bis-Tris 4-12% для определения количества белка в каждом образце нерастворимого белка. Как показано на рисунке 2, нерастворимый образец от старых червей N2 (дорожки 2 и 3, эксперименты с биологической репликацией) содержит значительно больше белка, чем образцы от молодых червей N2 (дорожки 1 и 4, эксперименты с биологической репликацией).
После расщепления в геле белковые профили нерастворимого раствора анализировали с помощью ВЭЖХ-МС. Используя этот рабочий процесс, мы можем в целом идентифицировать 1000–1500 белков и количественно определить 500–1000 белков из нерастворимой в SDS фракции с высокой воспроизводимостью (неопубликованные данные). Здесь мы смогли количественно оценить 989 белков из нерастворимого червя N2-Bristol C. elegans , проанализировав данные DIA и устранив избыточность: 768 белков были значительно обогащены, а 27 белков значительно снижены в нерастворимом черве N2 (10-й день) по сравнению с молодыми (2-й день) с использованием кратного изменения не менее 1,5 и значения Q менее 0,01 (рис. 3A). Как видно на графике гистограммы (рисунок 3B), изменение значительно измененных белков в несколько раз показывает нормальное распределение. Было продемонстрировано, что старые черви значительно обогащены для нерастворимого: самое большое наблюдаемое изменение показало, что относительное содержание белка в нераствором было в 592 раза выше у старых червей по сравнению с молодыми; А для 32 белков относительное содержание белка в нерастворимом было в >250 раз выше у старых и молодых червей, что указывает на значительные изменения нерастворимости с возрастом.
После извлечения списка нерастворимых белков, которые значительно увеличены у старых червей и идентифицированы по базе червя (WS271), был проведен анализ пути KEGG и онтологии гена (GO) для определения путей, обогащенных в старом нерастворимом веществе, чтобы получить биологическое представление о том, как они связаны со старением. Анализ путей KEGG белков, идентифицированных в этом исследовании, показывает обогащение нескольких путей, включающих рибосомы, митохондрии, протеасомы и сплайсосомы (рис. 4A). Онтологический анализ генов показывает, что нерастворимость от старых червей содержит множество белков в определенных категориях, включая митохондриальные, белки развития, детерминанты продолжительности жизни взрослого человека и рибосомные белки (рисунок 4B и дополнительная таблица 1A). Затем мы сравнили список белков, идентифицированных в этом исследовании, с ранее опубликованными работами David et al.2 и Mark et al.11 , как показано на диаграммах Венна (рис. 5A,5B). Сравнение показало значительное перекрытие идентифицированных белков 394/721 и 444/721 с исследованиями David et al. (рисунок 5A) и Mark et al. (рисунок 5B) соответственно. Биологические пути, выявленные в ходе анализа нерастворома методом KEGG в этом исследовании, также были идентифицированы в прошлом, что подтверждает нашу методологию (Дополнительная таблица 1B). Идентификация этих путей и белков позволяет предположить, что они могут служить кандидатами для дальнейших биологических исследований в отношении их функции в контексте старения.
Таким образом, использование эффективного метода ультразвуковой обработки позволяет проводить лизис нескольких образцов червей одновременно в среде с хорошо контролируемыми температурами и сниженным перекрестным загрязнением для достижения высокого белкового покрытия при значительно меньшем количестве исходного материала червей. Сочетание эффективного метода ультразвуковой обработки с рабочим процессом количественного определения белка без метки DIA позволило получить надежные и воспроизводимые результаты количественного определения нерастворимых белков червей.

Рисунок 1. Экспериментальная схема работы протокола. C. elegans культивировали и собирали в разные дни. После лизиса червя с помощью ультразвуковой канцелярии извлекали и выделяли из лизата 1% нерастворимую в SDS белковую фракцию (нерастворимый). Затем раствор расщепляли с помощью расщепления трипсина в геле и количественно определяли с помощью масс-спектрометрии DIA с последующим биоинформационным анализом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2. Гель SDS-PAGE нерастворимого изолировал молодых и старых червей штамма N2-Bristol. Несолюбломы молодых и старых червей штамма N2-Bristol были проанализированы с помощью SDS-PAGE для определения количества присутствующего белка. Гель SDS-PAGE окрашивали флуоресцентным белковым красителем для визуализации белковых полос. Дорожки 1 и 4: Нерастворимые результаты двух экспериментов по биологической репликации молодых червей N2 (День 2). Дорожки 2 и 3: Нерастворимые результаты двух экспериментов по биологической репликации старых червей N2 (день 10). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3. Белковые кандидаты были идентифицированы как демонстрирующие значительные изменения в возрастном и молодом нерастворимом и их распределении по изменению складок. (A) Вулканический график для количественной оценки нерастворимости старых и молодых N2-бристольских червей. Красными точками обозначены кандидаты с абсолютным изменением сворачивания >=1,5 и значением Q <0,01. (B) График гистограммы для кратного изменения распределения значительно обогащенных нерастворимых в SDS белков в образцах старых и молодых червей. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
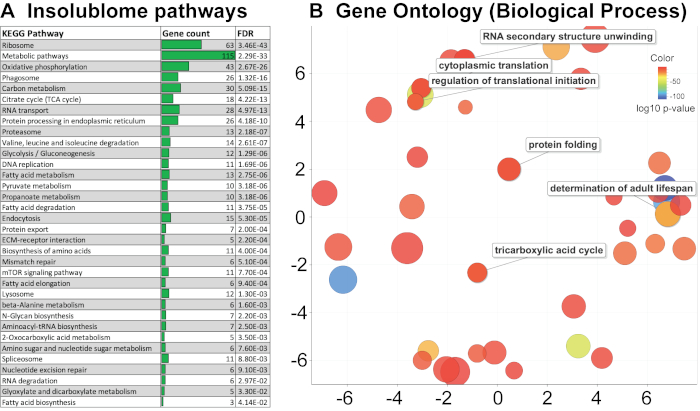
Рисунок 4. Анализ путей KEGG и онтологии генов (GO). (A) Анализ пути KEGG для нерастворимого дня 10-го дня, организованный в соответствии с p-значением, при этом высокозначимый путь показан вверху. (B) Онтологический анализ генов показывает, что нерастворимость старых червей обогащена многими белками в определенных категориях, включая митохондриальные, развивающие, определяющие продолжительность взрослой жизни и рибосомные белки. Вид диаграммы рассеяния визуализирует термины GO в «семантическом пространстве», где более похожие термины расположены ближе друг к другу. Цвет пузырька отражает p-значение, полученное в анализе STRING, в то время как его размер отражает общность термина GO в базе данных UniProt-GOA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5. Перекрытие белков нерастворимого было выявлено на 10-й день исследования при сравнении этого исследования с исследованиями (A) David et al.2 и (B) Mark et al.11 . Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительная таблица 1 (относящаяся к рисунку 4 и рисунку 5). (A) Онтология генов (биологический процесс), проанализированная с помощью базы данных STRING. (B) Подробный список белков и путей KEGG, идентифицированных в этом исследовании, с цветовыми кодами, отображающими их перекрытие с опубликованной работой. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
В этом протоколе мы сообщаем об улучшенном методе пробоподготовки для экстракции нерастворимых белков из C. elegans. Заменив традиционный лизис червей (например, методы ультразвуковой обработки зондов или взбивания бусин) эффективным ультразвуковым аппаратом, мы увеличили выход экстракции нерастворимого белка и сократили количество червей, необходимых для анализа РС без меток, с 40 000 до 3 000 червей. Для идентификации белков по данным DDA использовалась поисковая система базы данных, а спектральная библиотека C. elegans была построена с использованием программного обеспечения для количественного анализа DIA и соответствующих результатов поиска в базе данных DDA (импорт отчетов о файлах FDR, сгенерированных поисковой системой базы данных). Относительная количественная оценка данных о пожилых и молодых пациентах C. elegans была проведена с использованием программного обеспечения для количественного анализа DIA для обработки нового набора данных DIA и сгенерированной спектральной библиотеки.
В протоколе критически важно выполнить несколько шагов. Короткая продолжительность жизни C. elegans делает ее идеальной системой для изучения старения по сравнению с другими эукариотами, такими как клетки млекопитающих, но при изучении феномена, связанного со старением, крайне важно выделить однородную популяцию червей. В этом протоколе использовался FUDR для получения синхронизированных стареющих червей. Важно перенести червей на ранней стадии L4 на засеянную NGM пластину, содержащую FUDR, чтобы обеспечить его эффективность. Во время лизиса червей с использованием эффективного ультразвукового аппарата температура водяной бани должна быть установлена на уровне 4 °C, а ультразвуковая обработка — на 30 с ON и 30 s OFF для предотвращения перегрева образцов. После первого раунда ультразвуковой обработки в течение 10 циклов (10 минут) важно проверить под микроскопом, чтобы убедиться, что все черви были эффективно лизированы. Если нет, то необходимы дополнительные циклы ультразвуковой обработки. В процессе разложения в геле каждый ломтик геля должен быть нарезан кубиками на кусочки соответствующего размера (<1мм2) — если они слишком малы, они могут быть потеряны в процессе подготовки образца, а если слишком велики, то разложение может быть недостаточным.
Потребность в гораздо меньшем количестве исходного материала значительно снижает трудоемкую работу, связанную с культивированием червей для получения образцов для анализов несолюбилома. Тем не менее, экстракция и выделение 1% нерастворимой в SDS белковой фракции включает в себя несколько этапов промывки, и требуется тщательное обращение с образцом, чтобы избежать потери образца и обеспечить воспроизводимые результаты. Количество материала, полученного для анализа МС, достаточно для ~3 инъекций для последующего анализа DDA и DIA, но не для сохранения для будущих экспериментов. Кроме того, несмотря на его потенциально искажающиеэффекты, мы использовали минимально возможную концентрацию FUdR для стерилизации червей в процессе старения. Будущие исследования могут обойти использование FUdR путем использования стерильных мутантов или путем ручного переноса и сбора червей.
Использование высокоэффективного ультразвукового аппарата для лизиса червей позволяет эффективно экстрагировать нераствором, обеспечивая хорошее покрытие белка и экономичный анализ DIA MS без меток для количественного определения нерастворимости с использованием значительно меньшего количества червей. Это значительно снижает рабочую нагрузку, позволяя проводить скрининг большего количества условий в эксперименте. Кроме того, рабочий процесс MS DIA без меток является экономически эффективным и обеспечивает глубину белка и покрытие на уровнях, сопоставимых с методами мечения, включая iTRAQ, TMT или SILAC. Модель C. elegans представляет собой систему быстрого скрининга для исследований старения. Рабочий процесс может быть легко изменен и применен для изучения старения и исследований возрастных заболеваний у этого и других организмов. Например, в текущих исследованиях мы применяем этот рабочий процесс для изучения белковых профилей нерастворома и протеостаза в различных моделях C. elegans при болезни Альцгеймера (БА), включая Abeta, tau и двойных червей Abeta/tau с различными лекарственными вмешательствами или без них для будущего высокопроизводительного скрининга лекарств.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана грантом NIH на совместное использование приборов для системы TripleTOF (1S10 OD016281, Buck Institute), грантом NIH, RF1 AG057358 (GJL, JKA) и грантом NIH U01AG045844 (GJL). XX поддерживается стипендией T32 для постдокторантов (грант NIH 5T32AG000266, руководитель проекта: Джудит Кампизи и Лиза Эллерби). MC поддерживается стипендией для постдокторантуры от Фонда Ларри Л. Хиллблома.
Материалы
| Name | Company | Catalog Number | Comments |
| Strains used | |||
| Esherichia coli OP50 | Caenorhabditis Genetics Center (CGC) | ||
| N2 (Bristol) | Caenorhabditis Genetics Center (CGC) | ||
| Buffer/Solution | |||
| NGM (Nematode Growth Media) | Recipe: 3 g/L NaCl, 23 g/L agar; 2.5 g/L peptone; 1 mM CaCl2, 5 mg/L cholesterol, 1 mM MgSO4, 25 mM KH2PO4 | ||
| S-basal solution | Recipe: 5.85 g/L NaCl, 1g/L K2HPO4, 6 g/L KH2PO4, H2O to 1 L | ||
| Sodium hypochlorite bleach solution | Recipe: Mix 0.5 mL 5 N NaOH with 1 ml Sodium hypochlorite (5%) and make volume to 5 mL with H20. | ||
| Material/ Equipment | |||
| Agar | Difco Granulated Agar, BD Biosciences | 90000-782 | |
| Bioruptor Plus sonication device | Diagenode, USA | B01020001 | |
| Cholesterol | Sigma | c8503 | |
| 2'-deoxy-5-fluorouridine | VWR | TCD2235 | |
| Glycerol | Millipore Sigma | 356350-1000ML | |
| LB broth, Miller | Millipore Sigma | 60801-450 | |
| Sodium dodecyl sulfate (SDS? | Sigma | L4509-250G | |
| Sodium chloride | Sigma | 59888 | |
| M880 Ultrasonic bath, 117 V, holds 5.5 gallons | VWR, USA | 89375-458 | |
| Magnesium sulphate | Sigma | M506 | |
| Magnesium chloride | Sigma | 208337 | |
| NGM agar plate | VWR Disposable Petri Dishes | 25384-342 | |
| NuPAGE LDS Sample Buffer (4X) | Thermo Fisher Scientific | NP0007 | |
| NuPAGE protein gels, 4-12% | Invitrogen | NP 0335BOX | |
| Protease inhibiotr cocktail (PIC) | Roche | 11836170001 | |
| Pierce BCA Assay | Thermo Fisher Scientific | 23225 | |
| Sodium hypochlorite 5% | VWR | JT9416-1 | |
| SYPRO Ruby Protein Gel Stain | Thermo Fisher Scientific | S12000 | |
| MS Section | |||
| Acetonitrile, Burdick and Jackson LC-MS | Honeywell International Inc., Charlotte, NC, USA | 36XL66 | |
| Agilent Zorbax 300Extend C18 column | Agilent Technologies Inc., Santa Clara, CA, USA | 770995-902 | |
| Ammonium bicarbonate | Sigma Aldrich, St. Louis, MO, USA | 9830 (1 kg) | |
| Dithiothreitol (DTT) | Sigma Aldrich, St. Louis, MO, USA | D9779-5G | |
| Eppendorf Thermomixer Compact | Eppendorf AG, Hamburg, Germany | T1317-1EA | |
| Formic acid | Sigma Aldrich, St. Louis, MO, USA | F0507-500ML | |
| Indexed retention time (iRT) normalization peptide standard | Biognosys AG, Schlieren, Zurich, Switzerland | Ki-3002-2 | |
| Iodoacetamide (IAA) | Sigma Aldrich, St. Louis, MO, USA | I1149-25G | |
| Methanol, HPLC Grade | Honeywell International Inc., Charlotte, NC, USA | 34885 | |
| Nano cHiPLC Trap ChromXP C18-CL, 200 um x 6 mm, 3 um, 120A. (pre-column chip) (200 um x 6 mm ChromXP C18-CL chip, 3 um, 300 A) | Sciex LLC, Framingham, MA, USA | 804-00006 | |
| Nano cHiPLC ChromXP 75 um by 15cm, C18-CL, 3 um, 120 A (analytical column chip) | Sciex LLC, Framingham, MA, USA | 804-00001 | |
| Orthoganol quadrupole time-of-flight (QqTOF) TripleTOP 6600 mass spectrometer | Sciex LLC, Framingham, MA, USA | Per quote | |
| ProteinPilot 5.0 | Sciex LLC, Framingham, MA, USA | software download Sciex | |
| Savant SPD131DDA Speedvac Concentrator | Thermo Fisher Scientific, Waltham, MA, USA | SPD131DDA-115 | |
| Sequencing-grade lyophilized trypsin | Life Technologies | 23225 | |
| Spectronaut | Biognosys AG, Schlieren, Zurich, Switzerland | Sw-3001 | |
| SWATH 2.0 plugin into PeakView 2.2 | Sciex LLC, Framingham, MA, USA | software download Sciex | |
| Ultra Plus nano-LC 2D HPLC system | Sciex LLC, Eksigent Division, Framingham, MA, USA | Model # 845 | |
| Water, Burdick and Jackson LC-MS | Honeywell International Inc., Charlotte, NC, USA | 600-30-76 | |
| Waters 1525 binary HPLC pump system | Waters Corp., Milford, MA, USA | WAT022939 | |
| Waters 2487 Dual Wavelength UV detector | Waters Corp., Milford, MA, USA | WAT081110 | |
| Waters 717plus Autosampler | Waters Corp., Milford, MA, USA | WAT022939 | |
| Waters Fraction Collector III | Waters Corp., Milford, MA, USA | 186001878 |
Ссылки
- Walther, D. M., et al. Widespread Proteome Remodeling and Aggregation in Aging C. elegans. Cell. , 919-932 (2015).
- David, D. C., et al. Widespread protein aggregation as an inherent part of aging in C. elegans. PLoS Biology. 8 (8), 47-48 (2010).
- Labbadia, J., Morimoto, R. I. The Biology of Proteostasis in Aging and Disease. Annual Review of Biochemistry. (1), 435-464 (2013).
- Ross, C. A., Poirier, M. A. Protein aggregation and neurodegenerative disease. Nature Medicine. , 10-17 (2004).
- Reis-Rodrigues, P., et al. Proteomic analysis of age-dependent changes in protein solubility identifies genes that modulate lifespan. Aging Cell. 11 (1), 120-127 (2012).
- Ayyadevara, S., et al. Proteins that accumulate with age in human skeletal-muscle aggregates contribute to declines in muscle mass and function in Caenorhabditis elegans. Aging. 8 (12), 3486-3497 (2016).
- Huang, C., et al. Intrinsically aggregation-prone proteins form amyloid-like aggregates and contribute to tissue aging in Caenorhabditis elegans. eLife. 8, (2019).
- Morimoto, R. I. Proteotoxic stress and inducible chaperone networks in neurodegenerative disease and aging. Genes and Development. 22 (11), 1427-1438 (2008).
- Morimoto, R. I., Cuervo, A. M. Protein homeostasis and aging: Taking care of proteins from the cradle to the grave. Journals of Gerontology - Series A Biological Sciences and Medical Sciences. 64 (2), 167-170 (2009).
- Klang, I. M., et al. Iron promotes protein insolubility and aging in C. elegans. Aging. 6 (11), 975-991 (2014).
- Mark, K. A., et al. Vitamin D Promotes Protein Homeostasis and Longevity via the Stress Response Pathway Genes skn-1, ire-1, and xbp-1. Cell Reports. 17 (5), 1227-1237 (2016).
- Groh, N., et al. Methods to study changes in inherent protein aggregation with age in caenorhabditis elegans. Journal of Visualized Experiments. (129), 1-12 (2017).
- Schilling, B., Gibson, B. W., Hunter, C. L. Generation of High-Quality SWATH((R)) Acquisition Data for Label-free Quantitative Proteomics Studies Using TripleTOF((R)) Mass Spectrometers. Proteomics: Methods and Protocols, Methods in Molecular Biology. 1550, 223-233 (2017).
- Walther, D. M., et al. Widespread proteome remodeling and aggregation in aging C. elegans. Cell. 161 (4), 919-932 (2015).
- Angeli, S., et al. A DNA synthesis inhibitor is protective against proteotoxic stressors via modulation of fertility pathways in Caenorhabditis elegans. Aging. 5 (10), 759-769 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены