15.3 : Вода: кислота и основание Бренстеда-Лоури
Реакция между кислотой Брёнстед-Лоури и водой называется кислотной ионизацией. Например, когда фторид водорода растворяется в воде и ионизируется, протоны переносятся из молекул фторида водорода в молекулы воды, образуя ионы гидрония и ионы фторида:
Ионизация вида основание происходит, когда он принимает протоны из молекул воды. В приведенном ниже примере молекулы пиридина C5NH5 подвергаются ионизации основание при растворении в воде, дающих ионы гидроксида и пиридиния:
Предшествующие реакции ионизации предполагают, что вода может функционировать как основание (как в его реакции с фторидом водорода), так и как кислота (как в его реакции с аммиаком). Виды, способные либо жертвовать, либо принимать протоны, называются амфипротическими, или, в более общем смысле, амфотерическими, термин, который может использоваться для кислот и оснований в соответствии с определениями, отличными от Брёнстед-Лоури. Приведенные ниже уравнения показывают две возможные реакции кислотно-основная для двух амфипротических видов, бикарбоната иона и воды:

Первое уравнение представляет реакцию бикарбоната как кислоты с водой как основание, в то время как второе представляет реакцию бикарбоната как основание с водой как кислоты. При добавлении бикарбоната в воду оба этих равновесия устанавливаются одновременно, и состав получаемого раствор может быть определен с помощью соответствующих вычислений равновесия. В жидком состоянии молекулы амфипротического вещества могут вступать в реакцию друг с другом, как показано для воды в уравнениях ниже:
Процесс, в котором подобно молекулам реагируют на ионы намолота, называется автоматической ионизацией. Жидкая вода подвергается автоматической ионизации в очень небольшой степени; при 25 °C ионизируются приблизительно два из каждых миллиардов молекул воды. Степень процесса автоматической ионизации воды отражается в значении ее равновесной константы, константы ионного продукта для воды, КВТ:
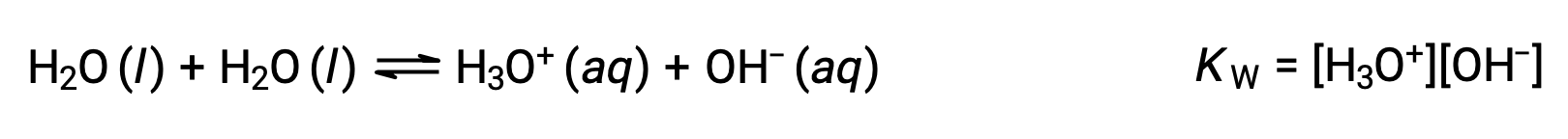
Небольшая ионизация чистой воды отражается в небольшом значении константы равновесия; при 25 °C, КВТ имеет значение 1.0 × 10-14.

Этот процесс является эндотермическим, поэтому степень ионизации и результирующие концентрации ионов гидрония и гидроксида увеличиваются при повышении температуры. Например, при 100 °C значение ДЛЯ КВТ составляет около 5.6 × 10-13, примерно в 50 раз больше значения при 25 °C.
Аутоионизация воды приводит к тому же количеству ионов гидрония и гидроксида. Поэтому в чистой воде при 25 °C:

Концентрации этих ионов в раствор часто являются критическими детерминантами свойств решения и химического поведения его других солей, и для описания этих концентраций в относительном выражении был разработан специальный словарь. раствор нейтрален, если он содержит одинаковые концентрации ионов гидрония и гидроксида; кислотен, если он содержит большую концентрацию ионов гидрония, чем ионы гидроксида; и является базовым, если он содержит меньшую концентрацию ионов гидрония, чем ионы гидроксида.
Резюме отношений по кислотным, базовым и нейтральным решениям
| Классификация | Относительные концентрации ионов | PH при 25 °C. |
| кислый | [H3O+] > [OH-] | PH < 7 |
| нейтраль | [H3O+] = [OH-] | PH = 7 |
| базовый | [H3O+] < [OH-] | PH > 7 |
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 14.1: Bronsted-Lowry кислоты и основания, и раздел 14.2: PH и Poh.
Из главы 15:

Now Playing
15.3 : Вода: кислота и основание Бренстеда-Лоури
Кислоты и основания
50.0K Просмотры

15.1 : Кислоты и основания Бренстеда-Лоури
Кислоты и основания
90.8K Просмотры

15.2 : Кислотно-щелочная сила и константы диссоциации
Кислоты и основания
60.1K Просмотры

15.4 : шкала pH
Кислоты и основания
68.3K Просмотры

15.5 : Относительные силы конъюгированных кислотно-основных пар
Кислоты и основания
45.3K Просмотры

15.6 : Сильные кислотные и щелочные растворы
Кислоты и основания
31.4K Просмотры

15.7 : Растворы слабой кислоты
Кислоты и основания
37.6K Просмотры

15.8 : Растворы слабых оснований
Кислоты и основания
22.5K Просмотры

15.9 : Смеси кислот
Кислоты и основания
19.5K Просмотры

15.10 : Ионы как кислоты и основания
Кислоты и основания
23.5K Просмотры

15.11 : Определение pH солевых растворов
Кислоты и основания
43.3K Просмотры

15.12 : Полипротонные кислоты
Кислоты и основания
29.0K Просмотры

15.13 : Кислотная сила и молекулярная структура
Кислоты и основания
30.7K Просмотры

15.14 : Кислоты и основания Льюиса
Кислоты и основания
43.4K Просмотры
Авторские права © 2025 MyJoVE Corporation. Все права защищены