Method Article
Entrega e expressão gênica aprimoradas usando injeção intraóssea de nanopartículas de quitosana encapsuladas em plasmídeos editores de base de adenina
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Aqui, apresentamos uma abordagem de terapia gênica que fornece quitosana revestida com ABE diretamente na medula óssea por injeção intraóssea.
Resumo
A entrega de plasmídeos exógenos em animais experimentais é crucial na pesquisa biomédica, incluindo a investigação das funções dos genes, a elucidação dos mecanismos da doença e a avaliação da eficácia do medicamento. No entanto, a eficiência de transfecção do método atual é relativamente baixa, e a introdução de plasmídeos para expressão gênica de longo prazo pode ser afetada pelo sistema imunológico. Para resolver essas limitações, desenvolvemos e investigamos um novo método que utiliza quitosana para encapsular plasmídeos editores de bases de adenina (ABE) e, em seguida, entregar diretamente o complexo à medula óssea de camundongos por injeção intraóssea. Neste estudo, para atingir o gene CaMK II δ , que está intimamente relacionado à diferenciação de osteoclastos, utilizamos quitosana para encapsular plasmídeos de δ ABE CaMK II . Injetamos diretamente a carga de plasmídeo na cavidade da medula óssea por injeção intraóssea. Os resultados mostraram uma alta eficiência de edição in vivo de 14,27% no locus A1 e 10,69% no locus A2 em camundongos receptores. Essa nova estratégia não é apenas particularmente adequada para doenças causadas pela função anormal dos osteoclastos, mas também possui um potencial significativo para o avanço do campo da terapia genética.
Introdução
A terapia gênica tem emergido como uma abordagem promissora no campo da pesquisa biomédica 1,2. Ele oferece o potencial de tratar uma variedade de distúrbios, introduzindo plasmídeos estranhos em animais experimentais para modular a expressão de genes específicos e estudar seus efeitos terapêuticos. No entanto, os métodos convencionais de entrega encontraram alguns problemas que limitam sua eficácia e segurança3. As preocupações incluem baixa eficiência de transfecção, alto dano biológico e baixa eficiência de expressão gênica. Portanto, é necessário estabelecer um novo método de entrega para terapia gênica que possa superar essas limitações.
A quitosana é um polissacarídeo natural com boa biodegradabilidade e biocompatibilidade 4,5,6, o que facilita sua degradação no corpo dos animais sem causar toxicidade biológica grave. Tem sido amplamente utilizado na administração de medicamentos devido à sua alta taxa de incorporação de medicamentos 7,8, maior eficiência de entrega e danos reduzidos aos animais.
A tecnologia de edição de genes ABE, que permite a conversão direta de pares de bases de A-T em G-C, é promissora em pesquisas genéticas e médicas. Em comparação com a atual tecnologia de edição de genes convencional, a tecnologia ABE pode alcançar mutação de base única precisa, reduzindo assim a edição de sequências de DNA não-alvo, reduzindo os efeitos fora do alvo 9,10 e levando a zero quebras de fita dupla de DNA11, o que reduz muito o risco de edição de genes12. A tecnologia ABE também é altamente biocompatível e é mais adequada para pesquisas de tratamento de doenças.
A injeção na veia da cauda é um método comum usado para entrega in vivo de plasmídeos, especialmente em terapia gênica. O gene alvo para este estudo é o CaMK II δ, que está intimamente relacionado à diferenciação dos osteoclastos13,14. O uso de injeção intraóssea em vez da veia da cauda permite que o plasmídeo editado entre nos osteoclastos diretamente na medula óssea. Essa transmissão direta para a medula óssea aumenta a eficiência e a estabilidade da expressão gênica, o que é vantajoso para o tratamento de doenças relacionadas à disfunção dos osteoclastos.
Aqui, apresentamos um novo método que envolve encapsular o plasmídeo ABE com quitosana e, em seguida, introduzir diretamente o complexo em camundongos por injeção intraóssea. Por meio desse método, esperamos abrir caminho para tratamentos de terapia gênica mais eficazes para plasmídeos estranhos que entram em organismos, especialmente doenças relacionadas à disfunção dos osteoclastos.
Protocolo
Todos os experimentos em animais descritos foram aprovados pelo Comitê de Saúde Animal da Universidade de Anhui sobre o Uso e Cuidado de Animais. Neste estudo, a ABE foi generosamente doada pelo Professor Tian Chi (Universidade de Ciência e Tecnologia de Xangai, Xangai, China; Figura 1D).
1. Construção do plasmídeo ABE
- Projete gRNA com a sequência TCCATGATGCACAGACAGGA onde o PAM é apresentado pelo GAC.
- De acordo com o guia da lista de primers da empresa, adicione o primer ao volume correspondente de ddH2O para atingir uma concentração de 100 μM. Em seguida, agite e misture bem para garantir uma distribuição uniforme. Para a reação de recozimento, prepare uma solução de 10 μM adicionando 10 μL da solução de primer de estoque ao novo tubo de microcentrífuga, 90 μL de ddH2O, e misture bem.
- Adicione 5 μL de primer a montante, 5 μL de primer a jusante e 40 μL de ddH2O em um tubo de microcentrífuga. Para facilitar a reação de recozimento, mergulhe o tubo em um recipiente cheio de água fervente por 5 min. Certifique-se de que o nível da água não atinja a abertura do tubo para evitar que a água entre e contamine os primers. Resfrie até a temperatura ambiente para completar a reação de recozimento.
- Adicione 2 μg de pLKO5.sgRNA.EFS.tRFP (Figura 1D), 1 μL de ESP3I, 4 μL de tampão e 33 μL de ddH2O em um tubo de microcentrífuga e deixe reagir em banho-maria de temperatura constante a 37 ° C por 45 min.
- Realize eletroforese em gel de agarose. Prepare um gel de agarose a 1% pesando 0,5 g de agarose e despeje-o em um frasco de vidro. Adicione 50 mL de 1x tampão TAE no frasco de vidro e agite para dissolver o pó de agarose. Aqueça no forno de micro-ondas por 2 min até derreter completamente. Adicione 5 μL de YeaRed Nucleic Acid Gel Stain, misture bem e despeje no molde de gel; Depois que o gel solidificar, comece a adicionar as amostras.
NOTA: Para preparar 1xTAE, use os reagentes listados na Tabela 1. - Adicione 1x TAE ao tanque de eletroforese e coloque no bloco de gel de agarose configurado, que deve ser imerso em TAE. Adicione 5 μL de tampão de carga 1x ao produto de digestão da etapa 1.4 e misture. Adicione a amostra ao gel. Além disso, adicione 6 μL de marcador ao gel também.
- Execute o programa de eletroforese a uma tensão constante de 110 V por 35 min. Após a eletroforese, determine a posição da banda na amostra de acordo com o marcador e corte a tira de gel com uma lâmina limpa para recuperação do gel.
- Execute a operação de recuperação de gel de acordo com as instruções do kit de purificação de gel maxi. Defina um banho-maria para 50 °C. Adicione o volume correspondente de solução NP ao tubo que contém o gel cortado conforme o kit. Pique o gel com uma ponta de pipeta para facilitar a dissolução e coloque-o em banho-maria. Agite o tubo de vez em quando e observe o processo de dissolução até que o bloco de gel esteja completamente dissolvido.
- Pegue uma coluna de rotação, CA3, do kit. Adicione 500 μL de solução BL do kit na coluna de centrifugação e centrifugue a 2.000 x g por 1 min para equilibrar a coluna. Após a centrifugação, remova o líquido residual do fundo do tubo de coleta e coloque a coluna de adsorção de volta no tubo de coleta.
- Continue a centrifugação a 2.000 x g por 1 min. Descarte o líquido residual no fundo do tubo da centrífuga, adicione 600 μL de solução de NP e centrifugue 2.000 x g por 30 s; Descarte o líquido residual novamente. Repita a operação e descarte novamente o líquido residual.
- Após a centrifugação, substitua o tubo de coleta de 2 mL por um novo tubo de 1,5 mL. Abra a tampa e deixe secar em local ventilado por 30 min para retirar completamente o etanol. Em seguida, adicione 40 μL pré-aquecidos de ddH2O, centrifugue e elua o DNA necessário.
NOTA: O PN deve ser adicionado com etanol anidro de acordo com as instruções. O uso de água pré-aquecida pode aumentar o rendimento. - Adicione 7 μL de produto de recozimento da etapa 1.3, 3 μL de produto de recuperação de gel da etapa 1.11, 1 μL de T4 DNA Ligase, 2 μL de 10x T4 Ligase Buffer e 7 μL de ddH2O em um tubo de microcentrífuga e mantenha durante a noite a 16 ° C para obter o produto de ligação.
- Adicione 10 μL de produto de ligadura e 70 μL de DH5α em um tubo de microcentrífuga em gelo por 30 min. Ajuste o banho-maria para 42 °C. Após o banho de gelo, coloque o tubo no banho-maria por 90 s e depois novamente no gelo por 2 min.
- Adicione 600 μL de meio líquido Luria-Bertani (LB) ao tubo e agite em um shaker por 30 min. Ao mesmo tempo, irradiar uma placa de meio sólido LB dentro de um gabinete de fluxo laminar por 30 min. Após a incubação, distribua uniformemente 100 μL da solução na placa. Após o revestimento, coloque a placa de cabeça para baixo em uma incubadora bacteriana a 37 °C para cultura.
NOTA: DH5α é geralmente armazenado a -80 °C. LB meio sólido é preparado usando os reagentes listados na Tabela 2. O meio líquido LB é preparado usando os reagentes listados na Tabela 3. - Selecione uma única colônia e expanda a colônia bacteriana por 14 h em um prato fresco. Pegue um tubo de centrífuga de 50 mL, adicione 50 mL de meio líquido LB, adicione 50 μL de ampicilina na proporção de 1:1000 e misture bem. Divida isso em novos tubos a 15 mL por tubo.
- Verifique a placa de cultura para colônias brancas redondas com bom crescimento. Selecione-os com uma pipeta de 10 μL e transfira-os para o meio LB. Cultive em um shaker por 12 h e depois envie esta amostra para sequenciamento.
- Compare os resultados do sequenciamento com o gRNA alvo para identificar a cepa com a sequência correspondente, Camk II δ-sgRNA, como a cepa alvo e, em seguida, extraia o plasmídeo.
- Realize a extração de plasmídeo de acordo com as instruções do mini kit de plasmídeo. Adicione 500 μL de BL à coluna de adsorção CP3, centrifugue por 1 min a 2.000 x g e descarte o líquido residual. Volte a colocar a coluna de adsorção no tubo de recolha. Adicione 500 μL de solução bacteriana e centrifugue a 4.000 x g por 10 min.
- Colete o fluxo. Centrifugue novamente e, após remover o sobrenadante, adicione 250 μL de P1 ao tubo da centrífuga com precipitação bacteriana e, em seguida, transfira-o para um tubo de microcentrífuga e vórtice. Adicione 250 μL de P2 e inverta suavemente para 6x-8x. Adicione 350 μL de P3 e inverta novamente suavemente por 6x-8x. Aparece um precipitado floculante branco.
- Centrifugue por 10 min a 2.000 x g. Transferir o sobrenadante para uma nova coluna de adsorção CP3, centrifugar a 2.000 x g durante 30 s e remover o líquido residual. Adicione 600 μL de PW, centrifugue novamente a 2.000 x g por 30 s e remova o líquido residual. Adicione 600 μL de PW novamente, centrifugue a 2.000 x g por 30 s e remova o líquido residual.
- Coloque a coluna de adsorção no tubo de coleta e centrifugue por 2 min a 2.000 x g para remover o PW residual. Em seguida, coloque a coluna de adsorção em um tubo de microcentrífuga limpo, deixe-a secar por 30 min e adicione 35 μL de ddH2O pré-aquecido ao meio do filme de adsorção e, em seguida, armazene o produto resultante a -20 °C para testes subsequentes.
NOTA: PW deve ser adicionado com etanol anidro de acordo com as instruções. O uso de água pré-aquecida pode aumentar o rendimento.
2. Extração de células da medula
- Selecione camundongos KM com idade entre 8 e 9 semanas, machos e pesando cerca de 30 g. Fixe os camundongos na mão esquerda com a cabeça voltada para baixo e injete 150 μL de Pentobarbital sódico a 1% do lado do abdômen com uma seringa usando a mão direita. Confirme a anestesia beliscando o dedo do pé.
- Realize a luxação cervical de camundongos, remova a tíbia com tesouras cirúrgicas e pinças e retire o excesso de tecido muscular circundante. Mergulhe a tíbia removida em PBS e lave, deixando apenas os ossos limpos.
- Tome 1 mL de PBS em uma seringa para lavar as células da medula óssea de uma extremidade da tíbia até que o osso fique branco.
- Recolha a suspensão celular e centrifugue a 800 x g a 4 °C durante 5 min. Depois de remover o sobrenadante, lise os glóbulos vermelhos com 500 μL de lisado de glóbulos vermelhos. Após 1 min, adicione 1 mL de tampão de separação para terminar o lisado de glóbulos vermelhos. Depois de centrifugar a 800 x g a 4 °C durante 5 min, retirar o sobrenadante e colocar as células no gelo para utilização posterior.
NOTA: Se os glóbulos vermelhos estiverem completamente lisados, as células precipitam e nenhum glóbulo vermelho é visível. Se os glóbulos vermelhos ainda puderem ser vistos, eles podem ser lisados novamente, mas o tempo de incubação não deve ser muito longo para evitar danos a outras células.
3. Transfecção de quitosana
- Preparação de quitosana: Pese 4 mg de quitosana e dissolva em 20 mL de solução de ácido acético 0,2 mg / mL. Ajuste o pH para 5,5 com NaOH 10 M. Pegue 500 μL desta solução e adicione-os a tubos de microcentrífuga individuais.
- Adicione 2 μg, 3 μg, 4 μg e 5 μg de plasmídeos ABE a tubos individuais e dissolva-os em 500 μL de 30 mM Na2SO4. Misture 500 μL de solução de quitosana e 500 μL do plasmídeo.
- Incube-os em banho-maria a 50-55 °C por 15 min. Depois de misturar bem as duas soluções, vortex por 15-30 s e deixe descansar por 30 min.
- Caracterização da quitosana: Analise os diâmetros e potenciais zeta da quitosana usando espalhamento dinâmico de luz (DLS), com a concentração de quitosana mantida em 0,1 mg / mL em ddH2O. Execute cada amostra 3x.
- Lançar amostras de 0,1 mg/mL em um chip de silício. Adicione 20 μL das amostras ressuspensas a grades de 200 mesh e incube em temperatura ambiente por 10 min. Manchar as grades com ácido fosfotúngstico a 2% por 3 min e remover o líquido restante com papel de filtro. Observe com um microscópio eletrônico de transmissão.
- Eficiência de encapsulamento de nanopartículas: Filtre o sobrenadante com um filtro de 0,1 μm para remover as partículas não precipitadas. Carregue o plasmídeo e meça a concentração com um espectrofotómetro a 260 nm. As eficiências calculadas do plasmídeo ABE e do plasmídeo de gRNA foram de 84% ± 0,37% e 85% ± 0,53%, respectivamente.
- Injete 100 μL de quitosana embebida com plasmídeo em camundongos através da cavidade da medula óssea (etapa 5). Após 7 dias da injeção, isole as células da medula óssea e lise os glóbulos vermelhos conforme descrito no passo 2.
- Adicione 2 mL de meio DMEM contendo soro a placas de cultura de células de 6 poços e adicione as células da medula óssea (aproximadamente 1 x 106) suspensas em 500 μL de meio DMEM contendo soro. Meça a intensidade de fluorescência em um microscópio de fluorescência. O plasmídeo CaMK II δ-sgRNA tem fluorescência vermelha TagRFP quando excitado a 580 nm (Figura 2B).
NOTA: O meio DMEM contendo soro é preparado usando os reagentes listados na Tabela 4.
4. Citometria de fluxo
- Preparar diferentes dosagens de plasmídeos ABE: 2 μg, 3 μg, 4 μg e 5 μg, e entregar aos ratinhos recetores conforme descrito no passo 3. Após 7 dias, isole as células da medula óssea dos camundongos conforme descrito na etapa 3.
- Recolha as células da medula óssea e centrifugue a 800 x g a 4 °C durante 5 min. Descarte o sobrenadante e lise os glóbulos vermelhos com 500 μL de lisado de glóbulos vermelhos. Após 1 min, termine a reação com 1 mL de tampão de separação e conte o número de células com um contador de células.
- Transferir 1 x 106 células para um novo tubo de microcentrífuga e centrifugar com 800 x g a 4 °C durante 5 min. Depois de remover o sobrenadante, ressuspenda as células com 500 μL de PBS e transfira-as para um tubo de fluxo. Meça a eficiência por citometria de fluxo. Preparar um grupo de controlo de citometria de fluxo conforme descrito no passo 2.
NOTA: Detritos celulares e células mortas com os sinais FSC mais baixos e localizados no canto inferior esquerdo do gráfico de dispersão FSC versus SSC (menos de 400) foram excluídos (Figura 3). Como os plasmídeos têm fluorescência vermelha TagRFP, eles podem ser classificados.
5. Injeção da cavidade da medula óssea
- Selecione camundongos machos KM com idade entre 8 e 9 semanas de idade, pesando cerca de 30 g. Anestesize-os com uma injeção intraperitoneal de 150 μL de Pentobarbital sódico a 1% (etapa 2.1). Confirme a profundidade da anestesia beliscando o dedo do pé.
- Fixe o mouse anestesiado em decúbito dorsal na mesa de operação e fixe o membro frontal do mouse com fita adesiva.
- Desinfete a tíbia posterior de camundongos com um cotonete embebido em álcool. Encha o plasmídeo a ser injetado em uma seringa de 1mL com uma agulha de 26G. Remova as bolhas de ar e prepare-se para a injeção.
- Toque na canela do mouse e segure a canela do mouse com os dedos. Determine a posição da agulha de injeção de modo que a diáfise tibial seja penetrada a partir do platô tibial na articulação do joelho do camundongo. Gire a agulha de injeção paralelamente à tíbia, esfaqueie a cavidade da medula óssea e injete lentamente (cerca de 3 s) para minimizar os danos aos camundongos.
- Após a injeção, puxe lentamente a agulha (cerca de 3 s) e use imediatamente um cotonete embebido em álcool para parar o sangramento e desinfetar o local da punção.
- Coloque suavemente os ratos em um ambiente quente (20-26 ° C), espere que os ratos se recuperem da anestesia e observe sua recuperação.
6. Sequenciamento de Sanger
- Após 7 dias da injeção, colete células da medula óssea de camundongo conforme descrito na etapa 2 e isole o DNA genômico usando um kit de extração. Colete as células centrifugando a 2.000 x g por 1 min. Descarte o sobrenadante, adicione 200 μL de solução de GA e vibre com um misturador de vórtice. Adicione 20 μL de proteinase K e 200 μL de GB, misture e coloque em banho-maria a 70 °C por 10 min.
- Após a incubação, adicione 200 μL de etanol anidro, agite por 15 s e, em seguida, coloque o líquido misturado na coluna de adsorção de suporte. Centrifugue a 2.500 x g por 1 min, descarte o líquido residual no fundo do tubo e adicione 500 μL de solução GD. Centrifugue e descarte o líquido residual, lave o pellet 2x com PW e, finalmente, seque-o, eluíndo-o com 40 μL de água pura.
NOTA: PW deve ser adicionado com etanol anidro de acordo com as instruções. - Amplificar o gene alvo CaMKIIδ por PCR com a sequência de primer direto gctaaggtgataaatgtggcact e a sequência de primer reverso de ctagtgtgcgggccagattc. Prepare a reação de PCR adicionando 25 μL de tampão 2x, 1 μL de dNTP Mix, 2 μL de primer direto, 2 μL de primer reverso, 1 μL de DNA polimerase, 2 μL de DNA molde e 17 μL de ddH2O. Execute o seguinte programa de PCR: 95 ° C por 3 min, 95 ° C por 15 s, 53,7 °C por 30 s, 72 °C por 60 s, 12 °C para preservação do calor.
- Após a reação em cadeia da polimerase (PCR), prepare um gel de agarose a 1% e realize a eletroforese em gel de agarose a 110 V por 35 min (etapa 1.5, etapa 1.6). Corte a área do gel alvo após a eletroforese e envie para o sequenciamento de Sanger (Figura 4).
Resultados
Plasmídeos in vitro foram injetados em camundongos por injeção intraóssea (Figura 1A). O tamanho médio das partículas das nanopartículas foi de cerca de 202,9 nm, o potencial foi de 2,77 mV e o PDI foi de 0,22 (Figura 1B). A Figura 1C mostra a forma da superfície das nanopartículas observadas como esféricas por microscopia eletrônica. A Figura 1D mostra o mapa de plasmídeo do vetor ABE e o mapa de plasmídeo do vetor gRNA.
A transdução de plasmídeo foi observada em microscópio de fluorescência. A Figura 2A mostra células normais da medula óssea. Após 7 dias de transferência de plasmídeo para o camundongo, as células da medula óssea do camundongo foram observadas em microscópio de fluorescência. Em comparação com o grupo controle, a eficiência de transfecção do grupo de transfecção de quitosana foi significativamente melhorada (Figura 2B). Isso indica que a quitosana como material de incorporação pode melhorar a eficiência do plasmídeo de transdução in vitro.
Após 7 dias de entrega nos camundongos, o plasmídeo foi totalmente expresso. Células da medula óssea de camundongos foram extraídas e a eficiência de transfecção das células da medula óssea foi detectada por citometria de fluxo. Os resultados mostraram que a eficiência de transfecção das células transfectadas diretamente com o plasmídeo ABE foi de 0,92% ± 0,02%. A eficiência de transfecção de células da medula óssea transfectadas com 2 μg de ABE revestidas com quitosana foi de 40,80% ± 4,31%, a de células da medula óssea transfectadas com 3 μg de ABE revestidas com quitosana foi de 47,20% ± 5,37%, a de células da medula óssea transfectadas com 4 μg de ABE revestidas com quitosana foi de 51,20% ± 2,02% e a de células da medula óssea transfectadas com 5 μg de ABE revestidas com quitosana foi de 48,2% ± 7,39% (Figura 3B). A eficiência do grupo de transfecção de quitosana foi maior do que a do grupo controle (Figura 3A). Os resultados da citometria de fluxo mostraram que o plasmídeo transduzido pode ser expresso de forma estável e eficiente em camundongos usando o método descrito neste artigo. Do ponto de vista da eficiência de expressão abrangente e economia de material, o esquema de transdução única de plasmídeo de 3 μg pode ser selecionado.
Extraímos DNA genômico de células da medula óssea e amplificamos o gene alvo por PCR. Após o sequenciamento de Sanger, a eficiência de edição in vivo em A1 foi de 14,27% ± 0,35%, e em A2 foi de 10,69% ± 0,30% (Figura 4).
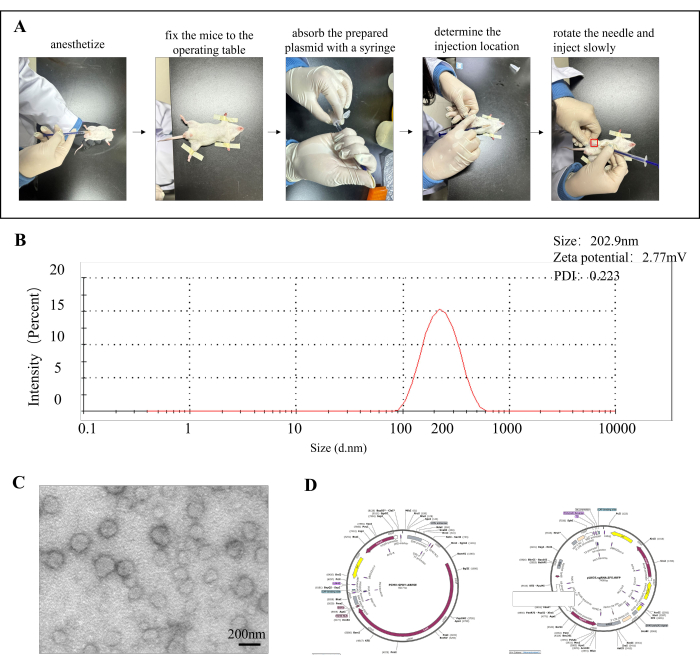
Figura 1: Fluxograma de injeção óssea, caracterização de nanopartículas e mapa vetorial de plasmídeo. (A) Procedimento para injeção intraóssea. (B) Tamanho de partícula, potencial Zeta e PDI de nanopartículas formadas por plasmídeos ABE embebidos com quitosana. (C) Imagem microscópica eletrônica de nanopartículas. (D) O lado esquerdo mostra o mapa do plasmídeo vetorial ABE e o lado direito mostra o mapa do plasmídeo vetorial gRNA. Clique aqui para ver uma versão maior desta figura.
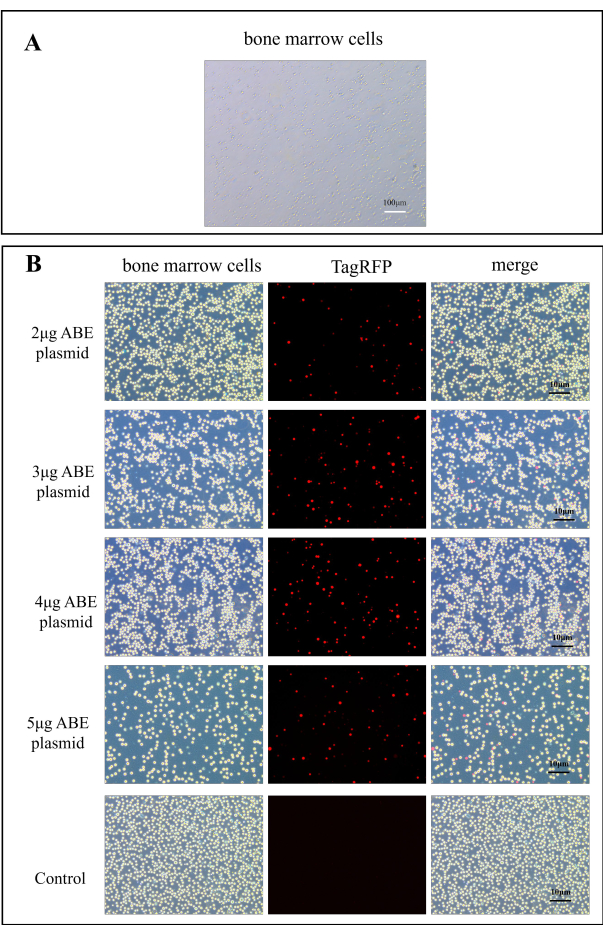
Figura 2: Imagens de fluorescência para eficiência de transfecção de plasmídeo ABE. (A) Imagem A100x de células da medula óssea. (B) Os mapas de fluorescência das células da medula óssea no grupo de transfecção de quitosana foram obtidos 7 dias após a transfecção de 2 μg, 3 μg, 4 μg e 5 μg de plasmídeo ABE, em comparação com os do grupo controle após injeção direta de plasmídeo ABE Clique aqui para ver uma versão maior desta figura.
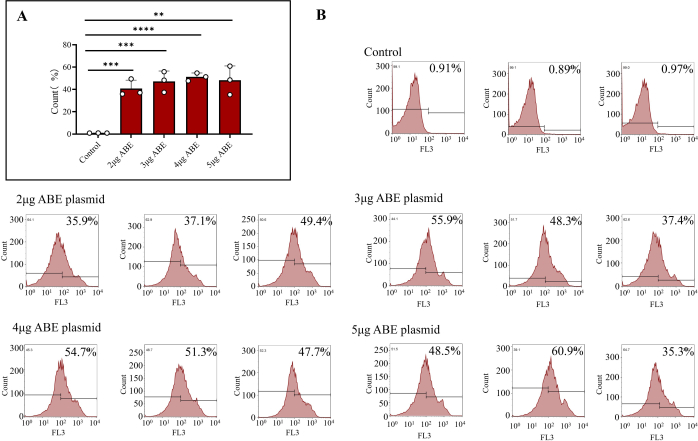
Figura 3: Resultados da citometria de fluxo de células transfectadas da medula óssea. (A) Células da medula óssea tratadas com citometria de fluxo transfectadas com plasmídeos ABE de 2 μg, 3 μg, 4 μg e 5 μg (grupo de transfecção de quitosana) e injetadas diretamente (grupo controle). Os resultados mostraram que a eficiência de transfecção das células da medula óssea injetadas diretamente com plasmídeos ABE foi baixa, enquanto a eficiência de transfecção e o efeito de transfecção dos outros quatro grupos foram maiores. (B) Os resultados da citometria de fluxo incluem a eficiência de transfecção do grupo controle e diferentes proporções de plasmídeo ABE. Clique aqui para ver uma versão maior desta figura.
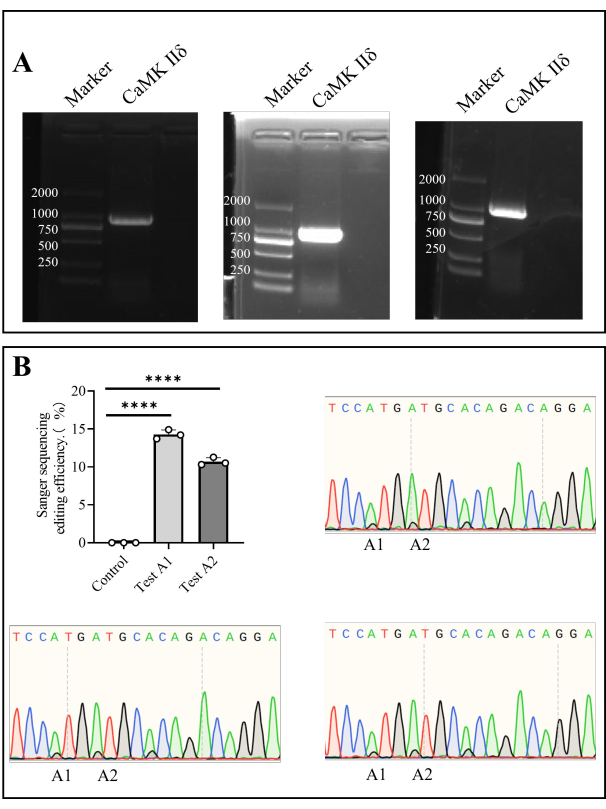
Figura 4: Sequenciamento de Sanger de Camk II δ eficiência de edição em camundongos. (A) Detecção por eletroforese em gel de agarose de Camk II δ. (B) O gráfico de barras mostra a análise do resultado do sequenciamento de Sanger da eficiência de edição do δ Camk II em camundongos, e os diagramas de sequenciamento de Sanger mostram os resultados do sequenciamento. Clique aqui para ver uma versão maior desta figura.
| Reagentes | Concentração utilizada |
| Ácido etilenodiaminotetracético | 1.142 mL |
| Ácido acético glacial | 2 mL |
| Tris | 4,84 gramas |
Tabela 1: Reagentes para preparar 1X tampão TAE
| Reagente | Volume |
| Ágar | 7,5 gramas |
| AMP | Adicionar 500 μL quando esterilizado e arrefecido a 70 °C |
| ddH2O | Até 500 μL |
| Cloreto de sódio | 5 g |
| triptona | 5 g |
| Extrato de levedura | 2,5 gramas |
Tabela 2: Reagentes para preparação de meio sólido LB.
| Reagente | Volume |
| ddH2O | Até 1 L |
| peptona | 10 gramas |
| Cloreto de sódio | 10 gramas |
| Extrato de levedura | 5 g |
Tabela 3: Reagentes para preparação de meio líquido LB.
| Reagente | Volume |
| DMEM | 450 mL |
| Soro fetal bovino | 5 ml |
| MEM | 5 ml |
| Penicilina/estreptomicina | 5 ml |
| β-mercaptoetanol | 500 μL |
Quadro 4: Reagentes para a preparação de meio DMEM contendo soro.
Discussão
Para a pesquisa biomédica, o desafio de fornecer plasmídeos exógenos aos animais envolve melhorar a eficiência da entrega e da expressão gênica, ao mesmo tempo em que minimiza os danos aos animais para alcançar o efeito terapêutico desejado15,16. Apresentamos um novo método de injeção intraóssea de entrega de plasmídeo ABE mediado por quitosana nas células da medula óssea de camundongos receptores. Essa estratégia melhora a eficiência da entrega de plasmídeos e a expressão gênica.
Primeiro, neste estudo, a quitosana, oferecida como um sistema de vetor não viral, foi usada como método de entrega de plasmídeo. Uma vez que foi demonstrado que a eficiência de transfecção do método convencional é relativamente baixa, a introdução de plasmídeos para expressão gênica de longo prazo pode ser afetada pelo sistema imunológico17,18. A quitosana, um polissacarídeo natural, é conhecida por sua excelente biocompatibilidade, capacidade de encapsulamento de plasmídeo e baixa toxicidade. O uso da quitosana como veículo de entrega ajuda a prevenir possíveis efeitos relacionados ao sistema imunológico durante a expressão a longo prazo do plasmídeo exógeno, ao mesmo tempo em que aumenta a eficiência da transferência de plasmídeo 19,20,21. Para pesquisas futuras, reconhecemos a importância de avaliar a toxicidade e os potenciais efeitos na medula óssea das nanopartículas de quitosana quando administradas por injeção intraóssea. Planejamos incorporar esses aspectos em nosso futuro projeto experimental, incluindo a realização de avaliações abrangentes de toxicidade e análises histopatológicas. Isso envolverá a avaliação de vários parâmetros, como viabilidade celular, respostas inflamatórias e morfologia da medula óssea em diferentes pontos de tempo e níveis de dose. Além disso, consideraremos o uso de técnicas avançadas de imagem e métodos de biologia molecular para obter uma compreensão mais profunda do perfil de segurança e dos possíveis impactos na saúde da medula óssea após o tratamento com nanopartículas de quitosana.
Em segundo lugar, o ABE é selecionado como um editor de genes que pode converter nucleotídeos de adenina em nucleotídeos de guanina sem introduzir quebras de DNA de fita dupla. Comparado ao CRISPR/Cas9, o ABE oferece maior precisão corrigindo diretamente uma única base sem induzir quebras de fita dupla, reduzindo assim os efeitos fora do alvo e os danos potenciais. No entanto, ao projetar o gRNA alvo, é necessária uma consideração cuidadosa para evitar a ligação não específica e reduzir os efeitos fora do alvo22. Implementamos medidas para reduzir o risco, mas a prevenção completa continua sendo um desafio e precisa de mais pesquisas.
Em terceiro lugar, para entrega in vivo, desenvolvemos uma estratégia de injeção intraóssea. A injeção intraóssea é um método seguro e eficaz, como foi relatado na revisão do sistema por Betzler et al.23. O gene alvo neste estudo é o Camk II δ, que desempenha um papel fundamental na regulação da diferenciação dos osteoclastos13,14. Em comparação com o método convencional de injeção da veia da cauda, a injeção intraóssea pode entregar o plasmídeo de δ Camk II direcionado direta e eficientemente nos osteoclastos, alcançando assim a alta eficiência de edição in vivo de 14,27% no locus A1, enquanto 10,69% no locus A2 em camundongos receptores.
Além disso, deve-se notar que a injeção intraóssea é uma operação que requer atenção especial. Assim, antes do experimento, usamos corante azul como prática para monitorar se a injeção é injetada corretamente na cavidade da medula óssea dos camundongos. Além disso, devido à possibilidade de que os camundongos receptores possam sofrer com os danos causados pela injeção intraóssea, recomenda-se escolher camundongos com peso de cerca de 30 g. Enfatizamos a importância de várias etapas importantes no procedimento de injeção intraóssea: evitar a administração de uma quantidade excessiva de anestésico, garantir uma desinfecção completa antes e depois da injeção para evitar infecções e girar a agulha para evitar bloqueios causados pela medula óssea. Se bloqueado, evite forçar o fluido na cavidade da medula óssea do camundongo, o que pode levar à morte do camundongo. O plasmídeo deve ser injetado lentamente e é crucial monitorar a condição dos camundongos após a injeção para garantir que não ocorram fatalidades devido à manipulação inadequada. Embora tenhamos especificado que os camundongos pesam 30 g para uma injeção intraóssea bem-sucedida. Em ambientes clínicos, a variabilidade específica do paciente deve ser considerada, e nossos estudos futuros, como otimizar técnicas de injeção para diferentes faixas de peso e explorar métodos alternativos de administração, estão em andamento.
Este método pode ser amplamente utilizado na edição de células derivadas da medula óssea, incluindo osteoblastos, células eritróides, linfócitos, células hematopoiéticas, etc. A alta precisão e eficiência do método permitem que os pesquisadores o usem não apenas para doenças causadas pela função anormal dos osteoclastos, mas também no campo da terapia gênica para outras doenças do sangue. Por exemplo, doenças comuns do sangue também podem estar bem alinhadas com nossos métodos de tratamento. As doenças do sangue causadas por mutações de base única24 podem ser tratadas com editores de genes ABE, e a injeção intraóssea também pode fornecer plasmídeos diretamente às células-tronco hematopoiéticas, obtendo assim melhores efeitos terapêuticos. No entanto, o método apresenta limitações em sua aplicação para os processos de edição e entrega de tipos celulares de origem não óssea, como células musculares e adiposas.
Divulgações
Os autores declaram não haver interesses conflitantes.
Agradecimentos
Este trabalho foi financiado pela Fundação de Ciências Naturais da Província de Anhui (2208085MC74, 2208085MC51) e pela Fundação de Pesquisa Científica do Departamento de Educação da Província de Anhui, China (KJ2021A0055).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.2 ml PCR Tubes, Flat cap | LABSELECT | PT-02-C | |
| 1 mL syringe | Anhui Jiangnan medical equipment Co., LTD | / | |
| 1% Pentobarbital sodium | / | / | |
| 1.5 ml Microcentrifuge Tubes | LABSELECT | MCT-001-150 | |
| 10 × DNA Loading Buffer | Vazyme | P022-01 | |
| 10X T4 DNA Ligase Buffer 1 ml | TaKaRa Biotechnology(Dalian)Co.,LTD | 2011A | |
| 1250 μl Pipette Tip 102.1mm | LABSELECT | T-001-1250 | |
| 200 μl Pipette Tips 50.55mm | LABSELECT | T-001-200 | |
| 2x Phanta Max Buffera | Vazyme | P505-d1 | |
| 4 ? centrifuge | Thermo Fisher | 75002425 | |
| 50 ml Centrifuge tube | LABSELECT | T-012-50 | |
| 6-well Cell Culture Plates | LABSELECT | 11110 | |
| Agar | Sangon Biotech | A505255-0250 | |
| Amp | Abiowell | / | |
| Chitosan | Sangon Biotech | A600614-0500 | |
| Constant temperature culture shaker | Shanghai Zhicheng Analytical Instrument Manufacturing Co., LTD | ZWY-200D | |
| Countess Automated Cell Counter | Thermo Fisher Scientific | Countess II/II FL | |
| Countess Cell Counting Chamber Slides and Holder, disposable | Thermo Fisher Scientific | C10228 | |
| CutSmart Buffer | New England Biolabs | B7204SVIAL | |
| DH5α | General Biosystems | CS01010 | |
| DMEM | gibco | C11995500BT | |
| dNTP Mix | Vazyme | P505-d1 | |
| Esp3I enzyme | NEBiolabs | R0734S | |
| Ethylenediaminetetraacetic acid | VETEC (sigma-aldrich) | V900106 | |
| Fetal bovine serum | OriCell | FBSAD-01011-500 | |
| Flow cytometer | BD FACSCalibur | 342975 | |
| Flow tube | Beyotime Biotechnology | FFC005-1bag | |
| Fluorescence microscope | Leica | 427019 | |
| gel maxi purification kit | TIANGEN | DP210 | |
| Genomic DNA extraction kit | TIANGEN | DP304 | |
| Glacial acetic acid | China National Pharmaceutical Group Corporation | 10000218 | |
| GoldBand DL2,000 DNA Marker | YESEN | 10501ES60 | |
| Ice machine | shanghaizhengqiao | BNS-30 | laboratory reserved |
| ImunoSep Buffer | Precision Biomedicals Co.,LTD | 604050 | |
| Megafuge 8 Small Benchtop Centrifuge Series | Thermo Fisher Scientific | 75004250 | |
| MEM | Life Technology | 11140050 | |
| NanoDrop 2000 | Thermo Fisher Scientific, USA | ||
| NaOH | SIGAM | S5881-500G | |
| PBS | XiGene | XG3650 | |
| PCMV-SPRY-ABE8E vector | / | / | |
| pcr amplification apparatus | Thermo Fisher | AKC96300441 | |
| Penicillin/Streptomycin | Solarbio | P1400 | |
| peptone | Sangon Biotech | A505247-0500 | |
| Phanta Max Super-Fidelity DNA Polymerase | Vazyme | P505-d1 | |
| Red cell lysate | Beyotime | C3702 | |
| Sodium chloride | China National Pharmaceutical Group Corporation | 10019318 | |
| Sodium sulfate | aladdin | S433911 | |
| T-001-10 10μl Pipette Tips 31.65mm | LABSELECT | T-001-10 | |
| T4 DNA Ligase | TaKaRa Biotechnology(Dalian)Co.,LTD | 2011A | |
| Tris | BioFroxx | 1115KG001 | |
| tryptone | Sangon Biotech | A505250-0500 | |
| vortex mixer | sigma | Z258423 | |
| Water bath | shanghaiyiheng | DK-80 | |
| YeaRed Nucleic Acid Gel Stain | YESEN | 10203ES76 | |
| Yeast extract | BBI | A610961-0500 | |
| Zetasizer Nano | Malvern Panalytical | Zetasizer Nano ZS | |
| β-mercaptoethanol | Sigma | 444203 |
Referências
- Ikawa, Y., et al. Gene therapy of hemoglobinopathies: Progress and future challenges. Hum Mol Genet. 28 (R1), R24-R30 (2019).
- Ginn, S. L., Mandwie, M., Alexander, I. E., Edelstein, M., Abedi, M. R. Gene therapy clinical trials worldwide to 2023-an update. J Gene Med. 26 (8), e3721(2024).
- Chen, J., Wang, K., Wu, J., Tian, H., Chen, X. Polycations for gene delivery: Dilemmas and solutions. Bioconjug Chem. 30 (2), 338-349 (2019).
- Tong, H., et al. Progress and prospects of chitosan and its derivatives as non-viral gene vectors in gene therapy. Curr Gene Ther. 9 (6), 495-502 (2009).
- Alizadeh, L., Zarebkohan, A., Salehi, R., Ajjoolabady, A., Rahmati-Yamchi, M. Chitosan-based nanotherapeutics for ovarian cancer treatment. J Drug Target. 27 (8), 839-852 (2019).
- Dimassi, S., Tabary, N., Chai, F., Blanchemain, N., Martel, B. Sulfonated and sulfated chitosan derivatives for biomedical applications: A review. Carbohydr Polym. 202, 382-396 (2018).
- Maity, S., Mukhopadhyay, P., Kundu, P. P., Chakraborti, A. S. Alginate coated chitosan core-shell nanoparticles for efficient oral delivery of naringenin in diabetic animals-an in vitro and in vivo approach. Carbohydr Polym. 170, 124-132 (2017).
- Abnoos, M., et al. Chitosan-alginate nano-carrier for transdermal delivery of pirfenidone in idiopathic pulmonary fibrosis. Int J Biol Macromol. 118 (Pt A), 1319-1325 (2018).
- Lee, H. K., Smith, H. E., Liu, C., Willi, M., Hennighausen, L. Cytosine base editor 4 but not adenine base editor generates off-target mutations in mouse embryos. Commun Biol. 3 (1), 19(2020).
- Lee, S. N., Jang, H. S., Woo, J. S. Heterologous expression and purification of a CRISPR-cas9-based adenine base editor. Methods Mol Biol. 2606, 123-133 (2023).
- Tang, J., Lee, T., Sun, T. Single-nucleotide editing: From principle, optimization to application. Hum Mutat. 40 (12), 2171-2183 (2019).
- Newby, G. A., et al. Base editing of hematopoietic stem cells rescues sickle cell disease in mice. Nature. 595 (7866), 295-302 (2021).
- Lu, D. Z., et al. Camkii(δ) regulates osteoclastogenesis through erk, jnk, and p38 mapks and creb signalling pathway. Mol Cell Endocrinol. 508, 110791(2020).
- Sato, K., et al. Regulation of osteoclast differentiation and function by the camk-creb pathway. Nat Med. 12 (12), 1410-1416 (2006).
- Li, X., et al. Viral vector-based gene therapy. Int J Mol Sci. 24 (9), 7736(2023).
- Gonçalves, G. A. R., Paiva, R. M. A. Gene therapy: Advances, challenges and perspectives. Einstein. 15 (3), 369-375 (2017).
- Mingozzi, F., High, K. A. Immune responses to AAV in clinical trials. Curr Gene Ther. 11 (4), 321-330 (2011).
- Mingozzi, F., et al. Cd8(+) t-cell responses to adeno-associated virus capsid in humans. Nat Med. 13 (4), 419-422 (2007).
- Dong, L., Li, Y., Cong, H., Yu, B., Shen, Y. A review of chitosan in gene therapy: Developments and challenges. Carbohydr Polym. 324, 121562(2024).
- Rizeq, B. R., Younes, N. N., Rasool, K., Nasrallah, G. K. Synthesis, bioapplications, and toxicity evaluation of chitosan-based nanoparticles. Int J Mol Sci. 20 (22), 5776(2019).
- Mansouri, S., et al. Chitosan-DNA nanoparticles as non-viral vectors in gene therapy: Strategies to improve transfection efficacy. Eur J Pharm Biopharm. 57 (1), 1-8 (2004).
- Zhou, C., et al. Off-target rna mutation induced by DNA base editing and its elimination by mutagenesis. Nature. 571 (7764), 275-278 (2019).
- Betzler, B. K., Chee, Y. J. Bin Abd Razak, H.R. Intraosseous injections are safe and effective in knee osteoarthritis: A systematic review. Arthrosc Sports Med Rehabil. 3 (5), e1557-e1567 (2021).
- Lin, Y. W., Aplan, P. D. Leukemic transformation. Cancer Biol Ther. 3 (1), 13-20 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados