Method Article
간 종양에 대한 Silk Thread Guided Laparoscopic Segmentectomy를 사용한 3차원 위치 접근법
요약
간 절제술을 위한 수술 전 계획에서 3D 재건 및 가상 시뮬레이션을 활용한 것은 외과 종양학의 중요한 발전을 나타냅니다. 우리 팀의 3D-LAST(명주실을 사용한 3차원 위치 접근) 기술은 실용적인 수술 중 탐색을 통해 안전하고 효율적이며 정확한 종양 제거를 가능하게 하여 광범위한 의료 채택을 약속합니다.
초록
간 종양을 치료하기 위해 간절제술을 시행할 때는 절제 가장자리를 정확하게 측정하고 잔류 간 실질의 적절성을 확인하는 것이 가장 중요합니다. 현재 수술 중 초음파 및 인도시아닌 녹색 형광 항법 방법이 자주 활용되고 있습니다. 그러나 특정 기술적 제약으로 인해 광범위한 적용이 불가능합니다. 정확한 간종양 절제를 위해 3D-LAST 기법을 개발했습니다. 이 기술은 컴퓨터 후처리를 사용하여 컴퓨터 단층 촬영(CT) 스캔에서 특징을 추출하고 체적 이미지를 생성하여 3차원(3D) 시각화를 생성합니다. 이는 복잡한 내부 해부학적 구조를 직관적이고 입체적인 방식으로 생생하게 표시할 수 있으므로 임상 의사 결정에 귀중한 리소스를 제공합니다. 이 연구에서는 단일 간 종양이 있는 환자를 대상으로 수술 전 3D 포지셔닝을 수행하여 해부학적 랜드마크를 식별하고 절제 범위를 계산했습니다. 수술 과정에서 수술 전 3D 소프트웨어로 계산한 길이의 가장자리 선을 설정하고 명주실을 사용하여 가장자리를 표시했습니다. 이 접근 방식은 최적의 절단 평면을 결정할 수 있는 시간을 절약하고 정확한 방법을 제공합니다. 이 기사의 목적은 간 종양에 대한 복강경 분절 절제술에 3D-LAST를 적용할 수 있는 실행 가능성을 입증하는 것입니다. 연구 결과는 3D-LAST가 수술 중 간 탐색을 위한 안전하고 효과적이며 실용적인 새로운 방법이며 광범위한 홍보에 큰 잠재력을 가지고 있음을 나타냅니다.
서문
간절제술은 간 종양의 초석 치료법으로 남아 있습니다. 최근 수십 년 동안 수술 접근법은 수술 중 초음파(IOUS) 및 인도시아닌 그린(ICG) 형광 이미징과 같은 보조 기술의 발전에 힘입어 불규칙 절제에서 정확한 해부학적 절제로 발전했습니다 1,2. 이러한 혁신에도 불구하고 충분한 기능적 간 용적을 유지하면서 최적의 절제 마진을 달성하는 것은 여전히 중요한 과제로 남아 있습니다. 우리가 제안한 3D-LAST(명주실을 사용한 3차원 위치 접근법) 기술의 전반적인 목표는 간 종양 절제술을 위한 정확하고 비용 효율적이며 보편적으로 접근 가능한 수술 중 탐색 방법을 제공하여 특수 장비에 대한 의존도를 최소화하는 동시에 공간 정확도를 개선하는 것입니다.
3D-LAST를 개발하게 된 이유는 현행 기술의 한계에 기인한다. IOU는 실시간 종양 위치 파악에 유용하지만 이미지 해석을 위해 숙련된 초음파 검사자가 필요하고 2차원(2D) 공간 시각화에 어려움을 겪어 종종 수술 시간이 연장됩니다 3,4. ICG 형광 항법은 표재성 종양에 효과적이지만 조직 침투 깊이(5-10mm)가 제한되어 있어 더 깊은 병변에 대해서는 신뢰할 수 없습니다 5,6. 두 방법 모두 비용이 많이 들고 특수한 하드웨어에 의존하기 때문에 리소스가 제한된 환경에서는 채택이 제한됩니다.
기존 기술에 비해 3D-LAST의 장점은 다방면에 걸쳐 있습니다. 수술 전 컴퓨터 단층 촬영(CT) 재구성에서 파생된 3차원 시각화는 입체 해부학적 지침을 제공하여 2D 이미징의 공간적 모호성을 극복합니다. 깊이 분해능이 없는 ICG와 달리 3D-LAST는 정확한 체적 절제 계획을 가능하게 하여 포지티브 마진이나 과도한 실질 손실의 위험을 줄입니다. 또한 수술 중 마킹을 위해 실크 실을 사용하면 실시간 이미징 장치의 필요성이 없어 작업 흐름이 간소화되고 비용이 절감됩니다.
3D-LAST는 고급 이미징 인프라나 복잡한 수술 중 탐색에 대한 전문 지식이 부족한 센터에 특히 적합합니다. 수술 전 CT에서 해부학적 랜드마크를 식별할 수 있고 절차적 복잡성을 최소화하는 것이 우선시되는 단일 종양 절제술에 이상적입니다. 3D-LAST는 현재 방법의 한계를 해결하고 검증된 3D 기술을 활용함으로써 광범위한 임상적 적응성을 갖춘 정밀 간 수술을 달성하는 데 있어 실용적인 발전을 나타냅니다.
사례 발표:
상복부에 불편함을 느낀 59세 남성이 우측 간에 2.7cm x 1.6cm의 간 종양이 있다는 진단을 받았습니다. 환자는 이전에 위 선암 진단을 받았고 위암으로 근치적 위절제술을 받은 후 정기적인 화학 요법을 받았습니다. 수술 전 조영제 강화 CT 스캔에서 간외 전이는 발견되지 않았다. CA19-9, CA15-3, CA72-4, AFP 및 CEA는 정상이었다.
프로토콜
이 연구는 쓰촨성 대학의 중국 서부 병원 검토 위원회의 승인을 받았습니다. 수술 전에 환자로부터 사전 동의를 받았습니다.
1. 수술 전 준비
- DICOM 형식으로 환자 간의 고해상도 CT 스캔을 얻을 수 있습니다(그림 1A).
- Mimics 소프트웨어를 실행하고, 새 프로젝트를 생성하고, DICOM 파일을 가져와서 모든 이미지 데이터가 3D 재구성 및 분석을 위해 올바르게 로드되었는지 확인합니다.
- 간, 혈관 및 종양의 3차원 구조를 재구성합니다. 간은 분홍색, 문맥은 파란색, 동맥은 빨간색, 간정맥 및 하대정맥은 파란색, 종양은 노란색으로 표시합니다(그림 1B).
- 3D 간 모델에 3개의 작은 가상 스틱을 놓고 간 표면에 4개의 핵심 점(S1, S2, S3, S4)을 얻습니다(그림 2A-B).
- 이러한 가상 스틱은 디지털 랜드마크 역할을 하여 외과의가 의도한 절단의 정확한 위치와 방향을 결정할 수 있도록 안내합니다. 절제점의 가상 스틱 마킹을 종양 가장자리에서 1cm 떨어진 곳에 놓고 담낭 하단의 간 가장자리 중간 지점을 배치합니다.
참고: 이러한 요점을 표시함으로써 외과의는 수술 중 목표 부위에 집중하여 불필요한 조직 손상의 위험을 최소화할 수 있습니다.
- 이러한 가상 스틱은 디지털 랜드마크 역할을 하여 외과의가 의도한 절단의 정확한 위치와 방향을 결정할 수 있도록 안내합니다. 절제점의 가상 스틱 마킹을 종양 가장자리에서 1cm 떨어진 곳에 놓고 담낭 하단의 간 가장자리 중간 지점을 배치합니다.
- 그림 2C-D와 같이 4개의 핵심 점을 간 표면의 선으로 연결하고 길이를 측정합니다(S1-S2 = 9.8cm, S1-S3 = 7.2cm, S2-S3 = 10.4cm, S4-S2 = 8.2cm, S4-S3 = 6.5cm). 이 선은 제안된 절제 경로를 나타내며, 외과의가 절제 후 간의 모양과 윤곽을 시각화하는 데 도움이 됩니다.
- 정확성과 일관성을 보장하기 위해 각 선의 길이를 꼼꼼하게 측정합니다. 이 측정은 외과의가 정확히 같은 길이의 명주실을 준비할 수 있게 해주기 때문에 매우 중요하며, 이 실은 수술 중 간 절개를 안내하는 데 사용됩니다.
2. 수술 절차
- 환자를 다리를 벌리고 오른쪽으로 기울어지게 누운 자세로 놓습니다(그림 3A). 기관 삽관 및 통제된 인공호흡을 포함한 표준 전신 마취를 시행합니다.
- 0.5% 요오드 기반 스크럽으로 젖꼭지 간 연결, 치골 심포, 오른쪽 중간 겨드랑이 및 왼쪽 중간 쇄골 라인 부위에 3x 피부를 소독합니다.
- 오른쪽에는 외과의가, 왼쪽에는 보조원이 있는 수술 팀을 구성합니다. 카메라를 투관침 사이트 중앙의 중앙에 배치하고 카메라 홀더도 중앙에 배치합니다.
- 복강경 구멍(H1)으로 배꼽 아래 12mm를 절개하고, 12mm 및 5mm 곡선 절개(H2 및 H3)를 주 수술 구멍으로, 12mm 및 5mm 절개(H4 및 H5)를 보조 수술 구멍으로 만듭니다(그림 3B).
- 그림 3B와 같이 절개 부위에 5개의 투관침(12mm, 12mm, 12mm, 5mm, 5mm)을 삽입합니다. 폐복막 시스템을 켜고 투관침을 통해 100% 이산화탄소 가스를 주입하여 폐복막을 약 12mmHg의 압력으로 유지합니다.
- 왼쪽 상복부에서 시작하여 오른쪽으로 아래쪽 위장까지 복강에 대한 탐색적 검사를 수행하여 복수, 간경변 및 전이의 존재 여부를 감지합니다.
- 복부 유착을 해제하고, 간의 둥근 인대를 분리하고, 오른쪽 간 인대와 유착을 해제하고, 초음파 칼을 사용하여 간 분절 V를 완전히 노출시킵니다.
- 초음파 칼을 사용하여 담낭 삼각형을 절개하여 담낭관과 동맥을 드러냅니다. 그런 다음 담낭을 절제하기 전에 작은 혈구 잠금 클립으로 이러한 구조를 접합합니다.
- 길이가 S1-S2 = 9.8cm, S1-S3 = 7.2cm, S2-S3 = 10.4cm 인 3 개의 명주실을 준비합니다. 포인트 S4는 담낭의 목에 위치하므로 S4-S2 = 8.2cm 및 S4-S3 = 6.5cm의 비단실을 준비하지 마십시오.
- 그림 4와 같이 수술 전에 계획된 절제 경로에 해당하는 간 표면의 해부학적 위치에 세 개의 실크 실을 놓습니다. 실크실을 물리적 가이드로 사용함으로써 외과의는 수술 중에 계획된 절제 경로를 보다 정밀하게 시각화하고 따라갈 수 있습니다.
참고: 이 단계는 가상 계획과 실제 수술 절차 사이의 격차를 해소합니다. - 전기 칼을 사용하여 간 표면의 명주실을 따라 마커를 절단하여 간을 소작하고(그림 4D) 견인을 위해 간에 고무 밴드를 꿰매십시오(그림 5A).
- 초음파 나이프를 사용하여 마커 라인을 따라 간 실질을 횡단합니다. home-o-lock 클리핑이 만나는 혈관을 절단하고, 흡인기로 혈액을 흡입하고, 양극성 겸자를 사용하여 출혈을 멈춥니다(그림 5B).
- 검체를 가방에 넣고 메스로 상복부를 4cm 절개하여 검체를 제거합니다. 복강에 활성 출혈이 없는지 확인하고, 간 절개 표면에 지혈 물질을 놓고 오른쪽 하복부에서 나오는 배액관 1개를 놓습니다.
- 투관침과 봉합사 절개를 3-0 흡수성 봉합사로 층별로 제거합니다. 종양 캡슐의 무결성을 확인하고 종양의 크기를 측정하기 위해 검체를 검사합니다(그림 5C-D).
3. 간절제술 후 관리
- 마취에서 성공적으로 회복된 후 환자를 병동으로 옮기고 수술 후 초기 24시간 회복 기간 동안 중단 없는 심장 모니터링을 사용하여 환자의 활력 징후를 관찰합니다.
- 잠재적인 패혈성 합병증을 줄이기 위해수술 후 1 일 내내 정맥 주입으로 예방적 항균 요법을 시행합니다.
- 시술 후 24시간 이내에 요로 카테터 삽입을 제거합니다. 수술 후 72시간 후에 일반 컴퓨터 단층 촬영 스캔을 수행합니다(그림 6). 수술 후 4일 후에는 다량의 복수와 담즙 누출 없이 수술용 배액관을 배출합니다.
결과
총 수술 시간은 150분이었고, 50mL의 출혈은 수혈이 필요하지 않았습니다. 수술 중 소변량은 500mL, 수술 중 소변량은 800mL였다. 수술 후 1일 째 되는 날, 혈액 검사 결과에서 트랜스아미나제 수치가 약간 증가한 것으로 나타났습니다. 복부 CT 스캔에서 간 종양이 완전히 절제되었으며 수술 3일 후 유의미한 복수가 없었습니다. 배수관은 수술 후 4일째에 제거되었습니다. 환자는 수술 후 별다른 일 없이 경과를 보였고 수술 후 5일 째 되는 날에 퇴원했습니다. 수술 후 총 병리학적 표본에서 종양 크기가 1.5cm x 1.5cm임을 입증하여 표 1과 같이 R0 절제를 확인했습니다.
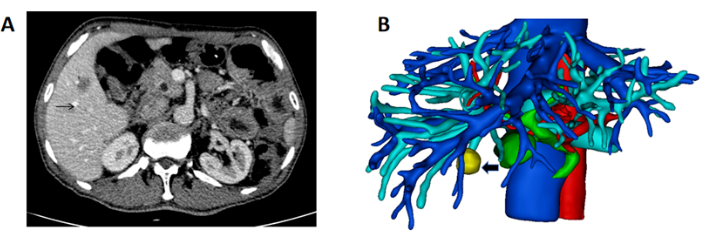
그림 1: 간 및 종괴의 종괴 및 3D 재건을 보여주는 CT. (A) 오른쪽 간에 위치한 종양을 보여주는 CT 스캔(종괴를 나타내는 검은색 화살표). (B) 간, 혈관 및 질량의 3D 재구성(질량을 나타내는 검은색 화살표). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
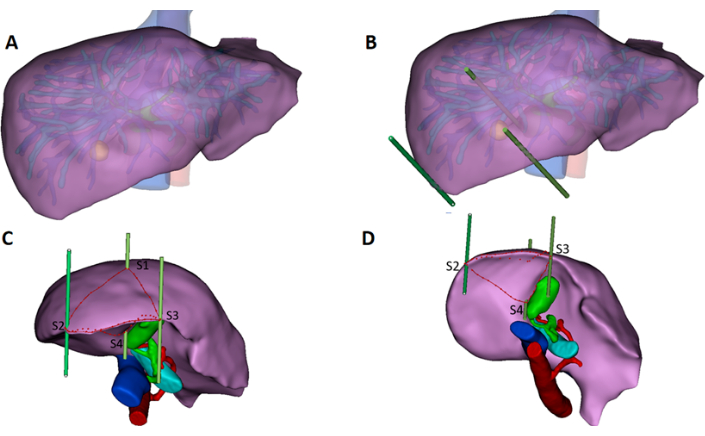
그림 2: 3D 모델에 절제선을 표시합니다. (A-D) 간내 관 구조와 종양을 3D로 재구성하고 절삭날의 핵심 지점(S1, S2, S3, S4)을 작은 막대기로 표시합니다. 가상 간 모델 표면의 요점을 따라 간 선을 그리고 각 선의 길이를 측정합니다(S1-S2 = 9.8cm, S1-S3 = 7.2cm, S2-S3 = 10.4cm, S4-S2 = 8.2cm, S4-S3 = 6.5cm). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 외과 의사, 환자 및 투관침 배치의 수술 중 레이아웃. (A) 수술 의사는 오른쪽에, 보조자는 왼쪽에, 카메라맨은 다리 사이에 있습니다. (B) 복강경 간 절제술 절차는 5포트 기술을 사용하여 수행됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
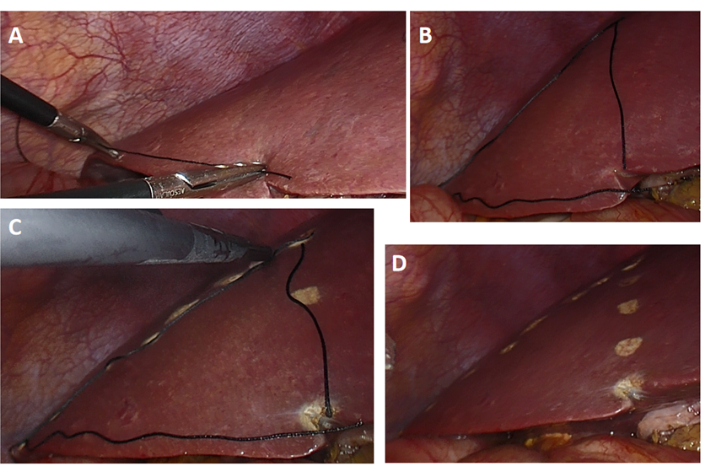
그림 4: 절제선을 표시하는 명주실. (A-D) 간 수술 중에는 명주실을 사용하여 절단면을 표시하고 같은 길이의 명사를 준비하여 간 표면의 해부학적 위치에 놓습니다. 명사로 둘러싸인 모양은 간의 절단선입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
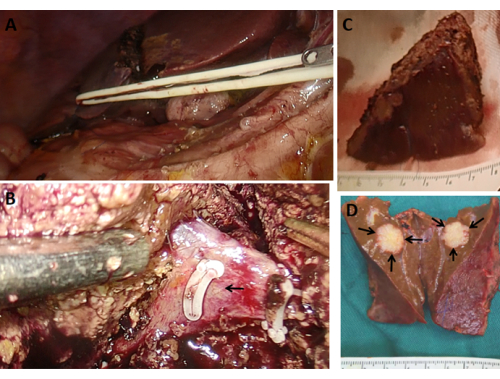
그림 5: 간 절제 및 표본. (A) 견인을 위해 간에 고무 밴드를 꿰매십시오. (B) 간 절제면(middle hepatic vein)에서 중간정맥(middle hepatic vein)을 노출시킨다(검은색 화살표는 중간정맥을 나타냄). (C-D) 간 종괴의 완전한 절제술(검은색 화살표), 종양 가장자리가 손상되지 않고 수술 전에 계획된 가장자리와 일치함을 보여주는 단면도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
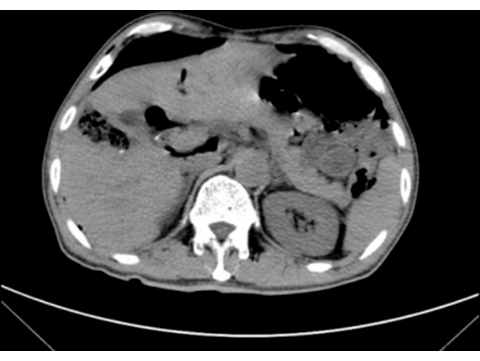
그림 6: 수술 후 CT 스캔. CT 스캔은 수술 후 3일째에 간주액 축적 없이 종양을 성공적으로 제거하는 것으로 나타났습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 매개 변수 | 결과 |
| 수술 기간 | 150분 |
| 출혈 | 50 밀리리터 |
| 수술 후 간 기능 | ALT 222 IU/L, AST 217 IU/L |
| 수술 후 CT 재검사 | 포드 3 |
| 배액관의 Rmovement | 포드 4 |
| 퇴원일 | 포드 5 |
| 종양 크기 | 1.5cm × 1.5cm |
| 병리학적 유형 | 선암종 |
표 1: 환자의 수술 결과. 약어: ALT = 알라닌 아미노전이효소; AST = 아스파르테이트 아미노전이효소; POD = 수술 후일.
토론
기술의 발전과 경험의 축적으로 복강경 간 절제술이 점점 더 보편화되고 있으며, 그 적응증은 개복 수술만큼이나 광범위합니다. 개복경 간 절제술은 개복술과 비교했을 때 통증이 적고, 수술 전후 합병증이 적으며, 회복이 빠르다는 등 많은 장점이 있다 7,8,9. 그러나 복강경 간 절제술은 몇 가지 본질적인 어려움에 직면해 있습니다. 촉각 및 깊이 인식의 부족, 제한된 작동 공간 및 제한된 시야는 광범위한 사용에 어려움을 초래합니다 10,11,12. 이러한 문제를 해결하기 위해 최근 몇 년 동안 IOUS 및 ICG 형광 이미징이 실시간 탐색 도구로 사용되었습니다. IOUS는 간 표면에 직접 적용하면 병변 감지 및 국소화의 정확도를 향상시킬 수 있습니다13,14.
그러나 일반적으로 초음파 검사자가 수술하기 때문에 외과의는 수술을 기다리기 위해 수술을 일시 중지해야 하는 경우가 많으며, 이는 수술 시간을 연장할 뿐만 아니라 초음파 기술에 대한 의존도를 높입니다. 또한, 간경화성 간에서 IOU는 재생 결절을 종양으로 잘못 해석하여 과잉 진단을 유발할 수 있습니다 15,16,17. 무해한 수용성 근적외선 형광제인 ICG는 특수 내시경을 통해 작업 중 해부학적 구조를 시각화하는 데 도움이 될 수 있습니다. 높은 감도와 선명한 대비로 인해 다양한 간 수술에서 외과적 탐색에 널리 사용되는 도구입니다. 그러나 근적외선(최대 10mm)의 조직 침투가 제한되어 있기 때문에 깊은 곳에 자리 잡은 간 병변을 감지하는 데 적용이 제한됩니다. 더욱이, ICG를 과도하게 투여하면 위양성 결과가 발생할 수 있으며, 종양 염색의 성공 여부는 혈액 공급, 간경변 및 괴사와 같은 요인과 관련이 있다 18,19,20. 따라서 뿌리 깊은 간 종양을 국소화하기 위한 혁신적이고 효율적이며 정확한 방법을 개발하는 것은 임상적으로 매우 중요합니다.
이 연구에서는 수술 전 3D 포지셔닝을 사용하여 해부학적 랜드마크를 식별하고 고립성 간 종양 환자의 절제 면적을 계산했습니다. 수술 중에는 수술 전 3D 소프트웨어로 계산한 길이의 마진선을 배치하고 가장자리를 표시하기 위해 명주실을 사용했습니다. 이 방법은 최적 절단면(21)을 탐색하기 위한 시간 효율적이고 정확한 방법을 제공한다. 본 연구의 수술 시간은 IOUS 및 ICG 유도 간절제술을 사용한 연구에서 보고된 것보다 훨씬 짧았습니다. 이 접근 방식은 IOUS에 대한 의존도를 줄여 수술 시간을 절약하고 기술 및 조건부 요구 사항을 낮춥니다. 종양의 크기와 깊이에 관계없이 다양한 간 종양 탐색 상황에 적용할 수 있습니다.
장점에도 불구하고 이 방법에는 한계가 있습니다. 첫째, 정확도는 수술 전 영상 품질에 달려 있습니다. 모션 아티팩트 또는 저해상도 스캔은 3D 모델의 충실도를 손상시킬 수 있습니다. 둘째, 이 기술은 정적 간 해부학적 구조를 가정하는 반면, 호흡 운동이나 외과적 조작은 종양의 위치를 이동할 수 있으므로 실시간 조정이 필요할 수 있습니다. 셋째, 3D 소프트웨어 작동 및 수술 중 공간 변환에 대한 학습 곡선으로 인해 전문 교육 없이는 수술에 채택하는 것이 제한될 수 있습니다. 또한, 본 연구의 표본 규모는 상대적으로 작으며, 이 방법의 효과를 더욱 검증하기 위해서는 향후 대규모 전향적 연구가 필요하다. 간단하고 광범위하게 적용할 수 있는 3D 재구성 프로그램을 개발하는 것도 향후 연구의 중요한 목표입니다.
공개
저자는 이해 상충이 없다고 보고합니다.
감사의 말
이 작업은 구이저우성 보건위원회 과학기술기금 프로젝트(gzwkj2025-300), 구이저우성 과학기술부 프로젝트(Qian Ke He Cheng Guo, LC[2024]109)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| BiClamp LAP | ERBE Company | No.20195-132 | |
| Laparoscopic system | Olympus | VISERA OTV-S400 | |
| Ultrasonic knife | Johnson and Johnson MedTech | ETHICON HARMONIC |
참고문헌
- Fan, S. T., et al. Continuous improvement of survival outcomes of resection of hepatocellular carcinoma: a 20-year experience. Ann Surg. 253 (5), 745-758 (2011).
- Torzilli, G., et al. "Radical but conservative" is the main goal for ultrasonography-guided liver resection: prospective validation of this approach. J Am Coll Surg. 201 (5), 517-528 (2005).
- Torzilli, G., et al. Contrast-enhanced intraoperative ultrasonography during surgery for hepatocellular carcinoma in liver cirrhosis: is it useful or useless? A prospective cohort study of our experience. Ann Surg Oncol. 14 (4), 1347-1355 (2007).
- Leen, E., et al. Potential value of contrast-enhanced intraoperative ultrasonography during partial hepatectomy for metastases: an essential investigation before resection. Ann Surg. 243 (2), 236-240 (2006).
- Ishizawa, T., et al. Real-time identification of liver cancers by using indocyanine green fluorescent imaging. Cancer. 115 (12), 2491-2504 (2009).
- Gotoh, K., et al. A novel image-guided surgery of hepatocellular carcinoma by indocyanine green fluorescence imaging navigation. J Surg Oncol. 100 (7), 75-79 (2009).
- Nguyen, K. T., Gamblin, T. C., Geller, D. A. World review of laparoscopic liver resection-2,804 patients. Ann Surg. 250 (5), 831-841 (2009).
- Abu Hilal, M., et al. The Southampton Consensus Guidelines for laparoscopic liver surgery: from indication to implementation. Ann Surg. 268 (1), 11-18 (2018).
- Ciria, R., Cherqui, D., Geller, D. A., Briceno, J., Wakabayashi, G. Comparative short-term benefits of laparoscopic liver resection: 9000 cases and climbing. Ann Surg. 263 (4), 761-777 (2016).
- Schneider, C., et al. Comparison of manual and semi-automatic registration in augmented reality image-guided liver surgery: a clinical feasibility study. Surg Endosc. 34 (10), 4702-4711 (2020).
- Lwin, T. Z., Sicklick, J. K., Hoffman, R. M., Bouvet, M. Fluorescence-guided laparoscopic hepatectomy. Ann Laparosc Endosc Surg. 1, 10(2016).
- Ziogas, I. A., Tsoulfas, G. Advances and challenges in laparoscopic surgery in the management of hepatocellular carcinoma. World J Gastrointest Surg. 9 (12), 233-245 (2017).
- Cai, X., et al. Does using indocyanine green fluorescence imaging for tumors help in determining the safe surgical margin in real-time navigation of laparoscopic hepatectomy? A retrospective study. Ann Surg Oncol. 30 (6), 1981-1987 (2023).
- Nishino, H., et al. Real-time navigation for liver surgery using projection mapping with indocyanine green fluorescence: development of the novel medical imaging projection system. Ann Surg. 267 (6), 1134-1140 (2018).
- Ishizawa, T., et al. Impact of intraoperative ultrasonography on surgical strategy and prognosis after hepatic resection for hepatocellular carcinoma. Ann Surg Oncol. 15 (13), 3665-3673 (2008).
- Solbiati, L., et al. Percutaneous sono-guided radio-frequency ablation of liver metastases: a multi-centre study. Eur Radiol. 11 (10), 1947-1954 (2001).
- Yang, T., et al. The role of intraoperative ultrasonography in laparoscopic liver resection for hepatocellular carcinoma: a propensity score-matched analysis. Surg Endosc. 34 (5), 2137-2144 (2020).
- van Manen, L., et al. A practical guide for the use of indocyanine green and methylene blue in fluorescence-guided abdominal surgery. J Surg Oncol. 118 (2), 283-300 (2018).
- Yoo, K. Y., et al. Intravenously administered indocyanine green may cause falsely high near-infrared cerebral oximetry readings. Anesthesiology. 120 (6), 1374-1379 (2014).
- Kimura, F., et al. Clinical impact of indocyanine green fluorescence imaging for liver tumor surgery: a single-center experience. Surgery. 161 (2), 475-481 (2017).
- Zhang, Z. H., Feng, Q. B., Jiang, C., Huang, J. W., Li, J. X. Three-dimensional location approach with silk thread guided hepatectomy for liver tumor. World J Gastroenterol. 31 (8), 10262(2025).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유