5.3 : 산과 염기: Ka, pKa 및 상대 강도
이 강의에서는 산과 염기의 상대적 강도에 대한 중요한 측면에 대해 알아봅니다. 산의 강도는 산이 물 속에서 짝염기와 하이드로늄 이온으로 해리되는 방식으로 평가됩니다. 강산의 완전한 해리는 매우 높은 농도의 하이드로늄 이온으로 확인됩니다. 결과적으로 불완전한 해리 과정은 약산을 확인합니다. 따라서 이러한 반응에서 평형은 강산의 경우 정방향이고 약산의 경우 역방향입니다.
따라서 산의 세기는 해리되지 않은 산 분자와 하이드로늄 이온의 농도로 정의됩니다. 약산은 평형상수(Keq)를 통해 추정할 수 있지만 묽은 용액에서는 일정하며 물 농도의 변화는 무시할 수 있습니다. 이러한 관찰은 산도 상수 또는 해리 상수 Ka로 알려진 수정된 평형 상수로 이어집니다. 산도의 척도인 산도 상수를 정의하려면 일반적인 산-염기 반응을 고려해 보세요.
Figure 1: 물에서 일반 산의 해리
여기서 HA는 일반 산을 나타내고 A-는 짝염기를 나타냅니다. 다음 식은 이 반응의 산도 상수를 나타냅니다.
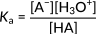
Figure 2: 일반적인 산 해리에 대한 산도 상수
이 관계는 분자의 하이드로늄 이온 농도에 중점을 둡니다. 따라서 이러한 이온이 증가하면 산도 상수가 증가하고 산이 강해집니다. 유기산에서는 일반적으로 Ka의 크기가 여러 차수에 걸쳐 분산되어 있습니다. 따라서 다양한 산의 강도는 Ka의 음의 로그로 계산된 pKa 값으로 표현됩니다.

Figure 3:: pKa
의 발현여기서 빼기 기호는 pKa 값과 산도 사이의 역관계를 나타냅니다. 벤조산 대 브롬화수소산으로 밝혀진 바와 같이 pKa 값이 높을수록 Ka 값이 낮고 이는 더 약한 산을 나타냅니다.
위의 원리를 확장하면 pKa 값으로 염기의 강도를 설정할 수도 있습니다. 염기의 해리는 짝산을 형성하기 때문에 더 강한 짝산은 더 약한 염기에 해당합니다. 예를 들어, 메탄올과 에틸아민을 생각해 보세요. pKa 값이 -3.8인 메탄올의 짝산은 pKa 값이 10.6인 에틸아민의 짝산보다 더 산성입니다. 따라서 메탄올은 에틸아민보다 약한 염기입니다.
Copyright © 2025 MyJoVE Corporation. 판권 소유






