Method Article
体積筋損失(VML)損傷の外科的作成後のラット咬筋のin vivo機能評価
要約
体積筋喪失(VML)損傷は内因性再生能力を超え、永続的な機能障害をもたらします。現在のVMLの研究は、主に手足と体幹の筋肉に焦点を当てています。VMLの機構研究を頭蓋顔面筋に拡張するために、この記事では、VML損傷前およびVML損傷後の咬筋機能の縦断的評価のための in vivo 法について説明します。
要約
体積筋の減少(VML)は、民間人や軍人に多く見られ、身体の自然な再生能力を超える衰弱性の骨格筋損傷を表しています。これらの損傷は、筋線維だけでなく、神経、血管、細胞外マトリックスも破壊し、骨格筋の再生能力を圧倒し、重度の線維化を引き起こし、筋肉の構造と機能に永続的な欠陥をもたらします。現在の臨床管理には多くの限界があるため、より効果的な治療アプローチを開発するための研究が進行中です。しかし、VML損傷に対する前臨床的な重点の多くは、四肢と体幹の筋肉に焦点を当てており、頭蓋顔面筋の研究は限られています。頭蓋顔面筋と四肢/体幹筋の発生生物学と再生能力の違いは、より損傷に特化したVML治療の選択肢を推進する重要な洞察を提供する可能性があります。さらに、機能回復の評価は、治療効果を確立するために重要です。この点で、経皮的神経刺激による筋収縮の in vivo 試験は、同じ動物での研究の過程で機能評価を繰り返すことを可能にする低侵襲の方法です。これらの考慮事項に照らして、この論文では、VML損傷の前後にラット咬筋の筋肉機能を in vivo で評価する方法について説明します。このプロトコルは、ラットにおける生物学的に関連する頭蓋顔面VML損傷の作成と機能評価を詳述した最初の公開された例です。
概要
基礎となる骨格筋が関与する軟部組織の外傷性および外科的損傷は、民間人と負傷した兵士の両方にとって、組織再建の最大の課題の1つであり続けています1。実際、戦場での負傷の約20%は、負傷した戦士の頭蓋顔面領域(頭と顔)にも発生しています2。包括的に、四肢の外傷と頭頸部の負傷は、最近の紛争における戦闘による負傷の>80%を占めています2。骨格筋が損傷後に修復、再生、および再構築する能力がかなりよく知られているにもかかわらず、筋肉組織のかなりの部分が失われるこれらのより深刻な損傷は、それ自体で治癒することができず、体積筋喪失(VML)損傷と呼ばれます。定義上、VMLは、損傷した筋肉または筋肉ユニット3のいずれかの永続的な審美的および機能的欠損をもたらします。
興味深いことに、頭蓋顔面VML損傷2,4の有病率にもかかわらず、これまでの研究の多くは四肢5,6,7,8と体幹9,10,11筋肉に焦点を当てており、頭蓋顔面筋12,13,14のVML損傷に関する報告はほんの一握りです.現存する文献は、頭蓋顔面と四肢および体幹の筋肉15,16との間に発生生物学と再生能力の両方に有意な違いがあることを示唆しているため、これは潜在的に重要なトランスレーショナルリサーチのギャップを示しています。実際、顔の両側には20以上の筋肉があり、これは頭蓋顔面領域がまばたき、飲み込み、咀嚼など、さまざまな重要なタスクの実行に関与しているという事実を反映しています15。さらに、頭蓋顔面筋の間でも、再生能力に関して違いが生じます。例えば、外眼筋は四肢の筋肉よりも急速に再生するように見える17。対照的に、咬筋は前脛骨筋(TA)18よりも遅い再生応答を示します。これらの違いは、少なくとも部分的には、筋肉の起源が分枝量体であるか体節由来であるかによるものであり、その結果、サテライト細胞の量が異なるだけでなく、常在するサテライト細胞集団の異なる遺伝子発現プロファイルも生じる19。頭蓋顔面筋のユニークな特徴、および四肢や体幹の筋肉に関連する特徴を考慮すると、筋肉特異的なVML損傷に対処するカスタマイズされた治療オプションの治療法開発を改善するための重要なメカニズムの洞察が得られる可能性があります。これらの筋肉特有の違いは、広背筋のようなシート状の筋肉の既知の限界を、頭頸部再建手術のためのドナー筋組織移植の選択肢として説明することもできるかもしれない20,21,22。
VML損傷の場所に関係なく、現在のところ、完全な形と機能を回復できる治療法はありません。ゴールドスタンダードの臨床管理には、自家組織移植とリハビリテーションが含まれます。しかし、前者は通常、筋力を改善しず、ドナー部位の罹患率3,23をもたらす可能性がありますが、後者は可動域を改善し、機能回復への影響や収縮強度の回復への影響を最小限に抑えます1,6。これらすべての理由から、VML損傷後の機能的な筋肉組織の再生のためのより効果的な治療アプローチを開発するための研究が進行中です。最近の分析では、VML損傷のラットモデルを用いた前臨床試験が、VML修復のための再生技術ソリューションを前進させる上で非常に重要であることが強調されました1。
先行研究5,8,9,10,24,25で述べたように、VML後の機能回復を評価することは、治療的介入の有効性を評価するために重要である。具体的には、創傷治癒と体積回復がVML修復の重要な特徴ですが、損傷と治療後の力回復を測定することで、VML欠損の原因となるマルチスケールの生体力学的メカニズムと、機能回復を促進するメカニズムに光を当てることができます。そのため、組織修復、体積回復、および筋力の向上の間のリンクを確立することは、VML修復のための最も効果的な再生ソリューションを特定するための絶対的な要件です9。
この点で、これらの機能測定を行うには、(1)in vitro、(2)in situ、(3)in vivo試験の3つの主要な方法があり、それぞれに長所と短所があります8。例えば、イン・ビトロ試験は、生体外で孤立した筋肉機能を調べることを含み、筋肉の興奮性と収縮に影響を与えるさまざまな薬物や化学物質を用いて、筋肉刺激をより直接的/特異的に操作する機会を提供する26。この方法は、筋肉機能と回復27の細胞的および分子的側面を詳細に調査することを可能にするが、血液供給と神経支配を取り除き、真の筋肉機能をどの程度うまく再現するかを制限する8,26。In situ試験では、筋肉がまだ自然な解剖学的位置にあるが、周囲の組織から分離されている間に筋肉の機能を評価する25,28。この方法では神経支配と血液供給が維持されますが、筋肉が分離されているため、所見のin vivo環境への適用性は依然として制限される可能性があります。さらに、そしておそらく最も重要なことは、in situ試験とin vitro試験の両方が、縦断的試験を排除する最終手順であり、これは同じ動物の経時的な機能回復を追跡するために必要です。対照的に、in vivo試験は、その本来の環境での筋肉機能の評価を含み、生理学的文脈での筋肉のパフォーマンスをより完全に理解することを可能にする29。インビボ研究は、最も侵襲性の低い技術でもあり、研究の経時的過程にわたって繰り返し実施することができる29。経皮的電気神経刺激を用いることで、腱、血管系、神経支配をそのまま残しつつ、特定の筋肉の機能測定値を収集することができる30。これらの縦断的評価は、同じ動物の治癒のさまざまな段階で発生する微妙でありながら重要な変化についての洞察を提供することができます。この方法は、小さなげっ歯類モデル8,31,32,33で一般的に採用されています。しかし、ブタ30やイヌ34の大型動物モデルにも使用されています。
現在、頭蓋顔面VML損傷後の機能回復の評価に関する3つの研究が発表されています。Rodriguezらは、ヒツジの大頬骨筋における頭蓋顔面VML損傷モデルの修復方法について報告しています。彼らの方法は、最終研究時点でのみ実施できる in situ 試験プロトコルを詳述しており、したがって、単一の動物13内での縦断的評価は許可されていない。Kimらは、VML損傷後のマウス咀嚼の連続筋電図データを追跡するためにナノメンブレンエレクトロニクスを使用する方法について説明しています。彼らは、負傷したマウスからの信号が対照群と比較して有意に低いと報告しましたが、運動アーチファクトが信号解析に影響を与え、マウスが時折回路を引っ掻こうとすることにも注目しました。さらに、ナノメンブレンを皮膚に確実に付着させるために、無痛性のヌードマウスを使用したが、これは現在、より一般的に使用される(そして費用対効果の高い)動物モデル12において、この方法の広範な利用を妨げている。最後に、Zhaoらは、マウス咬筋の重大的なサイズのVML欠損を、動物の栄養を損なうもので、これは体重増加の有意な減少に反映されているが、機能的転帰として記載されている14。これらの研究を念頭に置いて、この記事では、皮下電極による三叉神経の刺激によるVML損傷の前後のラット顎の収縮機能の in vivo 縦断的評価のための多用途で低侵襲の方法について説明します。テストが一連の増加するシミュレーション周波数(20〜200 Hz)を通過すると、トランスデューサーが筋肉の生成された力を測定します。これらの測定により、とりわけ、筋肉のこわばりや最大破傷風の決定が可能になります。以下のプロトコルは、外傷性 VML 損傷後の同側咬合力の機能回復を評価するように設計されており、そのため、検証済みの VML 損傷を外科的に作成するためのプロトコルも含まれています。この方法は、多種多様なラットおよびマウスに容易に実施することができ、適切な機器の変更により、より大きな動物モデルおよびVML損傷にも適用可能である30。
プロトコル
すべての動物の取り扱いと手順は、バージニア大学の動物管理および使用委員会(IACUC)のガイドラインに従って承認され、行われました。これらの実験に用いたラットは、手術時の体重が324.8g±12.72gの12-14週齢の雄Lewisラットでした。使用した試薬や機器の詳細は 、資料表に記載されています。
1. 咬筋のVML損傷
- 機器の準備
- 手術の前に、手術用ドレープ、メス、鉗子、マイクロハサミ、止血剤、縫合糸、ガーゼなど、必要なすべての器具が適切に滅菌されていることを確認してください。
- 加熱されたプラットフォームの電源を入れ、37°Cに設定します。
- 麻酔下での眼の乾燥を防ぐために、滅菌眼軟膏を両眼に塗布します。.動物を麻酔導入チャンバーに入れ、2%〜3%のイソフルランを送達します(施設で承認されたプロトコルに従います)。
- VML損傷の外科的作成
- 動物をチャンバーから取り外す前に、動物が適切に麻酔されていることを確認してください。
注:これは、動物がつま先のつま先つまみに反応しない場合に判断できます。 - イソフルランの継続的な投与を可能にするために、動物を体重を量り、左側の横方向の位置で手術台に置き、鼻をノーズコーンにしっかりと入れます。.
- 適切な鎮痛剤を投与し、顔の右側を剃り、ヨウ素とアルコール綿棒を3回交換してその領域を滅菌することにより、動物を手術に備えます。これらの研究では、鎮痛に徐放性ブプレノルフィンが使用されました(0.65 mg / kg体重)。
- ラットの頬側領域に沿って約2cmを切開して手術を開始します。切開部は動物の鼻と耳に沿っている必要があります。鈍い解剖を使用して、皮膚と筋膜を分離します。
- 筋膜に沿って同様の切開を行い、下にある咬筋からそっと離剖します。
- 頬側神経と辺縁神経の位置を特定します(図1A)。滅菌済みの外科用マーカーと定規を使用して、除去する領域に印を付けます。領域は、顔面神経の間にある露出した咬筋の中心にある10 mm x 5 mmの長方形である必要があります(図1B)。
- マイクロハサミを慎重に使用して、組織の除去を開始します。最終的な損傷が150 mgの切除組織で約4 mmの深さに達することを確認します(図1C)。除去された組織は、表在性咬筋の全厚から形成され、部分的に深部咬筋に入ります。
注:これらの実験で除去された組織の平均質量は146.1 mg±1.16 mgでした。. - 吸収性縫合糸(6-0)と非吸収性縫合糸(5-0)をそれぞれ使用して、筋膜と皮膚を閉じます。
- 動物をチャンバーから取り外す前に、動物が適切に麻酔されていることを確認してください。
- クリーンアップと監視
- 縫合後、麻酔ガスをオフにし、動物を加熱された表面に置いて、意識への復帰を監視します。ラットが意識を取り戻し始めたら、動物をケージに戻し、目を覚まして歩行できるようになるまで監視を続けます。
- 手術後3日間、動物を観察し、痛みや不快感の兆候がないか評価します。
- 手術後7日間は、顎への負担を軽減し、動物に十分な水分補給/栄養を与えるために、動物に柔らかい餌を与えます。
- 手術後7〜10日で中断した縫合糸を取り外し、除去する前に傷が完全に閉じていることを確認してください。
- 研究の最終時点に従って、IACUC ガイドラインに従って動物を安楽死させます。咬筋を外植片にし、液体窒素または液体窒素冷却イソペンタンに浸すことで瞬間凍結します。
注:凍結組織サンプルは、将来の組織学的評価のために-80°Cで長期間保存できます。
2. 顎の in vivo 機能評価
- 機器の準備
- すべての機器の適切な接続を確認して確認してください。
- 順番に、(1)コンピューター、(2)バイフェーズ刺激装置、(3)デュアルモードレバーシステム、そして最後に(4)37°Cに温めるための加熱プラットフォームの電源を入れます。
注意: ユーザーマニュアルには、刺激装置とレバーシステムが正確な読み取りを生成するためのウォームアップ時間が1分と記載されています。さらに、動物をテストする前に、プラットフォームが完全に加熱されるまで10〜15分待ちます。 - 麻酔下での眼の乾燥を防ぐために、滅菌眼軟膏を両眼に塗布します。.試験する動物を麻酔導入チャンバーに置き、2%〜3%のイソフルランを供給します。
- ポリテトラフルオロエチレンコーティングされた電極チップを70%エタノールに入れて滅菌します。
- Dynamic Muscle Control(DMC)ソフトウェアを見つけて開きます。これは、機能評価を実行するために必要になります。
- ソフトウェアのセットアップ
- DMCソフトウェアで、セットアップメニューで Instant Stim を見つけ、パラメータを目的の値に変更します。この研究では、プリセットからパラメータは変更されていません(図2A)。
- [セットアップ] メニューで、データを保存する自動保存フォルダーを作成して選択します。
- ソフトウェア画面の下部近くに、「 Autosave Base」というタイトルのボックスがあります。これを、テスト対象の動物に固有のタイトル (例: "rat#-timepoint") に変更します (図 2B)。
- ソフトウェア画面の上部にある [Sequencer ] を選択します。開いた新しいウィンドウで、画面の下部にある [シーケンスを開く] を選択します。開いたファイルエクスプローラーで事前に作成されたシーケンスを選択します。これにより、シーケンスウィンドウに、周波数、刺激の持続時間、休息時間などのパラメータのリストが表示されます(図2C)。
- Load Sequenceをクリックし、続いてClose Windowをクリックします。
注:このプロトコルで使用されるシーケンスは、9つのステップ(Twitch、20 Hz、40 Hz、50 Hz、60 Hz、80 Hz、100 Hz、150 Hz、200 Hz)で構成され、それぞれの間に20秒の休息があります。けいれん刺激を除けば、すべてのステップの持続時間は500ミリ秒です。シーケンシングプロトコルは、各ラボの特定の試験目標に合わせて調整する必要があります。
- Load Sequenceをクリックし、続いてClose Windowをクリックします。
- 新しいウィンドウを開き、リアルタイムデータ集録の表示を有効にするには、[ファイル]>[ライブデータモニタ]を選択します。
- [ライブ データ モニタ] ウィンドウで、タイムスケール、Y 値の最小値、および Y 値の最大値を手動で設定するか、チェック ボックスをオンにして自動スケールを有効にします。
- 動物の調理法
- 動物を麻酔室から取り外す前に、動物が適切な麻酔面にあることを確認してください。
- 動物を仰臥位に置き、鼻を鼻円錐にしっかりと入れて、イソフルランの継続的な投与を可能にします。.ラットの顎の上半分に固定ループを配置して、ラットの鼻をプラットフォームにしっかりと固定します。
- 顎の実験側で動物の首と顔を剃ります。
- 動物の腕と胸にストラップを付けて固定し、動物の上半分を固定します。
- リグのプラットフォームの近くにある3つの回転ノブを使用して、バイトレバーの位置を調整し、X、Y、Z平面を制御します(図3A)。上部のノブを使用して、噛み合わせレバーを動物の方に下げ、他の2つのノブを使用して、レバーの端が動物のあごのすぐ上になるように調整します。
- ピンセットを使用して、動物の底の歯の周りに吊り下げループを引っ掛けて、頭を固定し、頭が動かないようにします(図3B)。
注意: ループは、力変換器から3cm離れたバイトレバーに開けられた穴を通って配置されています。システムは、最初に使用する前に校正する必要があります。 - レバーの高さを調整して、顎の張力を高めます。これらの実験で使用された再現可能なベースライン張力は~0.5Nでした。
- 電極の配置
- 動物の顎を触診し、下顎骨の後隅を見つけます。電極をコーナーの両側に約2〜3mm離して皮下に配置します。電極は3〜5mmの深さに挿入する必要があります。ワニ口クリップとスタンドを使用して電極を所定の位置に保持します。
- 「ライブデータモニター」ウィンドウで、「Instant Stim」というラベルの付いた大きなオレンジ色のボタンをクリックしてアクティブにします。
- モニターは、各刺激中に上向きのスパイクを表示し始める必要があります。必要に応じて、ノブを使用して電極の配置とレバーアームの位置を調整します。顎の同側側の活性化のみを観察する必要があります(図4)。
- ハイパワーバイフェーズスティミュレータには、中央近くに「Range」と「Adjust」というラベルの付いた2つのノブがあります。 レンジ ノブを回し始めて、 amperage。アンペア数が増加すると、瞬間的な刺激ピークは、3つの連続した刺激が同一の収縮反応をもたらすレベルとして決定されるプラトーまで大きさが増し始めます。
- アンペア数を高くしすぎる、つまり、最大ピークが観察されたアンペア数より20%以上高くしないと、隣接する筋肉が動員され、力の測定値が不正確になる可能性があるため、避けてください。
- 調整ノブを回して、顎を刺激するために使用される現在の「範囲」のパーセンテージを調整します。twitchの応答を最適化するために、電流の増加または減少が必要になる場合があります。
- 電極がまだしっかりと固定されていることを確認し、 瞬間的な刺激を止めます。
- ライブデータモニターのオレンジ色の「Instant Stim」ボタンの下にある灰色の 「Start Sequence 」ボタンを見つけてクリックします。
- 刺激プロトコルの期間中、曲線を監視し続けます。刺激の頻度が増加すると、生成される最大力も増加します。破傷風に達すると、力曲線は横ばいになります(図5A)。
- クリーンアップ
- 機能刺激シーケンスが完了したら、電極を取り外し、70%エタノールできれいに拭きます。これが最後に試験される動物である場合は、電極をカバーに戻すことができます。
- 麻酔ガスをオフにしてくださいが、動物を加熱された表面に置いて、意識への復帰を監視します。ラットが意識を取り戻し始めたら、ケージに戻し、動物が目を覚まして歩行できるようになるまで監視を続けます。
- データ取得に使用した機器の電源を切り、すべての表面を拭き取ってください。
3. データ分析
注:この方法は、ラットTA8のin vivo機能試験のための方法を文書化するものとして以前に説明されていた。データ解析は、この研究の意図を判断するように設計されており、ユーザーの目標に応じてプロトコルが変わる場合があります。
- Dynamic Muscle Analysisソフトウェアを見つけて開きます。
- 「High Throughput」メニューをクリックし、「Force Frequency Analysis」を選択して、複数のサンプルを同時に分析します。
- [ファイルの選択] を選択し、分析に必要な数のデータ ファイルを強調表示します。「Pick Folder」ボタンは、ファイルシステム内でサンプルに明確な名前が付けられている場合にも使用できます。
- [ベースラインの削除] ボックスをオンにします。これにより、各試行で記録された最大力からベースライン力が自動的に削除され、絶対的な最大値が提供されます。
- [ 分析 ]ボタンをクリックし、[ テーブルをExcelにエクスポート ]をクリックして、データをスプレッドシートとして保存できます。「開始カーソル」と「終了カーソル」の値が刺激のタイムスタンプを正確にキャプチャしていることを確認します。これらの値は、必要に応じて手動で設定できます。
- 保存したスプレッドシートを開きます。
注意: 「最大」列を使用して、ユーザーはすべての周波数で生成される最大力を計算できます。力-周波数曲線も生成できます(図5)。
結果
以前の出版物で説明したように、破傷風曲線は、最適な結果と最適でない結果を区別するために使用できる8。理想的な結果は、筋肉が最大の力まで刺激され、破傷風の収縮の持続時間を通じてその最大を維持するときに得られます。150 Hzでの理想的な曲線は、刺激の開始時に急激な上昇、最大力値で振動が最小限に抑えられた平坦なプラトー相、および刺激が停止すると急激な垂直下降を示すため、 この 点を示しています。非理想的な破傷風曲線は、プラトーフェーズ中に振動を示し、負または正の傾きを示す場合があります(図5C、D)。
この機能テストプロトコルの結果は、研究者の目標と研究の実験デザインによって異なる表現される場合があります。このプロトコルの場合、絶対最大力は、刺激のすべての周波数から経験的に決定され、テストの各時点でグラフ化されます。これにより、咬筋に説明されたVML損傷が発生してから4週間ごとに、ベースラインの最大力の産生と最大の力の産生を比較できます(図1D)。比較のために、無傷の動物のコホート(n = 4)も各時点で試験しました(図1E)。各時点における動物の体重も比較しました(図1F)。VMLの4、8、および12週間後、ラットはそれぞれ7.958N±1.797N、7.183N±1.450N、および7.823N±0.626Nの平均最大力を生み出しました。フィッシャーの最小有意差(LSD)のポストホックペアワイズ比較を使用した一元反復測定分散分析(ANOVA)により、VML損傷後の任意の時点でこれらの値間に統計的に有意な差はなかったと判断されました。 ただし、それらはすべて、平均ベースライン力の 10.031 N ±0.564 N とは有意に異なっていました。
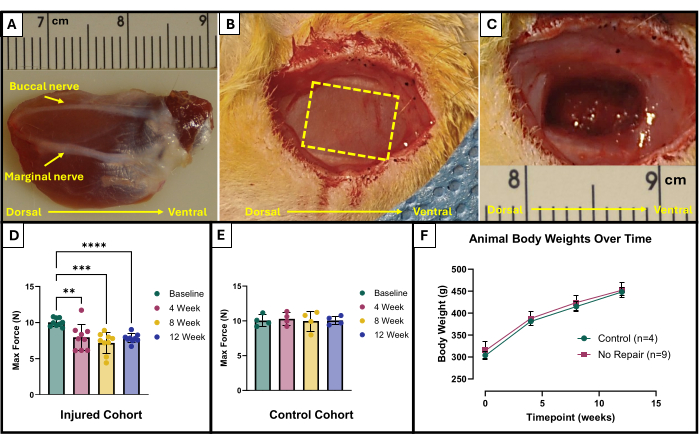
図1:VML損傷した咬筋の手術概略図と機能結果。 解剖学的方向を示す植開した咬筋と、損傷作成のための神経ランドマーク(A)。(B)および(C)VML損傷作成前および(C)後の手術中の動物。画像はすべて(A)と同じ向きの筋肉で提示されています。黄色の破線は、筋肉を切除する領域を示しています。咬筋にVML損傷(n = 9)を受けたラット(D)と、無傷のまま残された年齢一致対照ラット(n = 4)(E)のベースラインおよび経時的な最大力産生。ラットの体重の経時変化のグラフ(F)。(D) は、フィッシャーの LSD 事後対ワイズ比較 (**= p < 0.01, ***= p < 0.001, ****= p < 0.0001) を使用した一元配置反復測定 ANOVA を表します。(A)と(C)の定規はセンチメートル単位で、目盛りはミリメートルです。 この図の拡大版を表示するには、ここをクリックしてください。
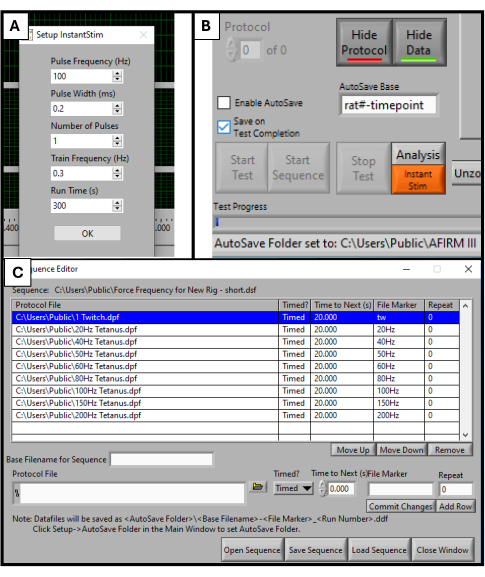
図2:機能テストのためのソフトウェアの初期化。 DMCソフトウェアのパラメータ設定。Instant Stimを目的の値に設定します(A)。ソフトウェアグラフィックユーザーインターフェイスとAutoSaveBase設定ボックスの場所(B)。テストに使用する9ステップのプロトコルシーケンスの選択(C)。ここに表示される値は、この調査で使用した値の例ですが、他の特定のユースケースによっては、最適化および調整が必要な場合があります。 この図の拡大版を表示するには、ここをクリックしてください。
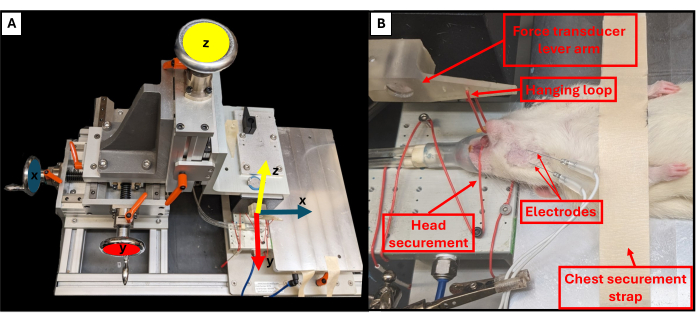
図3:機能的なリグの運動軸と適切な動物の位置決め。 概略図は、機能試験装置の3つの調整ホイールのそれぞれと、レバーアーム(A)の対応する移動軸との関係を示しています。機能試験を受けているラットの例画像で、プラットフォームやその他の重要なリグコンポーネント上の動物の適切な仰臥位を示しています(B)。 この図の拡大版を表示するには、ここをクリックしてください。

図4:試験中の片側および両側の顎の活性化の例(A)は、刺激を受ける前の安静時のラットの顎を示しています。電極が不適切に配置されると、黄色の矢印(B)で示されているように、両側の顎が収縮する可能性がありますが、適切に配置された電極は、目的の同側収縮(C)を引き起こします。黄色の矢印は、顎の収縮点を示しています。また、両側(D)および片側(E)の筋肉の活性化に関する150Hzでの力-時間曲線の例も示されています。この図の拡大版を表示するには、ここをクリックしてください。
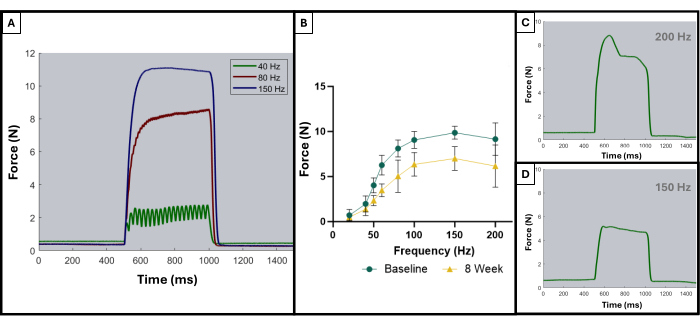
図5:許容できる試験と許容できない試験の代表的な刺激反応曲線。 40Hz、80Hz、150Hz(A)での刺激曲線の例は、破傷風の収縮前および収縮中に何を探すべきかを示しています。刺激周波数が増加するにつれて、記録されるピーク張力も高くなり、これは、ベースライン時とVML作成後8週間での負傷した動物(n = 9)の平均を示す力-周波数曲線(B)で観察できます。(C,D)は、不適切な破傷風による電極調整の必要性を示す力応答の形状の代表的な例を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、ラットの顎で生成される同側の咬合力のin vivo機能試験のための簡単で信頼性の高い方法を説明しています。また、ラット咬筋におけるVML損傷の外科的作成方法も記載されている。これらの方法を組み合わせることで、外傷性頭蓋顔面損傷の前後の機能回復の縦断的評価を実施するための生物学的に関連する動物モデルが提供されます。in vitroやin situなどの他の試験方法も貴重な情報を提供することができるが、それらは腱の分離と組織をその天然環境から除去する必要があり、in vivoの機能的転帰をよりよく理解するための適用性を制限する8,25,26,27,28 .適切なトレーニングと練習により、研究者は動物を試験のために迅速に配置し、最大の筋力生産を達成するために必要な調整を行うことができます。
適切な電極の配置と刺激を確保するために、各動物について検証する必要がある技術的な詳細があります。まず、ラットの頭が加熱されたプラットフォームに完全に接触するように、上切歯を固定する必要があります。これにより、ラットの鼻が鼻円錐形に配置され、吸入麻酔薬を連続的に投与できます。ヘッドが適切な位置に保たれていないと、ベースライン張力が逸脱するにつれて、力の読み取り値に一貫性が生じません。さらに、動物の体は仰向けで、背骨はまっすぐでなければなりません。動物を適切な位置に保つと、電極の配置と正しい位置でのメンテナンスに役立ちます。最後に、電極は、顎の実験側のみを刺激するために適切な深さと間隔で配置する必要があるため、電極の配置が難しい場合があります。再現性のある信頼性の高い結果を得るためには、電極の配置に長けておくために、警戒と実践が必要です。電極はすぐにくすんでしまうので、こまめに交換する必要があります。電極の配置が不十分な場合の特徴は、副筋肉の活性化、正/負に傾斜した力の読み取り(刺激中の電極の動き)、または未融合/振動する破傷風波形8 (図5C、D)です。
さらに、この方法には、このシステムの将来のアプリケーションで言及し、検討する必要があるいくつかの制限があります。まず、この研究で行われた測定には十分ですが、上顎を固定するために使用されるループは最も剛性の高いシステムではないかもしれません。代わりに、イヤーバーを使用した定位固定装置アプローチにより、ラットの上顎をよりよく保持できる可能性があります。さらに、この方法でのテストの設定位置として受動的な張力値が使用されましたが、筋肉が最適な長さ(LO)に配置された場合に得られる最大力の生成につながらない可能性があります。実際、LOは、本明細書に記載されるように動物を配置し、次いで、twitch刺激を実行しながら、顎の閉塞を小さな(0.5〜1mm)増分で操作することによって決定することができ、Loは、最大twitch力が生成された最適な試験位置として決定される。しかし、咬筋はかなり独特な形状と運動35,36を有しており、したがって、例えば四肢筋(典型的にはLOの周りで動作する)の特性よりもはるかに広い範囲の長さで作用する。ただし、噛むことは噛むことに比べて狭い範囲で発生します。そのため、この問題に対する完璧なアプローチはありません。したがって、ベースラインテンションを設定することがこの問題に取り組む唯一の方法ではありませんが、顎の筋肉の最適な長さは顎の自然な開口部を超えているため、そうすることには論理的な科学的根拠があります。いずれにせよ、与えられた受動的な張力における最大力は、たとえそれらがLOにおける最大力と異なるとしても、機能の側面について重要な洞察を与える。明らかに、咬筋の力と長さの関係についてさらに調査する必要があります。最後に、この方法では、ラットの三叉神経の刺激を調べます。これは、V1-V3の3つの枝に分かれています。V3、または下顎神経は運動成分を持つ唯一の枝ですが、咬筋、側頭筋、翼状突起、顎舌骨37などの複数の筋肉を神経支配します。これは、この方法が咬筋力のみを報告するわけではないことを意味し、他の研究調査に関連している可能性があるため、考慮することが重要です。
これらの技術的な側面と制限にもかかわらず、この方法は堅牢で一貫性があることが証明されています。本明細書では同側試験のみに記載されているが、プロトコルは、顎の反対側の追加試験を含むように容易に変更することができる。咬筋の収縮/機能の両側試験により、単一の動物内で健康な/損傷した動物との比較を行うことができ、おそらく負傷した側および/または対照側(負傷していない側)の重要な代償的変化を解明することができます。全体として、このモデルは、縦方向の筋肉機能と機能回復を低侵襲で評価するための強力なツールを提供します。そのため、このシステムは、VMLを介した機能障害に関与する生体力学的メカニズムの評価や、頭蓋顔面領域のVML損傷の修復のためのさまざまな治療法の有効性のテストに適用できます。
開示事項
著者は何も開示していません。
謝辞
Myologica LLCは、機能評価の実施に使用される機器を共有しています。本書で報告された研究は、米国国立衛生研究所(NIH)の国立歯科・頭蓋顔面研究所(National Institute of Dental & Craniofacial Research)の支援を受け、DE029463 24年後に授与されました。内容は著者の責任であり、必ずしも国立衛生研究所の公式見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| 200 proof ethanol | Decon Labs | Diluted to 70% with deionized water | |
| 25 mm x 27 G monopolar needle electrodes | Chalgren Enterprises | 111-725-24TP | Used to perform functional measurements |
| Alcohol Swabs | BD | 326895 | For sterilzation/cleaning |
| Alligator Clip and Stand/ Helping Hand Sodering Aid | Eclipse Enterprise | 115584 | Holding electrodes in place |
| Bead Sterilizer | 18000-45 | For surgery (resterilizing tools between animals) | |
| Bi-phase Electrical Stimulator | Aurora Scientific | 701C | Deliver electric impulses to animals during function testing |
| Bite lever | Custom | Cuttomized 3D printed (please contact the authors for details) | |
| Compressed Oxygen Gas | Praxair | UN1072 | |
| Cotton tipped aplicators | Fisher | 22363157 | For surgery |
| Dual Mode Muscle Lever System | Aurora Scientific | 309C | Used to perform functional measurements |
| Dynamic Muscle Data Acquisition and Analysis System | Aurora Scientific | 615A | Used to collect and analyze functional measurements |
| Face mask | High Five | AM101 | For surgery |
| Forceps | Integra Miltex | 6-100 | For surgery |
| Gauze | Medline | PRM21408C | For surgery |
| Hair Clippers | Phillips | MG3750 | Fur removal |
| Hairnet | VWR | 75829-204 | For surgery |
| Isoflurane | Covetrud | 29405 | |
| Isoflurane evaporizer funnel fill | Vet Equip | 911103 | |
| Isoflurane Vaporizer | Kent Scientific | VetFlo-1231 | Delivery of anesthesia |
| Large Rodent/Small Animal Apparatus | Aurora Sceintific | 807B | Used with 309C motor for functional measurements |
| Microscissors | FST | 91500-09 | For surgery |
| Needle Driver | FST | 1200-13 | For surgery |
| Povidone-Iodine | Medline | MDS093943 | For sterilzation/cleaning |
| Prolene Sutures 5-0 | Ethicon | 8698G | Suturing skin |
| Scalpel | Personna Medical | 73-8030 | For surgery |
| Scalpel Blade | Glass Van | 1834 | For surgery |
| Surgical drapes - ACT material | N/A | N/A | cut to 8 x 11 in and autoclaved prior to surgery |
| Surgical Gloves | Encore | 5711103PF | For surgery |
| Surgical gown | VWR | 414004-467 | For surgery |
| T/Pump Heating/Cooling Pump | Braintree Scientific, Inc | TP-700 | Heating animal platforms for surgery and function testing - set to continuous therapy time at 38/100 temperature |
| VaporGuard Activated charcoal filter | Vet Equip | 931401 | |
| Vicryl Sutures 6-0 | Ethicon | J492G | Suturing fascia |
参考文献
- Kulwatno, J., Goldman, S. M., Dearth, C. L. Volumetric muscle loss: A bibliometric analysis of a decade of progress. Tissue Eng Part B: Rev. 29 (3), 299-309 (2023).
- Owens, B. D., et al. Combat wounds in Operation Iraqi Freedom and Operation Enduring Freedom. J Trauma. 64 (2), 295-299 (2008).
- Grogan, B. F., Hsu, J. R. Volumetric Muscle Loss. J Am Acad Orthop Surg. 19, S35-S37 (2011).
- Lew, T. A., Walker, J. A., Wenke, J. C., Blackbourne, L. H., Hale, R. G. Characterization of craniomaxillofacial battle injuries sustained by United States service members in the current conflicts of Iraq and Afghanistan. J Oral Maxillofac Surg. 68 (1), 3-7 (2010).
- Dienes, J., et al. Semisynthetic hyaluronic acid-based hydrogel promotes recovery of the injured tibialis anterior skeletal muscle form and function. ACS Biomater Sci Eng. 7 (4), 1587-1599 (2021).
- Aurora, A., Garg, K., Corona, B. T., Walters, T. J. Physical rehabilitation improves muscle function following volumetric muscle loss injury. BMC Sports Sci Med Rehabil. 6, 41 (2014).
- Wu, X., Corona, B. T., Chen, X., Walters, T. J. A standardized rat model of volumetric muscle loss injury for the development of tissue engineering therapies. BioRes Open Access. 1 (6), 280-290 (2012).
- Mintz, E. L., Passipieri, J. A., Lovell, D. Y., Christ, G. J. Applications of in vivo functional testing of the rat tibialis anterior for evaluating tissue engineered skeletal muscle repair. J Vis Exp. 116, e54487 (2016).
- Passipieri, J. A., et al. In silico and in vivo studies detect functional repair mechanisms in a volumetric muscle loss injury. Tissue Eng Part A. 25 (17-18), 1272-1288 (2019).
- Corona, B. T., et al. Further development of a tissue-engineered muscle repair construct in vitro for enhanced functional recovery following implantation in vivo in a murine model of volumetric muscle loss injury. Tissue Eng Part A. 18 (11-12), 1213-1228 (2012).
- Chen, X. K., Walters, T. J. Muscle-derived decellularised extracellular matrix improves functional recovery in a rat latissimus dorsi muscle defect model. J Plast Reconstr Aesthet Surg. 66 (12), 1750-1758 (2013).
- Kim, H., et al. Real-time functional assay of volumetric muscle loss injured mouse masseter muscles via nanomembrane electronics. Adv Sci (Weinh). 8 (17), 2101037 (2021).
- Rodriguez, B. L., et al. A tissue engineering approach for repairing craniofacial volumetric muscle loss in a sheep following a 2, 4, and 6-month recovery. PLoS One. 15 (9), e0239152 (2020).
- Zhao, N., et al. A critical size volumetric muscle loss model in mouse masseter with impaired mastication on nutrition. Cell Prolif. 57 (6), e13610 (2024).
- Cheng, X., Shi, B., Li, J. Distinct embryonic origin and injury response of resident stem cells in craniofacial muscles. Front Physiol. 12, 690248 (2021).
- Noden, D. M., Francis-West, P. The differentiation and morphogenesis of craniofacial muscles. Dev Dyn. 235 (5), 1194-1218 (2006).
- Stuelsatz, P., et al. Extraocular muscle satellite cells are high performance myo-engines retaining efficient regenerative capacity in dystrophin deficiency. Dev Biol. 397 (1), 31-44 (2015).
- Pavlath, G. K., et al. Heterogeneity among muscle precursor cells in adult skeletal muscles with differing regenerative capacities. Dev Dyn. 212 (4), 495-508 (1998).
- Ono, Y., Boldrin, L., Knopp, P., Morgan, J. E., Zammit, P. S. Muscle satellite cells are a functionally heterogeneous population in both somite-derived and branchiomeric muscles. Dev Biol. 337 (1), 29-41 (2010).
- Aladimi, M. T., et al. Factors to consider when deciding on the type of free-flap reconstruction of head and neck soft tissue defects. ORL J Otorhinolaryngol Relat Spec. 79 (4), 230-238 (2017).
- Maxwell, G. P., Leonard, L. G., Manson, P. N., Hoopes, J. E. Craniofacial coverage using the latissimus dorsi myocutaneous island flap. Ann Plast Surg. 4 (5), 410-421 (1980).
- Strübing, F., et al. Scalp reconstruction using the latissimus dorsi free flap: A 12-year experience. J Clin Med. 12 (8), 2953 (2023).
- Carnes, M. E., Pins, G. D. Skeletal muscle tissue engineering: Biomaterials-based strategies for the treatment of volumetric muscle loss. Bioengineering. 7 (3), 85 (2020).
- Mintz, E. L., et al. Long-term evaluation of functional outcomes following rat volumetric muscle loss injury and repair. Tissue Eng Part A. 26 (3-4), 140-156 (2020).
- Westman, A. M., et al. A coupled framework of in situ and in silico analysis reveals the role of lateral force transmission in force production in volumetric muscle loss injuries. J Biomech. 85, 118-125 (2019).
- Park, K. H., et al. Ex vivo assessment of contractility, fatigability and alternans in isolated skeletal muscles. J Vis Exp. 69, e4198 (2012).
- Moorwood, C., Liu, M., Tian, Z., Barton, E. R. Isometric and eccentric force generation assessment of skeletal muscles isolated from murine models of muscular dystrophies. J Vis Exp. (71), e50036 (2013).
- MacIntosh, B. R., Esau, S. P., Holash, R. J., Fletcher, J. R. Procedures for rat in situ skeletal muscle contractile properties. J Vis Exp. (56), e3167 (2011).
- Iyer, S. R., Valencia, A., Hernández-Ochoa, E. O., Lovering, R. M. In vivo assessment of muscle contractility in animal studies. Methods Mol Biol. 1460, 293-307 (2016).
- Corona, B. T., Call, J. A., Borkowski, M., Greising, S. M. In vivo measurement of hindlimb dorsiflexor isometric torque from pig. J Vis Exp. (175), e62905 (2021).
- Brightwell, C. R., et al. In vivo measurement of knee extensor muscle function in mice. J Vis Exp. (169), e62211 (2021).
- Lovering, R. M., Roche, J. A., Goodall, M. H., Clark, B. B., McMillan, A. An in vivo rodent model of contraction-induced injury and non-invasive monitoring of recovery. J Vis Exp. (51), e2782 (2011).
- Chiu, C. S., et al. Non-invasive muscle contraction assay to study rodent models of sarcopenia. BMC Musculoskelet Disord. 12 (1), 246 (2011).
- Childers, M. K., Grange, R. W., Kornegay, J. N. In vivo canine muscle function assay. J Vis Exp. (50), e2623 (2011).
- Cox, P. G., Jeffery, N. Reviewing the morphology of the jaw-closing musculature in squirrels, rats, and guinea pigs with contrast-enhanced micro CT. Anat Rec. 294, 915-928 (2011).
- Nordstrom, S. H., Yemm, R. Sarcomere length in the masseter muscle of the rat. Arch Oral Biol. 12 (5), 895-902 (1972).
- Huff, T., Weisbrod, L. J., Daly, D. T. . Neuroanatomy, Cranial Nerve 5 (Trigeminal). , (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved