14.10 : 小さい x の仮定
反応の平衡定数が小さい場合、その平衡は反応物側に有利になります。このようなKcの値が小さな反応では、反応物の初期濃度が高い場合には、濃度の変化が無視できるほど小さくなる場合があります。このような状況では、平衡濃度はその初期濃度にほぼ等しいです。 この推定は、いくつかの平衡濃度が初期濃度に等しいと仮定することで、平衡計算を簡略化するために使用することができます。ただし、この仮定をするためには、弱酸または弱塩基の濃度変化、つまりxが初期濃度の5%未満でなければなりません。もしxが5%以上であれば、二次式を使って平衡方程式を解く必要があります。
代数的に単純化した仮定による平衡濃度の計算
HCNの0.15 M溶液の平衡濃度はいくらでしょうか?
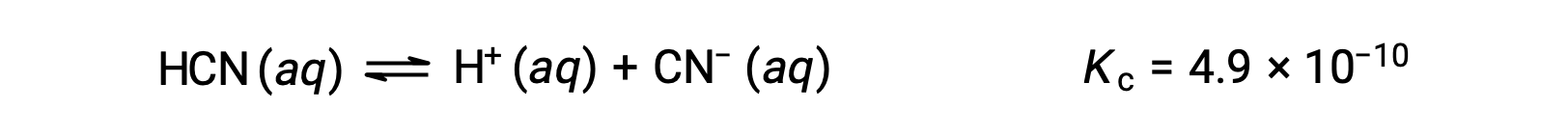
xを用いて平衡時の各生成物の濃度を表すと、このICE表のようになります。
| HCN (aq) | H+ (aq) | CN− (aq) | |
| 初期濃度 (M) | 0.15 | 0 | 0 |
| 濃度変化 (M) | −x | +x | +x |
| 平衡濃度 (M) | 0.15 − x | x | x |
平衡濃度の項をKcの式に代入します。

二次式に変形してxを解く。

したがって、[H+] = [CN–] = x = 8.6 × 10–6 M、[HCN] = 0.15 – x = 0.15 Mとなります。
この場合、濃度の変化は初期濃度よりもかなり小さく(Kが小さいため)、初期濃度の変化は無視できることに注意しましょう。

この近似を用いることで二次方程式を解く必要がなくなり、より簡便に計算することができます。
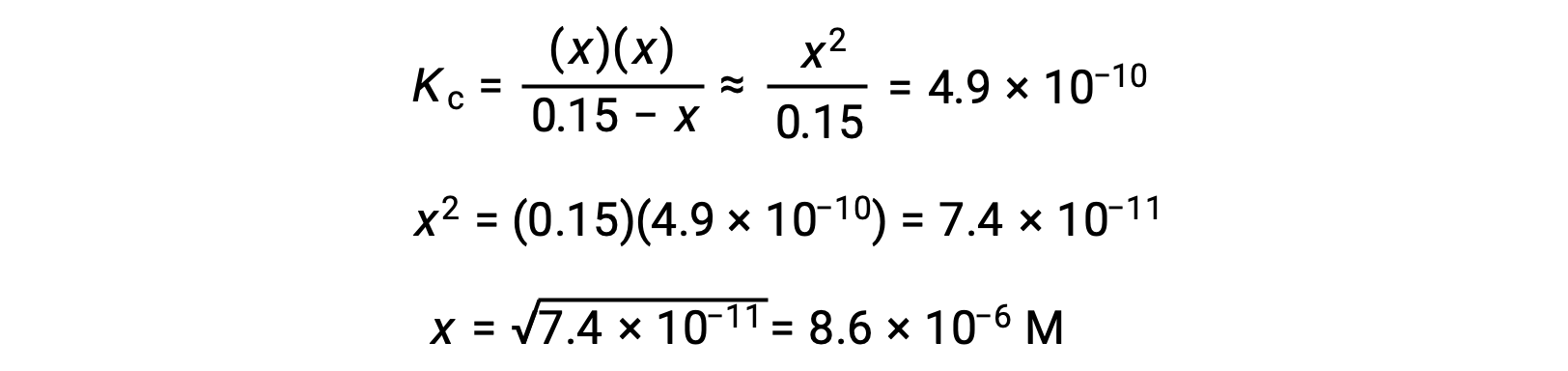
計算されたxの値は、実際には、初期濃度よりもはるかに小さいです。

となり、近似が正当化されます。この単純化された手法によって仮定を満たさないxの値が得られた場合は、近似値を使わずに再計算する必要があります。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 13.4 Equilibrium Calculations.
章から 14:

Now Playing
14.10 : 小さい x の仮定
化学平衡
45.9K 閲覧数

14.1 : 動的平衡
化学平衡
50.2K 閲覧数

14.2 : 平衡定数
化学平衡
46.5K 閲覧数

14.3 : 気相反応及び不均一系反応の平衡
化学平衡
24.6K 閲覧数

14.4 : 平衡定数の計算
化学平衡
30.9K 閲覧数

14.5 : 反応商
化学平衡
48.0K 閲覧数

14.6 : 平衡濃度の計算
化学平衡
47.4K 閲覧数

14.7 : ルシャトリエの原理:濃度の変更
化学平衡
57.4K 閲覧数

14.8 : ルシャトリエの原理:体積(圧力)の変更
化学平衡
34.1K 閲覧数

14.9 : ルシャトリエの原理:温度の変更
化学平衡
29.1K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved