16.6 : Calcoli di titolazione: acido forte - base forte
Calcolo del pH per le soluzioni di titolazione: acido forte / base forte
Viene effettuata una titolazione per 25,00 mL di 0,100 M HCl (acido forte) con 0,100 M di una forte base NaOH. Il pH a diversi volumi di soluzione di base aggiunta può essere calcolato come segue:
(a) Volume titolazione = 0 mL. Il pH della soluzione è dovuto alla ionizzazione acida dell'HCl. Poiché si tratta di un acido forte, la ionizzazione è completa e la molarità degli ioni di idronio è di 0,100 M. Il pH della soluzione è quindi:

(b) Volume di titolazione = 12,50 mL. Poiché il campione acido e il titolazione di base sono sia monoprotici che ugualmente concentrati, questa aggiunta di titolazione comporta meno di una quantità stechiometrica di base, e quindi viene completamente consumata per reazione con l'acido in eccesso nel campione. La concentrazione di acido rimanente viene calcolata sottraendo la quantità consumata dalla quantità iniziale e quindi dividendo per il volume della soluzione:
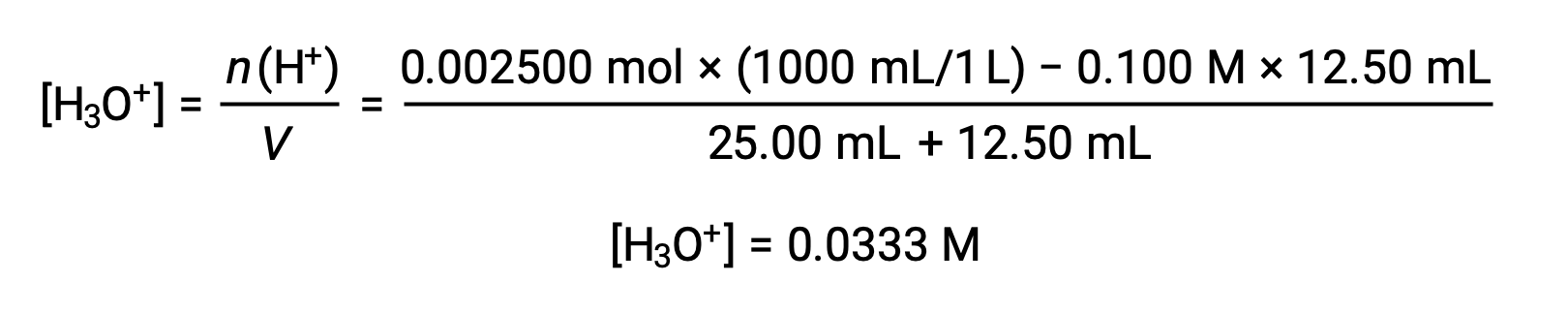
(e) Volume di titolazione = 25,00 mL. Questa aggiunta titolazione comporta una quantità stechiometrica di base (il punto di equivalenza), e quindi solo i prodotti della reazione di neutralizzazione sono in soluzione (acqua e NaCl). Né la catione né l'anione di questo sale subiscono ionizzazione acido-base; l'unico processo che genera ioni di idronio è l'autoprotolisi dell'acqua. La soluzione è neutra, con un pH = 7,00.
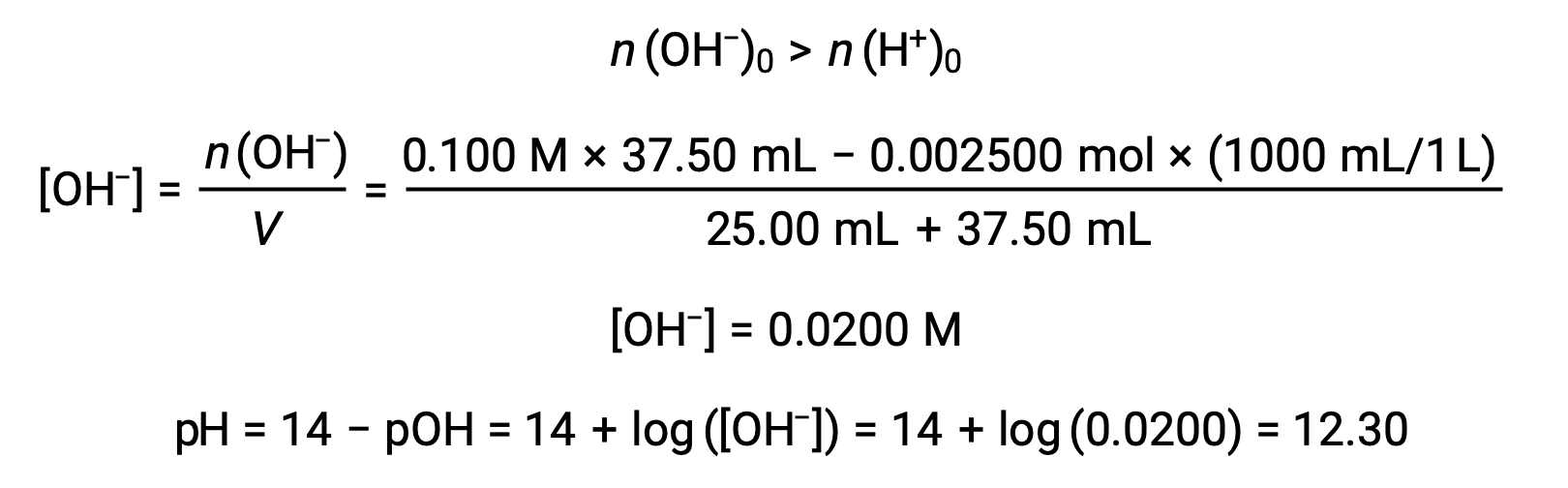
(d) Volume del titolazione = 37,50 mL. Ciò comporta l'aggiunta di titolazione superiore al punto di equivalenza. Il pH della soluzione viene quindi calcolato utilizzando la concentrazione di ioni idrossido:
Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.7: Titolazioni acido-base.
Dal capitolo 16:

Now Playing
16.6 : Calcoli di titolazione: acido forte - base forte
Equilibri acido-base e di solubilità
28.9K Visualizzazioni

16.1 : Effetto ionico comune
Equilibri acido-base e di solubilità
40.9K Visualizzazioni

16.2 : Buffer
Equilibri acido-base e di solubilità
163.3K Visualizzazioni

16.3 : Equazione di Henderson-Hasselbalch
Equilibri acido-base e di solubilità
68.0K Visualizzazioni

16.4 : Calcolo delle variazioni di pH in una soluzione tampone
Equilibri acido-base e di solubilità
52.5K Visualizzazioni

16.5 : Efficacia del buffer
Equilibri acido-base e di solubilità
48.4K Visualizzazioni

16.7 : Calcoli di titolazione: acido debole - base debole
Equilibri acido-base e di solubilità
43.7K Visualizzazioni

16.8 : Indicatori
Equilibri acido-base e di solubilità
47.7K Visualizzazioni

16.9 : Titolazione di un acido poliprotico
Equilibri acido-base e di solubilità
95.6K Visualizzazioni

16.10 : Equilibrio di solubilità
Equilibri acido-base e di solubilità
51.9K Visualizzazioni

16.11 : Fattori che influenzano la solubilità
Equilibri acido-base e di solubilità
33.0K Visualizzazioni

16.12 : Formazione di ioni complessi
Equilibri acido-base e di solubilità
23.1K Visualizzazioni

16.13 : Precipitazione di ioni
Equilibri acido-base e di solubilità
27.5K Visualizzazioni

16.14 : Analisi qualitativa
Equilibri acido-base e di solubilità
20.5K Visualizzazioni

16.15 : Curve di titolazione acido-base
Equilibri acido-base e di solubilità
126.3K Visualizzazioni