Method Article
Élaboration d’un modèle de rat pour le trouble bipolaire
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cet article présente un protocole pour l’induction d’un modèle unique de trouble bipolaire chez le rat qui capture à la fois le comportement maniaque et le comportement dépressif.
Résumé
Le trouble bipolaire est un problème de santé mentale caractérisé par des sautes d’humeur extrêmes, y compris des périodes de hauts et de bas émotionnels (manie) et de bas (dépression). Bien que la neurobiologie sous-jacente exacte ne soit pas encore entièrement comprise, les déséquilibres dans les systèmes de neurotransmetteurs, en particulier la dopamine, semblent jouer un rôle central. Pour cette raison, des manipulations des voies dopaminergiques ont été utilisées pour modéliser la manie ou la dépression chez les rongeurs. Cependant, les modèles qui représentent avec précision le basculement typique entre ces deux épisodes sont rares, ce qui limite la validité apparente. Dans un modèle unique, des techniques modernes sont utilisées pour augmenter temporairement l’expression du récepteur de la dopamine D1, qui a été impliqué dans la pathologie du trouble bipolaire. Une construction lentivirale inductible par la tétracycline qui exprime le récepteur D1 de la dopamine sous le contrôle du promoteur alpha de la calmoduline kinase II est injectée stéréotaxiquement dans le cortex préfrontal médial de rats adultes. La surexpression du récepteur de la dopamine D1 est obtenue en ajoutant la doxycycline, un analogue de la tétracycline, à l’eau de boisson des animaux, ce qui entraîne une augmentation des comportements impulsifs et de prise de risque liés à la récompense et une diminution de l’anxiété. Ces comportements ressemblent à un phénotype maniaque. En éliminant la doxycycline de l’eau de boisson, un phénotype de type dépressif, caractérisé par une augmentation de l’impuissance et de l’anhédonie, peut être induit chez le même animal. Cet article fournit un protocole étape par étape pour effectuer la chirurgie, ainsi que des procédures pour induire le phénotype de type trouble bipolaire. De plus, les considérations pour évaluer les changements de comportement associés aux comportements maniaques et dépressifs sont décrites. Ce modèle prometteur, qui démontre une bonne validité conceptuelle et apparente, offre un outil précieux pour approfondir l’étude des mécanismes physiopathologiques du trouble bipolaire.
Introduction
Le trouble bipolaire (MB) est un trouble de l’humeur grave qui touche environ 1 % de la population mondiale1. Elle se caractérise par des épisodes d’humeur extrême, de dépression et de manie, ainsi que par des états euthymiques. Les symptômes des épisodes dépressifs dans la MB ressemblent à ceux de la dépression unipolaire. Les patients montrent moins d’intérêt et de plaisir pour les activités et des sentiments de tristesse, de désespoir et d’inutilité. De plus, des changements dans l’appétit, le comportement de sommeil, ainsi que des troubles cognitifs peuvent souvent être observés2. Les épisodes maniaques sont caractérisés par une humeur anormalement élevée, une diminution du besoin de sommeil, une désinhibition sociale, une augmentation de l’estime de soi et des sentiments de grandeur, ainsi qu’une prise de risque et une irritabilitéaccrues 2.
L’étiologie de la maladie de Parkinson semble être une interaction complexe de facteurs génétiques et développementaux3, mais les mécanismes exacts impliqués dans sa physiopathologie ne sont pas encore entièrement compris. On pense que les symptômes proviennent de déséquilibres dans les systèmes de neurotransmetteurs4 et, en particulier, les études axées sur le système dopaminergique ont été influentes5. Par exemple, Berk et coll.6 ont postulé l’hypothèse de la dopamine, en supposant qu’un état d’hyperdopaminergie sous-tend la manie, tandis que la dépression découle de l’hypodopaminergie. Depuis lors, des preuves provenant de modèles animaux, ainsi que des études pharmacologiques et d’imagerie, ont rassemblé un solide soutien pour une association entre les symptômes maniaques et l’hyperdopaminergie. De plus, un lien entre la diminution de la signalisation dopaminergique et les épisodes dépressifs a pu être trouvé, bien que dans une moindre mesure7. De plus, les résultats des investigations génétiques ont renforcé l’idée d’une hypothèse de dopamine de BD8.
Pour mieux comprendre le rôle du système dopaminergique dans la BD, des modèles animaux peuvent être utilisés pour étudier les mécanismes neurobiologiques qui sous-tendent les symptômes. Les applications et les limites des modèles de maladies sont souvent évaluées sur la base de trois critères de validation, proposés à l’origine par Willner9. Il s’agit notamment de la validité faciale, de la validité conceptuelle et de la validité prédictive. La validité apparente décrit la capacité du modèle à imiter les caractéristiques comportementales du trouble. La validité conceptuelle est atteinte lorsque la physiopathologie et l’étiologie du trouble sont à la base du modèle, tandis que la validité prédictive implique que le traitement pharmacologique du trouble peut être reproduit dans le modèle.
Jusqu’à présent, divers modèles de rongeurs ont contribué à une compréhension de BD10 et incluent un large éventail de modifications génétiques, d’interventions pharmaceutiques ainsi que de manipulations environnementales11.
Il a été démontré que des manipulations expérimentales du gène de l’horloge , par exemple, induisent un phénotype maniaque chez la souris. Le facteur de transcription CLOCK joue un rôle important dans la régulation des rythmes circadiens, et les souris génétiquement modifiées, exprimant une protéine qui ne peut pas activer la transcription de Clock, sont caractérisées par une hyperactivité et des réponses de récompense accrues12. Le phénotype qui en résulte semble être médié par des gènes régulés différentiellement pour la signalisation dopaminergique dans l’aire tegmentale ventraledu cerveau 13.
Il a été démontré que l’influence directe de la signalisation de la dopamine via l’administration de médicaments augmentant la dopamine, tels que l’amphétamine, psychostimulante, induit une hyperlocomotion, et le sevrage ultérieur a été associé à des symptômes de type dépressif, y compris l’anhédonie14. Il a également été démontré que les défis pharmacologiques liés à la kétamine ou au quinpirole, agoniste des récepteurs D2/D3 de la dopamine, induisent un comportement pertinent pour BD15,16.
En plus de l’intervention pharmacologique, des manipulations de l’environnement, telles que la privation de sommeil, peuvent être utilisées pour induire des phénotypes comportementaux pertinents pour le BD17. Les animaux privés de sommeil présentent un phénotype maniaque caractérisé par une locomotion accrue et l’émission de vocalisations ultrasoniques associées à des changements dans la signalisation de la dopamine18.
Il existe de nombreux autres modèles de rongeurs pour étudier le comportement dépressif19 ou maniaque20 . Cependant, si tous ces modèles ont fortement contribué à la compréhension de la pathologie de la MB, ils sont limités par l’étude d’un seul épisode à la fois ou d’effets à court terme. En revanche, la modélisation du basculement caractéristique entre les états affectifs a été difficile à réaliser.
Ici, un protocole pour un modèle de rat unique pour la BD est présenté. Il démontre une validité apparente accrue en induisant les deux épisodes chez un animal à l’aide d’une seule manipulation ciblée du système dopaminergique, c’est-à-dire en surexprimant conditionnellement le récepteur de la dopamine D1 (DRD1) dans le cortex préfrontal médian (mPFC) à partir d’une construction lentivirale inductible par la tétracycline. En pilotant la transcription des gènes sous le contrôle du promoteur de la calmoduline kinase II alpha (CamKIIa), DRD1 est principalement exprimé dans les neurones glutamatergiques, augmentant ainsi la spécificité de la manipulation génétique.
Le squelette lentiviral original pRRL.cPPT.WPRE.Sin a été fourni par le Dr Didier Trono (Ecole Polytechnique Fédérale de Lausanne, Suisse)21 et modifié en remplaçant le minigène GFP par un site polylinker (vecteur lentiviral PL13). Le PL13 a ensuite été utilisé pour produire le PL13.pTRE2.DRD1.CamKIIa.rtTA3 ou le PL13.pTRE2.dsRedExpress.CamKIIa.rtTA3. L’ADNc de DRD1 de rat a été obtenu du Dr David Sibley (NINDS/NIH)22, et l’ADNc de l’activateur contrôlé par la tétracycline inverse 3 (rtTA3) des Drs Atze Das et Ben Berkhout (Academic Medical Center, Université d’Amsterdam)23. L’ADN promoteur de CamKIIa a été fourni par le Dr Karl Deisseroth (Université de Stanford, Californie), et les séquences dsRedExpress et de l’élément de réponse tétracycline 2 (pTRE2) ont été sous-clonées à partir des plasmides internes pcDNA3.1-dsRedExpress et pcDNA3.1-pTRE2, respectivement. Les vecteurs viraux ont été générés par sous-clonage de séquences d’ADN amplifiées par PCR flanquées de sites de restriction.
Le modèle utilisant ce vecteur viral a démontré que la surexpression de DRD1 dans les neurones positifs à mPFC CamKIIa conduit à un phénotype maniaque24,25, tandis que la régulation négative ultérieure de l’expression génique induit un comportement dépressif26. Étant donné que le phénotype de type maladie peut être induit de manière répétée chez un animal27, le modèle reflète un haut niveau de validité apparente. De plus, les manipulations du système dopaminergique ont une forte validité de construction pour les modèles animaux de BD7, car des changements dans les niveaux28,29 de DRD1 ou les polymorphismes de DRD1 ont été associés à la pathologie de BD30,31,32.
D’autres études animales ont également permis de mieux comprendre les fonctions de DRD1 préfrontal. Par exemple, une diminution de DRD1 a été une constatation cohérente dans des modèles de dépression33,34, tandis que la stimulation optogénétique de DRD1 dans les neurones glutamatergiques mPFC réduit l’anxiété et induit des effets antidépresseurs35. Dans une publication récente de Wu et al.36, le rôle de mPFC DRD1 dans les transitions d’état affectif a été démontré. Cette étude souligne que ces récepteurs sont cruciaux pour les changements sous-jacents de la plasticité des synapses excitatrices.
Dans l’ensemble, l’utilisation d’un modèle de BD chez le rat qui consiste en une manipulation ciblée et conditionnelle de DRD1 dans les neurones CamKIIa-positifs du mPFC constitue un système modèle avec une validité de construction et de surface élevée et, par conséquent, présente un fort potentiel pour la recherche translationnelle sur le BD.
Dans ce qui suit, les procédures chirurgicales pour la génération de modèles sont décrites. De plus, les considérations méthodologiques pour l’induction du modèle et les évaluations comportementales seront présentées aux côtés des résultats représentatifs du phénotype de type maladie qui en résulte. Les obstacles et facteurs d’influence possibles dans la génération de modèles et l’évaluation comportementale sont discutés, et une perspective sur les orientations futures est donnée.
Protocole
Le protocole d’injection stéréotaxique décrit ici a été approuvé par la LANUV (Landesamt für Natur, Umwelt und Verbraucherschutz, Rhénanie-du-Nord-Westphalie, Allemagne). Des rats Sprague Dawley mâles adultes (350-650 g de poids corporel) ont été utilisés. Les réactifs et l’équipement utilisés dans cette étude sont énumérés dans la table des matériaux.
1. Les constructions lentivirales
REMARQUE : Un système lentiviral de troisième génération est utilisé pour l’expression conditionnelle de DRD1 ou de la protéine fluorescente rouge (dsRed) comme condition de contrôle25,27.
- Produire le lentivirus basé sur le protocole de Stewart et al.37 avec les plasmides d’emballage 8454 et 8455 du dépôt Addgene.
REMARQUE : Si la production du virus n’est pas planifiée indépendamment, de nombreuses installations centrales fournissent du lentivirus à titre élevé, comme la Charité Berlin, en Allemagne. - Titrez les virus concentrés et conservez-les à -80 °C.
- Préparer 2 × 107 unités de transduction (UT) par μL pour les préparations injectables.
- Transporter les virus vers le bloc opératoire sur de la glace sèche.
2. Animaux
REMARQUE : Le modèle de rat pour le BD a été établi chez des rats Sprague Dawley mâles adultes (350-650 g de poids corporel). Pour l’étude de rats femelles ou de points de développement plus précoces, il est crucial de considérer que l’expression de DRD1 dans le mPFC change au cours du développement et peut être influencée par le cycle œstral 38,39,40.
- Rats domestiques en paires avec des animaux de même état avec de la nourriture et de l’eau à volonté dans des conditions de température et d’humidité constantes (45 % à 65 % d’humidité relative, température 22 °C ± 2 °C).
- Gardez les rats sous un cycle inverse lumière-obscurité de 12 heures (lumières éteintes à 11 heures), car l’enquête comportementale doit être effectuée pendant la phase active des animaux dans l’obscurité.
- Donnez aux animaux au moins sept jours pour s’acclimater à l’installation et à la manipulation par les expérimentateurs avant le début de toute expérience.
3. Injection stéréotaxique de la construction virale
REMARQUE : Effectuez l’intervention chirurgicale sous une cagoule de sécurité (précaution pour travailler avec le lentivirus) et dans des conditions aseptiques.
- Préparation
- S’assurer que tout le matériel nécessaire est disponible et fonctionnel (Table des matériaux).
- Installez le cadre stéréotaxique avec le porte-seringue fixé au bras stéréotaxique. Connectez le porte-seringue au pousse-seringue.
- Installez la perceuse dentaire et montez une fraise de 0,9 mm.
- Posez le coussin chauffant et réglez-le à 37 °C. Élevez le coussin chauffant à une hauteur appropriée pour faciliter le positionnement du rat.
- Couvrez le coussin chauffant avec un rideau absorbant.
- Préparez les instruments chirurgicaux autoclavés sur une surface stérile.
- Montez une seringue d’injection stéréotaxique de 10 μL avec une aiguille d’injection de 33 G sur le porte-seringue.
- Prélever 2,3 μL de suspension virale pour des injections bilatérales de 1 μl chacune. Confirmez visuellement le retrait réussi. Assurez-vous d’effectuer cette étape comme dernière étape préparatoire afin de minimiser le temps nécessaire pour que le lentivirus soit à température ambiante.
- Induction de l’analgésie et de l’anesthésie
- Le matin de l’opération, administrer du méloxicam (1 mg/kg de poids corporel, p.o.).
- Vingt minutes avant le début des interventions chirurgicales d’analgésie, injectez au rat de la buprénorphine (0,5 mg/kg de poids corporel, s.c.).
- Allumez l’appareil d’anesthésie avec un débit d’oxygène de 0,8 à 1 L/min.
- Inondez la chambre d’induction avec 4 % d’isoflurane et placez le rat dans la chambre d’induction.
- Après l’induction réussie de l’anesthésie, visible par une respiration ralentie et une perte de conscience, retirez le rat de la chambre d’induction et déplacez-le vers le cadre stéréotaxique.
- Positionnement du rat
- Assurez-vous que le débit d’anesthésie est commuté sur le masque nasal.
- Transférez le rat de la chambre d’induction au cadre stéréotaxique, en plaçant ses dents de devant dans le support.
- Placez correctement le masque d’anesthésie sur le nez et tournez l’isoflurane à 1,5-2,3 % pour l’entretien.
- Protégez les yeux avec une crème stérile pour les yeux.
- Au moins 10 minutes avant de faire une incision, injectez localement au rat de la lidocaïne (10 mg/kg de poids corporel, s.c.) directement sous le site d’incision prévu.
- Fixez le rat dans le cadre stéréotaxique à l’aide de barres d’oreille. Assurez-vous que les barres d’oreille sont planes et à un niveau de la tête.
- Coupez la fourrure autour du site d’incision à l’aide de ciseaux. Retirez les morceaux de fourrure à l’aide d’un tampon en cellulose imbibé d’un antiseptique cutané.
- Désinfectez le champ opératoire à l’aide d’un antiseptique cutané.
- Craniotomie et injection de construction virale
- Assurez-vous d’une anesthésie appropriée en vérifiant l’absence de réflexe de l’orteil.
- Désinfectez-vous les mains et mettez des gants stériles avant de toucher tout équipement.
- Faites une petite incision médiale (~1,5 cm) à l’aide d’une lame de scalpel.
- Sécurisez l’accès au champ opératoire en poussant la peau sur les côtés à l’aide de pinces bouledogue.
- Nettoyez le champ opératoire du sang et des tissus restants à l’aide d’échanges stériles. Assurez-vous d’avoir une bonne vision du bregma et un espace antérieur suffisant.
- Définissez les coordonnées A/P et M/L à zéro en fonction de bregma.
- Déplacez le bras stéréotaxique aux coordonnées A/P + 2,7 et M/L ± 0,4 et visualisez à l’aide d’un crayon désinfecté.
- Percez un trou de ~1 mm de diamètre, couvrant les côtés d’injection pour les deux hémisphères.
- Retirez tout sang à l’aide d’un produit d’échange stérile.
- Réglez les coordonnées D/V à zéro à la surface du cerveau et abaissez lentement l’aiguille d’injection à -2,8 pour l’injecter dans la zone prélimbique du mPFC.
- Attendre 5 min pour permettre la relaxation des tissus.
- Injecter 1 μL de suspension virale à un débit de 0,1 μL/min.
- Attendez 5 minutes pour l’absorption avant de retirer lentement l’aiguille.
- Répétez l’injection dans l’autre hémisphère.
- Fermeture et soins postopératoires
- Retirez l’aiguille et fermez l’ouverture du crâne à l’aide de cire d’os.
- Retirez les pinces de bouledogue et suturez la peau (suture chirurgicale 3-0).
- Injectez chez le rat du méloxicam (1 mg/kg, s.c.) pour l’analgésie postopératoire.
- Éteignez l’anesthésie, retirez l’animal du cadre stéréotaxique et placez-le dans sa cage d’origine. Assurez-vous que le rat se réveille complètement.
- Rincez la seringue avec de l’éthanol à 100 % pour désactiver le lentivirus restant, puis distillez duH2O en préparation de l’injection suivante.
- Effectuer une analgésie postopératoire au méloxicam (1 mg/kg, p.o.) toutes les 24 h pendant 3 jours et noter l’état de santé des animaux pendant 1 semaine.
- Animaux domestiques pendant les 24 premières heures après la chirurgie pour éviter que d’autres personnes n’altèrent les sutures. Remettez-les ensuite avec leurs compagnons de cage.
4. Traitement à la doxycycline pour l’induction du modèle
REMARQUE : Démarrez l’induction du modèle dès 24 h après l’injection. On peut également attendre des périodes plus longues entre l’injection et l’induction, jusqu’à plusieurs mois, par exemple pour tester de plus grandes cohortes d’animaux en même temps. Il a été démontré que cela n’influence pas la fonctionnalité de la construction virale.
- Induction d’un épisode maniaque
- Pour induire un phénotype maniaque, donnez aux animaux 0,5 g/L d’hyclate de doxycycline en l’ajoutant à l’eau de boisson. Cela induit la transcription virale et la surexpression de DRD1 supplémentaire.
- Préparez l’eau contenant de la doxycycline fraîchement toutes les 48 à 72 h, une période où la stabilité de la doxycycline n’est pas influencée, même dans les bouteilles d’eau non opaques41.
REMARQUE : Après un traitement à la doxycycline pendant sept jours, la surexpression médiée par le virus aura atteint son maximum et on peut effectuer une enquête comportementale pendant l’épisode de type maniaque.
- Induction d’un épisode de type dépressif
- Remettez les animaux à boire normalement, pour induire un épisode dépressif.
- Attendez 4 jours jusqu’à ce que la transcription virale s’arrête, puis effectuez une évaluation comportementale de l’épisode dépressif.
- Effectuez les déclenchements d’épisodes subséquents selon le même schéma.
5. Évaluation comportementale
REMARQUE : Après l’induction du modèle, on peut évaluer un comportement de type bipolaire. Différents cadres de traduction des symptômes cliniques aux modèles comportementaux observables chez les rongeurs ont été proposés. L’un des plus influents est le critèrede domaine de recherche 42, où les changements dans les domaines du fonctionnement et du comportement, éventuellement affectés dans les troubles psychiatriques, sont examinés. Il est toutefois important de noter qu’en raison de la barrière d’espèce, certains symptômes, par exemple la suicidalité, ne peuvent pas être recherchés chez les rongeurs43. En raison de leurs capacités cognitives et émotionnelles avancées, les modèles de rats ont un potentiel particulièrement fort pour l’évaluation translationnelle des symptômes44, ce qui permet des procédures de test plus élaborées. Les considérations relatives à l’évaluation comportementale sont décrites dans le tableau 1.
- Planifier l’investigation comportementale sous la forme d’une batterie de tests comportementaux45, afin de fournir une image complète du phénotype résultant.
- Faites attention à effectuer des tests plus invasifs en dernier.
- Tenez compte des changements de comportement pouvant résulter d’expériences de test antérieures lorsque vous essayez de tester un animal dans les deux épisodes de maladie.
REMARQUE : Selon la question à poser, il peut être bénéfique de tester différents groupes de rats pendant l’épisode maniaque ou dépressif, ce qui permettrait également de collecter des tissus pendant l’épisode respectif. L’expérience a montré que les tests sur des animaux naïfs peuvent entraîner un phénotype plus important dans certains tests comportementaux. - Tenez également compte d’autres facteurs tels que les conditions de logement46 ou le sexe de l’expérimentateur47.
- Adopter toutes les mesures possibles pour réduire le stress involontaire des animaux, non seulement pour le bien-être des animaux, mais aussi pour exclure les interactions possibles des phénotypes psychiatriques avec le stress48.
- Portez une attention particulière au rythme circadien, car les perturbations du rythme circadien sont un symptôme du BD17. Étant donné que les rats sont plus actifs au crépuscule et à l’aube, il faut tester sous une faible lumière rouge avec des animaux logés sous un cycle inverse lumière-obscurité49.
REMARQUE : La plupart des résultats représentatifs présentés ici ont été recueillis selon cette approche. Un phénotype semblable à celui d’une maladie est cependant toujours observable si l’évaluation comportementale est effectuée sans changer le cycle jour-nuitdes animaux 27. - Pré-enregistrez toujours l’expérience et menez et décrivez en suivant les directives PREPARE50 et ARRIVE51 .
Résultats
Lorsque la doxycycline est ajoutée à l’eau de boisson des animaux, DRD1 supplémentaire sera exprimé, et après 7 jours, il y aura une surexpression suffisante pour tester l’animal pour un comportement maniaque. Jusqu’à présent, une augmentation des comportements liés à la récompense a été démontrée. Les animaux ressemblant à la manie boivent plus de solution de saccharose par rapport à l’eau dans un test de choix de deux bouteilles par rapport aux témoins25. Lorsqu’ils sont placés dans une boîte d’observation avec une femelle réceptive et observés pendant 25 min, les animaux maniaques montrent plus de montures sexuelles que les témoins27 (Figure 1A). Dans un paradigme d’auto-administration de cocaïne, ils administrent plus de cocaïne selon un calendrier à ratio fixe et présentent un point de rupture plus élevé dans un calendrier à ratio progressif. Leur courbe dose-réponse est décalée vers une sensibilité plus élevée aux faibles doses25. Ce changement de sensibilité est également observé dans une saillance motivationnelle accrue dans plusieurs paradigmes de conditionnement de lieu. Les animaux ressemblant à la manie ont passé plus de temps dans les côtés conditionnés pour la nicotine, l’alcool et la cocaïne par rapport aux témoins25. Une recherche accrue de nouveauté et des choix plus impulsifs dans un test basé sur un labyrinthe en T sur l’actualisation différée ont également été constatés25. Dans une version rat opérant de la tâche de jeu de l’Iowa, les animaux ressemblant à la manie décident plus souvent pour les choix désavantageux (risque élevé, gain élevé) que les témoins24 (Figure 1B). L’anxiété chez les animaux maniaques est réduite, comme l’indique le fait de passer plus de temps à bras ouverts dans le labyrinthesurélevé plus 25.
Un phénotype de type dépressif peut être induit en mettant fin à la surexpression de DRD1. Dans l’épisode de type dépressif, une augmentation de l’impuissance a pu être observée. Dans un paradigme triadique de l’impuissance, le groupe qui a été présenté pour la première fois à un choc électrique (Figure 1C), ainsi que le groupe qui avait appris à contrôler le choc, étaient plus impuissants avec des latences d’évasion accrues par rapport à leurs témoins respectifs27. Les groupes dans lesquels l’impuissance a été induite n’ont montré aucune différence entre l’animal d’expérience et l’animal témoin. L’anhédonie a été trouvée dans le test de choix de deux bouteilles pour le saccharose27 et dans le comportement sexuel (données non publiées). Dans l’essai d’enfouissement du marbre, les animaux de type dépressif étaient également plus anxieux26 (Figure 1D).
Le modèle animal décrit offre non seulement la possibilité d’étudier le comportement maniaque ou dépressif, mais il offre également une occasion unique d’observer un changement de comportement lors de la fin de la surexpression de DRD1, ressemblant au passage de la manie à la dépression chez les patients. Ici, il est important de garder à l’esprit l’accoutumance à certains comportements et de choisir des tests avec une accoutumance minimale. Par exemple, une augmentation du comportement sexuel dans l’épisode de type maniaque et dans l’épisode de type dépressif, une réduction de ce comportement à des niveaux similaires à ceux observés chez les animaux témoins a été montrée. Dans cette expérience, trois cycles de type maniaque/dépressif ont été induits chez le même animal27. Pour la consommation de saccharose, la préférence pour la solution de saccharose dans l’état maniaque a non seulement été réduite à des niveaux de contrôle lors du passage à l’état dépressif, mais a diminué de27. Dans la version rat de la tâche de jeu de l’Iowa, le nombre de choix désavantageux était augmenté chez les animaux maniaques, mais pas significativement différent de celui des témoins lorsque les animaux étaient dans un état dépressif. Dans ce dernier état, le nombre total de granulés gagnés a été réduit par rapport aux animaux témoins24.
Dans l’ensemble, les animaux présentent un phénotype bipolaire robuste, observable dans différents domaines comportementaux au cours des deux épisodes. Le passage d’un épisode à l’autre dans ce modèle contribue à améliorer la validité du visage. La figure 2 donne un aperçu des domaines comportementaux affectés.

Figure 1 : Changements comportementaux dans les états de type manie et dépression suite à la surexpression virale de DRD1. Au cours de la surexpression virale de DRD1, dans l’état maniaque, les animaux montrent plus de montures sexuelles (A) et une augmentation des choix risqués dans la tâche de jeu de l’Iowa (B) par rapport aux témoins. Après la fin de la surexpression, les animaux passent à un état dépressif. Ils montrent une augmentation de l’impuissance (C) et de l’anxiété (D). *p < 0,05 ; **p < 0,01 ; Les barres d’erreur indiquent l’erreur type de la moyenne. Veuillez cliquer ici pour voir une version agrandie de cette figure.
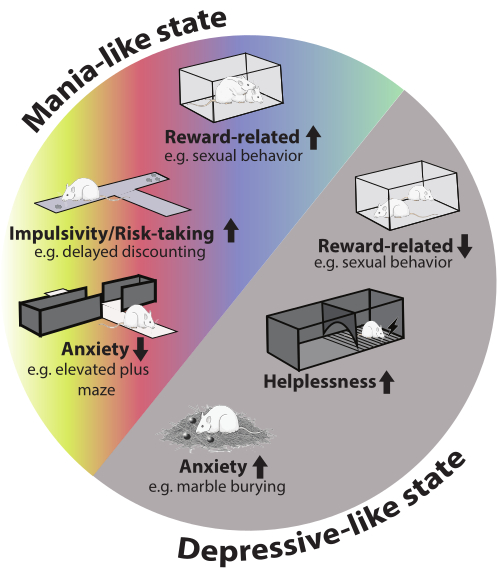
Figure 2 : Phénotype comportemental du modèle. Dans l’épisode de type manie, il y a une augmentation des comportements liés à la récompense (par exemple, le comportement sexuel), de l’impulsivité et de la prise de risque. L’anxiété a été réduite dans le test du labyrinthe élevé. Au cours de l’épisode dépressif, l’anxiété a augmenté dans le test d’enterrement de marbre, le comportement sexuel a été réduit et les animaux ont montré plus d’impuissance. L’image du rat dans la figure a été tirée de Servier Medical Art et est sous licence CC BY 4.0. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Considérations pour l’évaluation comportementale. Le tableau met en évidence les considérations importantes pour les principales étapes expérimentales de l’évaluation comportementale. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Ici, un nouveau modèle de rat pour le BD avec une validité faciale accrue est présenté. Une manipulation ciblée de DRD1 dans le mPFC permet l’induction d’un phénotype maniaque et dépressif chez le même animal. Les résultats représentatifs mettent en évidence un phénotype pathologique observable dans les deux épisodes. Le modèle est relativement facile à appliquer. Deux vecteurs lentiviraux inductibles exprimant DRD1 ou dsRed comme contrôle sont nécessaires. Pour la production et l’utilisation de systèmes lentiviraux chez les animaux, certains niveaux de sécurité sont requis, qui doivent être mis en place. Si l’équipement nécessaire à la production du virus n’est pas disponible, l’expérience de travail avec les installations centrales a été positive.
L’étape la plus cruciale pour générer le modèle est l’injection stéréotaxique du système lentiviral. Les chirurgies stéréotaxiques sont des procédures bien établies en neurosciences, et les taux de réussite parmi les chercheurs formés sont élevés. Il existe deux principales sources d’erreur possibles. Les problèmes d’anesthésie peuvent entraîner des décès pendant l’intervention chirurgicale. Ici, l’utilisation de l’anesthésie par inhalation d’isoflurane, telle que décrite dans le protocole, s’est avérée être la meilleure approche, car les niveaux de médicament facilement ajustables constituent un avantage évident par rapport à l’anesthésie par injection. Étant donné que l’isoflurane n’a pas d’effets analgésiques et que les nocicepteurs méningés sont sensibles à la stimulation52, il est recommandé d’utiliser un opioïde pour l’analgésie peropératoire. Combiné à une médication postopératoire appropriée, comme décrit dans le protocole, il n’y a aucun signe observable de douleur postopératoire. Cependant, il faut toujours tenir compte des influences possibles sur les questions de recherche, par exemple en ce qui concerne les interactions de la dopamine avec le système opioïde, et choisir un régime médicamenteux approprié en conséquence53. Si la chirurgie est réalisée dans des conditions aseptiques, l’apparition d’infections ou d’une altération de la cicatrisation des plaies est rare. En cas de problèmes pendant l’opération ou la convalescence, le dépannage doit se concentrer sur l’exécution correcte du protocole décrit. Il est essentiel d’assurer des conditions de travail aseptiques et un dosage précis des médicaments. L’administration de solutions liquides ou de glucose peut également aider à la récupération. En cas d’infection, le traitement ne doit pas inclure de tétracyclines car celles-ci interagiront avec la transcription des systèmes viraux. Le traitement de première intention des infections postopératoires des plaies serait l’enrofloxacine, éventuellement associée à du carprofène.
Une autre source possible d’erreur lors de la chirurgie est le placement de l’injection en dehors de la zone cible. Cependant, cela se produit rarement lorsque le protocole est suivi correctement et que le bon positionnement de la tête de l’animal est assuré. Le placement réussi doit toujours être vérifié. Alors que le placement du virus exprimant dsRed est facilement détectable chez les animaux témoins, la vérification du placement des virus exprimant DRD1 nécessite des étapes supplémentaires. La coloration des anticorps contre différentes parties de la construction virale n’a pas donné de résultats satisfaisants. Il est recommandé de vérifier l’emplacement du virus en disséquant le mPFC et en effectuant une PCR pour détecter les transcrits rtTA3, comme décrit dans Beyer et al.24. Il est également important de noter que l’injection du virus doit être bilatérale avec des quantités égales de virus. Il a été démontré que la latéralisation cérébrale et comportementale diffère chez les patients atteints de trouble bipolaire54,55, et les injections virales unilatérales peuvent ne pas induire le phénotype comportemental souhaité.
L’induction de l’expression virale de DRD1 et l’épisode maniaque par l’ajout de doxycycline à l’eau de boisson fonctionnent très bien. Il a été prouvé que le remplacement de l’eau potable normale par de la doxycycline ne provoque pas de changements marqués dans le comportement de consommation. Cependant, la consommation de liquide doit être surveillée. Des modulations sont possibles, si d’autres substances, par exemple des médicaments, sont destinées à être administrées par l’eau potable. L’administration de doxycycline pourrait également être effectuée via des granulés alimentaires. Mais cela n’a pas encore été validé.
Pour l’investigation comportementale, plusieurs considérations sont énumérées dans le tableau 1. Les exigences spécifiques au modèle, en particulier, doivent être évaluées lors de la planification d’une expérience. Par exemple, il faut décider si deux groupes d’animaux seront testés ou si un animal subira une évaluation comportementale au cours des deux épisodes, ce qui peut nécessiter de nouveaux tests. Si le phénotype de type bipolaire n’est pas détectable pendant l’enquête comportementale, bien que le placement puisse être vérifié, le dépannage peut se concentrer sur divers facteurs susceptibles d’influencer le résultat comportemental. Les changements chez les expérimentateurs ou le rythme circadien doivent être évalués de manière critique au cours du processus, car les conditions stressantes de l’environnement peuvent influencer les résultats comportementaux.
Bien que le modèle démontre une bonne validité conceptuelle et apparente, la validité prédictive doit encore être évaluée. L’administration chronique de lithium, en tant que traitement de première intention du BD56, devrait réussir à prévenir les changements de comportement induits par le modèle. Les réponses à d’autres médicaments utilisés dans la BD, tels que les antipsychotiques ou les anticonvulsifs, pourraient être étudiées pour tester pleinement la validité prédictive du modèle.
De plus, une limite actuelle est que la validité du modèle chez les animaux femelles doit encore être évaluée dans les études futures. Bien qu’il y ait une tendance à inclure les animaux femelles dans la recherche préclinique, cela est encore souvent négligé. Pour le modèle présenté, il faut s’attendre à des interactions du système dopaminergique avec le cycle œstral. On ne sait toutefois pas dans quelle mesure ils se produiront. Il est également important de garder à l’esprit les limites générales des modèles animaux psychiatriques. Bien que la possibilité d’induire les deux épisodes pathologiques chez un rat offre une validité apparente accrue, les changements induits de l’extérieur diffèrent toujours de l’apparition spontanée et du cycle des épisodes pathologiques chez les patients atteints de MB. Étant donné que le modèle est uniquement basé sur la manipulation ciblée du système dopaminergique, les effets majeurs seront causés par des altérations de la transmission de la dopamine et des effets secondaires connexes. Les contributions d’autres systèmes à la symptomatologie de la MB ne sont donc pas prises en compte.
En conclusion, le modèle présenté a un fort potentiel pour l’étude de la MB, car les deux épisodes de la maladie peuvent être étudiés chez un seul animal. Cela offre des possibilités uniques pour l’étude des transitions entre les épisodes par rapport à la plupart des modèles établis. Le protocole présenté nécessite des équipements et des compétences techniques qui sont disponibles dans la plupart des laboratoires de recherche préclinique, ce qui le rend largement applicable. Jusqu’à présent, le phénotype comportemental qui en résulte a été robuste pour différents comportements. D’autres domaines comme le comportement social57 ou les fonctions cognitives restent à explorer. Bien que le protocole présenté se concentre sur les résultats comportementaux, il existe diverses possibilités d’applications futures pour étudier davantage les mécanismes moléculaires. L’élargissement des recherches pour comprendre les mécanismes sous-jacents de la pathogenèse de la MB, en particulier en ce qui concerne la transition entre les épisodes, pourrait conduire à l’identification de cibles thérapeutiques qui pourraient éventuellement être traduites en applications cliniques futures.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par des subventions de la Fondation allemande pour la recherche (Deutsche Forschungsgemeinschaft, DFG) : projet numéro 552842155 et GRK2862/1, projet n° : 492434978. JA a reçu un financement du Fonds de recherche FoRUM de la Faculté de médecine de la Ruhr-Universität Bochum (subvention n° P109-24). L’image du rat dans la figure 2 a été tirée de Servier Medical Art et est sous licence CC BY 4.0.
matériels
| Name | Company | Catalog Number | Comments |
| 0.9 mm burr | FST | 19007-09 | Burr for craniotomy |
| 10 µl Neuros Syringe | Hamilton | 65460-06 | Mounted to syringe pump for injection |
| 1ml single use Syringes | Braum | 9166017V | Administration of medication |
| 33 G Needles | Hamilton | 65461-02 | Replacement needles for neuros syringe |
| 4-way valve | UNO | 180000259 | For simultaneous connection of induction chamber and face mask |
| Absorbent Drape | Sabanindas | 1834014 | Covering equipment before placing the animal |
| Anaesthetic Gas Filter | UNO | 180000140 | Anesthesia fume collection |
| Anasthesia mask for stereotactic | Hugo Sachs Electronic | 73-4922 | Administering anesthesia during surgery |
| Anesthesia vaporiser | UNO | 180000002 | Provide and adjust levels of vaporised isoflurane |
| Bone wax | SMI | Z046 | Closing the hole in the skull |
| Bulldog clamps | FST | 18038-45 | To retain skin and allow access to the surgical field |
| Buprenorphine | Elanco | 18760711 | Interoperative analgesia |
| Cannula | Tegler | T138339 | Administration of medication |
| Cellulose swabs | Meditrade | 1177 | Cleaning Skin |
| Connector | UNO | 180000005 | Connecting anesthesia tubing to face mask |
| Control Unit for heating pad | UNO | 180000122 | Controlling heating pad |
| Dental Dril | Saeyang | SMT K-38 | Dental drill for craniotomy; equipable with fine dental burrs |
| Desktop digital stereotaxic instrument | RWD | E03135-002 | Fully equipped stereotactic frame with digital manipulator |
| Destilled H2O | - | - | Rinsing the syringe |
| Doxycycline hyclate | Sigma aldrich | D9891 | For model induction |
| Dry ice | - | - | Transporting viral suspension |
| Earbars | RWD | 68302 | Head fixation in the stereotactic frame |
| Ethanol | - | - | Rinsing the syringe and deactivating virus |
| Flowmeter | UNO | CM2 | Verify and adjust flow rate |
| Forceps - anatomical | FST | 11000-12 | Holding skin |
| Forceps - surgical | FST | 11027-12 | Holding skin |
| Heating pad | UNO | 180000028 | Heating pad for keeping the animal warm during surgery |
| Induction chamber | UNO | 180000233 | Chamber for initial induction of anesthesia |
| Isoflurane | CP Pharma | V7005232.00.00 | Anesthesia |
| Lentiviral suspension | - | - | Lentiviral construct coding for DRD1 or dsRed for model induction |
| Lidocaine | Combustin | 8780701 | Local analgesia |
| Meloxicam | Boehringer Ingelheim | 7578423 | Pre- and postoperative analgesia |
| Needle holder | FST | 91201-13 | Sutering |
| Oxygen concentrator | UNO | 180000399 | Providing oxygen for anesthesia |
| PE Tubing | - | - | Connecting components of the anesthesia machine to induction chamber & face mask |
| Pencil | - | - | Marking the correct side for craniotomy |
| Scalpel blade holder | FST | 10003-12 | To hold scalpel blade |
| Scapel blades | FST | 10011-00 | Fine surgical blade for incision |
| Scavenger Unit | UNO | 180000260 | Controlling capacity of fume collector |
| Skin disinfectant | Bode | 975042 | Disinfacting skin before incision |
| Sterile cotton swabs | Boettger | 1102241 | Cleaning surgical field |
| Sterile eye cream | Bayer | 1578675 | Protect eyes during surgery |
| Surgical Scissors | FST | 14000-12 | Trimming fur and cutting suture material |
| Suture 3-0 polyglycolic acid | SMI | 11201519 | Suturing skin |
| Syringe pump | KdScientific | 788130 | Syring pump with connectable holder |
Références
- Müller-Oerlinghausen, B., Berghöfer, A., Bauer, M. Bipolar disorder. Lancet. 359 (9302), 241-247 (2002).
- Grande, I., Berk, M., Birmaher, B., Vieta, E. Bipolar disorder. Lancet. 387 (10027), 1561-1572 (2016).
- Vieta, E., et al. Bipolar Disorders. Nat Rev Dis Primers. 4 (1), 1-16 (2018).
- Lee, J. G., et al. Neuromolecular etiology of bipolar disorder: Possible therapeutic targets of mood stabilizers. Clin Psychopharmacol Neurosci. 20 (2), 228-239 (2022).
- Mohamadian, M., et al. Mood and behavior regulation: Interaction of lithium and dopaminergic system. Naunyn Schmiedebergs Arch Pharmacol. 396 (7), 1339-1359 (2023).
- Berk, M., et al. Dopamine dysregulation syndrome: implications for a dopamine hypothesis of bipolar disorder. Acta Psychiatr Scand. 116 (s434), 41-49 (2007).
- Ashok, A. H., et al. The dopamine hypothesis of bipolar affective disorder: the state of the art and implications for treatment. Mol Psychiatry. 22 (5), 666-679 (2017).
- Zhang, C. -. Y., et al. Genetic evidence for the "dopamine hypothesis of bipolar disorder.". Mol Psychiatry. 28 (2), 532-535 (2023).
- Willner, P. The validity of animal models of depression. Psychopharmacology. 83 (1), 1-16 (1984).
- Beyer, D. K. E., Freund, N. Animal models for bipolar disorder: From bedside to the cage. Int J Bipolar Disord. 5 (1), 35 (2017).
- Valvassori, S. S., Gava, F. F., Cararo, J. H., Quevedo, J. Chapter 9 - The evolution of animal models for bipolar disorder. Neurobiol Bipol Dis. , 109-115 (2021).
- McClung, C. A., et al. Regulation of dopaminergic transmission and cocaine reward by the Clock gene. Proc Natl Acad Sci U S A. 102 (26), 9377-9381 (2005).
- Roybal, K., et al. Mania-like behavior induced by disruption of CLOCK. Proc Natl Acad Sci U S A. 104 (15), 6406-6411 (2007).
- Pathak, G., Ibrahim, B. A., McCarthy, S. A., Baker, K., Kelly, M. P. Amphetamine sensitization in mice is sufficient to produce both manic- and depressive-related behaviors as well as changes in the functional connectivity of corticolimbic structures. Neuropharmacol. 95, 434-447 (2015).
- Krug, J. T., et al. Effects of chronic lithium exposure in a modified rodent ketamine-induced hyperactivity model of mania. Pharmacol Biochem Behav. 179, 150-155 (2019).
- Shaldubina, A., Einat, H., Szechtman, H., Shimon, H., Belmaker, R. H. Preliminary evaluation of oral anticonvulsant treatment in the quinpirole model of bipolar disorder. J Neural Transm. 109 (3), 433-440 (2002).
- Freund, N., Haussleiter, I. Bipolar chronobiology in men and mice: A Narrative review. Brain Sci. 13 (5), 738 (2023).
- Wendler, E., et al. Mania-like elevated mood in rats: Enhanced 50-kHz ultrasonic vocalizations after sleep deprivation. Prog Neuropsychopharmacol Biol Psychiatry. 88, 142-150 (2019).
- Krishnan, V., Nestler, E. J. Animal models of depression: molecular perspectives. Curr Top Behav Neurosci. 7, 121-147 (2011).
- Schmerder, K., Freund, N. Animal models for mania. Psychiatr Vulnerab Mood Anxiety Disord. 190, 233-277 (2023).
- Zufferey, R., et al. Self-inactivating lentivirus vector for safe and efficient in vivo gene delivery. J Virol. 72 (12), 9873-9880 (1998).
- Gardner, B., Liu, Z. F., Jiang, D., Sibley, D. R. The role of phosphorylation/dephosphorylation in agonist-induced desensitization of D1 dopamine receptor function: Evidence for a novel pathway for receptor dephosphorylation. Mol Pharmacol. 59 (2), 310-321 (2001).
- Das, A. T., et al. Viral evolution as a tool to improve the tetracycline-regulated gene expression system. J Biol Chem. 279 (18), 18776-18782 (2004).
- Beyer, D. K. E., Horn, L., Klinker, N., Freund, N. Risky decision-making following prefrontal D1 receptor manipulation. Transl Neurosci. 12 (1), 432-443 (2021).
- Sonntag, K. C., et al. Viral over-expression of D1 dopamine receptors in the prefrontal cortex increase high-risk behaviors in adults: Comparison with adolescents. Psychopharmacology. 231 (8), 1615-1626 (2014).
- Beyer, D. K. E., Mattukat, A., Freund, N. Prefrontal dopamine D1 receptor manipulation influences anxiety behavior and induces neuroinflammation within the hippocampus. Int J Bipolar Disord. 9 (1), 9 (2021).
- Freund, N., Thompson, B. S., Sonntag, K., Meda, S., Andersen, S. L. When the party is over: Depressive-like states in rats following termination of cortical D1 receptor overexpression. Psychopharmacology. 233 (7), 1191-1201 (2016).
- Pantazopoulos, H., Stone, D., Walsh, J., Benes, F. M. Differences in the cellular distribution of D1 receptor mRNA in the hippocampus of bipolars and schizophrenics. Synapse. 54 (3), 147-155 (2004).
- Suhara, T., et al. D1 dopamine receptor binding in mood disorders measured by positron emission tomography. Psychopharmacology. 106 (1), 14-18 (1992).
- Dmitrzak-Weglarz, M., et al. Dopamine receptor D1 Gene -48A/G polymorphism is associated with bipolar illness but not with schizophrenia in a polish population. Neuropsychobiology. 53 (1), 46-50 (2006).
- Rybakowski, J., Dmitrzak-Weglarz, M., Suwalska, A., Leszczynska-Rodziewicz, A., Hauser, J. Dopamine D1 receptor gene polymorphism is associated with prophylactic lithium response in bipolar disorder. Pharmacopsychiatry. 42 (01), 20-22 (2009).
- Severino, G., et al. A48G polymorphism in the D 1 receptor genes associated with bipolar I disorder. Am J Med Genet B Neuropsychiatr Genet. 134B (1), 37-38 (2005).
- Shinohara, R., et al. Dopamine D1 receptor subtype mediates acute stress-induced dendritic growth in excitatory neurons of the medial prefrontal cortex and contributes to suppression of stress susceptibility in mice. Mol Psychiatry. 23 (8), 1717-1730 (2018).
- Yang, Y., Zhong, Z., Wang, B., Wang, Y., Ding, W. Activation of D1R signaling in the medial prefrontal cortex rescues maternal separation-induced behavioral deficits through restoration of excitatory neurotransmission. Behav Brain Res. 441, 114287 (2023).
- Hare, B. D., et al. Optogenetic stimulation of medial prefrontal cortex Drd1 neurons produces rapid and long-lasting antidepressant effects. Nat Commun. 10 (1), 223 (2019).
- Wu, M., et al. Dopamine pathways mediating affective state transitions after sleep loss. Neuron. 112 (1), 141-154 (2024).
- Stewart, S. A., et al. Lentivirus-delivered stable gene silencing by RNAi in primary cells. RNA. 9 (4), 493-501 (2003).
- Andersen, S. L., Thompson, A. T., Rutstein, M., Hostetter, J. C., Teicher, M. H. Dopamine receptor pruning in prefrontal cortex during the periadolescent period in rats. Synapse. 37 (2), 167-169 (2000).
- Brenhouse, H. C., Sonntag, K. C., Andersen, S. L. Transient D1 dopamine receptor expression on prefrontal cortex projection neurons: Relationship to enhanced motivational salience of drug cues in adolescence. J Neurosci. 28 (10), 2375-2382 (2008).
- Thompson, T. L., Moss, R. L. Modulation of mesolimbic dopaminergic activity over the rat estrous cycle. Neurosci Lett. 229 (3), 145-148 (1997).
- Redelsperger, I. M., et al. Stability of doxycycline in feed and water and minimal effective doses in tetracycline-inducible systems. J Am Assoc Lab Anim Sci. 55 (4), 467-474 (2016).
- Insel, T., et al. Research domain criteria (RDoC): Toward a new classification framework for research on mental disorders. Am J Psychiatry. 167 (7), 748-751 (2010).
- von Mücke-Heim, I. -. A., et al. Introducing a depression-like syndrome for translational neuropsychiatry: a plea for taxonomical validity and improved comparability between humans and mice. Mol Psychiatry. 28 (1), 329-340 (2023).
- Ben-Ami Bartal, I. The complex affective and cognitive capacities of rats. Science. 385 (6715), 1298-1305 (2024).
- Jaehne, E. J., Corrone, M., van den Buuse, M. Administering a behavioral test battery in rodents. Neurobiol Methods Protoc. , 87-100 (2024).
- Prager, E. M., Bergstrom, H. C., Grunberg, N. E., Johnson, L. R. The Importance of reporting housing and husbandry in rat research. Front Behav Neurosci. 5, 38 (2011).
- Sorge, R. E., et al. Olfactory exposure to males, including men, causes stress and related analgesia in rodents. Nat Methods. 11 (6), 629-632 (2014).
- Du Preez, A., et al. Do different types of stress differentially alter behavioral and neurobiological outcomes associated with depression in rodent models? A systematic review. Front Neuroendocrinol. 61, 100896 (2021).
- Burn, C. C. What is it like to be a rat? Rat sensory perception and its implications for experimental design and rat welfare. Appl Anim Behav Sci. 112 (1), 1-32 (2008).
- Smith, A. J., Clutton, R. E., Lilley, E., Hansen, K. E. PREPARE: Guidelines for planning animal research and testing. Lab Anim. 52 (2), 135-141 (2018).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biol. 8 (6), e1000412 (2010).
- Messlinger, K., Ellrich, J. Meningeal nociception: Electrophysiological studies related to headache and referred pain. Microsc Res Tech. 53 (2), 129-137 (2001).
- Jirkof, P. Side effects of pain and analgesia in animal experimentation. Lab Anim. 46 (4), 123-128 (2017).
- Moebus, L., Quirin, M., Ehrlenspiel, F. Cerebral asymmetry in bipolar disorders: A scoping review. Biol Psychol. 179, 108551 (2023).
- Mundorf, A., Borawski, J., Ocklenburg, S. Behavioral lateralization in bipolar disorders: A systematic review. Int J Bipolar Disord. 11 (1), 37 (2023).
- Alda, M. Lithium in the treatment of bipolar disorder: Pharmacology and pharmacogenetics. Mol Psychiatry. 20 (6), 661-670 (2015).
- Reinhardt, P. R., Theis, C. D. C., Juckel, G., Freund, N. Rodent models for mood disorders - understanding molecular changes by investigating social behavior. Biol Chem. 404 (10), 939-950 (2023).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon