Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Test immunochimique validé pour la détermination complète du récepteur 2 du facteur de croissance épidermique humain libéré et lié aux cellules
Dans cet article
Résumé
Nous présentons un test ELISA sandwich validé utilisant de nouveaux anticorps monoclonaux anti-HER2. Ce test permet de quantifier avec précision la protéine HER2 liée aux cellules et libérée à partir de cellules cultivées in vitro et d’autres échantillons, y compris le sang et les tissus.
Résumé
Le récepteur 2 du facteur de croissance épidermique humain (HER2) est un marqueur du cancer bien établi. Il est devenu une cible diagnostique et thérapeutique très efficace, en particulier dans le cancer du sein et d’autres types de cancer exprimant HER2. En clinique, les méthodes de diagnostic immunohistochimique de référence utilisant les anticorps anti-HER2 spécifiques sont utilisées pour mesurer le niveau d’expression du récepteur lié à la membrane. Le domaine extracellulaire soluble (ECD) de HER2 qui est libéré par les cellules surexprimant circule dans le sang et peut refléter l’expression tissulaire du récepteur. Il est nécessaire de disposer d’essais précis et validés pour corréler la concentration de la protéine HER2 circulante avec les manifestations cliniques de la maladie.
Notre équipe a développé et validé le nouveau test immuno-enzymatique sandwich (ELISA) pour la quantification du domaine ECD lié à la membrane et libéré des cellules de HER2. Le test utilise deux anticorps monoclonaux uniques spécifiques de HER2 développés précédemment. La plage de quantification comprend une concentration de HER2 de 1,56 à 100 ng/mL, ce qui est attendu pour les cellules cancéreuses cultivées in vitro et montre une sensibilité de 0,5 ng/mL. La précision et l’exactitude satisfaisantes de la méthode à l’intérieur et entre les essais la rendent applicable à la quantification de HER2 dans divers types d’échantillons biologiques, y compris les milieux de culture cellulaire, le sérum et les tissus tumoraux solides. Ici, nous nous concentrons sur la détermination complète du récepteur associé et sécrété par les cellules cancéreuses cultivées in vitro . L’article présente un protocole étape par étape pour la quantification de la protéine HER2 qui peut être utilisé pour tester une variété de lignées cellulaires, de sang et de tissus.
Introduction
Le succès des thérapies modernes est souvent lié à une médecine de précision basée sur l’identification précise des patients sensibles au traitement1. Parmi ces thérapies figurent les médicaments anti-HER2 ciblant le récepteur surexprimé sur une variété de tumeurs, notamment le sein, l’endomètre, l’estomac, le poumon et autres. Plusieurs agents ciblant HER2 sont disponibles avec des bénéfices confirmés chez les patients atteints de cancers HER2-positifs, y compris le type2 HER2-low. La confirmation du statut HER2 positif est essentielle pour l’identification des patients répondeurs potentiels ; cependant, cela reste un défi, en particulier dans le groupe HER2-low.
Les méthodes de référence en milieu clinique, couramment utilisées pour les tests HER2, comprennent l’expression des protéines d’immunohistochimie (IHC) et l’amplification du gène HER2 par des approches d’hybridation in situ en fluorescence (FISH). De plus, le test Oncotype DX est utilisé pour l’expression de l’ARNm HER2. La biopsie tissulaire requise pour ces méthodes rend incertaine la détermination de l’éligibilité du patient à un traitement approprié et de sa réponse potentielle aux traitements. Malgré la mise à jour des directives de 2018 par l’American Society of Clinical Oncology (ASCO) et le College of American Pathologists (CAP) visant à réduire la variabilité entre les unités de test, la concordance HER2 reste un sujet d’amélioration3.
HER2 est un proto-oncogène de la famille des récepteurs du facteur de croissance épidermique (EGFR) dont la surexpression et l’activation dans les états pathologiques entraînent une issue agressive ou contribuent à un mauvais pronostic4. HER2 est une protéine modulaire de 185 kDa ancrée dans la membrane cellulaire qui contient une tyrosine kinase cytoplasmique et un domaine extracellulaire (ECD). L’ECD HER2 peut être excrété des cellules pour être libéré dans la matrice extracellulaire5 en tant que protéine acellulaire, circulant ensuite dans le sang. L’augmentation de l’expression de HER2 pourrait être reflétée par le niveau plus élevé de l’ECD circulant, présentant un marqueur prédictif et pronostique précieux 6,7, un marqueur de substitution de la réponse au traitement8, ou en tant que méthode complémentaire à l’IHC pour identifier les patients éligibles au traitement anti-HER29. Cependant, le défi reste d’établir la corrélation entre l’expression tumorale de HER2 et le niveau systémique du récepteur dans le sang qui pourrait avoir une signification clinique.
L’ECD HER2 libéré peut être quantifié à l’aide d’un test immuno-enzymatique (ELISA)10. L’ELISA sandwich est une approche qui utilise deux anticorps spécifiques se liant à des épitopes différents sur le même antigène cible. Il permet une mesure précise des protéines solubilisées dans le matériel biologique sanguin et liquide facilement accessible (biopsie liquide). Malgré la présence de tests approuvés par la Food and Drug Administration (FDA), l’utilité du diagnostic HER2 ECD5 et la valeur seuil pour une augmentation du taux de HER2 dans le sang suscitent une controverse. Des recherches supplémentaires avec des méthodes validées et des seuils uniformément acceptés sont nécessaires pour confirmer l’applicabilité des tests11.
Les composants critiques de tout ELISA sont la capture (immobilisée sur la plaque et définissant la spécificité et la sensibilité du dosage) et la détection des anticorps (ajoutés après l’application des échantillons) (Figure 1). Dans ce rapport, nous présentons le protocole ELISA basé sur les nouveaux anticorps monoclonaux (mAb) anti-HER2 ECD récemment développés qui ont été générés, purifiés sur une colonne d’affinité et soigneusement caractérisés, et présentons des séquences uniques12. L’ELISA mis au point qui utilise ces anticorps personnalisés montre son utilité pour la quantification précise de la protéine HER2 associée à la membrane cellulaire et libérée dans un milieu de culture pour une évaluation complète de l’état du récepteur. Le test peut être utilisé dans les essais précliniques et pour soutenir la recherche en cours. Les performances du test ont été testées sur des échantillons biologiques de différentes origines, y compris des homogénats de sérum et de tissus12, afin de montrer le potentiel dans le développement de la recherche, des diagnostics et de nouveaux traitements anti-HER2 à l’avenir.
Protocole
1. Culture de cellules cancéreuses humaines
- Cultiver les lignées MDA-MB-231, SK-BR-3 et SK-OV-3 dans le milieu modifié de Dulbecco’s Eagle contenant 4,5 g/L de ᴅ-glucose (DMEM-HG), complété par 2 mM ʟ-glutamine et 10 % (v/v) de FBS inactivé par la chaleur. Incuber les cultures à 37 °C dans une atmosphère humidifiée à 5 % de CO2.
- Lorsque la culture atteint ~80 % de confluence, détacher les cellules par trypsinisation et les rassembler dans des tubes coniques séparés de 15 ml.
- Comptez les cellules à l’aide d’un compteur automatique de cellules et de cellules d’ensemencement pour l’expérience dans des plaques de 12 puits à une densité de 3 × 105 cellules /puits dans 1 mL de milieu de croissance. Incuber les cultures à 37 °C dans une atmosphère humidifiée à 5 % de CO2.
REMARQUE : Semez un puits à chaque point de l’expérience. Le milieu de post-culture et les lysats cellulaires seront utilisés pour une analyse plus approfondie.
2. Prélèvement et préparation des échantillons
- À partir de la culture de 24 heures, prélever le milieu de culture dans un puits de chaque lignée cellulaire dans un tube de 1,5 mL.
- Centrifuger les échantillons prélevés à 10 000 × g pendant 10 min à 4 °C. Transférez le surnageant dans un nouveau tube et conservez-le à -20 °C pour déterminer davantage le niveau de HER2 ECD sécrété.
- Lavez les cellules restantes sur la plaque avec 1 ml de PBS froid, aspirez doucement et jetez le PBS.
- Ajouter 200 μL de tampon RIPA (complété par 1 % d’inhibiteur de protéase) dans chaque puits et incuber pendant 5 min. Racler les cellules avec le racleur cellulaire et mélanger par pipetage plusieurs fois pour homogéner le lysat.
- Prélever les cellules lysées dans un nouveau tube et aspirer lentement dans une seringue de 2 ml à l’aide d’une aiguille (G21 / 0,8 mm × 40 mm). Répétez l’étape d’aspiration 5 à 10 fois pour désintégrer davantage les cellules.
- Centrifuger les échantillons prélevés à 10 000 x g pendant 10 min à 4 °C. Transférez le surnageant dans un nouveau tube et stockez-le à -20 °C pour une détermination plus poussée de la fraction liée aux cellules de la protéine HER2.
- Répétez la collecte du milieu de culture et du matériel cellulaire, en suivant les étapes de préparation pour les points temporels restants - 48 h et 72 h de culture.
3. Réalisation d’un ELISA sandwich pour la détermination de HER2
- Préparez les tampons.
- Tampon d’enrobage : Préparez une solution de NaHCO3 0,1 M en dissolvant 0,42 g de NaHCO3 dans 50 ml d’eau distillée et mélangez soigneusement. Ajustez le pH à 9,6 avec 3 M de NaOH.
- Tampon de blocage : Préparez du lait de vache écrémé à 5 % (NFDM) dans du PBS en ajoutant 0,5 g de lait en poudre à 10 ml de PBS et mélangez soigneusement.
- Tampon de lavage : Préparez une solution saline tamponnée au phosphate avec du Tween 20 (PBST) en ajoutant 0,5 mL de Tween-20 à 0,05 % à 1000 mL de PBS et mélangez (évitez de mousser excessivement).
- Biotinylate l’anticorps détectant.
- Biotinylate 50-200 μg de détection d’anticorps anti-HER2 (clone 70.21.73.67) à l’aide d’un kit d’étiquetage de biotine commercial selon les instructions du fabricant.
REMARQUE : La fiabilité et la répétabilité du procédé de biotinylation sont basées sur la mesure de la concentration protéique finale de l’anticorps résultant et sur la comparaison du produit d’un lot à l’autre.
- Biotinylate 50-200 μg de détection d’anticorps anti-HER2 (clone 70.21.73.67) à l’aide d’un kit d’étiquetage de biotine commercial selon les instructions du fabricant.
- Enduire l’assiette.
- Diluer l’anticorps capteur anti-HER2 (clone 70.27.58) à la concentration de 1 μg/mL dans le tampon d’enrobage. Pour enrober une plaque, utilisez 6,5 mL de la solution d’anticorps de capture.
- À l’aide d’une pipette multicanaux, ajouter 100 μL de la solution d’anticorps de capture (préparée à l’étape 3.3.1) dans chaque puits d’une plaque ELISA à 96 puits.
REMARQUE : Évitez les puits les plus extérieurs de la plaque (par exemple, A1, H12) pour réduire la variabilité causée par l’effet de bord. Les puits les plus extérieurs doivent être remplis d’eau distillée pour assurer des conditions de réaction stables. - Recouvrez la plaque d’un film d’étanchéité.
- Incuber la plaque pendant la nuit (N/H) à 4 °C.
- Après l’incubation O/N, placez la plaque à température ambiante (RT) sur un agitateur de microplaques horizontal (20-30 tr/min avec un angle d’inclinaison de 4°-6°) pendant 1 h.
- À l’aide d’un laveur de microplaques, aspirer la solution de revêtement et laver la plaque trois fois avec un tampon de lavage (3 x 300 μL de PBST par puits).
- Bloquez la plaque.
- À l’aide d’une pipette multicanaux, ajouter 100 μL de tampon de blocage (5 % NFDM en PBS) dans chaque puits enrobé pour bloquer les sites de liaison non spécifiques.
- Recouvrez la plaque d’un film d’étanchéité.
- Incuber la plaque pendant 1 h à 37 °C dans une chambre d’humidité.
- À l’aide d’un laveur de microplaques, aspirer la solution de revêtement et laver la plaque trois fois avec un tampon de lavage (3 x 300 μL de PBST par puits).
- Préparez une courbe d’étalonnage et une commande positive (Figure 2).
- Préparer la solution étalon de travail de l’antigène HER2 en ajoutant 2 μL de solution mère de 1 mg/mL à 1998 μL de PBS pour obtenir une concentration de HER2 de 0,001 mg/mL (1000 ng/mL).
- Diluer la solution étalon de travail (WSS) en ajoutant 200 μL de la solution à 1800 μL de PBS pour obtenir la solution étalon 1 (STD 1).
- Préparer les six étalons suivants (STD 2-STD 7) par dilutions en série de STD 1 dans le PBS (Figure 2).
- IST 2 : Ajouter 500 μL de STD 1 à 500 μL de PBS et bien mélanger pour préparer 50 ng/mL.
- IST 3 : Ajouter 500 μL de STD 2 à 500 μL de PBS et bien mélanger pour préparer 25 ng/mL.
- IST 4 : Ajouter 500 μL de STD 3 à 500 μL de PBS et bien mélanger pour préparer 12,5 ng/mL.
- STD 5 : Ajouter 500 μL de STD 4 à 500 μL de PBS et bien mélanger pour préparer 6,25 ng/mL.
- NORME 6 : Ajouter 500 μL de STD 5 à 500 μL de PBS et bien mélanger pour préparer 3,125 ng/mL.
- NORME 7 : Ajouter 500 μL de STD 6 à 500 μL de PBS et bien mélanger pour préparer 1,5625 ng/mL.
- NORME 8 : Ajouter 500 μL de PBS pour préparer 0 ng/mL.
- Contrôle positif : Diluer la MST 1 en ajoutant 100 μL de la solution de la STD 1 à 900 μL de PBS pour obtenir une solution de HER2 à une concentration protéique de 10 ng/mL.
- Préparer des échantillons pour les expériences de pointe et de récupération.
- Préparez les échantillons de matrice (PBS, lysats cellulaires et milieu de culture) enrichis avec la concentration connue de la protéine HER2. Diluer les lysats cellulaires à l’échelle 1:2000 en ajoutant 2,5 μL de lysat cellulaire approprié à 5 mL de PBS pour obtenir une matrice d’échantillon avec un niveau HER2 inférieur à la LD de la méthode.
- Utilisez WSS (1000 ng/mL) et STD1 (100 ng/mL) pour dépister les échantillons de matrice.
- Pour chaque matrice, préparez 6 échantillons à des concentrations de 0, 2, 5, 10, 30 et 50 ng/mL.
- Pour préparer 0 ng/mL, ajoutez 400 μL de PBS/milieu de culture/lysat cellulaire.
- Pour préparer 2 ng/mL, ajoutez 8 μL de STD1 à 392 μL de PBS/milieu de culture/lysat cellulaire et mélangez soigneusement.
- Pour préparer 5 ng/mL, ajoutez 20 μL de STD1 à 380 μL de PBS/milieu de culture/lysat cellulaire et mélangez soigneusement.
- Pour préparer 10 ng/mL, ajoutez 4 μL de WSS à 396 μL de PBS/milieu de culture/lysat cellulaire et mélangez soigneusement.
- Pour préparer 30 ng/mL, ajoutez 12 μL de WSS à 388 μL de PBS/milieu de culture/lysat cellulaire et mélangez soigneusement.
- Pour préparer 50 ng/mL, ajoutez 20 μL de WSS à 380 μL de PBS/milieu de culture/lysat cellulaire et mélangez soigneusement.
- Ajoutez l’échantillon, le blanc et la norme.
- À l’aide d’une pipette monocanal, ajoutez 100 μL d’étalons, de blanc (PBS) et d’échantillons testés (lysats cellulaires et milieu de culture) dans les puits appropriés.
REMARQUE : Il est conseillé d’exécuter chaque échantillon en trois exemplaires. - Recouvrez la plaque d’un film d’étanchéité.
- Incuber la plaque pendant 1 h à 37 °C dans une chambre d’humidité.
- À l’aide d’un laveur de microplaques, aspirer la solution de revêtement et laver la plaque trois fois avec un tampon de lavage (3 x 300 μL de PBST par puits).
- À l’aide d’une pipette monocanal, ajoutez 100 μL d’étalons, de blanc (PBS) et d’échantillons testés (lysats cellulaires et milieu de culture) dans les puits appropriés.
- Détecter la liaison des anticorps.
- Diluer l’anticorps de détection biotinylé (clone 70.21.73.67) dans du PBS jusqu’à une concentration de travail de 1 μg/mL. Pour une plaque, utilisez 6,5 ml de solution de détection d’anticorps.
- À l’aide d’une pipette multicanaux, ajoutez 100 μL de la solution de détection d’anticorps dans chaque puits.
- Recouvrez la plaque d’un film d’étanchéité.
- Incuber la plaque pendant 1 h à 37 °C dans une chambre d’humidité.
- À l’aide d’un laveur de microplaques, aspirez la solution de revêtement et lavez la plaque trois fois avec un tampon de lavage (3 x 300 μL de PBST par puits).
- Ajouter le conjugué Avidin-HRP.
- Diluer le conjugué Avidin-HRP 1:40 000 disponible dans le commerce en ajoutant 1 μL de conjugué enzymatique à 40 mL de PBST.
- À l’aide d’une pipette multicanaux, ajoutez 100 μL du conjugué dilué dans chaque puits.
- Recouvrez la plaque d’un film d’étanchéité.
- Incuber la plaque pendant 1 h à 37 °C dans une chambre d’humidité.
- À l’aide d’un laveur de microplaques, aspirer la solution de revêtement et laver la plaque trois fois avec un tampon de lavage (3 x 300 μL de PBST par puits).
- Réaction colorimétrique
- À l’aide d’une pipette multicanaux, ajoutez 100 μL de substrat de 3,3′,5,5′-tétraméthylbenzidine (TMB) dans chaque puits.
- Recouvrez la plaque d’un film d’étanchéité.
- Incuber la plaque pendant 1 à 5 minutes à 37 °C à l’abri de la lumière et surveiller l’évolution de la couleur.
- Lorsque la couleur atteint le niveau attendu, ajoutez 100 μL de solution d’arrêt pour terminer la réaction.
REMARQUE : Le niveau attendu correspond à une couleur bleue intense dans les puits contenant des échantillons à forte concentration de l’analyte.
- Acquérir et analyser des données.
- Mesurez l’absorbance à 450 nm à l’aide d’un lecteur de microplaques.
- À l’aide d’une courbe d’étalonnage à 4 paramètres, calculez la concentration de l’échantillon à l’aide de l’équation de la courbe.

Figure 1 : Schéma de principe du flux de travail ELISA sandwich anti-HER2 développé. Aperçu des étapes clés de la procédure ELISA sandwich. Il s’agit notamment des étapes critiques (mises en évidence par un cadre rouge) telles que l’enrobage de la plaque avec l’anticorps anti-HER2 de capture 70.27.58, l’ajout d’échantillons (étalons de courbe, échantillons vierges et expérimentaux des lysats cellulaires ou du milieu de culture) et la liaison de l’anticorps anti-HER2 de détection 70.21.73.67. Le test se termine par la détection du signal et l’analyse des données, où le signal colorimétrique est quantifié à l’aide d’un lecteur de microplaques pour déterminer la concentration de l’antigène cible. Veuillez cliquer ici pour voir une version agrandie de cette figure.
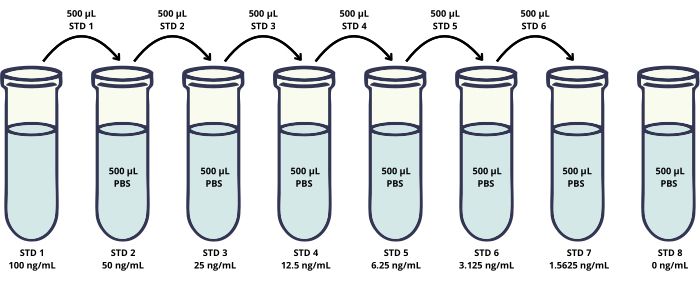
Figure 2 : Schéma de préparation des solutions étalons de la courbe d’étalonnage. Des dilutions en série de la protéine recombinante HER2 sont préparées pour générer une courbe d’étalonnage dans une plage de concentration de 1,56 à 100 ng/mL (flacons STD 1-STD 7). De plus, l’échantillon témoin négatif sans la protéine HER2 est inclus (STD 8). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Validation ELISA sandwich
Le test nouvellement mis au point nécessite une procédure de validation. Les paramètres de validation importants comprennent la linéarité, la précision et les limites de détection, c’est-à-dire la limite inférieure de détection (LLOD) et la limite supérieure de détection. Dans l’article précédent, nous avons effectué une validation approfondie de la méthode. La linéarité ELISA a été testée en utilisant les échantillo...
Discussion
Parmi les composants critiques de la construction d’un ELISA sandwich, il y a la capture des anticorps qui sont immobilisés sur la plaque et contribuent à la spécificité et à la sensibilité du test. Dans le test présenté, nous avons utilisé comme anticorps de capture la nouvelle protéine monoclonale (HER2/70.27.58) générée et caractérisée en interne. L’anticorps avait une séquence unique de la CDR (région déterminant la complémentarité), et sur la base de l’affi...
Déclarations de divulgation
D.L., A.A., A.M., M.S. déclarent le soutien financier de SDS Optic S.A. ; A.A, A.M., M.S. déclarent la propriété de SDS Optic S.A.
Remerciements
L’étude a été financée par la subvention STRATEGMEDII/269364/5/NCBR/2015 du Centre national pour la recherche et le développement et la subvention n° 783818 de l’instrument PME de l’UE pour Horizon 2020.
matériels
| Name | Company | Catalog Number | Comments |
| Biotin labeling kit-NH2 | Abnova | KA0003 | |
| Blotting Grade, powdered milk, low in fat | Roth | T145.1 | |
| Cell Counting Slides for TC10/TC20 cell Counter, Dual-Chamber | Bio-Rad | 145-0011 | |
| Cell Culture Plates | Biologix | 07-6012 | |
| Cell Scrapers | Biologix | 70-1250 | |
| Centrifuge | Ohaus | 30130868 | |
| Class II Biological Safety Cabinet - Telstar Bio II Advance 6 | Telstar | N/A | |
| Clear Flat-Bottom 96-Well Plates | Thermo Fisher | 442404 | |
| Culture Safe CO2 Incubators - Touch 190S | Leec | N/A | |
| Dimethyl sulfoxide | Sigma Aldrich | D2650 | |
| DMEM - high glucose | Sigma Aldrich | D0822 | |
| ELISA plate reader | BioTek | 800TSUVI | |
| FBS Standard, fetal bovine serum | PAN Biotech | P30-19375 | |
| Forced circulation laboratory dryer | BINDER | 9090-0018 | |
| HRP-Avidin | Thermo Fisher | 43-4423 | |
| Human Her2 / ErbB2 Protein, Fc Tag, premium grade | AcroBIOSYSTEMS | HER2-H5253 | |
| Immunowash Microplate Washer | Bio-Rad | 170-7009 | |
| L-Glutamine solution | Sigma Aldrich | G7513 | |
| mAb a-HER2 (clone 70.21.73.67) | SDS Optic | BIO-ABH-2 | |
| mAb a-HER2 (clone 70.27.58) | SDS Optic | BIO-ABH-1 | |
| MDA-MB-231 Cell line | ATCC | HTB-26 | |
| NaHCO3 | POCH | 810530115 | |
| NaOH | POCH | BA0981118 | |
| Protease Inhibitor Cocktail | Sigma Aldrich | P8340 | |
| RIPA Buffer | Sigma Aldrich | R0278 | |
| ROTI Fair PBS | Roth | 1111.2 | |
| SK-BR-3 [SKBR3] Cell line | ATCC | HTB-30 | |
| SK-OV-3 [SKOV-3; SKOV3] Cell line | ATCC | HTB-77 | |
| Stop solution 1x | Abcam | ab210900 | |
| TC20 Automated Cell Counter | Bio-rad | 1450102 | |
| TMB substrate 1x | Abcam | ab210902 | |
| Tween-20 | Sigma Aldrich | P9416 | |
| Vortex | Ohaus | 30392117 | |
| Wave motion shaker | Ohaus | 30391968 |
Références
- Subbiah, V., Kurzrock, R. Debunking the delusion that precision oncology is an illusion. Oncologist. 22 (8), 881-882 (2017).
- Swain, S. M., Shastry, M., Hamilton, E. Targeting HER2positive breast cancer: advances and future directions. Nat Rev Drug Discov. 22 (2), 101-126 (2023).
- McLemore, L. E. et al. HER2 testing in breast cancers: comparison of assays and interpretation using ASCO/CAP 2013 and 2018 guidelines. Breast Cancer Res Treat. 187 (1), 95-104 (2021).
- Iqbal, N., Iqbal, N. Human epidermal growth factor receptor 2 (HER2) in cancers: overexpression and therapeutic implications. Mol Biol Int. 2014, 852748 (2014).
- Tsé, C., Gauchez, A. S., Jacot, W., Lamy, P. J. HER2 shedding and serum HER2 extracellular domain: biology and clinical utility in breast cancer. Cancer Treat Rev. 38 (2), 133-142 (2012).
- Reix, N. et al. A prospective study to assess the clinical utility of serum HER2 extracellular domain in breast cancer with HER2 overexpression. Breast Cancer Res Treat. 160 (2), 249-259 (2016).
- Di Gioia, D. et al. Serum HER2 supports HER2testing in tissue at the time of primary diagnosis of breast cancer. Clin Chim Acta. 430, 86-91 (2014).
- Carney, W. P. et al. Monitoring the circulating levels of the HER2/neu oncoprotein in breast cancer. Clin Breast Cancer. 5 (2), 105-116 (2004).
- Azar, F. P., Fatemeh, H. S. Value of serum human epidermal growth factor receptor 2 (HER2)/neu testing in breast cancer patients to maximize detection of HER2/neupositive patients and susceptibility to trastuzumab. Clin Biochem. 44 (13) (2011).
- Pandey, I., Misra, V., Pandey, A., Verma, A. Expression of HER2/neu in gastric adenocarcinoma and its correlation with serum HER2/neu level and Ecadherin expression. Indian J Pathol Microbiol. 65 (1), 35-41 (2022).
- Agnon, V. et al. ELISA assay employing epitopespecific monoclonal antibodies to quantify circulating HER2 with potential application in monitoring cancer patients undergoing therapy with trastuzumab. Sci Rep. 10 (1), 3016 (2020).
- Antos, A. et al. The unique monoclonal antibodies and immunochemical assay for comprehensive determination of the cellbound and soluble HER2 in different biological samples. Sci Rep. 14 (1), 3978 (2024).
- Andreasson, U. et al. A practical guide to immunoassay method validation. Front Neurol. 6, 179 (2015).
- Perrier, A., Gligorov, J., Lefèvre, G., Boissan, M. The extracellular domain of HER2 in serum as a biomarker of breast cancer. Lab Invest. 98 (6), 696-707 (2018).
- Van Gorkom, T., van Arkel, G. H. J., Voet, W., Thijsen, S. F. T., Kremer, K. Consequences of the edge effect in a commercial enzymelinked immunosorbent assay for the diagnosis of Lyme neuroborreliosis. J Clin Microbiol. 59 (8), e0328020 (2021).
- Sadok, I., Rachwał, K., Staniszewska, M. Simultaneous quantification of selected kynurenines analyzed by liquid chromatographymass spectrometry in medium collected from cancer cell cultures. J Vis Exp. 159, 61031 (2020).
- Giordani, E. et al. Monitoring changing patterns in HER2 addiction by liquid biopsy in advanced breast cancer patients. J Exp Clin Cancer Res. 43 (1), 182 (2024).
- Wu, Y. et al. Imaging and monitoring HER2 expression in breast cancer during trastuzumab therapy with a peptide probe 99mTcHYNICH10F. Eur J Nucl Med Mol Imaging. 47 (11), 2613-2623 (2020).
- NinioMany, L. et al. miR125a induces HER2 expression and sensitivity to trastuzumab in triplenegative breast cancer lines. Front Oncol. 10, 191 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon