Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Nouveau traitement pour les fuites biliaires complexes après une transplantation hépatique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La fuite de bile est une complication fréquente après une transplantation hépatique qui affecte considérablement le pronostic des patients. Le protocole présente une nouvelle méthode de combinaison de la cholangiopancréatographie rétrograde endoscopique (CPRE), du cholédochoscope ramifié et de la cholangioscopie transhépatique percutanée (PTCS) pour traiter les fuites biliaires complexes après une transplantation hépatique.
Résumé
Les fuites biliaires sont une complication fréquente après une transplantation hépatique qui peut généralement être guérie par cholangiopancréatographie rétrograde endoscopique (CPRE), drainage cholangiolien transhépatique percutané (PTCD), cholangioscopie transhépatique percutanée (PTCS) et chirurgie. Nous rapportons un nouveau traitement pour les fuites biliaires qui a duré 9 mois après la transplantation hépatique, au cours duquel la CPRE, le PTCD, le PTCS et le traitement chirurgical ont été vains. Nous avons utilisé une nouvelle méthode de traitement multi-endoscopique. Tout d’abord, la CPRE et la cholangioscopie perorale à opérateur unique sont utilisées pour placer un stent en plastique comme marqueur à l’extrémité distale du site de fuite biliaire. Deuxièmement, le PTCS est effectué par le tube PTCD. Au cours de l’opération, l’extrémité proximale du site de fuite biliaire est localisée par le stent en plastique et l’échographie B, et la continuité des voies biliaires est temporairement reconstruite par le fil-guide et le cathéter urinaire. Troisièmement, un fil-guide à double tête est placé, la sonde urinaire est retirée, les stents sont placés et la continuité biliaire est reconstruite. En conclusion, nous avons trouvé une nouvelle méthode combinant la CPRE, la cholangioscopie perorale à opérateur unique et le PTCS pour traiter les fuites biliaires complexes après une transplantation hépatique.
Introduction
La transplantation hépatique est devenue une norme de soins chez les patients atteints d’une maladie hépatique en phase terminale. Après une transplantation hépatique, environ 1/3des patients sont touchés par des complications des voies biliaires, ce qui entraîne une morbidité importante et une diminution de la survie des patients, ce qu’on appelle le talon d’Achille de la transplantation hépatique1. Les fuites biliaires sont la deuxième complication la plus fréquente après la transplantation hépatique, avec une incidence de 2 à 21 %2,3,4. Les approches couramment utilisées pour traiter les complications biliaires comprennent la cholangiopancréatographie rétrograde endoscopique (CPRE), le drainage cholangiographique transhépatique percutané (PTCD), la cholangioscopie transhépatique percutanée (PTCS) et la chirurgie5, mais elles ne sont pas toutes efficaces.
L’objectif de cette méthode est de traiter les fuites biliaires complexes après une transplantation hépatique en combinant la CPRE, la cholangioscopie perorale à opérateur unique et le PTCS.
Le principe technique de cette méthode est divisé en trois étapes. Tout d’abord, grâce à la CPRE et à la cholangioscopie perorale à opérateur unique, l’extrémité distale de la fuite biliaire est identifiée en vision directe, et un stent en plastique est placé comme marqueur. Ensuite, grâce au PTCS, sous la direction de l’endoprothèse en plastique, l’extrémité proximale de la fuite biliaire est recherchée à partir du canal hépatique commun en vision directe, et le cathéter urinaire reconstruit la continuité des voies biliaires. Enfin, grâce à la CPRE, un fil-guide à double tête est utilisé, le cathéter urinaire est retiré et les endoprothèses des canaux hépatiques gauche et droit sont placées pour reconstruire la continuité biliaire.
La cholangioscopie perorale (POCS) a été signalée pour la première fois par le Japon en 19766. Chen et al.7 ont signalé pour la première fois la première génération de système de cholédochoscope de visualisation à opérateur unique, SpyGlass, en 2007, et la deuxième génération de SpyGlass (SpyGlass DS) a été lancée par Boston en 20158. Avec le développement des instruments, la cholangioscopie perorale à opérateur unique est devenue plus fine et a plus de fonctions.
Le plus grand avantage de cette méthode est qu’elle peut être réalisée sous la vision directe de la cholangioscopie perorale à opérateur unique, ce qui augmente le taux de réussite et la sécurité de l’opération 9,10,11,12. Rainer9 a signalé une mise en place réussie d’un stent à l’aide d’un système de vision biliaire directe chez des patients post-transplantation hépatique présentant un échec d’implantation d’un stent ERCP, et ils ont suggéré que la visualisation directe de la minuscule ouverture au niveau du rétrécissement biliaire était le seul moyen de réussir le passage du fil-guide.
Cette méthode convient aux patients présentant des fuites biliaires complexes après une transplantation hépatique qui ne peuvent pas être guéris par la CPRE, le PTCD, le PTCS et la chirurgie.
Nous rapportons le cas d’un homme de 38 ans qui avait des antécédents de maladie de Crohn et de vitiligo en plus d’une insuffisance hépatique aiguë ou chronique provoquée par une épidémie du virus de l’hépatite B. La fonction hépatique a diminué au fil du temps malgré des traitements artificiels répétés du foie. Lorsqu’un enfant de 15 ans atteint de mort cérébrale a fourni un foie de donneur compatible, une fuite de bile s’est produite 14 jours après la transplantation hépatique (figure 1A). Le tube de drainage de la cavité abdominale et le PTCD ont été installés immédiatement en raison de douleurs abdominales aiguës et d’un choc septique. Après le drainage, l’état de santé général du patient s’est amélioré et la quantité d’épanchement péritonéal a été considérablement réduite (Figure 1B).
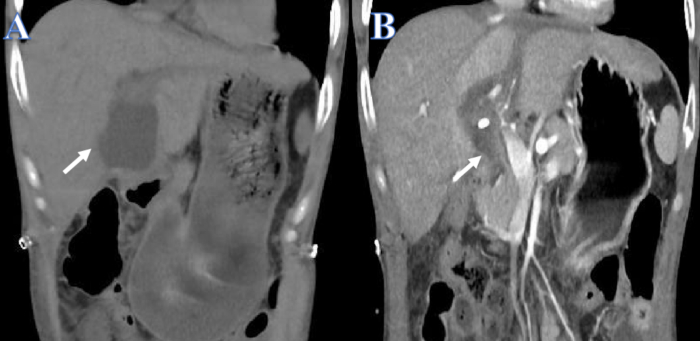
Figure 1 : Avant et après le drainage de la fuite de bile. (A) La flèche blanche indique le liquide avant le drainage. (B) La flèche blanche indique le liquide après drainage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Après 3 semaines, le canal biliaire intrahépatique était insuffisant pour supporter le fil-guide, qui passait facilement à travers le canal biliaire intrahépatique vers d’autres endroits, de sorte que la tentative de reconstruction des voies biliaires de haut en bas à travers le tube PTCD dans les canaux hépatiques gauche et droit a échoué (Figure 2). Après 4 semaines, une tentative de reconstruction des voies biliaires à l’aide de la CPRE de bas en haut a échoué car le fil-guide ne pouvait pas passer à travers le rétrécissement dans le canal biliaire intrahépatique (Figure 3). Après 2 semaines, le canal cholédoque n’a pas pu être localisé, et il y avait de nombreux calculs à la jonction des canaux hépatiques gauche et droit dans l’hilaire, rendant impossible la reconstruction des voies biliaires de haut en bas avec le PTCS. Environ 4 semaines plus tard, une tentative de reconstruction des voies biliaires par cholédochojéjunostomie a échoué en raison de l’inflammation et de l’œdème évidents du tissu entourant la fuite biliaire, et les antécédents de Crohn du patient ont considérablement augmenté le risque de fuite biliaire postopératoire avec fistule intestinale.

Figure 2 : Continuité biliaire reconstruite par PTC. (A) La flèche blanche indique une tentative du canal hépatique gauche. (B) La flèche blanche indique une tentative à partir du canal hépatique droit. Veuillez cliquer ici pour voir une version agrandie de cette figure.
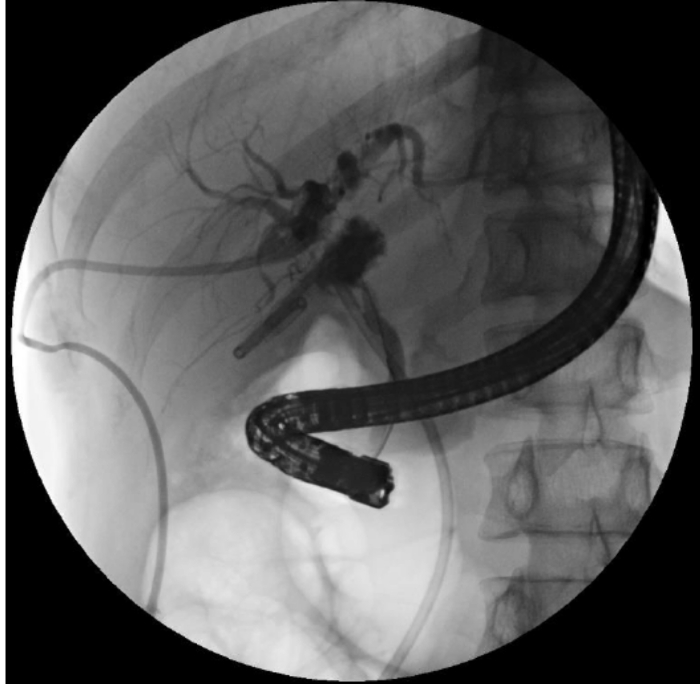
Figure 3 : Continuité biliaire reconstruite par CPRE. Le fil-guide n’a pas pu pénétrer dans le canal biliaire intrahépatique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ici, nous avons trouvé une nouvelle méthode de combinaison de la CPRE, de la cholangioscopie perorale à opérateur unique et du PTCS pour traiter les fuites biliaires complexes après une transplantation hépatique. Une endoprothèse en plastique a d’abord été placée pour localiser l’extrémité distale de la fuite biliaire par CPRE et cholangioscopie perorale à opérateur unique. L’extrémité proximale de la fuite biliaire a ensuite été localisée par l’échographie PTCS et B, et enfin, la continuité des voies biliaires a été reconstruite par CPRE.
Access restricted. Please log in or start a trial to view this content.
Protocole
L’étude était conforme aux directives éthiques de la Déclaration d’Helsinki de 1975 et a été approuvée par le Comité d’éthique du premier hôpital affilié de l’Université Sun Yat-sen. Le consentement éclairé a été obtenu du patient.
1. Préparation préopératoire
- Demandez au patient d’être à jeun pendant 6 à 8 heures avant la CPRE. Administrer de la péthidine 1 mg/kg, de l’anisodamine 20 mg, du midazolam injectable 1 mg, du flurbiprofène 100 mg par voie intraveineuse et du chlorhydrate de tétracaïne par voie orale. Lorsque le réflexe pharyngé a disparu, l’anesthésie locale, la sédation et l’analgésie ont été jugées efficaces.
2. Mise en place d’un stent en plastique
- Assurez-vous que le patient est placé en position couchée, et une fois que la profondeur de l’anesthésie est satisfaisante, commencez la procédure. Insérez le duodénoscope dans la bouche, passez-le dans l’œsophage et l’estomac pour atteindre le duodénum, et trouvez la papille duodénale.
- Insérez le fil-guide dans le canal cholédoque.
- Administrer l’injection d’iopromide (concentration d’iode de 300 mg/mL) à raison de 2 mL/s par le tube de CPRE ou de PTCD. Observer la cholangiographie des canaux biliaires intrahépatiques et extrahépatiques après l’injection et identifier le rétrécissement des canaux biliaires. Notez que le rétrécissement du canal biliaire est situé dans le canal hépatique commun et que les canaux biliaires intrahépatiques et extrahépatiques ne peuvent pas être visualisés simultanément (Figure 4A).
- Dilater l’ouverture inférieure du canal cholédoque à l’aide d’un ballonnet de dilatation de 6 à 8 mm à 7 mm en injectant de l’iopromide dans le ballonnet.
- Insérer la cholangioscopie perorale à opérateur unique pour observer le canal biliaire, trouver les sténoses qui ne peuvent pas être traversées et insérer le fil-guide à travers le rétrécissement, suivie d’une dilatation avec une bougie de dilatation biliaire de 6 mm.
- Dilater la sténose à l’aide d’un ballonnet de dilatation de 6 à 8 mm à 7 mm en injectant de l’iopromide (figure 4B).
- Insérez à nouveau la cholangioscopie perorale à opérateur unique pour observer le canal biliaire. Notez le canal biliaire aveugle avec des calculs et du matériel floculant, sans canal biliaire intrahépatique observé même après l’injection d’iopromide.
- Placez une endoprothèse biliaire en plastique de 7F x 7 cm dans le conduit aveugle à travers le rétrécissement, et l’autre extrémité a été placée hors de la papille duodénale (Figure 4C).
- Tout au long de l’intervention, fournissez de l’oxygène par une canule nasale à 3 L/min et surveillez de près les signes vitaux pendant la CPRE. Ensuite, fournissez des médicaments pour l’inhibition de l’acide (ésoméprazole 40 mg deux fois par jour), l’inhibition enzymatique (octréotide 0,6 mg Q12H), la nutrition parentérale (émulsion de graisse, acides aminés (17) et injection de glucose (1 %) 1920 mL QD), l’inhibition de la douleur (Flurbiprofène 100 mg QD) et l’inhibition de l’infection (céfopérazone sodique et sulbactam sodique pour injection 1,5 g Q8H). Effectuez un test d’amylase après l’opération.
- Terminez l’opération et demandez au patient d’être à jeun jusqu’à ce que le taux d’amylase retombe à la normale. Observez de près le patient pour détecter des douleurs abdominales, des méléna, etc.
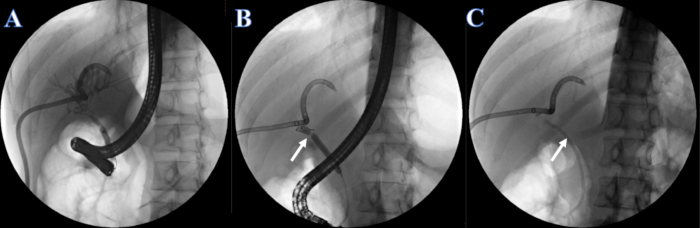
Figure 4 : Endoprothèse en plastique placée par la CPRE. (A) Cholangiographie PTCD. (B) La flèche blanche indique la section étroite. (C) La flèche blanche indique un stent en plastique. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Placement de la sonde urinaire
- Après 1 semaine de convalescence, demandez au patient de s’allonger en position couchée et d’administrer une anesthésie. Désinfectez la peau de l’épigastre avec de l’iodophore à 0,5 % et couvrez-la avec des serviettes stériles.
- Après avoir confirmé la bonne anesthésie anesthésique, insérez le fil-guide le long du tube PTCD, retirez le tube PTCD et placez un tube de gaine de protection 20F le long du fil-guide. Retirez le fil-guide et placez un cholédochoscope le long de la gaine.
- Rincer la matière floculante jaune observée dans les canaux biliaires des lobes hépatiques droit et gauche avec une solution saline normale.
- Identifiez le canal hépatique commun en trouvant la jonction des canaux hépatiques gauche et droit sous la direction de l’échographie B. Rincer la matière floculante jaune dans l’ouverture du canal hépatique commun et dilater la sténose du canal hépatique commun avec des ballons de 6 mm et 8 mm.
- Identifiez le canal cholédoque à l’aide de l’endoprothèse en plastique placée à l’étape 2 sous guidage par échographie B. Insérez le cholédochoscope le long du canal hépatique commun, puis rincez et dilatez le segment sténosé du canal hépatique commun à plusieurs reprises. Ouvrez complètement le segment sténosé et trouvez le stent en plastique placé à l’étape 2.
- Insérez le fil-guide dans la papille duodénale, retirez la gaine et insérez un cathéter urinaire 12F le long du fil-guide jusqu’au duodénum. Une fois cela fait, retirez le fil-guide.
- Coudre la peau avec une aiguille conique et une suture non résorbable 0-0/T et nouer la suture sur la peau et la sonde urinaire.
- Retournez le patient dans le service et administrez-lui un médicament pour l’inhibition de l’acide (ésoméprazole 40 mg deux fois par jour), l’inhibition enzymatique (octréotide 0,6 mg Q12H), la nutrition parentérale (émulsion de graisse, acides aminés (17) et glucose (1 %) injection 1920 mL QD), l’inhibition de la douleur (flurbiprofène 100 mg QD) et l’inhibition de l’infection (céfopérazone sodique et sulbactam sodique pour injection 1,5 g Q8H). Effectuez un test d’amylase après l’opération.
- Demandez au patient d’être à jeun jusqu’à ce que le taux d’amylase redescende à la normale. Observez de près le patient pour détecter des douleurs abdominales, des méléna, etc.
4. Mise en place d’une endoprothèse biliaire
- Après 1 semaine de convalescence, placez le stent biliaire. Demandez au patient de s’allonger en position couchée et d’administrer l’anesthésie. Vérifiez que l’endoprothèse en plastique et le cathéter urinaire sont en place (Figure 5A).
- Après une bonne anesthésie, insérez le duodénoscope dans la bouche, passez-le dans l’œsophage et l’estomac, atteignez le duodénum et trouvez la papille duodénale. Identifiez le cathéter urinaire et les extrémités de l’endoprothèse en plastique et retirez l’endoprothèse en plastique de la bouche.
- Insérez le fil-guide à double tête le long de la sonde urinaire. Assurez-vous d’entrer correctement le fil-guide dans le duodénum, puis clampez avec un clamp à corps étranger, en passant à travers le duodénum, l’estomac et l’œsophage, et retirez-le de la bouche.
- Coupez la ligne de fixation cutanée de la sonde urinaire et retirez la sonde urinaire. Sous fluoroscopie à rayons X, ajustez l’autre extrémité du fil-guide à deux têtes dans le canal hépatique droit en tirant le fil-guide à deux têtes du côté de la bouche (Figure 5B).
- Insérez un autre fil-guide dans le canal hépatique gauche (Figure 5B).
- Placez un canal biliaire en queue de cochon double de 7 ° F x 7 cm dans le canal hépatique gauche (figure 5C) et une endoprothèse en plastique de 8,5 ° F x 12 cm dans le canal hépatique droit, l’autre extrémité partant de la papille duodénale (figure 5D).
- Tout au long de l’intervention, fournissez de l’oxygène par une canule nasale à 3 L/min et surveillez de près les signes vitaux pendant la CPRE. Ensuite, fournissez des médicaments pour l’inhibition de l’acide (ésoméprazole 40 mg deux fois par jour), l’inhibition enzymatique (octréotide 0,6 mg Q12H), la nutrition parentérale (émulsion de graisse, acides aminés (17) et injection de glucose (1 %) 1920 mL QD), l’inhibition de la douleur (Flurbiprofène 100 mg QD) et l’inhibition de l’infection (céfopérazone sodique et sulbactam sodique pour injection 1,5 g Q8H). Effectuez un test d’amylase après l’opération.
- Terminez l’opération. Demandez au patient d’être à jeun jusqu’à ce que le taux d’amylase redescende à la normale. Observez de près le patient pour détecter des douleurs abdominales, des méléna, etc.
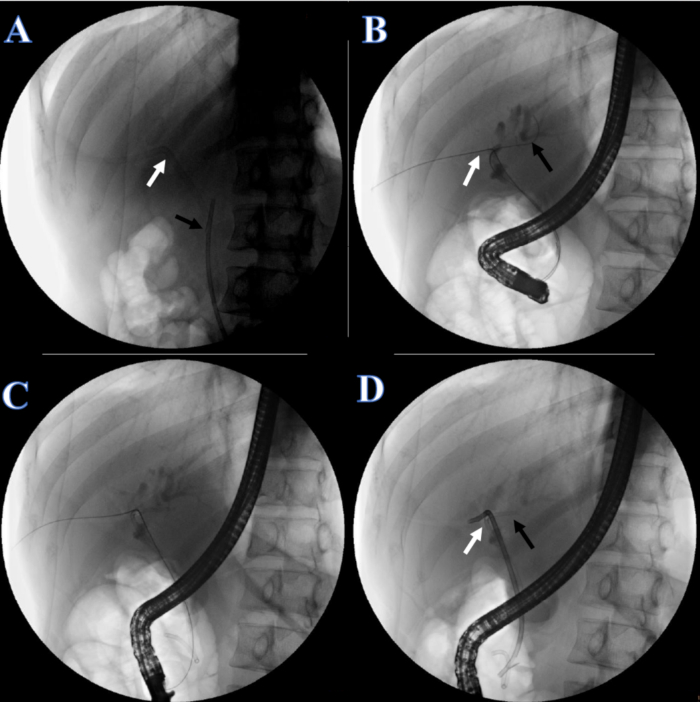
Figure 5 : Continuité biliaire reconstruite par CPRE. (A) La flèche blanche indique le tube PTCD. La flèche noire indique le stent en plastique. (B) La flèche blanche indique le double fil-guide traversant le canal hépatique droit. La flèche noire indique un fil-guide traversant le canal hépatique gauche. (C) Un stent en plastique pour le canal hépatique gauche. (D) La flèche blanche indique l’endoprothèse en plastique du canal hépatique droit. La flèche noire indique l’endoprothèse en plastique du canal hépatique gauche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Résultats
Nous décrivons une nouvelle méthode combinant la CPRE, la cholangioscopie perorale à opérateur unique et le PTCS pour traiter les fuites biliaires complexes après une transplantation hépatique. Pour reconstruire la continuité biliaire, nous avons placé un canal biliaire double en queue de cochon de 7 x 7 cm dans le canal hépatique gauche (figure 5C) et un stent en plastique de 8,5 x 12 cm dans le canal hépatique dro...
Access restricted. Please log in or start a trial to view this content.
Discussion
Dans l’étude, nous avons trouvé une nouvelle méthode de combinaison de la CPRE, de la cholangioscopie perorale à opérateur unique et du PTCS pour le traitement des fuites biliaires complexes après une transplantation hépatique. Les étapes clés de cette méthode étaient les suivantes : tout d’abord, dans le cadre de la cholangioscopie perorale à opérateur unique, l’extrémité de la fuite de bile a été identifiée et un stent en plastique a été placé. Deuxièmement,...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce travail a été soutenu par des subventions de la Fondation nationale des sciences naturelles de Chine (81873591) ; la Fondation des sciences naturelles du Guangdong (2022A1515011052) ; le projet de planification scientifique et technologique de la province du Guangdong (2018A050506030) ; le Programme de science et de technologie de Guangzhou (201704020073) ; la projection de la construction d’un laboratoire clé de la province du Guangdong sur l’immunologie du don et de la transplantation d’organes (2013A061401007 et 2017B030314018) ; et la Base de coopération internationale de la province du Guangdong pour la science et la technologie (transplantation d’organes) (2015B050501002).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Biliary stent | Boston Scientific | M00533560 | 7 F*7 cm |
| Branch choledochoscope | Leinzett | LAN-EP-2612 | |
| Disposable electric snare | Boston Scientific | M00562320 | |
| Disposable sphincterotomy knife | Boston Scientific | M00545170 | |
| Electronic choledochoscope | Olympus | / | |
| Electronic duodenum mirror | Olympus | / | |
| Guidewire | Boston Scientific | M00556140 | |
| Guidewire guided the dilated balloon catheter | Boston Scientific | M00558600 | |
| Integrated biliary stent | Boston Scientific | M00539210 | 7 F*7 cm |
| Integrated biliary stent | Boston Scientific | M00539280 | 8.5 F*12 cm |
Références
- Duffy, J. P., et al. Long-term patient outcome and quality of life after liver transplantation: Analysis of 20-year survivors. Ann Surg. 252 (4), 652-661 (2010).
- Riediger, C., et al. T-tube or no t-tube in the reconstruction of the biliary tract during orthotopic liver transplantation: Systematic review and meta-analysis. Liver Transpl. 16 (6), 705-717 (2010).
- Wojcicki, M., Milkiewicz, P., Silva, M. Biliary tract complications after liver transplantation: A review. Dig Surg. 25 (4), 245-257 (2008).
- Thuluvath, P. J., Pfau, P. R., Kimmey, M. B., Ginsberg, G. G. Biliary complications after liver transplantation: The role of endoscopy. Endoscopy. 37 (9), 857-863 (2005).
- Macías-Gómez, C., Dumonceau, J. M. Endoscopic management of biliary complications after liver transplantation: An evidence-based review. World J Gastrointest Endosc. 7 (6), 606-616 (2015).
- Nakajima, M., Akasaka, Y., Fukumoto, K., Mitsuyoshi, Y., Kawai, K. Peroral cholangiopancreatosocopy (pcps) under duodenoscopic guidance. Am J Gastroenterol. 66 (3), 241-247 (1976).
- Chen, Y. K., et al. Single-operator cholangioscopy in patients requiring evaluation of bile duct disease or therapy of biliary stones (with videos). Gastrointest Endosc. 74 (4), 805-814 (2011).
- Kulpatcharapong, S., Pittayanon, R. S. J. K., Rerknimitr, R. Diagnostic performance of different cholangioscopes in patients with biliary strictures: A systematic review. Endoscopy. 52 (3), 174-185 (2020).
- Rainer, F., et al. A novel way to avoid reoperation for biliary strictures after liver transplantation: Cholangioscopy-assisted guidewire placement. Endoscopy. 51 (11), E314-E316 (2019).
- Bokemeyer, A., et al. Digital single-operator cholangioscopy: A useful tool for selective guidewire placements across complex biliary strictures. Surg Endosc. 33 (3), 731-737 (2019).
- Woo, Y. S., et al. Spyglass cholangioscopy-assisted guidewire placement for post-ldlt biliary strictures: A case series. Surg Endosc. 30 (9), 3897-3903 (2016).
- Martins, F. P., Seleti, S. M. R., Contini, M. L., Ga, D. E. P., Ferrari, A. P. Is there a place for cholangioscopic evaluation of biliary anastomotic stricture after deceased donor liver transplant. Arq Gastroenterol. 57 (4), 347-353 (2020).
- Magro, B., Tacelli, M., Mazzola, A., Conti, F., Celsa, C. Biliary complications after liver transplantation: Current perspectives and future strategies. Hepatobiliary Surg Nutr. 10 (1), 76-92 (2021).
- Arain, M. A., Attam, R., Freeman, M. L. Advances in endoscopic management of biliary tract complications after liver transplantation. Liver Transpl. 19 (5), 482-498 (2013).
- Tsujino, T., et al. Endoscopic management of biliary complications after adult living donor liver transplantation. Am J Gastroenterol. 101 (10), 2230-2236 (2006).
- López Álvarez, M., Otero, M., Vázquez Millán, M. A., Suárez López, F., Alonso Aguirre, P. Endoscopic treatment of biliary complications after liver transplantation. Rev Esp Enferm Dig. 112 (8), 605-608 (2020).
- Alves, A. R., Gomes, D., Furtado, E., Tomé, L. Efficacy of endoscopic retrograde cholangiopancreatography in the treatment of biliary complications following liver transplant: 10 years of a single-centre experience. GE Port J Gastroenterol. 25 (1), 10-17 (2018).
- Yasen, A., et al. Efficiency of percutaneous transhepatic cholangioscopy in the treatment of biliary complications after liver transplantation. HPB (Oxford). 25 (4), 463-471 (2023).
- Zimmerman, M. A., et al. resolution of biliary complications after living and deceased donor liver transplantation: A report from the adult-to-adult living donor liver transplantation cohort study consortium. Liver Transpl. 19 (3), 259-267 (2013).
- Moy, B. T., Birk, J. W. A review on the management of biliary complications after orthotopic liver transplantation. J Clin Transl Hepatol. 7 (1), 61-71 (2019).
- Wadhawan, M., Kumar, A. Management issues in post living donor liver transplant biliary strictures. World J Hepatol. 8 (10), 461-470 (2016).
- Enochsson, L., et al. Nationwide, population-based data from 11,074 ercp procedures from the swedish registry for gallstone surgery and ercp. Gastrointest Endosc. 72 (6), 1184.e1171-1173 1175-1184 (2010).
- Khan, M. A., et al. Endoscopic ultrasound-guided biliary drainage: A systematic review and meta-analysis. Dig Dis Sci. 61 (3), 684-703 (2016).
- Dhir, V., et al. Endoscopic ultrasonography-guided biliary and pancreatic duct interventions. Dig Endosc. 29 (4), 472-485 (2017).
- Derdeyn, J., Laleman, W. Current role of endoscopic cholangioscopy. Curr Opin Gastroenterol. 34 (5), 301-308 (2018).
- Iwashita, T., Doi, S., Yasuda, I. Endoscopic ultrasound-guided biliary drainage: A review. Clin J Gastroenterol. 7 (2), 94-102 (2014).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon