Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Paradigme Stroop à double tâche pour détecter les déficits cognitifs chez les patients de haut niveau victimes d’un AVC
Dans cet article
Résumé
Les échelles d’évaluation clinique ne sont pas suffisamment sensibles au dysfonctionnement cognitif chez les patients victimes d’un AVC de haut niveau. Le paradigme de la double tâche présente des avantages et un potentiel dans l’évaluation et l’entraînement cognitif du dysfonctionnement cognitif. L’étude propose ici un paradigme de Stroop à double tâche pour identifier le dysfonctionnement cognitif chez les patients victimes d’un AVC de haut niveau.
Résumé
Les échelles d’évaluation cognitive clinique générale ne sont pas suffisamment sensibles aux troubles cognitifs chez les patients ayant subi un AVC de haut niveau. L’évaluation à double tâche présente des avantages pour identifier les déficits cognitifs chez les patients victimes d’un AVC de haut niveau et a été progressivement appliquée à l’évaluation clinique et à l’entraînement cognitif. De plus, le paradigme de Stroop a une sensibilité et une spécificité plus élevées pour l’évaluation attentionnelle que les échelles d’évaluation cognitive clinique conventionnelles. Par conséquent, cette étude présente l’évaluation à double tâche basée sur le paradigme de Stroop pour identifier les déficits cognitifs chez les patients de haut niveau ayant subi un AVC. Cette étude démontre une évaluation à une ou deux tâches basée sur le paradigme de Stroop et confirme sa faisabilité par des expériences de cas et une évaluation synchronisée de spectroscopie fonctionnelle proche infrarouge. Le temps de réaction de Stroop et le taux correct sont utilisés comme principaux indicateurs pour évaluer le niveau cognitif des sujets. Ce protocole d’étude vise à fournir de nouvelles idées pour comprendre l’effet de plafond dans l’échec de l’évaluation clinique générale chez les patients de haut niveau de fonctionnement d’un AVC.
Introduction
L’AVC est la principale cause d’invalidité chez l’homme1 et peut causer divers degrés de déficits moteurs, cognitifs, émotionnels et autres déficits fonctionnels2. Certains patients victimes d’un AVC avec un meilleur pronostic et seulement de légères déficiences fonctionnelles montrent une plus grande autonomie fonctionnelle dans les activités quotidiennes, mais l’état fonctionnel de leur incapacité peut ne pas être suffisant pour soutenir leur retour au travail ou leurs activités antérieures. Ces patients sont appelés patients ayant subi un AVC de haut niveau 3,4. En raison de leurs déficits fonctionnels mineurs, il est difficile d’identifier leurs dysfonctionnements, notamment en termes de fonctions cognitives, par l’évaluation générale des échelles fonctionnelles, telles que l’évaluation cognitive de Montréal (MoCA)5 et la cote clinique de démence (CDR)6, qui ont un effet de plafond et une faible sensibilité pour identifier les défauts fonctionnels légers chez les patients de haut niveau ayant subi un AVC. Par conséquent, il est nécessaire de développer des méthodes objectives et simples pour identifier le dysfonctionnement cognitif chez les patients de haut niveau victimes d’un AVC.
Au cours des dernières années, les avantages du paradigme de la double tâche dans l’évaluation et la formation se sont progressivement appréciés 7,8. Par exemple, les patients peuvent effectuer normalement des tâches cognitives simples (par exemple, le calcul), mais montrer divers degrés de déclin cognitif lorsque des tâches supplémentaires sont ajoutées 9,10 (par exemple, marcher en comptant). Manaf et al. ont constaté que les patients victimes d’un AVC utilisent souvent des stratégies compensatoires lorsqu’ils effectuent des tâches cognitives et motrices doubles, telles que le maintien de la stabilité en sacrifiant la performance des tâches cognitives11. Par conséquent, l’évaluation à double tâche peut présenter des avantages dans l’identification des déficits cognitifs chez les patients victimes d’un AVC de haut niveau. D’une part, le contenu de l’évaluation à double tâche est plus proche de la vie quotidienne qu’une seule tâche, comme marcher en observant l’environnement environnant ou parler et appeler. Dans des études antérieures, la tâche marche + dénomination et la tâche marche + franchissement d’obstacles ont été conçues pour simuler la marche dans des environnements réels12.
D’autre part, la capacité exécutive dans les tâches doubles a une relation étroite avec l’attention partagée (appartenant à la catégorie de la fonction cognitive avancée)13. L’attention partagée est la capacité de gérer plusieurs tâches simultanément et d’allouer de l’attention à deux tâches ouplus 14. Cette compétence cognitive est d’une grande importance pour améliorer l’efficacité des activités quotidiennes. Par conséquent, les résultats de l’évaluation à deux tâches peuvent être utilisés pour refléter l’attention partagée de l’individu. Normalement, les gens peuvent faire face à deux ou plusieurs tâches simples simultanément dans leur vie quotidienne et ne sont pas dérangés. Cependant, lorsque la fonction cérébrale est altérée, il peut y avoir plus d’interférences à double tâche lorsqu’il est confronté à des tâches doubles simples; c’est-à-dire que lors de l’exécution de tâches doubles, la réduction de l’attention divisée peut être susceptible de nuire à l’exécution d’une ou deux tâches15. Il est conclu que l’exécution à double tâche est plus susceptible d’être en mesure de détecter une déficience de la fonction cognitive avancée chez les patients victimes d’un AVC de haut niveau.
Le paradigme de Stroop est un paradigme expérimental classique pour étudier l’effet Stroop (également connu sous le nom d’effet de conflit)16, qui a été largement utilisé dans l’évaluation de l’attention dans les tests de fonction cognitive, en particulier dans le domaine de l’inhibition de l’attention17. L’effet Stroop classique fait référence au fait qu’il est difficile pour les individus de répondre rapidement et avec précision aux stimuli non dominants en raison de l’interférence de la réponse dominante. Il en résulte un temps de réponse plus long et une précision de réponse plus faible pour les stimuli non dominants. La différence de temps de réaction ou de taux de précision entre les réactions dominantes et non dominantes est l’effet Stroop18. Par conséquent, le Stroop nécessite des niveaux élevés d’attention19. Les effets de Stroop plus petits représentent une inhibition attentionnelle plus élevée, tandis que les effets de Stroop plus importants représentent une diminution de l’inhibition attentionnelle18.
Le paradigme de Stroop peut être plus approprié pour évaluer le dysfonctionnement cognitif chez les patients victimes d’un AVC de haut niveau et présente une sensibilité et une spécificité plus élevées pour l’évaluation de l’attention que l’échelle d’évaluation clinique traditionnelle20. Par conséquent, cette étude a conçu une évaluation à double tâche basée sur le paradigme de Stroop pour identifier les déficits cognitifs chez les patients de haut niveau ayant subi un AVC. Le protocole comprend également une évaluation clinique de la fonction cognitive, de la fonction motrice des membres inférieurs et de la fonction d’équilibre chez les patients victimes d’un AVC afin de s’assurer que les patients peuvent compléter l’évaluation à double tâche. La spectroscopie fonctionnelle dans le proche infrarouge (fNIRS) a été utilisée comme outil d’évaluation objective de la fonction cérébrale pour détecter l’activation de la fonction cérébrale chez les patients de haut niveau victimes d’un AVC dans le cadre de la double tâche. L’efficacité et la faisabilité du schéma d’évaluation à double tâche basé sur le paradigme de Stroop ont été vérifiées du point de vue de la neuroimagerie, qui apporte de nouveaux aspects à la pratique clinique.
Protocole
Ce projet a été approuvé par l’Association d’éthique médicale du cinquième hôpital affilié de l’Université médicale de Guangzhou (No. KY01-2020-08-06) et a été enregistré au Centre d’enregistrement des essais cliniques de Chine (No. ChiCTR2000036514). Le consentement éclairé a été obtenu des patients pour l’utilisation de leurs données dans cette étude.
1. Recrutement
- Recruter des patients victimes d’un AVC avec des conditions stables, comme confirmé par l’examen d’imagerie-diagnostic conforme aux critères diagnostiques des maladies cérébrovasculaires de la branche de neurologie de l’Association médicale chinoise (2005). Choisissez les patients ayant subi un AVC au stade IV21 de Brunnstrom.
- S’assurer que les patients peuvent effectuer les activités quotidiennes de base de manière autonome. Assurez-vous que les patients ne présentent aucune déficience cognitive évidente et répondent aux exigences suivantes: MoCA dans la plage normale; pas de négligence unilatérale (test d’Albert, nombre d’omissions ≤2)22; aucune autre maladie neurologique, comme les défauts de langage; et peut coopérer avec les instructions pertinentes pour mener à bien cette étude.
- Assurez-vous que les sujets participent volontairement au test et signez un formulaire de consentement éclairé.
2. Évaluation clinique
- Consignez les renseignements du sujet, y compris son nom, son sexe, sa date de naissance, son niveau d’éducation, son indice de masse corporelle, ses antécédents médicaux et ses antécédents médicaux.
- Effectuer une évaluation de la fonction cognitive.
- Effectuez MoCA23 sur des patients victimes d’un AVC en posant 11 questions portant sur l’attention et la concentration, la fonction exécutive, la mémoire, le langage, les compétences en structure visuelle, la pensée abstraite, l’informatique et l’orientation des sujets.
- Le score total du MoCA est de 30, ce qui est lié au niveau d’éducation. Si le sujet a pris moins de 12 ans d’éducation, ajoutez un point au score total du MoCA. Considérez un score de 26 et plus comme la normale23.
- Effectuer un CDR24 sur les patients victimes d’un AVC. Recueillir de l’information au cours d’entrevues structurées avec des patients victimes d’un AVC et leurs familles et évaluer les capacités des sujets sous six aspects : mémoire, orientation, jugement et résolution de problèmes, travail et interaction sociale, vie familiale et passe-temps personnel, et vie autonome.
- Le score le plus élevé possible est de 3. Évaluez les scores obtenus comme suit : le score total = 0 indique l’absence de démence; le score total = 0,5 indique une démence soupçonnée; Le score total = 1 indique une déficience cognitive légère; le score total = 2 indique une déficience cognitive modérée; et le score total = 3 indique une déficience cognitive grave24.
- Effectuer le test d’Albert pour détecter la présence de négligence spatiale unilatérale (USN) chez les patients victimes d’un AVC. Demandez au sujet de rayer toutes les lignes placées dans des orientations aléatoires sur une feuille de papier.
- Présentez au sujet une série de 40 lignes noires, chacune d’environ 2 cm de long, orientées au hasard sur une feuille de papier blanc de 11 po x 8,6 po sur six rangées. Évaluer la présence ou l’absence d’USN, en fonction du nombre de lignes non franchies de chaque côté de la feuille de test. Si des lignes ne sont pas franchies et que plus de 70% de ces lignes non croisées sont du même côté que le déficit moteur, cela indique une négligence spatiale unilatérale.
- Effectuer une évaluation de la fonction motrice.
- Effectuer l’évaluation Fugl-Meyer (FMA) sur les patients victimes d’un AVC afin d’évaluer la fonction motrice, la sensation, l’équilibre, l’amplitude des mouvements articulaires et les douleurs articulaires chez les patients atteints d’hémiplégie post-AVC. Le domaine moteur comprend des éléments évaluant le mouvement, la coordination et les actions réflexes de l’épaule, du coude, de l’avant-bras, du poignet, de la main, de la hanche, du genou et de la cheville.
- Le score de la fonction motrice varie de 0 (hémiplégie) à 100 points (performance motrice normale), divisé en 66 points pour les membres supérieurs et 34 points pour les membres inférieurs. Évaluez le score comme suit : 0-49 points indiquent une déficience motrice sévère; 50 à 84 points indiquent une déficience motrice marquée; 85 à 95 points indiquent une déficience motrice modérée; et 96-99 points indiquent une légère déficience motrice.
- Effectuer une évaluation de la fonction d’équilibre.
- Effectuez l’échelle d’équilibre de Berg (BBS)27 sur le patient victime d’un AVC, avec un total de 14 éléments allant de facile à difficile, y compris l’équilibre assis, l’équilibre debout, le transfert du corps, le virage et la position debout sur une jambe.
- Évalue les scores comme suit : le score le plus élevé sur l’échelle est de 56; Un score total de <40 points suggère un risque de chute; 0-20 points marqués indique une mauvaise fonction d’équilibre et qu’un fauteuil roulant est nécessaire; 21-40 points marqués suggèrent que le sujet a une certaine fonction d’équilibre et a besoin de marcher avec de l’aide; 41-56 points marqués suggèrent une bonne fonction d’équilibre et que le sujet peut marcher indépendamment28.
- Effectuer une évaluation du risque de chute.
- Effectuer le test chronométré et aller (TUGT)29 sur des patients victimes d’un AVC. Demandez au sujet de se lever de la chaise, de marcher sur 3 m, de tourner son corps, puis de revenir et de s’asseoir sur la chaise à une vitesse confortable pour assurer sa sécurité. Parallèlement, demandez à l’évaluateur de chronométrer tout le processus, de l’émission de l’ordre de départ à la séance dans le fauteuil.
- Évaluer le résultat obtenu comme suit : si le temps total pour que le sujet complète le TUGT ≥14 s, cela indique que le sujet a le risque de tomber29.
3. Évaluations des tâches Stroop
- Effectuer l’évaluation de la tâche unique Stroop (tâche Stroop uniquement ; Graphique 1).
- Demandez au patient de s’asseoir dans une chaise stable.
- Exécutez le logiciel commercial de présentation de stimulus et sélectionnez les essais de test de congruence. Créez un nouveau profil pour le patient. Sélectionnez les essais de congruence de la tâche de Stroop et répétez trois essais.
- Réaliser le paradigme expérimental suivant. Concevoir l’expérience avec un temps de repos du patient de 10 s, puis demander au patient d’effectuer un test cognitif avec une fréquence de 6 s pour un total de trois essais, chaque essai ayant un stimulus de 60 s + 60 s de repos.
- Fixer la durée totale de l’expérience à 370 s (le processus spécifique est illustré à la figure 1). Au repos, demandez au patient de se détendre. Lorsque l’expérience est au stade de la stimulation, demandez au patient d’effectuer le test lié à l’attention, terminez la tâche en 6 s et complétez-la 10x en 60 s.
- Demandez aux patients de suivre les instructions pour les deux essais décrits ci-dessous.
- Sélectionnez les essais de test de congruence. Cliquez sur le bouton fléché à gauche (←) dès que possible lorsqu’il
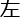 est affiché à gauche du carré. Cliquez sur le bouton fléché à droite (→) dès que possible lorsqu’il
est affiché à gauche du carré. Cliquez sur le bouton fléché à droite (→) dès que possible lorsqu’il  est affiché à droite du carré.
est affiché à droite du carré. - Sélectionnez les essais de test d’incongruence, qui partagent la même étape que les essais de test de congruence. Cliquez sur le bouton fléché à gauche (←) dès que possible lorsqu’il
 est affiché à gauche du carré, en ignorant la signification du caractère et en vous concentrant sur sa position.
est affiché à gauche du carré, en ignorant la signification du caractère et en vous concentrant sur sa position. - Cliquez sur le bouton fléché à droite (→) dès que possible, lorsque
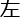 s’affiche à droite du carré, en ignorant la signification du caractère et en se concentrant sur sa position. Terminez la tâche, enregistrez les données et exportez-les vers une base de données auto-créée.
s’affiche à droite du carré, en ignorant la signification du caractère et en se concentrant sur sa position. Terminez la tâche, enregistrez les données et exportez-les vers une base de données auto-créée.
- Sélectionnez les essais de test de congruence. Cliquez sur le bouton fléché à gauche (←) dès que possible lorsqu’il
- Effectuez l’évaluation de la double tâche Stroop (tâche Stroop + contrôle de la balance).
- Demandez au patient de s’asseoir sur une balle d’équilibre avec le thérapeute responsable de la protection du patient. Laissez le patient compléter le paradigme expérimental de Stroop avec les étapes mentionnées ci-dessus (étapes 3.1.1.-3.1.5.).
- Lorsque l’expérience est en phase de repos, demandez au patient de garder l’équilibre et de se détendre autant que possible sur la balle d’équilibre. Lorsque l’expérience est en état de stimulation, demandez au patient d’effectuer le test lié à l’attention tout en maintenant l’équilibre sur la balle d’équilibre autant que possible.
- Demandez au patient de s’asseoir sur une balle d’équilibre avec le thérapeute responsable de la protection du patient. Laissez le patient compléter le paradigme expérimental de Stroop avec les étapes mentionnées ci-dessus (étapes 3.1.1.-3.1.5.).
4. Évaluation du SRNI
- Placez 10 sources lumineuses et 12 récepteurs sur le capuchon de test fNIRS pour correspondre aux quatre régions d’intérêt (ROI) de cette étude, qui comprennent le cortex préfrontal gauche (LPFC), le cortex préfrontal droit (RPFC), le cortex promoteur gauche (LPMC) et le cortex promoteur droit (RPMC).
- Préparation du sujet
- Informer les sujets du but expérimental et observer les patients.
- Assurez-vous du site Cz au sommet du capuchon d’essai, le quatrième point du front au lobe occipital sur la ligne médiane du capuchon complet. Assurez-vous que le point médian de la connexion se situe entre la racine nasale et le bord inférieur de la protubérance occipitale, le point d’intersection de la connexion de la racine nasale à la protubérance occipitale ou la connexion entre la fosse auriculaire supérieure des deux oreilles (cymba conchae).
- Placez le capuchon sur la tête du sujet et ajustez la position du capuchon de sorte que le point Cz sur la tête du sujet coïncide avec le point Cz sur le capuchon. Serrez la cravate des deux côtés du capuchon et laissez les oreilles du sujet percer l’espace; L’avant du capuchon est naturellement attaché au front et le dos est naturellement attaché à l’occiput.
- Acquisition et pré-acquisition
- Ouvrez le logiciel, sélectionnez le sujet expérimental et entrez les informations de base des patients. Réglez la fréquence d’échantillonnage sur 11 Hz.
- Cliquez sur le bouton Pré-acquisition pour démarrer la pré-acquisition et calibrer le signal de test. En fonction de l’intensité du signal de chaque point affiché par la spectroscopie proche infrarouge fonctionnelle, ajustez les points de signal faibles en déplaçant le capuchon ou en exposant davantage le cuir chevelu. Lorsque l’intensité du signal de chaque point collecté par le capuchon tend à être stable, arrêtez la précollecte et cliquez sur le bouton de gain automatique. Cliquez sur le bouton Démarrer pour collecter le signal.
REMARQUE: Assurez-vous de la qualité du signal lors de l’acquisition et de la pré-acquisition comme suit. La courbe du signal d’intensité lumineuse d’origine doit être stable, accompagnée d’une fluctuation du signal de pulsation de 1 à 2 Hz, et la valeur doit atteindre le seuil raisonnable fixé par l’équipement. L’intensité du signal peut être indiquée par la couleur, où l’intensité d’un signal d’affichage gris est faible, le jaune est bon, le vert est excellent et le rouge est trop fort.
- Effectuez une évaluation de tâche unique Stroop synchronisée avec fNIRS. Ensuite, effectuez une évaluation Stroop à double tâche synchronisée avec fNIRS.
5. Traitement et analyse des données
- Traiter les informations générales et les données d’évaluation clinique des patients.
- Analysez les données dans le proche infrarouge à l’aide du progiciel NirSpark dans MATLAB.
- Effectuer la pré-procession des données.
- Cliquez sur le bouton Exclure pour éliminer l’intervalle de temps sans rapport avec l’expérience. Cliquez sur le bouton Motion pour éliminer les artefacts de mouvement causés par des activités physiologiques telles que la respiration, le rythme cardiaque, le pouls, etc., et des activités involontaires telles que cligner des yeux, avaler, etc., et convertir le signal d’intensité lumineuse en un signal de densité optique.
- Cliquez sur le bouton Filtre pour sélectionner le filtre passe-bande (0,01-0,2 Hz) afin de supprimer les bruits physiologiques et instrumentaux. Cliquez sur le bouton Hémo pour calculer les changements relatifs de l’oxyhémoglobine (HbO2) et de la désoxyhémoglobine (HbR) selon la loi de Beer-Lambert modifiée et convertir le signal de densité optique en signal de concentration d’oxygène dans le sang.
NOTE: HbO 2 est plus sensible aux changements entre les conditions que l’HbR, de sorte que l’analyse ultérieure utilise uniquement les données HbO2 dans ce protocole d’étude.
- Bâtiment à modèle linéaire général (GLM)
- Choisissez HbO2 dans Hemo Type comme données d’analyse. Cliquez sur le bouton Spécification pour prendre quelques secondes comme unité de temps et sélectionnez le type HRF standard comme fonction de base. Ensuite, éliminez l’étape de repos pour établir la matrice de conception GLM et sélectionnez l’étape de stimulus dans la tâche en fonction de la conception expérimentale.
- Cliquez sur le bouton Estimation pour adapter la matrice de conception établie aux données collectées. Cliquez sur le bouton Afficher pour extraire la valeur β calculée.
REMARQUE: GLM est une combinaison linéaire de signaux hémodynamiques observés (variable dépendante) sous forme de régressions intéressantes (variable de tâche), de covariables redondantes (telles que le bruit de surface mesuré dans des canaux à courte portée) et de termes d’erreur.
- Calculez la valeur β comme suit. Calculez les données expérimentales dans les ROI à l’aide du modèle de corrélation linéaire établi. Obtenir les paramètres GLM du canal requis et dériver la valeur β de l’activation cérébrale dans chaque condition expérimentale (c’est-à-dire le coefficient de poids dans le modèle linéaire) pour analyse.
- Effectuer la pré-procession des données.
- Exécutez le logiciel commercial de présentation de stimulus pour exporter les données de performance des tâches cognitives dans la tâche Stroop et obtenir la précision (ACC) et le temps de réaction (RT) pour l’analyse finale des données.
Résultats
Cette étude présente les résultats d’un patient de haut niveau ayant subi un AVC, un homme de 71 ans qui a souffert d’un AVC ischémique avec hémiplégie gauche il y a 2 ans. L’imagerie par résonance magnétique (IRM) a présenté un infarctus chronique bilatéral des noyaux gris centraux à la couronne rayonnante. Il était capable de marcher et de vivre de façon autonome dans la communauté, mais il n’était pas satisfait de son rétablissement cognitif. Cependant, les évaluations fonctionnelles se situa...
Discussion
Dans notre étude, les résultats des échelles d’évaluation cognitive clinique de routine pour le patient de haut niveau de l’AVC n’ont montré aucun déficit cognitif significatif. Cependant, ces échelles d’évaluation pourraient montrer un effet de plafond et être moins sensibles pour identifier les déficits cognitifs légers des patients de haut niveau de l’AVC. Par conséquent, ce protocole a sélectionné l’ACC et la RT dans l’évaluation à double tâche basée sur le paradigme de Stroop comme in...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette étude a été financée par des subventions de la Fondation nationale des sciences naturelles de Chine (n ° 81804004, 81902281), de la Fondation chinoise des sciences postdoctorales (n ° 2018M643207), du projet de la Commission municipale de la santé de Shenzhen (n ° SZBC2018005), du projet scientifique et technologique de Shenzhen (n ° JCYJ20160428174825490), du programme d’orientation générale de la santé municipale et de la planification familiale de Guangzhou (n ° 20211A010079, 20211A011106), de la Fondation de Guangzhou et de l’Université (n ° 202102010100), Fondation de l’Université médicale de Guangzhou (n ° PX-66221494), laboratoire clé des instituts d’enseignement supérieur du Guangdong [numéro de subvention: 2021KSYS009] et Département de l’éducation de la province du Guangdong [numéro de subvention: 2021ZDZX2063].
matériels
| Name | Company | Catalog Number | Comments |
| Balance Ball | Shanghai Fanglian Industrial Co, China | PVC-KXZ-EVA01-2015 | NA |
| E-Prime 3.0 | Psychology softwares Tools | commercial stimulus presentation software | |
| fNIRS | Hui Chuang, China | NirSmart-500 | NA |
Références
- Dichgans, M., Pulit, S. L., Rosand, J. Stroke genetics: Discovery, biology, and clinical applications. The Lancet. Neurology. 18 (6), 587-599 (2019).
- Chen, G., Leak, R. K., Sun, Q., Zhang, J. H., Chen, J. Neurobiology of stroke: Research progress and perspectives. Progress In Neurobiology. 163-164, 1-4 (2018).
- Maratos, M., Huynh, L., Tan, J., Lui, J., Jarus, T. Picture this: Exploring the lived experience of high-functioning stroke survivors using photovoice. Qualitative Health Research. 26 (8), 1055-1066 (2016).
- Platz, T., Prass, K., Denzler, P., Bock, S., Mauritz, K. H. Testing a motor performance series and a kinematic motion analysis as measures of performance in high-functioning stroke patients: reliability, validity, and responsiveness to therapeutic intervention. Archives of Physical Medicine and Rehabilitation. 80 (3), 270-277 (1999).
- Trzepacz, P. T., Hochstetler, H., Wang, S., Walker, B., Saykin, A. J. Relationship between the Montreal Cognitive Assessment and Mini-mental State Examination for assessment of mild cognitive impairment in older adults. BMC Geriatrics. 15, 107 (2015).
- McDougall, F., et al. Psychometric properties of the Clinical Dementia Rating - Sum of boxes and other cognitive and functional outcomes in a prodromal Alzheimer's disease population. The Journal of Prevention of Alzheimer's Disease. 8 (2), 151-160 (2021).
- McHorney, C. A., Tarlov, A. R. Individual-patient monitoring in clinical practice: Are available health status surveys adequate. Quality of Life Research. 4 (4), 293-307 (1995).
- Silsupadol, P., et al. Effects of single-task versus dual-task training on balance performance in older adults: a double-blind, randomized controlled trial. Archives of Physical Medicine and Rehabilitation. 90 (3), 381-387 (2009).
- Feld, J. A., et al. Relationship between dual-task gait speed and walking activity poststroke. Stroke. 49 (5), 1296-1298 (2018).
- Liu, Y. -. C., Yang, Y. -. R., Tsai, Y. -. A., Wang, R. -. Y. Cognitive and motor dual task gait training improve dual task gait performance after stroke - A randomized controlled pilot trial. Scientific Reports. 7 (1), 4070 (2017).
- Manaf, H., Justine, M., Ting, G. H., Latiff, L. A. Comparison of gait parameters across three attentional loading conditions during timed up and go test in stroke survivors. Topics In Stroke Rehabilitation. 21 (2), 128-136 (2014).
- Ou, H., et al. Motor dual-tasks for gait analysis and evaluation in post-stroke patients. Journal of Visualized Experiments. (169), e62302 (2021).
- Hirano, D., Goto, Y., Jinnai, D., Taniguchi, T. Effects of a dual task and different levels of divided attention on motor-related cortical potential. Journal of Physical Therapy Science. 32 (11), 710-716 (2020).
- Loetscher, T., Potter, K. -. J., Wong, D., das Nair, R. Cognitive rehabilitation for attention deficits following stroke. The Cochrane Database of Systematic Reviews. 2019 (11), (2019).
- Chen, C., Leys, D., Esquenazi, A. The interaction between neuropsychological and motor deficits in patients after stroke. Neurology. 80, 27-34 (2013).
- Puglisi, G., et al. Frontal pathways in cognitive control: Direct evidence from intraoperative stimulation and diffusion tractography. Brain. 142 (8), 2451-2465 (2019).
- MacLeod, C. M. Half a century of research on the Stroop effect: An integrative review. Psychological Bulletin. 109 (2), 163-203 (1991).
- Su, M., Wang, R., Dong, Z., Zhao, D., Yu, S. Decline in attentional inhibition among migraine patients: An event-related potential study using the Stroop task. The Journal of Headache and Pain. 22 (1), 34 (2021).
- Tsang, C. S. L., Chong, D. Y. K., Pang, M. Y. C. Cognitive-motor interference in walking after stroke: test-retest reliability and validity of dual-task walking assessments. Clinical Rehabilitation. 33 (6), 1066-1078 (2019).
- Bai, Q., Hu, J., Zhang, L. J., Chen, Y., Zhang, Y. H., Wang, X. C., Chi, L. Y. Application value of Stroop test in the evaluation of cognitive function in asymptomatic cerebral infarction. China Journal of Alzheimer's Disease and Related Disorders. 4 (4), 269-274 (2021).
- Pandian, S., Arya, K. N. Stroke-related motor outcome measures: Do they quantify the neurophysiological aspects of upper extremity recovery. Journal of Bodywork and Movement Therapies. 18 (3), 412-423 (2014).
- Albert, M. L. A simple test of visual neglect. Neurology. 23 (6), 658-664 (1973).
- Nasreddine, Z. S., et al. The Montreal Cognitive Assessment, MoCA: A brief screening tool for mild cognitive impairment. Journal of the American Geriatrics Society. 53 (4), 695-699 (2005).
- Morris, J. C. The Clinical Dementia Rating (CDR): Current version and scoring rules. Neurology. 43 (11), 2412-2414 (1993).
- Sullivan, K. J., et al. Fugl-Meyer assessment of sensorimotor function after stroke: Standardized training procedure for clinical practice and clinical trials. Stroke. 42 (2), 427-432 (2011).
- Sanford, J., Moreland, J., Swanson, L. R., Stratford, P. W., Gowland, C. Reliability of the Fugl-Meyer assessment for testing motor performance in patients following stroke. Physical Therapy. 73 (7), 447-454 (1993).
- Downs, S. The Berg Balance Scale. Journal of Physiotherapy. 61 (1), 46 (2015).
- Blum, L., Korner-Bitensky, N. Usefulness of the Berg Balance Scale in stroke rehabilitation: A systematic review. Physical Therapy. 88 (5), 559-566 (2008).
- El Said, S. M. S., Adly, N. N., Abdul-Rahman, S. A. Executive function and physical function among community-dwelling Egyptian older adults. Journal of Alzheimer's Disease. 80 (4), 1583-1589 (2021).
- Al-Yahya, E., et al. Prefrontal cortex activation while walking under dual-task conditions in stroke: A multimodal imaging study. Neurorehabilitation and Neural Repair. 30 (6), 591-599 (2016).
- Matjacic, Z., Zadravec, M., Olensek, A. Feasibility of robot-based perturbed-balance training during treadmill walking in a high-functioning chronic stroke subject: A case-control study. Journal of Neuroengineering and Rehabilitation. 15 (1), 32 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon