Method Article
Imágenes de alta resolución de C. elegans en todas las etapas larvales
En este artículo
Resumen
Este protocolo describe la obtención de imágenes de lapso de tiempo de C. elegans basadas en microfluidos a lo largo de todo el desarrollo postembrionario.
Resumen
Caenorhabditis elegans se ha convertido en uno de los modelos animales más estudiados y mejor comprendidos en biología. Tres características son clave para el éxito de C. elegans como organismo modelo: su linaje celular invariante, su transparencia y su trazabilidad genética. Esto lo hace ideal para una amplia gama de estudios basados en microscopía directamente in vivo. Las larvas y adultos vivos de C. elegans a menudo necesitan ser inmovilizados durante la adquisición de imágenes. Los métodos tradicionales de inmovilización afectan negativamente al desarrollo de los animales, especialmente en aplicaciones de imágenes de lapso de tiempo. Aquí, se presenta un protocolo detallado de configuración y operación para un nuevo método de imágenes microfluídicas, que aborda las limitaciones asociadas con la inmovilización tradicional basada en agar-pad y otras estrategias microfluídicas. Este enfoque permite la obtención simultánea de imágenes en vivo a través de varias etapas larvarias, al tiempo que preserva la orientación y la identidad del gusano a lo largo del tiempo. Para lograr esto, se emplea un conjunto de canales de trampa microfluídica, con su geometría diseñada con precisión para mantener una orientación estable del gusano mientras se adapta al crecimiento y la muda. La inmovilización se ve facilitada por una válvula hidráulica activa que aplica presión para asegurar los gusanos contra el cubreobjetos únicamente durante la adquisición de imágenes. Este diseño permite obtener imágenes de alta resolución con efectos mínimos en la viabilidad de los gusanos o el momento del desarrollo.
Introducción
Las imágenes de C. elegans se pueden llevar a cabo de varias maneras dependiendo de la aplicación, el rendimiento deseado y la resolución. Cuando se necesita una alta resolución, el método estándar utiliza almohadillas de agar 1,2,3, una construcción simple de portaobjetos de vidrio, agarosa y vidrio de cubierta. Los animales en estos portaobjetos están inmovilizados por la presión ejercida por un cubreobjetos. La inmovilización puede mejorarse aún más mediante la adición de agentes anestésiantes, por ejemplo, levamisol o azidasódica 1,2, de modo que los animales en almohadillas de agar estén perfectamente quietos y puedan ser visualizados a alta resolución, incluidos varios métodos de superresolución2. Desafortunadamente, se sabe que las almohadillas de agar afectan la progresión del desarrollo, con la combinación de altas presiones aplicadas y agentes anestésicos que retrasan el desarrollo o causan la detención completa del desarrollo 4,5.
Además de estos métodos estándar, en los últimos años han surgido varias metodologías microfluídicas, cada una con sus ventajas y desventajas o casos de uso especializados 6,7,8,9,10,11,12,13,14,15,16,17,18,19. Por ejemplo, Gritti et al.20 introdujeron un método en el que los gusanos están confinados dentro de grandes cámaras. Los embriones colocados en estas cámaras se desarrollan y se mueven libremente mientras permanecen dentro de la región de interés designada en un microscopio. Si bien generalmente es efectivo, este enfoque se limita al uso de marcadores fluorescentes brillantes. Más recientemente, Keil et al.21 propusieron una versión modificada de este método, incorporando una válvula hidráulica en chip para sujetar a los animales durante la adquisición de imágenes, abordando así algunas limitaciones del enfoque original. Sin embargo, dado que ambos métodos utilizan cámaras más grandes que las utilizadas para los gusanos atrapados, los animales continúan moviéndose y rotando durante todo el experimento. Como resultado, el seguimiento de los procesos de desarrollo se convierte en un desafío y requiere un extenso procesamiento posterior de la imagen para corregir el movimiento de los animales.
Para abordar estas limitaciones, se adapta el enfoque introducido por Berger et al.18 (Figura 1), donde los animales no se mantienen en una cámara grande, sino que se alojan en un canal trampa diseñado para acomodar a los animales dentro de una ventana de desarrollo más corta (hasta 2,5 etapas larvarias). A diferencia de los métodos microfluídicos existentes, este enfoque preserva la orientación y la identidad del animal a lo largo de un experimento y permite la adquisición de imágenes de alta resolución de múltiples gusanos en paralelo y a través de múltiples etapas larvales dentro de un solo dispositivo.
Los animales se atrapan utilizando una geometría de canal especializada en la que la altura del canal es cercana al grosor de un animal al comienzo de un experimento, evitando así la rotación. Los anchos y longitudes de los canales se seleccionan para que los animales puedan moverse y crecer con el tiempo, lo que facilita la muda y la transición de una etapa larvaria a la siguiente. La paralelización se logra simplemente colocando varios canales de trampa uno al lado del otro, de modo que varios animales sean visibles en un solo campo de visión (FOV, Figura 1A'), y se puedan obtener imágenes de hasta 41 animales en una sola unidad de dispositivo (Figura 1A). A los animales en el chip se les suministra continuamente una suspensión de alimento bacteriano altamente concentrada a través de un canal de baja altura, que al mismo tiempo ayuda a confinar a los animales al final de la matriz de canales de la trampa (escalón de altura, Figura 1A, rojo). De manera similar al enfoque adoptado por Keil et al.21, se implementa una gran válvula hidráulica en chip, que se puede inflar durante la adquisición de la imagen, presionando a los animales contra el cubreobjetos, mejorando así la inmovilización de los animales (Figura 1B). Limitar el accionamiento de la válvula hidráulica solo al período de adquisición de imágenes minimiza cualquier efecto adverso en el desarrollo de los animales, lo que garantiza un desarrollo confiable en todas las etapas larvarias. A diferencia de los métodos descritos por Gritti et al.20 y Keil et al.21, los animales no pueden ser fotografiados a lo largo de todo el desarrollo postembrionario dentro del mismo dispositivo. En su lugar, se introducen cinco dispositivos distintos, denominados L1, L1-4, L2-A, L3-A y L4-A, que cubren toda la etapa L1 y la etapa L2 temprana, la etapa L1 media-tardía hasta la etapa L4 media, la L2 media-tardía hasta la adultez temprana, la L3 media-tardía hasta la adultez temprana y la L4 tardía hasta la adultez temprana, respectivamente (Figura 1C), que permiten obtener imágenes ininterrumpidas de gran parte del desarrollo postembrionario. Este enfoque se adopta debido al gran aumento en el tamaño de los animales desde L1 hasta la edad adulta, de modo que un canal adecuado para los animales L1 sería demasiado pequeño para los adultos, lo que resultaría en la detención del desarrollo, y un canal que se ajustara a los adultos sería demasiado grande para los L1, lo que resultaría en un movimiento excesivo, rotación y animales que escaparían de los canales de la trampa.
Con este enfoque, se logra una progresión confiable del desarrollo para una variedad de tejidos18, por ejemplo, el desarrollo postembrionario de la hipodermis (etapa L1 a L4), la inducción de los destinos de las células vulvares (etapa L2 y L3), la morfogénesis vulvar (L3 a la edad adulta19) y la invasión de células ancla. Desde su introducción, estos dispositivos de imagen a largo plazo se han utilizado para estudiar una variedad de procesos22,23, e incluso se han combinado con técnicas como la microscopía de superresolución AiryScan24, lo que ha permitido numerosos descubrimientos antes imposibles.
A continuación, se presentan los aspectos de funcionamiento de estos dispositivos de imagen a largo plazo en un protocolo paso a paso, destacando los resultados esperados y algunos desafíos potenciales al configurar el sistema.
Protocolo
Los detalles de los reactivos y el equipo utilizado en este estudio se enumeran en la Tabla de Materiales.
1. Fabricación de dispositivos
NOTA: Todos los dispositivos se fabricaron utilizando el protocolo a continuación, sin embargo, los dispositivos están disponibles directamente de los autores. Se fabrica una oblea separada para cada tipo de dispositivo, y cada oblea del dispositivo se fabrica a partir de dos capas de SU8 de diferentes alturas (es decir, capa de alimento y capa de trampa). La oblea de válvula se fabrica en una oblea separada, con una sola altura de SU-8, omitiendo los pasos 1.3-1.6. Los silanos son tóxicos y liberan vapores corrosivos. Este paso, por lo tanto, debe realizarse en una campana extractora. Para más detalles sobre el procedimiento de fabricación, véase Berger et al.18.
- Limpie las obleas con plasma de aire.
- Aplicar una capa de centrifugado a la primera capa de SU8 y, a continuación, realizar un horneado suave a 95 °C.
- Exponer la primera capa, seguida de un post-horneado a 95 °C y revelado.
- Vuelva a realizar la limpieza con plasma después del desarrollo y el secado de las obleas.
- Aplicar una capa de centrifugado a la segunda capa de SU8, seguida de un horneado suave a 95 °C (si es necesario, realizar un horneado inicial a 65 °C).
- Alinee la segunda máscara con las entidades existentes utilizando marcadores de alineación a ambos lados de la oblea y, a continuación, exponga la segunda capa.
- Después de hornear y desarrollar la oblea, luego realizar un horneado duro a 200 °C.
- Trate la oblea con clorotrimetilsilano durante al menos 2 h.
- Prepare un lote de 20 g de prepolímero PDMS (Parte A) y mézclelo bien con 1 g del reticulante (proporción 20:1, Parte B) (consulte la Tabla de materiales).
- Desgasificar durante 10 minutos o hasta que desaparezcan todas las burbujas.
- Retire 2 ml de la mezcla de PDMS y reserve para el paso 1.13.
- Añada otros 3 g de reticulante a la mezcla de PDMS restante y mezcle bien (proporción final de aprox. 5:1).
- Con el lote de PDMS 20:1, centrifugar la oblea del dispositivo a 750 rpm durante 30 s.
- Coloque la oblea de válvula en un plato de aluminio y vierta el PDMS 5:1 sobre ella. Desgasifique la oblea del dispositivo durante aproximadamente 10 minutos. Después de la desgasificación, elimine las burbujas restantes con una pipeta.
- Hornee las capas de la válvula y del dispositivo a 70 °C durante aproximadamente 15/20 min respectivamente.
- Evalúe el curado del dispositivo y las capas de la válvula sondeándolas suavemente con una punta de pipeta o pinzas. La capa de la válvula debe ser sólida, mientras que la capa del dispositivo debe permanecer ligeramente pegajosa.
- Separe la capa de la válvula y recórtela al tamaño requerido con un bisturí o una hoja de afeitar.
- Perfore un orificio de acceso en el canal de la válvula (calibre 20).
- Coloque la oblea del dispositivo debajo de un microscopio estereoscópico equipado con iluminación superior.
- Coloque con cuidado la pieza de PDMS que contiene la capa de la válvula en la oblea del dispositivo.
- Alinee la válvula y las características del dispositivo con precisión, asegurando la eliminación de todo el aire atrapado entre las capas.
- Transfiera el dispositivo ensamblado a un horno y hornee a 70 °C durante la noche.
- Desconecte el dispositivo de la oblea.
- Perfore todos los orificios de acceso restantes (calibre 20).
- Adhiera el PDMS a un cubreobjetos con plasma de aire y, a continuación, coloque el dispositivo adherido en un horno a 70 °C durante unas horas.
2. Preparación de lombrices
NOTA: En esta sección se describe la preparación de lombrices por blanqueo, que permite la generación de un gran número (cientos) de animales. Otros métodos de sincronización, como la selección manual, son posibles, pero suelen requerir más tiempo y mano de obra. Todos los gusanos utilizados en el protocolo se mantienen de acuerdo con los protocolos estándar a 20 °C y en placas NGM sembradas con E. coli OP50.
- A partir de placas con muchos animales grávidos.
- Lave a los animales del plato con un tampón M9.
- Agregue 5% de NaClO y 5 M de NaOH a la suspensión de gusano (200 μL/100 μL por cada 1 mL de suspensión de gusano).
- Agite suavemente la mezcla blanqueadora hasta que los animales comiencen a separarse (~ 10 min).
- Centrifugar la mezcla blanqueadora a temperatura ambiente, 1300 x g durante 1 min.
- Retire el sobrenadante con una pipeta y añada una cantidad igual de tampón M9 fresco.
- De nuevo, centrifugar a temperatura ambiente, 1300 x g durante 1 min.
- Retire el sobrenadante y transfiera los gusanos peletizados a un tubo de 15 mL con 5 mL de tampón M9 fresco.
- Agitar durante la noche a 20 °C.
- Pase la suspensión de tornillo sin fin a través de un filtro de células de 10 μm.
- Centrifugar la suspensión helicoidal a 1300 × g durante 1 min a temperatura ambiente.
- Deseche el sobrenadante y vuelva a suspender los gusanos en un volumen igual de tampón M9.
- Vuelva a centrifugar la mezcla de gusanos a 1300 × g durante 1 min a temperatura ambiente.
- Retire el sobrenadante y transfiera los gusanos a placas NGM. Si se necesitan larvas L1, úselas de inmediato.
- Una vez que los gusanos alcancen la etapa de desarrollo deseada, lávelos de la placa con tampón S-Basal fresco filtrado a través de un filtro de 0,2 μm.
- Deje que los gusanos se sedimenten por gravedad o pelíquelos por centrifugación a 750 × g durante 1 min a temperatura ambiente.
- Deseche el sobrenadante y agregue un volumen igual de tampón S-Basal fresco.
- Repita los pasos de sedimentación o centrifugación (pasos 2.16 y 2.17)
- Retire el sobrenadante y agregue un volumen igual de tampón S-Basal fresco.
- Realice los pasos de sedimentación o centrifugación por última vez.
- Retire la mayor parte del sobrenadante.
- Mantenga los gusanos en el tubo hasta que comience el experimento.
3. Preparación de bacterias
NOTA: Se pueden utilizar diferentes cepas de bacterias (por ejemplo, OP50, NA22, HT114, etc.) en el chip. Ajuste la proporción de medio de gradiente de densidad agregado a la mezcla de alimentos para compensar las diferencias de densidad. Todos los tampones pasan a través de un filtro de 0,2 μm para eliminar las partículas.
- Prepare 40 mL de LBroth, ya sea en 2 x 20 mL en tubos de centrífuga, matraces Erlenmeyer estériles, etc.
- Inocular LB con bacterias recogidas de un plato.
- Cultive las bacterias mientras se agitan durante la noche a 37 °C (~16 h) (OD600 = 1,9).
- Centrifugar las bacterias a 3000 x g durante 10 min.
- Retire el sobrenadante y añada 2 mL de tampón S-Basal fresco a cada tubo. Combina todos los tubos.
- Resuspender mecánicamente las bacterias con una pipeta.
- Centrifugar las bacterias a 3000 x g durante 5 min.
- Retire el sobrenadante y vuelva a añadir 2 mL de tampón S-Basal fresco.
- Resuspender mecánicamente las bacterias con una pipeta.
- Centrifugar las bacterias a 3000 x g durante 5 min.
- Retire la mayor cantidad posible del sobrenadante y agregue 1 mL de tampón S-Basal fresco antes de resuspender mecánicamente todas las bacterias.
- Combine 0,60 mL de medio de gradiente de densidad, 0,38 mL de S-Basal + 1% en peso de Pluronic F-127 (un copolímero tribloque no iónico, representado aquí como PF) con 1 mL de suspensión de bacterias OP50, o 0,65 mL de medio de gradiente de densidad, 0,33 mL de S-Basal + 1% en peso de PF con 1 mL de suspensión de bacterias NA22 o HT114.
- Mezcle bien la preparación de alimentos con una batidora de vórtice.
- Filtre el alimento a través de un colador de células de 5 μm o 10 μm. Se recomienda especialmente un colador más pequeño cuando se utilizan dispositivos más pequeños, por ejemplo, dispositivos L1.
NOTA: Los alimentos se pueden mantener a temperatura ambiente hasta por 2 días.
4. Preparación de las virutas
NOTA: Consulte la Figura 2 para obtener una descripción general esquemática del dispositivo, la tubería y las conexiones. Todos los tampones se pasan a través de un filtro de 0,2 μm para eliminar el polvo. El pasador de acero mencionado en los siguientes pasos se refiere a un tubo corto y hueco que se utiliza para conectar el tubo de diámetro exterior más grande (1/16") con los orificios de diámetro pequeño fabricados en el dispositivo PDMS. Estos pasadores de acero simplemente se insertan en el diámetro interior de la tubería y luego se empujan en el material PDMS, conectando efectivamente los dos.
- Comience llenando una jeringa con agua desionizada (DI).
- Coloque una aguja de 23 G y un trozo largo de tubo de 1/16", con un pasador de acero hueco (doblado en un ángulo de 90°) en el extremo. El tubo debe ser lo suficientemente largo como para extenderse desde el solenoide hasta la etapa del microscopio.
- Llene el tubo con agua desionizada de la jeringa y conéctelo a la entrada de la válvula insertando el pasador de acero en el orificio perforado (Figura 2A, J).
- Retire la jeringa y la aguja, luego conecte el tubo al solenoide sin chip (Figura 2A, J).
- Con el software de imágenes, encienda el solenoide y presurice el dispositivo durante varios minutos para expulsar todo el aire de la válvula. Verifique la finalización comprobando visualmente la interfaz aire-agua en el chip, que debería aparecer oscura y desaparecer en el material PDMS (Figura 2B).
- Apague el solenoide (Figura 2C).
- Llene una jeringa de 1 ml con la solución de bacterias filtrada (~0,5 ml de alimento es suficiente).
- Conecte una aguja de 30 G y un trozo largo de tubo de 1/32" a la aguja.
- Presione el émbolo para llenar tanto la aguja como el tubo conectado, asegurándose de que no quede aire en la jeringa o el tubo.
- Inserte el tubo de 1/32" directamente en la entrada de alimentos del dispositivo microfluídico, utilizando pinzas para evitar daños en el tubo (se recomiendan pinzas SMD) (Figura 2D, K).
- Coloque la jeringa en la bomba de jeringa (Figura 2D).
- Presione el émbolo de la jeringa con el tornillo de mariposa en la parte posterior para llenar el dispositivo con líquido. Debe aparecer una gota de líquido en cada conexión abierta (Figura 2D, flecha).
- Bloquee tanto la entrada como la salida del tornillo sin fin con un pasador de acero sellado (un pasador de acero con un trozo corto de tubo de 1/16" unido y sellado mediante quema) (Figura 2E, L).
- Aplique presión adicional con el tornillo de mariposa para eliminar el aire restante en el dispositivo (Figura 2E, flecha).
- Retire el pasador bloqueado en la salida y coloque el contenedor de residuos (hecho de un tubo criovial o microcentrífugo, con dos pasadores de acero pegados a través de la tapa y asegurados con pegamento). El contenedor de residuos se conecta mediante un trozo corto de tubo de 1/16", con un extremo unido al contenedor y el otro extremo conectado a un pasador de acero hueco (doblado 90°) (Figura 2F, G, M).
- Empuje la jeringa para asegurarse de que el contenedor de residuos esté conectado correctamente y de que no existan obstrucciones en el sistema. Para esto, empuje una pequeña cantidad de líquido a través del sistema (gire el tornillo de mariposa de la bomba de jeringa) hasta que el líquido fluya a través del tubo de desecho (Figura 2G, flecha).
- Retire el segundo pasador de acero bloqueado.
- Empuje la jeringa hasta que aparezca una pequeña gota de líquido en la entrada del gusano (Figura 2H, N).
- Conecte un trozo más largo de tubo de 1/16" (15-20 cm) a una jeringa de 1 ml llena de tampón S-Basal, utilizando una aguja de 23 G (Figura 2H,N).
- Fije un pasador recto de acero de 23 G al otro extremo del tubo.
- Llene la aguja y el tubo con tampón de la jeringa, asegurándose de que no quede aire en la jeringa o el tubo.
- Inserte el pasador de acero en el extremo del tubo en el tubo que contiene los gusanos.
- Empuje una pequeña cantidad de líquido a través del tubo, asegurándose de que no quede aire.
- Tire de los gusanos dentro del tubo, pero no los introduzca en la jeringa.
- Empuje la jeringa conectada a los gusanos hasta que aparezca una pequeña gota de líquido en el pasador de acero (Figura 2H).
- Inserte el pasador de acero en la entrada del tornillo sin fin (Figura 2I).
NOTA: La preparación del dispositivo se puede realizar antes de la preparación final de los gusanos y dejarlo en el microscopio hasta que los gusanos estén listos.
5. Carga de gusanos e imágenes
- Coloque el dispositivo en un microscopio de bajo aumento (5x o 10x) o en un microscopio de disección.
- Identifique la unidad de dispositivo actualmente en uso y encuentre la entrada del tornillo sin fin utilizando iluminación de campo claro.
- Coloque el dispositivo de manera que la entrada sea visible en un lado del campo de visión y la parte posterior de la entrada del canal de trampa sea visible en el otro lado.
- Empuje suavemente el émbolo de la jeringa para gusanos. El líquido fluirá notablemente desde la entrada a través del conjunto de canales hacia la salida. La presencia de bacterias y la diferencia en el índice de refracción debido a la adición del medio de gradiente de densidad hacen que el flujo de líquido sea evidente.
- Asegúrese de que los gusanos aparezcan desde la entrada y fluyan hacia la parte posterior del conjunto de canales.
- Empuje suavemente a los animales hacia el conjunto de canales. Una vez que un animal mire hacia el canal, empújelo hacia el canal y repita para animales adicionales.
NOTA: Los animales deben estar orientados con la cabeza hacia la salida para tener fácil acceso a la comida. Se pueden orientar empujando y tirando del émbolo y nadando. - Una vez que se hayan atrapado suficientes animales, coloque la jeringa, aún unida a la entrada del gusano, en la etapa del microscopio, donde permanecerá durante todo el experimento. Puede ser necesario separar brevemente el tubo de gusano de la jeringa para liberar cualquier acumulación de presión, luego vuelva a conectarlo con cuidado a la aguja roma.
- Si la carga se realizó en un microscopio de disección, transfiera el dispositivo al microscopio de imágenes. El tubo puede permanecer conectado al chip y la jeringa está conectada a la bomba.
- Encienda la bomba de jeringa y hágala funcionar a la velocidad preestablecida de 1 μL/h para 0,5 μL, aumente la tasa en 100 μL/h para 0,5 μL y redúzcala a 1 μL/h. Este ciclo se repite automáticamente durante todo el experimento. Para obtener información sobre cómo programar la bomba, consulte el manual del usuario del equipo.
- Coloque el dispositivo en la platina del microscopio y asegúrese de que esté firmemente sujeto (las sugerencias para los mecanismos de montaje se pueden encontrar en la Figura 3A).
- Si no se realizó la carga en el microscopio de imágenes, identifique la unidad del dispositivo de interés con un aumento bajo.
- Cambie a la ampliación de imagen deseada.
NOTA: Los dispositivos son compatibles con todos los tipos de objetivos. - Identifique los animales y las regiones de interés dentro de la matriz de canales de trampa y configure las condiciones de imagen deseadas.
- Imagen en las condiciones de imagen deseadas, con la válvula en chip, accionada a través del solenoide 10 s antes de la adquisición de la imagen, para que los animales se mantengan en su lugar.
NOTA: El accionamiento de la válvula en chip alargará y aplanará a los animales, lo que posiblemente requiera ajustes en la región de interés (ROI) de la imagen.
6. Preparación de la configuración
NOTA: Esta sección se refiere a la preparación inicial del mecanismo de control del dispositivo y no es necesario repetirla antes de cada experimento. Consulte la Figura 3B,C. Debido a que muchos solenoides requieren un voltaje más alto, lo más probable es que el solenoide no se conecte directamente al microcontrolador, sino a través de un relé o MOSFET (consulte la Figura 3C).
- Identifique una fuente de aire presurizado (por ejemplo, una instalación de suministro en la pared o un cilindro de gas).
- Conecte la fuente de presión a un regulador de presión adecuado (rango de presión de 0-2 bar) utilizando un tubo de 6 mm (fuente de pared) o conecte directamente un regulador adecuado al cilindro de gas.
- Conecte el regulador de presión a la entrada de la válvula solenoide (tubo de 6 mm, consulte la Figura 3B).
- Coloque el solenoide lo más cerca posible de la platina del microscopio (se sugiere ~0,5-1 m de la platina, aunque son posibles distancias más largas si es necesario).
- Conecte la válvula solenoide electrónicamente al controlador seleccionado. Hay diferentes opciones disponibles, como controlarlo mediante una placa de microcontrolador separada (por ejemplo, Arduino) o una tarjeta DAq existente.
7. Limpieza y almacenamiento
- Una vez finalizado el experimento, retire el dispositivo del microscopio.
- Retire el líquido de inmersión. El aceite de inmersión se puede eliminar con disolventes orgánicos (por ejemplo, acetona, metanol, etc.).
- Coloque el dispositivo sobre una superficie plana y desconecte todos los tubos, excepto el tubo de la válvula. Para desconectar de manera segura cada tubo, presione hacia abajo el PDMS cerca de él y tire suavemente. No levante ni doble el dispositivo, ya que esto puede hacer que la cubierta se rompa.
- Limpie la superficie del PDMS con etanol al 70%.
- Guarde el dispositivo a temperatura ambiente con el tubo de la válvula conectado.
NOTA: El dispositivo se puede reutilizar hasta que se hayan utilizado todas las unidades, probablemente sin necesidad de volver a llenar el tubo de la válvula. Sin embargo, el agua en el tubo de la válvula se evaporará durante un período prolongado y es posible que eventualmente deba rellenarse.
Resultados
Diseño y dimensiones del dispositivo
Se diseñaron cinco dispositivos distintos para acomodar las cuatro etapas larvarias. Estos dispositivos se designan de la siguiente manera: L1, para las larvas L1 cargadas inmediatamente después de la eclosión y fotografiadas hasta la etapa L2; L1-L4, capaz de contener larvas desde la etapa L1 media a tardía hasta L4 temprana a media; L2-A, adecuado para animales desde aproximadamente la mitad de la etapa L2 hasta la edad adulta temprana; L3-A, para animales desde aproximadamente la mitad de la etapa L3 hasta la edad adulta temprana; y L4-A, que acomoda a los animales desde aproximadamente la etapa L4 tardía hasta la edad adulta temprana.
Todos los dispositivos siguen el mismo diseño esencial, que consta de una entrada de gusano, 1 (o 2 en caso de intercambio de medios) entradas de alimentos bacterianos y una salida de residuos común. Entre la parte de entrada y salida, se coloca una matriz de 41 canales de trampa paralelos, con el lado de entrada y salida efectivamente separados por el canal de suministro de alimentos de menor altura (Figura 1A, A'). Las dimensiones del canal se eligieron para que fueran significativamente más largas y anchas que los gusanos cargados al comienzo de un experimento, con una longitud/anchura de 400/15 μm para los dispositivos L1, 575/22 μm para los dispositivos L1-L4, 800/27 μm para los dispositivos L2-A, 900/30 μm para los dispositivos L3-A y 1000/65 μm para los dispositivos L4-A (Archivo Suplementario 1, Archivo Suplementario 2, Legajo Complementario 3, Legajo Complementario 4 y Legajo Complementario 5).
La longitud del canal se seleccionó para que coincidiera con el tamaño que los animales alcanzaron al final del experimento, mientras que el ancho se eligió de modo que los gusanos al comienzo del experimento ocuparan aproximadamente dos tercios del ancho del canal. Este diseño permite suficiente espacio para el crecimiento y el movimiento durante la muda, al tiempo que evita que los gusanos giren o giren. A diferencia del ancho, la altura del canal se estableció cerca del grosor de los gusanos al comienzo del experimento: 8 μm para las larvas L1 tempranas, 12 μm para las larvas L1 medias/tardías, 15 μm para las larvas L2 medias, 17,5 μm para las larvas L3 medias y 22,5 μm para las larvas L4 tardías, correspondientes a las larvas L1, L1-L4, L2-A, L3-A, y dispositivos L4-A, respectivamente. La altura reducida del canal, combinada con una anchura cuidadosamente seleccionada (manteniendo una relación altura-anchura de 0,5-0,6), garantiza que los gusanos permanezcan en una orientación fija. En particular, con una altura de canal suficientemente pequeña, todos los tornillos sin fin se colocan de manera consistente en la orientación lateral deseada.
El canal de suministro de alimentos se fabricó a una altura de 3 μm para L1 y de 5 μm para todos los demás dispositivos, lo que garantiza que las bacterias puedan llegar fácilmente a los animales sin que estos escapen de los canales de trampa. Todos los dispositivos utilizan la misma capa de suministro de alimentos (Archivo Suplementario 6) y la misma capa de válvula (Archivo Suplementario 7). Tenga en cuenta que la capa de la válvula se fabrica en una oblea separada a una altura de 20 μm y solo se coloca en la capa del dispositivo durante la fabricación del dispositivo PDMS (paso 1.21).
Estas limitaciones geométricas específicas de la etapa, esenciales para evitar que los gusanos giren o inviertan la cabeza a la cola, requieren el uso de tres tipos de dispositivos distintos para acomodar todas las etapas larvarias. Si las larvas L1 se colocaran en un canal dimensionado para animales adultos jóvenes, no permanecerían estables y saldrían rápidamente del canal trampa.
Preparación de C. elegans
A menos que se indique lo contrario, los gusanos se mantuvieron de acuerdo con los protocolos estándar25 en placas NGM sembradas con E. coli OP50 a 20 °C. La sección de preparación de lombrices describe explícitamente la preparación de una población sincronizada de lombrices utilizada en un experimento de imagen. La sincronización se llevó a cabo de acuerdo con los protocolos estándar utilizando lejía de hipoclorito de sodio26, modificada con un paso de filtración adicional para eliminar los desechos y los animales no eclosionados después de la inanición nocturna. El objetivo es obtener muchas larvas L1 sincronizadas, que luego se siembran en placas NGM o se cargan directamente en el dispositivo de imagen. Otros métodos de sincronización, como la recogida manual o la puesta controlada de huevos, son igualmente adecuados. Sin embargo, son más laboriosos en la generación de suficientes animales (se recomiendan 200 por condición).
Una vez que los gusanos han alcanzado la etapa deseada, se pueden lavar suavemente de la placa NGM utilizando S-Basal limpio (idealmente filtrado a través de un filtro de 0,2 μm). El objetivo es recolectar tantos animales como sea posible sin recolectar bacterias o desechos del plato. Los animales se recogen en un pequeño tubo de centrífuga y se lavan 2-3 veces con tampón S-Basal fresco, eliminando finalmente la mayor cantidad de líquido posible. A continuación, los animales se toman directamente del volumen concentrado. Si la concentración de animales es demasiado baja, la carga será más lenta, lo que requerirá que fluya un mayor volumen de líquido a través del dispositivo y aumentará el riesgo de bloquear los canales de la trampa con escombros.
Preparación de alimentos bacterianos
El crecimiento de las bacterias se lleva a cabo siguiendo protocolos estándar, con la concentración inicial de bacterias (OD600 = 1,9) aumentada aproximadamente 40 veces en el tampón S-basal (filtrado a través de un filtro de 0,2 μm) y mezclado con el medio de gradiente de densidad y el tampón S-basal que contiene PF (filtrado a través de un filtro de 0,2 μm). El resultado esperado de este paso del proceso es la preparación de una suspensión de bacterias muy densa y la prevención de la sedimentación de bacterias durante el experimento de imagen. La alta densidad es necesaria para alimentar a los animales en chip a los bajos caudales empleados en la entrega de medios (1 μL/h). El propósito del medio de gradiente de densidad es evitar la precipitación de bacterias durante el experimento, y el propósito de PF es evitar que las bacterias se adhieran a las paredes del canal. Tanto el medio de gradiente de densidad como el PF no son tóxicos y no afectan la viabilidad de los animales.
Si se utiliza un tipo de bacteria diferente en un experimento, será necesario determinar la concentración necesaria del medio de gradiente de densidad. Esto se puede lograr mezclando la suspensión de bacterias con cantidades variables del medio, seguida de centrifugación. Si la concentración del gradiente de densidad es demasiado baja, las bacterias sedimentarán; Si la concentración es demasiado alta, las bacterias flotarán. Una vez encontrada una concentración adecuada, se recomienda validar el resultado dejando la mezcla de bacterias a temperatura ambiente durante aproximadamente 48 h para indicar cómo se comportará el alimento a lo largo del experimento. Después del experimento, también se recomienda revisar la jeringa a través de la cual se suministran las bacterias y asegurarse de que las bacterias no se sedimenten ni floten. La diferencia de volumen resultante de la adición de diferentes cantidades de Optiprep puede compensarse añadiendo más o menos S-Basal + 1% en peso PF. Del mismo modo, se pueden agregar medios o compuestos adicionales (por ejemplo, auxina) a la suspensión, y el volumen adicional se resta del volumen de S-Basal + 1% en peso PF.
Preparación de la configuración
Coloque el sistema de suministro de presión lo más cerca posible del microscopio, de modo que pueda operarse cómodamente. Todos los tramos de tubería, especialmente el tubo de 1/16" que se conecta al chip, deben permanecer cortos (menos de 0,5 m para el tubo de 1/16" de diámetro exterior) (Figura 2 y Figura 3B). Como se indica en la sección anterior, el control por computadora de la válvula en chip se puede lograr de varias maneras. Debería ser posible en cualquier software de microscopio (probado en Micro-Manager, Metamorph, NIS y ZenBlue), ya sea conectando una placa de microcontrolador dedicada (por ejemplo, Arduino) o conectando el sistema a una tarjeta de adquisición de datos (DAq) existente, utilizando una salida digital. La salida de la placa seleccionada debe configurarse como un obturador, que se enciende 10 s antes de la adquisición de la imagen o se acciona manualmente durante la configuración del dispositivo. Como se mencionó anteriormente, no se recomienda conectar el solenoide directamente al microcontrolador; en su lugar, se conecta a través de un MOSFET o un interruptor de relé para que el solenoide y el microcontrolador permanezcan aislados electrónicamente (Figura 3C).
Al igual que en el tubo de suministro de presión, mantenga todos los demás tramos de tubo hasta el chip (1/16" de diámetro exterior y 1/32" de diámetro exterior) lo más cortos posible. Mantenga los tubos de gusano y de desecho (1/16" de diámetro exterior) por debajo de 2,5 cm y 20 cm, respectivamente. El tubo de suministro de bacterias (1/32" de diámetro exterior) debe ser lo suficientemente largo como para conectarse desde la bomba de jeringa al dispositivo una vez colocado en la platina del microscopio. No obstante, se recomienda encarecidamente acortarlo tanto como sea posible y colocar la bomba de jeringa cerca de la platina del microscopio, por ejemplo, al lado de la plataforma, utilizando un estante o encima de un recinto de incubadora. Cualquier longitud de tubería agregada al sistema aumentará la contrapresión que se siente al cargar animales en el dispositivo y aumentará la presión total sobre los animales atrapados.
Funcionamiento del dispositivo
Todos los tubos se pueden preparar y conectar a la aguja roma, el pin de acero y la jeringa respectivos en esta etapa (comienzo del paso 4 del protocolo). Como se mencionó anteriormente, mantenga la longitud del tubo lo más corta posible (Figura 2J-N). Es importante destacar que se debe tener cuidado de que no queden burbujas de aire en las jeringas o tubos, ya que interferirán con la carga de los animales y pueden hacer que los animales escapen del canal de la trampa durante el experimento. Las burbujas de aire se pueden eliminar de la jeringa de varias maneras diferentes, por ejemplo, llenando la jeringa, invirtiéndola y agitándola suavemente de modo que las burbujas de aire suban a la parte superior de la jeringa (no se recomienda mover la jeringa, ya que eso puede resultar en que queden atrapadas burbujas de aire adicionales). Alternativamente, la jeringa se puede llenar metiéndola en el tampón y moviendo rápidamente el émbolo hacia arriba y hacia abajo para eliminar la mayoría de las burbujas rápidamente.
Una vez que la jeringa está llena y sin burbujas, la aguja roma y el tubo se unen y se llenan con tampón. También se debe tener especial cuidado al llenar la jeringa, ya que el aire puede quedar atrapado fácilmente en la parte de plástico de la aguja roma. Si hay aire atrapado, reemplace la aguja. Alternativamente, el llenado previo de la aguja con líquido, por ejemplo, con una pipeta, puede aliviar el problema.
Con todos los componentes en su lugar, el tubo se puede conectar al dispositivo, comenzando con el tubo que conecta el solenoide y la válvula en chip (Figura 2A-C,J). Esta tubería se llena inicialmente con agua desionizada y el sistema se presuriza para eliminar todo el aire del canal de la válvula sin salida. El PDMS es permeable al gas; por lo tanto, la presión elevada empujará todo el aire del canal hacia el PDMS, dejando el canal de la válvula lleno de agua. Este proceso se puede seguir en un microscopio, asegurándose de que todo el canal de la válvula esté lleno. Después de llenar la válvula, se puede conectar el suministro de bacterias y el dispositivo se puede llenar y presurizar bloqueando todas las entradas/salidas abiertas (Figura 2D, E, K, L). El aire se desplaza y el proceso se puede monitorear con un microscopio. Una vez que se desplaza todo el aire, las bacterias deben llenar el dispositivo de manera uniforme. Se retiran los pasadores de bloqueo y se conecta el tubo de recolección de desechos (Figura 2F, G, M). En este punto, una pequeña cantidad de líquido debe fluir a través del dispositivo hacia el tubo de recolección de desechos, asegurando que todas las conexiones al tubo estén abiertas. Esto se puede confirmar visualmente antes de conectar el tubo al tubo de recolección. Si no fluye líquido hacia el tubo de recolección de desechos, es probable que esté bloqueado. Esto resultaría en una acumulación de presión sobre el experimento, afectando negativamente a los animales atrapados. Si el tubo o sus conexiones están bloqueados, retírelo y limpie todas las conexiones con una aguja o enjuáguelas con una jeringa llena de agua.
Finalmente, se puede conectar el tubo helicoidal (Figura 2H,N). Los gusanos se recogen del tubo de centrífuga simplemente succionándolos en el tubo conectado a la jeringa llena de S-Basal. Los animales solo deben introducirse en el tubo, no en la jeringa. A continuación, el tubo se puede conectar al dispositivo. Antes de eso, se expulsa una pequeña cantidad de líquido del dispositivo y del tubo helicoidal, y las dos gotas se conectan de manera que no se introduzca aire en el dispositivo durante la carga.
Carga de gusano
Con todas las conexiones hechas, los animales se pueden cargar empujando y tirando del émbolo de la jeringa de gusano. Los animales serán expulsados de la entrada hacia el conjunto de canales de trampa; Sin embargo, naturalmente nadarán contra la corriente que experimentan. Los animales, por lo tanto, necesitan ser reorientados con la cabeza hacia el canal de la trampa. La orientación correcta de los animales se logra empujando y tirando del émbolo y dando tiempo a los animales para girar a la orientación deseada. Esto casi se puede lograr con un solo gusano, pero requerirá algo de práctica. Una vez que los animales están correctamente orientados, pueden ser empujados hacia el canal de la trampa y deslizarse hasta el final del canal, donde un escalón de altura los detiene (Figura 1A, B). Si los animales no pueden entrar en el canal, son demasiado grandes para el dispositivo seleccionado y necesitan ser fotografiados en un dispositivo más grande. Si los animales pueden rotar o darse la vuelta cuando se colocan en el canal de la trampa, son demasiado jóvenes y es necesario usar un dispositivo más pequeño, o se debe dejar que los animales crezcan durante unas horas más.
Es importante destacar que los animales en diferentes canales no se afectarán entre sí. Por lo tanto, los animales cargados incorrectamente no afectarán a los cargados correctamente, sin embargo, no tendrán suficiente acceso a la comida y, por lo tanto, crecerán más lentamente o detendrán el desarrollo.
Si los animales se cargan a la edad adecuada, debe producirse un movimiento mínimo a lo largo del eje longitudinal del canal. Sin embargo, los animales pueden moverse libremente (Figura 1B) y comenzar a alimentarse en un par de minutos. Si los animales muestran un movimiento significativo a lo largo del eje longitudinal del canal, es probable que esto se deba a la acumulación de presión en el dispositivo o a una burbuja de aire alojada en algún lugar del tubo, la aguja roma o la jeringa. La acumulación de presión dentro del dispositivo se puede liberar separando suavemente el tubo helicoidal de la aguja roma y volviéndolo a conectar suavemente. Si una burbuja de aire ha permanecido alojada dentro del sistema a pesar de los pasos y precauciones mencionados anteriormente, es posible que sea necesario quitar toda la jeringa de gusano y reemplazarla por una nueva sin burbujas de aire. Las burbujas de aire en el sistema funcionan como resortes que se comprimen durante la carga y se liberan lentamente después de cargar los animales. El flujo creado por la expansión de las burbujas de aire puede provocar inestabilidades en el sistema, empujando a los animales fuera de los canales de la trampa.
Adquisición y desarrollo de imágenes on-chip
Finalmente, una vez que los animales están cargados, puede comenzar la adquisición de imágenes. En principio, los dispositivos son compatibles con la mayoría de los métodos de imagen, campo claro, epifluorescencia 18,19,22,23 (Figura 4), disco giratorio confocal19 e incluso modalidades de superresolución (AiryScan24), ya que todas las imágenes se realizan a través de un cubreobjetos de 170 μm de grosor. En consecuencia, el dispositivo microfluídico muestra poco o ningún efecto en la calidad de imagen alcanzable en el chip. Sin embargo, se deben seleccionar las condiciones de imagen apropiadas que no afecten a la viabilidad del animal, independientemente de la modalidad de imagen. Las altas intensidades de excitación darán lugar fácilmente al blanqueo de fluoróforos y a la detención del desarrollo debido a la alta energía y calor impartidos a la muestra. Se recomiendan tiempos de exposición cortos (~10 ms) e intensidades de excitación bajas (menos del 10% de una fuente LED de fluorescencia típica), lo que produce una imagen utilizable con un ajuste de contraste de min = 0 y max = 1000 (cuando se utiliza una cámara de 16 bits) (Figura 4).
En la Figura 4 se muestran los datos representativos obtenidos con los dispositivos L1, L1-4 y L2-A. Mostrando el desarrollo de las células epiteliales de C. elegans desde la eclosión/inanición nocturna hasta la etapa larvaria de L2 media (Figura 4A, Vídeo Suplementario 1), la inducción de las células precursoras de la vulva 1° predestinada y sus divisiones posteriores desde la etapa larvaria L1 tardía hasta la etapa larvaria L4 temprana (Figura 4B, Vídeo Suplementario 2) y, finalmente, la formación de la vulva de C. elegans desde la etapa larvaria L3 temprana hasta la eversión en la transición a la edad adulta (Figura 4C, Película complementaria 3).
Cada aplicación va acompañada de una cuantificación de diferentes métricas de tiempo de desarrollo. Las imágenes de la Figura 4A, B se muestran sin ningún procesamiento posterior aplicado, es decir, no se aplicó ninguna deconvolución ni registro de imagen. Las imágenes de la Figura 4C, por otro lado, se desconvolucionaron27 y se registraron, lo que destaca las mejoras en la calidad de la imagen posibles cuando se utilizan dispositivos de imagen a largo plazo.
En primer lugar, identificar el inicio de cada división de células de veta para los animales que se muestra en la Figura 4A (ver Vídeo Suplementario 1 para un curso a tiempo completo), lo que indica la división consistente y oportuna de todas las células en 12 animales (Figura 4D). Utilizando las células de costura, también se evaluó el tiempo general de desarrollo en las cuatro etapas larvarias, y se encontró que todas las divisiones de células de costura se completaron después de 12,0 h ± 1,7 h (media ± DE) en L1 (n = 22), 10,2 h ± 1,0 h en L2 (n = 27), 10,9 h ± 1,4 h en L3 (n = 27) y 14,6 h ± 2,2 h en animales L4 (n = 19). Estos datos son consistentes con los valoresde la literatura 2,28, así como con los valores medidos en animales criados en placa, que arrojaron tiempos medios de desarrollo para L1 15 h (n = 21), L2 10 h (n = 15), L3 12 h (n = 21) y L4 12,5 h (n = 61) (Adaptado de Berger et al.18). Los ligeros retrasos observados son probablemente consecuencia de la adquisición de imágenes y la fototoxicidad resultante o del aumento del confinamiento una vez que los animales han crecido y se encuentran en un canal trampa.
En segundo lugar, seguimos el crecimiento de los animales a través de las etapas L2 y L3, cuantificando la longitud de las gónadas como un excelente indicador de la progresión del desarrollo (Figura 4E, ver Película Suplementaria 2 para un curso de tiempo completo). Al igual que con la división celular de la costura, la longitud precisa de la gónada se pudo medir gracias a la orientación recta de los animales, y se encontró un crecimiento constante de las gónadas en todos los animales fotografiados (n = 19). La primera división de VPC en estos experimentos se observó 14,26 h ± 2,47 h después de que comenzara el experimento (~30 h después de la siembra), y la segunda ocurrió 1,46 h ± 0,13 h después (n = 19). Estos datos concuerdan con los valores de la literatura establecidos en las placas NGM29,30. Euling y Ambros30 encontraron que la primera división ocurrió aproximadamente 29 h y la segunda aproximadamente 3 h después.
Por último, se cuantificó el tiempo en el que se alcanzan estadios específicos en el desarrollo vulvar (Figura 4F, ver Vídeo Suplementario 3 para el curso a tiempo completo), evaluando específicamente el tiempo necesario para progresar desde la invaginación (L4.0, t1) hasta la etapa L4 media (L4.5, t4) de acuerdo con las subetapas definidas por Mok et al.31. El tiempo medio de progresión entre t1-t2 fue de 3,8 h ± 1,2 h, entre t2-t3 fue de 3,5 h ± 1,2 h, y entre t3-t4 fue de 2,8 h ± 1,6 h (n = 7), lo que indica una progresión del desarrollo aproximadamente lineal. Al igual que en el ensayo de tiempo de desarrollo, estos tiempos, en particular t1-t2, parecen ligeramente retrasados en comparación con los valores reportados en la literatura (t1-t2: 0,7 h, t2-t3: 3 h, t3-t4: 2,3 h31), posiblemente debido a las dimensiones estrechas del dispositivo que ralentizan la muda. Sin embargo, el tiempo de desarrollo sigue siendo muy constante entre los animales, y todos progresan con éxito hasta la edad adulta.
Compensación del movimiento de los animales y la deriva del microscopio
El movimiento de los animales a lo largo de una sola pila Z suele ser mínimo cuando se acciona la válvula en el chip. Sin embargo, no se espera que los animales permanezcan completamente quietos. La fluctuación residual observada en una sola pila se puede compensar aumentando la presión para accionar la válvula en chip, disminuyendo el tiempo de exposición utilizado o aumentando el paso Z seleccionado para acelerar la adquisición de la pila. El tiempo de adquisición de la pila se puede reducir aún más mediante el uso de una unidad Z piezoeléctrica, lo que da como resultado un movimiento Z significativamente más rápido en comparación con una unidad de enfoque de microscopio convencional, o mediante la utilización de filtros multibanda (por ejemplo, GFP / mCherry) de modo que se puedan adquirir colores separados sin la necesidad de cambios de filtro que consumen mucho tiempo. Como referencia, en los ejemplos proporcionados (Figura 4 y Película complementaria 1, Película complementaria 2 y Película complementaria 3), el tiempo de adquisición de la pila suele oscilar entre 3 y 8 segundos. El movimiento residual también se puede eliminar a través de varios métodos de registro de imágenes si es necesario.
Se espera que los animales en chip crezcan de manera constante. Por lo tanto, las características de interés cambiarán inevitablemente a lo largo del eje del canal longitudinal (Figura 4A, B, Película Suplementaria 1 y Película Suplementaria 2). Por lo tanto, se recomienda configurar el campo de visión de la imagen de manera que la característica de interés pueda convertirse en el campo de visión y no se pierda en el transcurso de un experimento (Figura 1B y Figura 4A,B). Alternativamente, se pueden obtener imágenes de los animales en múltiples campos de visión adyacentes, cubriendo todo el cuerpo del animal. Sin embargo, esto puede impartir fototoxicidad y estrés adicionales. Al igual que con Z-motion, varios procedimientos de registro pueden compensar el movimiento de los animales en el canal con el tiempo. Si los animales muestran un movimiento errático a lo largo del eje longitudinal, más extenso de lo que se puede atribuir al crecimiento, es probable que esto sea causado por una burbuja de aire.
Cada dispositivo de imagen a largo plazo contiene seis unidades de imagen individuales, cada una de las cuales se puede utilizar para un experimento independiente. Cada unidad puede albergar hasta 41 animales, y los canales de las trampas están espaciados de tal manera que se pueden obtener imágenes de varios animales en un solo campo de visión. Además, se pueden obtener imágenes de múltiples campos de visión dentro de una sola unidad o dispositivo. Al igual que con todas las muestras de microscopio, el movimiento a través de la superficie de la muestra puede introducir una deriva del enfoque debido a la pérdida de medios de inmersión. Esta deriva se puede compensar mediante el uso de un aceite de inmersión de menor viscosidad o mediante varias modalidades de enfoque automático. Sin embargo, es posible que algunos sistemas de enfoque automático de hardware no funcionen cuando se utilizan con un dispositivo microfluídico PDMS, ya que utilizan la transición de vidrio a un medio acuoso como punto de referencia (lado de la muestra del vidrio de cubierta). Gran parte del campo de visión está lleno de silicona dentro del dispositivo, que tiene un índice de refracción más alto que el agua; Si bien esto no afecta la calidad de la imagen, puede afectar negativamente al enfoque automático. Al obtener imágenes de un solo campo de visión, la desviación del enfoque observada dentro del dispositivo es mínima (menos de 2 μm). Si se observa una desviación excesiva del enfoque, esto puede ser el resultado de la inestabilidad térmica del sistema o entorno del microscopio, un movimiento XY excesivo que adquiere múltiples FOV o un montaje incorrecto del dispositivo en el microscopio (consulte la Figura 3A para conocer los mecanismos de montaje sugeridos).
Del mismo modo, el movimiento excesivo de XY y el montaje incorrecto también pueden dar lugar a una deriva de XY. Dado que el dispositivo y el objetivo del microscopio están conectados a través del líquido de inmersión, los movimientos rápidos en X, Y o Z pueden hacer que se apliquen fuerzas al dispositivo. Si los dispositivos están montados correctamente y no actúan fuerzas externas sobre ellos, son excepcionalmente estables con una deriva de enfoque mínima y sin deriva XY.
Por último, si los parámetros específicos del sistema son inapropiados, los dispositivos microfluídicos PDMS pueden afectar negativamente al desarrollo de los animales. La viabilidad se ve afectada por la presión excesiva de la válvula, la alta fototoxicidad resultante de altas intensidades de excitación, largos tiempos de exposición o cortos intervalos de tiempo entre las adquisiciones de la pila. Especialmente cuando se utiliza este sistema por primera vez, se recomienda encarecidamente evaluar la viabilidad de los animales utilizando un marcador fluorescente brillante o imágenes de campo claro, asegurándose de que la condición de la imagen no afecte el crecimiento del animal. Una vez que los animales se desarrollan de manera confiable, los parámetros de imagen se pueden variar según sea necesario.

Figura 1: Diseño del dispositivo y funcionamiento esquemático. (A) Descripción general del dispositivo que muestra una sola unidad con la entrada de gusano (i), la entrada de alimento bacteriano (ii) y la salida general (iii). (A') Vista ampliada del canal de trampa en un dispositivo L2-A, resaltando el número de gusanos visibles en un solo campo de visión a diferentes aumentos (40x-100x). (B) Principio de funcionamiento de la válvula en chip. Cuando está apagado, la altura del canal se selecciona para que los animales puedan caber cómodamente en el canal de la trampa. Cuando está encendido, la altura del canal disminuye, presionando al animal sobre el cubreobjetos, inmovilizando así de forma reversible a los animales atrapados. Las imágenes muestran a dos animales atrapados en el chip con la válvula en el chip apagada y con la válvula encendida, con los animales visiblemente enderezados y alargados bajo presión. El animal superior cargó correctamente y mirando hacia la fuente de alimento ( ), y el inferior mirando hacia afuera (X). (C-C") Configuración esquemática del dispositivo. (C) Tamaños de dispositivos disponibles. L1 es adecuado para animales desde la etapa L1 hasta la etapa L2 media, L1-4 para animales desde la etapa larvaria media L2 hasta la etapa larvaria media L4, y L2-A para animales desde la etapa larvaria media L2 hasta la edad adulta. Las barras de escala son (A) 1000 μm, (B) 100 μm y (C) 50 μm. La figura es una adaptación parcial de Berger et al.18. Haga clic aquí para ver una versión más grande de esta figura.
), y el inferior mirando hacia afuera (X). (C-C") Configuración esquemática del dispositivo. (C) Tamaños de dispositivos disponibles. L1 es adecuado para animales desde la etapa L1 hasta la etapa L2 media, L1-4 para animales desde la etapa larvaria media L2 hasta la etapa larvaria media L4, y L2-A para animales desde la etapa larvaria media L2 hasta la edad adulta. Las barras de escala son (A) 1000 μm, (B) 100 μm y (C) 50 μm. La figura es una adaptación parcial de Berger et al.18. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Configuración del dispositivo y conexiones. (A-I) Resumen esquemático del proceso de configuración. (A) Conexión de tubería llena de agua de 1/16" a la entrada de la válvula usando un pasador de acero hueco (gris), con el otro extremo unido al sistema de suministro de presión. (B) Llenado de la válvula hidráulica en chip a través del solenoide fuera de chip y presurización del dispositivo durante unos minutos. (C) Desactivación de la presión antes de continuar con los siguientes pasos. (D) Conexión de una jeringa que contenga alimentos bacterianos a la entrada de alimentos usando un tubo de 1/32" y una aguja roma de 30 G, seguido de llenar el dispositivo hasta que aparezca líquido en ambas conexiones abiertas. (E) Sellado de la entrada del tornillo sin fin y la salida de desechos con pasadores de acero bloqueados por un trozo de tubo de 1/16" ( ) y presurización del dispositivo usando la jeringa para alimentos y la bomba (mediante ajuste de tornillo de mariposa), manteniendo la presión durante unos minutos. (F) Extracción de los tapones de (E), asegurando que se formen gotas de líquido en cada conexión abierta. (G) Conexión del contenedor de residuos a través de una pieza corta de tubo de 1/16" y un pasador de acero hueco. (H) Fijación de una jeringa llena de tampón al dispositivo mediante un alfiler de acero hueco y una aguja roma de 23 G. Los tornillos sin fin se introducen en el tubo antes de conectarlo al dispositivo, lo que garantiza que no se introduzca aire alineando las gotas de líquido en la entrada y el extremo del tubo. (I) Configuración final con todas las conexiones de dispositivos establecidas. (J) Imagen del dispositivo con el tubo de la válvula conectado a la entrada y al solenoide (fondo), correspondiente a (A-C). (K) Vista ampliada del dispositivo con el tubo de suministro de alimentos conectado, que muestra dos gotas de líquido (flechas) en la entrada del tornillo sin fin y la salida de desechos, correspondientes a (D). (L) Vista ampliada del dispositivo con el tubo de suministro de alimentos conectado y la entrada de tornillo sin fin y la salida de desechos bloqueadas, correspondiente a (E). (M) Vista ampliada del dispositivo con el tubo de desagüe y el contenedor adjuntos, correspondiente a (G). (N) Montaje final con todas las conexiones de tubería en su lugar, correspondiente a (I). Adaptado parcialmente de Berger et al.18. Haga clic aquí para ver una versión más grande de esta figura.
) y presurización del dispositivo usando la jeringa para alimentos y la bomba (mediante ajuste de tornillo de mariposa), manteniendo la presión durante unos minutos. (F) Extracción de los tapones de (E), asegurando que se formen gotas de líquido en cada conexión abierta. (G) Conexión del contenedor de residuos a través de una pieza corta de tubo de 1/16" y un pasador de acero hueco. (H) Fijación de una jeringa llena de tampón al dispositivo mediante un alfiler de acero hueco y una aguja roma de 23 G. Los tornillos sin fin se introducen en el tubo antes de conectarlo al dispositivo, lo que garantiza que no se introduzca aire alineando las gotas de líquido en la entrada y el extremo del tubo. (I) Configuración final con todas las conexiones de dispositivos establecidas. (J) Imagen del dispositivo con el tubo de la válvula conectado a la entrada y al solenoide (fondo), correspondiente a (A-C). (K) Vista ampliada del dispositivo con el tubo de suministro de alimentos conectado, que muestra dos gotas de líquido (flechas) en la entrada del tornillo sin fin y la salida de desechos, correspondientes a (D). (L) Vista ampliada del dispositivo con el tubo de suministro de alimentos conectado y la entrada de tornillo sin fin y la salida de desechos bloqueadas, correspondiente a (E). (M) Vista ampliada del dispositivo con el tubo de desagüe y el contenedor adjuntos, correspondiente a (G). (N) Montaje final con todas las conexiones de tubería en su lugar, correspondiente a (I). Adaptado parcialmente de Berger et al.18. Haga clic aquí para ver una versión más grande de esta figura.
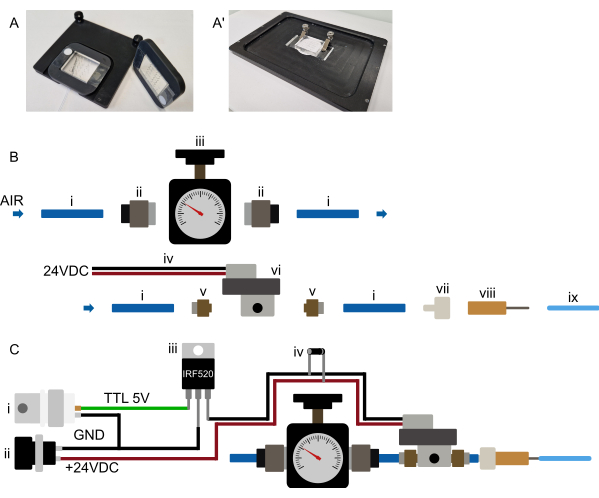
Figura 3: Configuración de hardware. (A-A') Montaje sugerido del dispositivo. (A) Posible montaje para un microscopio vertical. Los dispositivos están unidos a un marco rectangular impreso en 3D con un gran recorte central. Inicialmente se colocan dos pequeñas tiras de cinta adhesiva de doble cara en el vidrio de la cubierta, a cada lado de la parte PDMS del dispositivo. A continuación, el marco impreso en 3D se coloca sobre el dispositivo, de modo que la parte del PDMS sobresale a través del recorte y el marco se presiona firmemente sobre la cinta de doble cara, fijando permanentemente el dispositivo al marco. Por lo tanto, el marco sujeta el dispositivo de forma segura y se mantiene en la platina del microscopio mediante imanes incrustados en el marco y el inserto de la platina. Esto garantiza un montaje estable del dispositivo y evita la colisión del objetivo del microscopio con cualquier hardware de montaje. Todos los tubos se dirigen a la parte delantera del dispositivo. (A') Posible montaje para un microscopio invertido. Un conjunto de abrazaderas sujeta firmemente el dispositivo. Asegúrese de que las abrazaderas presionen el dispositivo sobre el inserto de la plataforma para evitar cualquier movimiento XY durante el funcionamiento. (B) Vista de las partes del sistema de presión. (i) Tubo de poliuretano de 6 mm de diámetro exterior conectado a una fuente de presión. (ii) Adaptador a presión G1/8 a 6 mm que conecta el tubo (i) al regulador de presión (iii). A continuación, el tubo se conecta a un solenoide (vi) a través de un adaptador de empuje de M5 a 6 mm (v) y, por último, el tubo se conecta a un conector luer-lock-to-barb (vii) y a una aguja roma de 23 G (viii) al tubo de 1/16" de diámetro exterior conectado al dispositivo microfluídico. (C) Vista general esquemática de las conexiones electrónicas y el sistema de presión ensamblado. (i) El disparador TTL (+3.3-5 V) generado por un Arduino, una tarjeta DAq o cualquier otro microcontrolador, junto con una fuente de alimentación adecuada (ii, 24 VDC) está conectado a un MOSFET (iii) y a las conexiones electrónicas del solenoide como se muestra en el esquema, con un diodo flyback (iv) conectado a través de las conexiones de alimentación de los solenoides. Una vez que se envía una señal TTL desde el microcontrolador a la puerta del MOSFET, se aplican +24 VDC al solenoide normalmente cerrado y se infla la válvula hidráulica en el chip. Una vez que se elimina la señal TTL, se libera la presión y se desinfla la válvula hidráulica en el chip. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Resultados representativos. (A) Animal que muestra un creador de unión epitelial (ML2615, dlg-1(mc103[dlg-1::gfp])) que crece desde la inanición nocturna hasta la etapa larvaria L2 temprana/media, utilizando el dispositivo L1. Visibles son las células de la costura divisoria, así como las células P, que migran y se dividen hacia la etapa larvaria L1 tardía. (B) Animales que crecen desde la etapa larvaria L1 tardía hasta la etapa L4 temprana, utilizando el dispositivo L1-4. Visible es un marcador para la célula precursora de la vulva (VPC) 1° predestinada (AH1187, arIs92[egl-17::cfp]), con una sola célula visible al principio del experimento, seguida de dos rondas de divisiones celulares visibles en la etapa larvaria L3. (C) Animales que crecen desde la etapa larvaria L2 tardía hasta la edad adulta temprana, utilizando el dispositivo L2-A. Visible es un creador de uniones epiteliales (AH5786, hmr-1(cp21[hmr-1::gfp + LoxP])), que destaca el tejido vulvar en desarrollo formando estructuras toroidales distintas, y una imagen combinada con un marcador para la célula de anclaje uterina (AC) (AH5786, qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)]) que invade el tejido vulvar hacia el final de la etapa larvaria L3, conectando los tejidos. Para todos los experimentos (A-C), el campo de visión se configura inicialmente de modo que solo una parte de los animales sea visible. A medida que avanza el experimento, el animal llenará más del canal y las características se desplazarán a lo largo del eje del canal como consecuencia del crecimiento animal. (D) Momento en el que las divisiones individuales de las células de la costura comienzan a dividirse durante la etapa larvaria L1 (n = 12). El inserto resalta las identidades de las células de costura (H1-V6) a lo largo del eje antero-posterior del cuerpo. (E) Muestra el crecimiento de las gónadas con el tiempo para los animales en la Figura 4B (n = 19). (F) Muestra el tiempo requerido para alcanzar 4 puntos de tiempo de desarrollo distintos en la morfogénesis vulvar (t1-t4), lo que indica una transición consistente para todos los animales fotografiados (n = 7). Las barras de escala son (A, B) 50 μm y (C) 25 μm. Consulte Película Suplementaria 1, Película Suplementaria 2 y Película Suplementaria 3 para el curso de tiempo completo. Los diagramas de caja muestran los valores medianos (líneas rojas) con cuartiles superiores e inferiores y barras que indican los extremos de la distribución, excluyendo los valores atípicos. La figura es una adaptación de Berger et al.18. Haga clic aquí para ver una versión más grande de esta figura.
Película suplementaria 1: Una sola larva de C. elegans que se desarrolla desde la inanición nocturna hasta la etapa L2 temprana. Se muestran imágenes de epifluorescencia proyectadas de máxima intensidad (la altura total de la proyección es de 1,5 μm), en un formato sin procesar. Visibles son todos los eventos de división y fusión de células de costura que ocurren en la etapa especificada (arriba). Las características se describen utilizando el marcador DLG-1::GFP (unión epitelial) a intervalos de 15 minutos durante un total de 25 h. La película es una reutilización de Berger et al.18. Por favor, haga clic aquí para descargar esta película.
Vídeo suplementario 2: Una sola larva que se desarrolla desde el estadio L1 tardío hasta el estadio L4 temprano, expresando un marcador EGL-17::CFP (célula precursora vulvar (VPC) 1° predestinada)). A principios de L2 (~400 min), la fluorescencia EGL-17::CFP se manifiesta en P6.p, aumentando continuamente en intensidad. Durante L3, P6.p se somete a dos rondas consecutivas de división, formando las etapas de desarrollo de la vulva de 1, 2 células y 4 células. Las imágenes se muestran a intervalos de 30 minutos durante un total de 34 h. La película es una reutilización de Berger et al.18. Por favor, haga clic aquí para descargar esta película.
Vídeo complementario 3: Vista superior: Proyección Z de la vulva en desarrollo desde la etapa L3 hasta la transición L4/adulta. Vista inferior: Proyección X de la misma vulva a lo largo del tiempo. Ambas vistas muestran la división inicial de las VPC, seguida de invaginación, formación y agrandamiento de los toroides, seguido de un colapso durante la eversión. Las imágenes de epifluorescencia se muestran después del recorte, la deconvolución, el registro y la proyección. Las características se describen a través del marcador HMR-1::GFP (hipodermis y VPC) y el marcador mCherry::moeABD (que delinea el AC). La película es una reutilización de Berger et al.18. Por favor, haga clic aquí para descargar esta película.
Archivo complementario 1: Archivo CAD para el dispositivo L1. Haga clic aquí para descargar este archivo.
Archivo complementario 2: Archivo CAD para el dispositivo L1-4. Haga clic aquí para descargar este archivo.
Archivo complementario 3: Archivo CAD para el dispositivo L2-A. Haga clic aquí para descargar este archivo.
Archivo complementario 4: Archivo CAD para el dispositivo L3-A. Haga clic aquí para descargar este archivo.
Archivo complementario 5: Archivo CAD para el dispositivo L4-A. Haga clic aquí para descargar este archivo.
Fichero complementario 6: Fichero CAD para la estructura de distribución de alimentos. Haga clic aquí para descargar este archivo.
Archivo complementario 7: Archivo CAD para la capa de válvulas. Haga clic aquí para descargar este archivo.
Discusión
Este artículo ha descrito el funcionamiento de una plataforma única de imágenes microfluídicas a largo plazo, que es adecuada para la obtención de imágenes de alta resolución y el seguimiento de varios procesos de desarrollo en C. elegans durante las cuatro etapas larvales hasta la edad adulta temprana18. La capacidad de seguir los procesos de desarrollo a lo largo del tiempo in vivo, utilizando este método de imagen y otros, se ha vuelto indispensable en muchos campos de la investigación de C. elegans y ha permitido responder a preguntas antes inaccesibles 23,24,29.
A diferencia de los métodos de imagen tradicionales que utilizan almohadillas de agar y las estrategias de imagen a largo plazo basadas en microfluídica publicadas anteriormente, este enfoque preserva la identidad y la orientación del gusano durante todo el experimento, lo que permite el seguimiento de procesos de desarrollo complejos a lo largo del tiempo. Independientemente de la etapa de desarrollo, los animales están confinados a uno de los 41 canales de trampa paralelos, cada uno conectado a un suministro de alimentos en chip y cubierto por una gran válvula hidráulica. La inmovilización de todos los gusanos atrapados se produce a través del inflado de la válvula hidráulica, presionando los gusanos sobre el vidrio de cubierta solo durante la adquisición de la imagen. La obtención de imágenes de alto rendimiento es posible gracias a la matriz de canales de trampa espaciados estrechamente, con múltiples animales visibles dentro de un solo campo de visión. Los dispositivos de imágenes a largo plazo son compatibles con la mayoría de las configuraciones de microscopios, requieren un hardware adicional mínimo (menos de $ 1000) y no hay modificaciones en el hardware existente. El funcionamiento de los dispositivos es intencionadamente sencillo, por lo que todos los usuarios deberían poder aprenderlo rápidamente siguiendo el protocolo anterior y los resultados descritos.
En resumen, se pueden obtener imágenes de animales en chip a lo largo de hasta 2,5 etapas larvales (Figura 1C). Inicialmente, los animales se sincronizan y se cargan directamente en el chip (dispositivo L1) o se siembran en la placa NGM hasta la etapa de desarrollo deseada (dispositivos L1-L4 y L2-A). Los animales en chip se alimentan con una suspensión de bacterias altamente concentrada y se inmovilizan mediante una válvula hidráulica en chip accionada por el software de imágenes (Figura 1B). Los animales son conducidos a los canales de trampa usando una jeringa, orientando cuidadosamente a los animales con la cabeza hacia el suministro de alimento y finalmente atrapando a los animales al final del canal de trampa (Figura 1A y Figura 2). Se debe tener cuidado para que no quede aire atrapado en las jeringas, las agujas romas y los tubos, ya que las burbujas de aire perturbarán fácilmente la posición del animal. Los dispositivos son compatibles con la mayoría de las modalidades de imagen 18,19,24, ya que el material PDMS es altamente transparente, no fluorescente y está sellado contra una cubierta de vidrio delgada (Figura 4, Película Suplementaria 1, Película Suplementaria 2 y Película Suplementaria 3). Sin embargo, se debe tener cuidado al seleccionar las condiciones de imagen, ya que los tiempos de exposición prolongados y las altas intensidades de excitación afectarán fácilmente la viabilidad del animal y darán lugar a un fotoblanqueo.
Además de la versión presentada de este método de imagen, ya son posibles y ya están disponibles varias modificaciones al protocolo. La modificación más sencilla es la sustitución de las cepas de bacterias estándar, por ejemplo, por bacterias que expresan ARNi18 o bacterias con diferentes valores nutricionales32. Las cepas bacterianas pueden intercambiarse fácilmente ajustando el contenido de Optiprep para tener en cuenta las diferencias de densidad. Del mismo modo, se puede añadir cualquier número de compuestos al alimento bacteriano, por ejemplo, auxina, nutrientes o compuestos farmacológicos de moléculas pequeñas, y su efecto se observa directamente in vivo, sin necesidad de realizar ningún cambio en el protocolo. En particular, se desarrolló un dispositivo de intercambio de medios para la degradación de proteínas inducida por auxinas o cualquier aplicación que necesite una exposición cronometrada o reversible mediante la adición de una entrada de alimento al diseño del dispositivo sin cambiar la geometría o el funcionamiento. La entrada adicional permite cambiar fácilmente entre dos condiciones diferentes, por ejemplo, auxina y sin auxina, conectadas al dispositivo de la misma manera que se muestra aquí para una sola fuente de alimento, y los cambios resultantes se observan directamente. También se desarrollaron variantes de dispositivos en las que la válvula hidráulica no se comparte entre todas las unidades de un dispositivo, sino que se separa para cada unidad, de modo que se pueden obtener imágenes de múltiples condiciones dentro del mismo dispositivo y experimentar individualmente, lo que reduce los efectos potencialmente dañinos de los largos tiempos de accionamiento y adquisición de la válvula. Por último, más allá de las variantes originales del dispositivo descritas en Berger et al.18, se desarrollaron dos nuevas variantes del dispositivo, L3-A y L4-A (introducidas aquí), que permiten obtener imágenes desde la etapa media de L3 o mediados de L4 hasta la edad adulta. El propósito de estas modificaciones es retrasar el tiempo de inicio de un experimento a una etapa larvaria posterior, de modo que los animales más grandes puedan cargarse en aplicaciones donde las etapas de desarrollo anteriores no son de interés.
Divulgaciones
Los autores declaran no tener intereses contrapuestos ni financieros.
Agradecimientos
Deseamos agradecer a los miembros del laboratorio Hajnal por la discusión crítica y los comentarios sobre el manuscrito. También agradecemos al Centro de Genética de C. elegans CGC, financiado por la Oficina de Programas de Infraestructura de Investigación de los NIH (P40 OD010440). Además, deseamos agradecer a los miembros del laboratorio Galli (Instituto Hubrecht), el laboratorio Conradt (University College London) y el laboratorio van den Heuvel (Universidad de Utrecht) por sus valiosas aportaciones sobre el protocolo presentado. Este trabajo contó con el apoyo de subvenciones de la Fundación Nacional Suiza para la Ciencia n.º 31003A-166580 a AH, la Liga Suiza contra el Cáncer n.º 4377-02-2018 a AH, y la financiación de ETH Zürich a AdM.
Materiales
| Name | Company | Catalog Number | Comments |
| 3/2 solenoid valve | Distrelec | 154-22-898 and 154-22-899 | Alternative to above. Solenoid valve connecting the pressure regulator to the on-chip valve. |
| Arduino | Distrelec | 301-01-956 | Optional microcontroller depending on the selected controller and interface. |
| Bacto-Tryptone | Thermo Fisher Scientific | 211705 | For L Broth production. |
| Bacto-Yeast | Thermo Fisher Scientific | 212750 | For L Broth production. |
| Blunt needle 23G | Gonano Dosiertechnik | GGA723050 | Blunt needle connecting the 1/16" tubing to a syringe. |
| Blunt needle 30G | Gonano Dosiertechnik | IG-TE730050 | Blunt needle connecting the 1/32" tubing to a syringe. |
| C. elegans Construct 1 | NA | NA | AH5786 LGI: hmr-1(cp21[hmr-1::gfp + LoxP]) Marston, D.J. et al. MRCK-1 drives apical constriction in C. elegans by linking developmental patterning to force generation. Curr. Biol. 26 (16), 2079-2089. 2016. |
| C. elegans Construct 2 | NA | NA | AH1187 LGII: arIs92[egl-17::cfp] Yoo, A.S., Bais, C., Greenwald, I. Crosstalk between the EGFR and LIN-12/Notch pathways in C. elegans vulval development. Science. 303 (5658), 663-666. 2004. |
| C. elegans Construct 3 | NA | NA | AH5786 LGV: qyIs50[Pcdh-3>mCherry::moeABD, unc-119(+)] Ziel, J.W., Hagedorn, E.J., Audhya, A., Sherwood, D.R. UNC-6 (netrin) orients the invasive membrane of the anchor cell in C. elegans. Nat. Cell Biol., 11 (2), 183-189. 2009. |
| C. elegans Construct 4 | NA | NA | ML2615 LGX: dlg-1(mc103[dlg-1::gfp]) Vuong-Brender, T.T.K., Suman, S.K., Labouesse, M. The apical ECM preserves embryonic integrity and distributes mechanical stress during morphogenesis. Development. 144 (23), 4336-4349. 2017. |
| Cable | Distrelec | 143-46-644 | Needed if selecting the solenoid from distrelec. Cable connecting the solenoid to the MOSFET. |
| Chlorotrimethyl silane | Sigma Aldrich | 386529-25ML | Silane for wafer passivation. |
| Cholesterol | Sigma Aldrich | C8667 | For S-Basal production. |
| Flyback Diode | Distrelec | 110-52-628 | Flyback diode protecting the microcontroller. |
| Hollow steel pin | Gonano Dosiertechnik | GGA7R23050 | 23G hollow steel pin connecting the 1/16" tubing to the device. |
| L Broth | NA | NA | Prepared in house following standard recipe. 10 g Bacto-tryptone, 5 g Bacto-yeast, 5 g NaCl, H2O to 1 litre, pH to 7.0 using 1 M NaOH |
| Long-term Imaging Device L1 | NA | NA | Long-term imaging device for L1 to early/mid L2 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L1-4 | NA | NA | Long-term imaging device for mid L1 to mid L4 larvae. Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L2-A | NA | NA | Long-term imaging device for mid L2 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L3-A | NA | NA | Long-term imaging device for mid L3 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| Long-term Imaging Device L4-A | NA | NA | Long-term imaging device for mid L4 to adulthood (eversion). Made inhouse, available on request. Also available as media exchange variant. |
| M9 Buffer | NA | NA | Prepared in house following standard recipe. |
| MOSFET | Distrelec | 303-41-391 | Metal-oxide-semiconductor field-effect transistor, used to switch the 24VDC required for the solenoid. |
| NGM plates | NA | NA | Prepared in house following standard recipe. |
| Nylon Luer-Fitting | Fisher Scientific | 11776048 | Adapter from OD 6mm tubing to 23G blunt needle. |
| Optiprep | Sigma Aldrich | D1556 | Density matching liquid. |
| PDMS | Ameba | Elastosil RT601A/B | PDMS elastomer kit. |
| Pluronic F-127 | Sigma Aldrich | P2443 | Non-ionic surfactant. |
| Potassium dihydrogen phosphate | Sigma Aldrich | 1.37039 | For S-Basal production. |
| Potassium hydrogen phosphate | Sigma Aldrich | 1.05099 | For S-Basal production. |
| Power Supply 24VDC | Distrelec | 301-63-304 | 24VDC power supply. Select a power supply suitable for the solenoid selected. |
| Precision pressure regulator | Distrelec | 154-23-578 | Alternativ to above. Pressure regulator. |
| Pressure Gauge G1/8 | Distrelec | 154-23-643 | Pressure gauge attaches to the pressure regulator. |
| PU Tubing OD 6mm | Distrelec | 154-23-866 | Tubing connecting the pressure source and regulator, as well as regulator and solenoid valve. |
| Push-in fitting G1/8 to 6mm | Distrelec | 301-69-330 | Alternativ to above. 2x Push-in fitting attaches to the pressure regulator and connects to the 6mm tubing. |
| Push-in fitting M5 to 6 mm | Distrelec | 301-69-459 | 2x Push-in fitting attaches to the solenoid and the 6mm tubing. |
| S-Basal Buffer | NA | NA | Prepared in house following standard recipe. 5.85 g NaCl, 1 g K2HPO4, 6 g KH2PO4, 1 ml cholesterol (5 mg/ml in ethanol), H2O to 1 litre. Sterilize by autoclaving. |
| Sodium Chloride | Sigma Aldrich | S9625 | For L Broth and S-Basal production. |
| Sodium hydroxite (5M) | Sigma Aldrich | 567530 | Sodium hydroxide used when bleaching C. elegans (prepare solution at 5M concentration) |
| Sodium hypochlorite (5%) | Sigma Aldrich | 1.05614 | Sodium hypochlorite used when bleaching C. elegans (prepare solution at 5% concentration) |
| Strainer 10 µm | pluriSelect | 43-10010-40 | Alternative for bacteria food preparation, especially if smaller devices are used. |
| Strainer 5 µm | pluriSelect | 43-10005-40 | Strainer used to filter L1 larvae after overnight starvation and bacteria after completed food preparation. |
| SU-8 | Gersteltec | GM1050 | SU-8 for height from 1-10 µm. |
| SU-8 | Gersteltec | GM1060 | SU-8 for height from 5-30 µm. |
| SU-9 | Gersteltec | GM1070 | SU-8 for height from 15-200 µm. |
| Syringe 1 mL | Fisher Scientific | 11338763 | 1mL syringe. If using a different type ensure that the syringe body and plunger are stiff, such that they won't be deformed by the syringe pump. |
| Syringe Pump | WPI | Al1000-220 | Syringe pump (https://www.wpiinc.com/var-2300-aladdin-single-syringe-pump.html). |
| Tube 15 mL | Fisher Scientific | 50-809-220 | Tube used for worm bleaching and bacteria preparation. |
| Tube 2 mL | Fisher Scientific | NC1186931 | Tube used for worm preparation and bacteria preparation. |
| Tube 50 mL | Fisher Scientific | 50-465-232 | Tube used for bacteria preparation and growth. |
| Tweezer SMD | Brütsch Rüegg Werkzeuge | 448980 | Tweezers used to plug the 1/32" tubing into the device. |
| Tygon tubing 1/16" | Fisher Scientific | 642002 | Flexible 1/16" OD tubing connecting most components to the device. |
| Tygon tubing 1/32" | Fisher Scientific | 641900 | Flexible 1/32" OD tubing connecting the bacteria supply to the device. |
| UV KUB-3 | Kloe | NA | Mask aligner and UV exposure system. |
| Wafer | Siegert Wafer | 4P0/>1/525±25/SSP/TTV<10 | Silicon Wafer. |
| Waste Container | NA | NA | Prepared in house using a 2mL tube or a cryo vial and hollow steel pins. |
Referencias
- Sulston, J. E., Horvitz, H. R. Post-embryonic cell lineages of the nematode, Caenorhabditis elegans. Dev Biol. 56 (1), 110-156 (1977).
- Lin, R., Kipreos, E. T., Zhu, J., Khang, C. H., Kner, P. Subcellular three-dimensional imaging deep through multicellular thick samples by structured illumination microscopy and adaptive optics. Nat Commun. 12 (1), 3148 (2021).
- Sulston, J. E., Schierenberg, E., White, J. G., Thomson, J. N. The embryonic cell lineage of the nematode Caenorhabditis elegans. Dev Biol. 100 (1), 64-119 (1983).
- Luke, C. J., Niehaus, J. Z., O'Reilly, L. P., Watkins, S. C. Non-microfluidic methods for imaging live C. elegans. Methods. 68 (3), 542-547 (2014).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D., Bargmann, C. I., Avery, L. Laser microsurgery in Caenorhabditis elegans. Methods Cell Biol. 107, 177-206 (2012).
- Wolke, U., Jezuit, E. A., Priess, J. R. Actin-dependent cytoplasmic streaming in C. elegans oogenesis. Development. 134 (12), 2227-2236 (2007).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat Methods. 4 (9), 727-731 (2007).
- Hulme, S. E., Shevkoplyas, S. S., Apfeld, J., Fontana, W., Whitesides, G. M. A microfabricated array of clamps for immobilizing and imaging C. elegans. Lab Chip. 7 (11), 1515-1523 (2007).
- Rohde, C. B., Zeng, F., Gonzalez-Rubio, R., Angel, M., Yanik, M. F. Microfluidic system for on-chip high-throughput whole-animal sorting and screening at subcellular resolution. Proc Natl Acad Sci U S A. 104 (35), 13891-13895 (2007).
- Chung, K., Crane, M. M., Lu, H. Automated on-chip rapid microscopy, phenotyping and sorting of C. elegans. Nat Methods. 5 (7), 637-643 (2008).
- Krajniak, J., Lu, H. Long-term high-resolution imaging and culture of C. elegans in chip-gel hybrid microfluidic device for developmental studies. Lab Chip. 10 (14), 1862-1868 (2010).
- Samara, C., et al. Large-scale in vivo femtosecond laser neurosurgery screen reveals small-molecule enhancer of regeneration. Proc Natl Acad Sci U S A. 107 (43), 18342-18347 (2010).
- Stirman, J. N., Brauner, M., Gottschalk, A., Lu, H. High-throughput study of synaptic transmission at the neuromuscular junction enabled by optogenetics and microfluidics. J Neurosci Methods. 191 (1), 90-93 (2010).
- San-Miguel, A., Lu, H. Microfluidics as a tool for. WormBook: The Online Review of C. elegans Biology. , (2013).
- Lee, H., et al. A multi-channel device for high-density target-selective stimulation and long-term monitoring of cells and subcellular features in C. elegans. Lab Chip. 14 (23), 4513-4522 (2014).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nat Commun. 7 (1), 13023 (2016).
- Berger, S., et al. Long-term C. elegans immobilization enables high-resolution developmental studies in vivo. Lab Chip. 18 (9), 1359-1368 (2018).
- Berger, S., Spiri, S., DeMello, A., Hajnal, A. Microfluidic-based imaging of complete Caenorhabditis elegans larval development. Development. 148 (18), dev199674 (2021).
- Spiri, S., Berger, S., Mereu, L., DeMello, A., Hajnal, A. Reciprocal EGFR signaling in the anchor cell ensures precise inter-organ connection during Caenorhabditis elegans vulval morphogenesis. Development. 149 (1), dev199900 (2022).
- Gritti, N., Kienle, S., Filina, O., Van Zon, J. S. Long-term time-lapse microscopy of C. elegans post-embryonic development. Nat Commun. 7 (1), 12500 (2016).
- Keil, W., Kutscher, L. M., Shaham, S., Siggia, E. D. Long-term high-resolution imaging of developing C. elegans larvae with microfluidics. Dev Cell. 40 (2), 202-214 (2017).
- Heinze, S. D., Berger, S., Engleitner, S., Daube, M., Hajnal, A. Prolonging somatic cell proliferation through constitutive hox gene expression in C. elegans. Nat Commun. 14 (1), 6850 (2023).
- Agarwal, P., Berger, S., Shemesh, T., Zaidel-Bar, R. Active nuclear positioning and actomyosin contractility maintain leader cell integrity during gonadogenesis. Curr Biol. 34 (11), 2373-2386 (2024).
- Segos, I., et al. Non-random segregation of mitochondria during asymmetric cell division contributes to cell fate divergence in daughter cells. bioRxiv. , 2024-2109 (2024).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77 (1), 71-94 (1974).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. elegans Biology. , (2006).
- Pepin, B. . GPU Deconvolution Library with C and Matlab API for Nvidia GPUs. , (2025).
- Podbilewicz, B., White, J. G. Cell fusions in the developing epithelia of C. elegans. Dev Biol. 161 (2), 408-424 (1994).
- Nusser-Stein, S., et al. Cell-cycle regulation of NOTCH signaling during C. elegans vulval development. Mol Syst Biol. 8 (1), 618 (2012).
- Euling, S., Ambros, V. Heterochronic genes control cell cycle progress and developmental competence of C. elegans vulva precursor cells. Cell. 84 (5), 667-676 (1996).
- Mok, D. Z., Sternberg, P. W., Inoue, T. Morphologically defined sub-stages of C. elegans vulval development in the fourth larval stage. BMC Dev Biol. 15, 1-8 (2015).
- Laranjeira, A. C., Berger, S., Kohlbrenner, T., Greter, N. R., Hajnal, A. Nutritional vitamin B12 regulates RAS/MAPK-mediated cell fate decisions through one-carbon metabolism. Nat Commun. 15 (1), 8178 (2024).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados