Method Article
Cultivo Y Ensayo De Las Poblaciones De Caenorhabditis elegans De Etapa Mixta A Gran Escala
En este artículo
Resumen
Para utilizar Caenorhabditis elegans (C. elegans) en la investigación ómica, se necesita un método para generar grandes poblaciones de gusanos donde se pueda medir una sola muestra a través de plataformas para análisis comparativos. Aquí, un método para cultivar las poblaciones de C. elegans en placas de cultivo a gran escala (LSCPs) y para documentar el crecimiento de la población se presenta.
Resumen
Caenorhabditis elegans (C. elegans) ha sido y sigue siendo un valioso organismo modelo para estudiar la biología del desarrollo, el envejecimiento, la neurobiología y la genética. El gran cuerpo de trabajo sobre C. elegans lo convierte en un candidato ideal para integrarse en estudios de grandes poblaciones, en animales enteros, para diseccionar los componentes biológicos complejos y sus relaciones con otro organismo. Con el fin de utilizar C. elegans en la investigación ómica colaborativa, se necesita un método para generar grandes poblaciones de animales donde una sola muestra puede ser dividida y ensayada a través de diversas plataformas para análisis comparativos.
Aquí, un método para cultivar y recoger una población abundante de los elegans de la C. de la mezclado-etapa en una placa de cultivo en grande (LSCP) y los datos fenotípicos subsecuentes se presentan. Esta tubería produce un número suficiente de animales para recopilar datos fenotípicos y de población, junto con cualquier dato necesario para los experimentos -ómicos (es decir, genómica, transcriptómica, proteómica y metabolómica). Además, el método LSCP requiere una manipulación mínima de los propios animales, menos tiempo de preparación del usuario, proporciona un control ambiental estricto y garantiza que el manejo de cada muestra sea consistente a lo largo del estudio para la reproducibilidad general. Por último, se presentan métodos para documentar el tamaño de la población y la distribución de la población de las etapas de la vida de C. elegans en un LSCP dado.
Introducción
C. elegans es un pequeño nematodo de vida libre que se encuentra en todo el mundo en una variedad de hábitats naturales1. Su relativa facilidad de crecimiento, el rápido tiempo de generación, el sistema de reproducción y el cuerpo transparente lo convierten en un poderoso organismo modelo que ha sido ampliamente estudiado en biología del desarrollo, envejecimiento, neurobiología y genética2,3. El copioso trabajo sobre C. elegans lo convierte en un candidato principal para usar en estudios ómicos para vincular exhaustivamente los fenotipos con componentes biológicos complejos y sus relaciones en un organismo dado.
Para utilizar C. elegans en la investigación ómica colaborativa, se necesita un método para generar grandes poblaciones de animales en etapas mixtas donde una sola muestra se pueda dividir y utilizar en diversas plataformas e instrumentos para análisis comparativos. La creación de una canalización para generar una muestra de este tipo requiere un gran conocimiento de la dieta, el medio ambiente, el estrés, la estructura de la población y el manejo y la recolección de muestras. Por lo tanto, es crucial tener condiciones de cultivo estándar y reproducibles integradas en tuberías a gran escala. En la investigación de C. elegans, se utilizan dos métodos tradicionales para cultivar gusanos: placas de Petri de agar y cultivo líquido4.
Históricamente, cuando se necesitan grandes cantidades de C. elegans, se cultivan en cultivo líquido4. Los pasos involucrados en la generación de una gran población de gusanos en cultivo líquido requieren múltiples pasos de manejo que a menudo incluyen la sincronización de la lejía para romper las cutículas adultas grávidas, liberando embriones para lograr el tamaño de población deseado. Sin embargo, cuando se utiliza la sincronización de la lejía, el crecimiento de la población depende del tamaño inicial del censo y, por lo tanto, afecta el crecimiento posterior y los números de población. Además, las cepas de C. elegans varían en su sensibilidad a la cutícula, el tiempo de exposición y la respuesta de estrés a la sincronización de la lejía, lo que dificulta el ensayo de muchas cepas a la vez5,6,7,8,9.
Además, el crecimiento de gusanos en el cultivo de líquidos requiere un par de pasos de transferencia, ya que a menudo se recomienda cultivar solo una generación de gusanos antes de la cosecha porque el hacinamiento puede ocurrir fácilmente si se cultiva durante varias generaciones y conducir a la formación de dauer a pesar de la presencia de alimentos10. La formación de Dauer se produce a través de pequeñas moléculas de señalización como los ascarósidos, a menudo denominados "feromonas dauer"11,12,13,14,se liberan en medios líquidos y afectan el crecimiento de la población. Además, el crecimiento de grandes poblaciones de gusanos en cultivo líquido conduce a un exceso de acumulación de bacterias en el cultivo, creando dificultades cuando se necesita una muestra limpia para ensayos fenotípicos aguas abajo. Por último, cuando un cultivo líquido se contamina, es más difícil de mantener ya que las esporas fúngicas o las células bacterianas se dispersan fácilmente por todo el medio15.
El otro método tradicional de cultivo de C. elegans es en placas de Petri de agar. Las placas de Petri disponibles comercialmente permiten cultivar fácilmente múltiples generaciones de gusanos de etapa mixta sin los rápidos efectos del hacinamiento y la formación de altos dauer como se ve en los cultivos líquidos. Sin embargo, una desventaja para el crecimiento de gusanos en las placas de Petri de agar tradicional es que la placa de Petri más grande disponible comercialmente no produce grandes poblaciones de gusanos para un estudio -omics sin agregar un paso de sincronización de lejía. En resumen, el cultivo de poblaciones de etapa mixta de C. elegans en placas de Petri de agar es más adecuado para la recolección de datos ómicos, pero se requiere un método para generar tamaños de población muy grandes sin cultivo líquido.
Aquí, presentamos un método para cultivar y recolectar grandes poblaciones de C. elegans de etapa mixta en placas de cultivo a gran escala (LSCP). La recolección de muestras a través de esta tubería produce suficiente muestra para recopilar datos fenotípicos y de población, junto con cualquier dato necesario para los experimentos de -ómica(es decir,genómica, transcriptómica, proteómica y metabolómica). Además, el método LSCP requiere una manipulación mínima de los animales, menos tiempo de preparación del usuario, proporciona un control ambiental estricto y garantiza que el manejo de cada muestra sea consistente a lo largo del estudio para la reproducibilidad general.
Protocolo
1. Esterilizar LSCP y equipos
- Prepare LSCPs de vidrio lavando las manos, seguido de lavado de platos y posterior autoclave para asegurarse de que la cristalería esté libre de contaminantes antes de comenzar el experimento. Guarde los LSP en autoclave en un lugar limpio y seco hasta que estén en uso.
NOTA: Asegúrese de que los LSCPs sean seguros para lavavajillas y autoclave. Asegúrese de que las tapas de LSCP sean seguras para lavavajillas. - Prepare las tapas de LSCP lavando las manos seguido de lavaplatos. Guarde las tapas de LSCP en un contenedor limpio hasta que sea necesario.
- El día en que se prepare nematodo Growth Media Agarose (NGMA), limpie las tapas de LSCP con una solución de lejía al 10% dos veces, seguida de etanol al 70%. Una vez limpiado con 10% de lejía y 70% de etanol, mantenga las tapas de LSCP en un contenedor limpio en la campana de flujo laminar donde se preparará el NGMA.
2. Preparar la agarosa de medios de crecimiento de nematodos (NGMA)
- Prepare NGMA combinando los siguientes reactivos en un matraz Erlenmeyer de 2 L en autoclave con barra de agitación en una placa de agitación: 2,5 g de peptona, 3 g de NaCl, 7 g de agarosa, 10 g de agar y 975 ml de agua estéril16. Asegúrese de que el volumen total sea igual a 1 L. Tape una tapa de papel de aluminio al matraz.
NOTA: Los pasos de preparación para el NGMA como se describe aquí producirá suficiente material para 2.5 LSCPs. El protocolo se puede adaptar al tamaño de lote LSCP necesario en un experimento determinado. - Autoclave en ciclo líquido a 121 °C y 21 p.s.i. durante 45 min.
- Encienda el baño de agua y establezca a 50 °C. Lleve el NGMA en autoclave al baño de agua para enfriar a 50 °C.
- Traiga 2 L Erlenmeyer matraz de NGMA en el capó o espacio limpio y fijar en una placa de agitación. Utilice un termómetro para rastrear la temperatura ngma.
- Después de que la NGMA haya alcanzado los 50 °C, añádase lo siguiente en el orden indicado con una pipeta desechable estéril dentro de la campana o del espacio limpio: 25 mL de1MKH 2 PO 4 (Tampón de fosfato K), 1 mL de colesterol (5 mg/mL en etanol), 1 mL de 1 M CaCl2,1 mL de 1 M MgSO4,1 mL de nistatina (10 mg/mL) y 1 mL de estreptomicina (100 mg/mL)16.
- Vierta 400 mL de NGMA en un vidrio estéril LSCP, de aproximadamente 1,3 cm de profundidad, permita que el LSCP se solidifique en una superficie plana en el capó y coloque la tapa de la lámina en autoclave de nuevo en el LSCP.
- Una vez que el agar esté ajustado, retire la lámina y coloque una tapa hermética limpia sobre LSCP y muévase a 4 °C para su almacenamiento. Guarde NGMA en LSCPs a 4 °C hasta que esté en uso y use dentro de los 5 días.
3. Generar alimentos de E. coli para NGMA en LSCP
- Para generar una fuente de alimento estable, genere lotes de HT115 (DE3) E. coli utilizando un concepto de promediación de lotes pequeños consistente con el teorema del límite central17. Conservar a -80 °C. Cuando sea necesario tire de las cepas bacterianas de E. coli de -80 °C para descongelar18.
NOTA: En este protocolo, las existencias bacterianas de E. coli se cultivaron en un biorreactor. Al final del crecimiento de la cultura, la cultura fue diluida 1:50, y el OD medido600 era 0.4. Por lo tanto, la cultura tenía un OD600 efectivo de 20. Las bacterias fueron peletadas, pesadas y resuspendidas en medio K a una concentración de 0,5 g/mL (peso húmedo), transferidas a alícuotas de 2 mL y congeladas19.
4. Césped bacteriano en NGMA
- Lleve NGMA LSCPs de 4 °C a temperatura ambiente (RT) durante varias horas antes de extender el césped bacteriano para permitir que todo el LSCP alcance RT.
- Extraiga las existencias bacterianas necesarias de E. coli de -80 °C para descongelar18.
- Diluir las cepas bacterianas de E. coli con 2 mL de K-medio estéril para lograr 0,5 g de E. coli en 4 mL por NGMA LSCP. Pipetear cuidadosamente 4 mL de E. coli en medio de la NGMA LSCP.
- Use un esparcidor estéril para esparcir bacterias en un rectángulo que deje aproximadamente 3.8 cm de espacio alrededor de los bordes de la NGMA E. coli libre.
- Deje el NGMA LSCP con E. coli en el capó con el ventilador encendido durante 1 h para asegurarse de que la suspensión de E. coli se seque completamente.
- Una vez que el césped bacteriano esté seco, empuje la tapa firmemente y guárdelo a 4 °C hasta que se use.
5. Gusanos de trozos para reducir el estrés y la variabilidad de la edad entre las muestras
- Gusanos rayados de una cepa de gusanos congelados a una placa recién sembrada de 6 cm4. Esta placa servirá como la placa "master chunk".
NOTA: La fragmentación es un método óptimo para transferir gusanos de una cepa homocigótica20. Si una cepa es heterocigótica o necesita ser mantenida por picking y apareamiento, la fragmentación no es aconsejable. La frecuencia de fragmentación puede necesitar ser optimizada dependiendo de los genotipos de gusano utilizados, la temperatura elegida para el crecimiento y los pasos aguas abajo. - Después de que la placa de trozo maestro está llena de adultos grávidos sanos (aproximadamente 3 días) con un montón de césped de E. coli todavía presente, siga las pautas estándar de fragmentación de C. elegans como se describe en WormBook para producir cuatro placas de trozos totales4.
- Guarde todas las placas de trozos en una habitación de temperatura controlada (TC) a 20 °C a menos que se especifique lo contrario para el crecimiento.
NOTA: Si los usuarios de este protocolo no tienen acceso a una sala de TC como se describe aquí, se recomienda utilizar una pequeña incubadora donde se pueda controlar la temperatura o una habitación designada donde se puedan controlar las condiciones ambientales tanto como sea posible. Si ninguna de estas opciones alternativas está disponible, tenga en cuenta que la variación en el crecimiento de la muestra puede ser mayor. - Una vez que se observan muchos adultos grávidos en la4ª placa de trozos, pase al Paso 6.
6. Blanqueamiento puntual de adultos grávidos en LSCP
NOTA: Esta técnica de blanqueo se utiliza para erradicar la mayoría de los contaminantes y disolver la cutícula de los hermafroditas liberando embriones del gusano adulto. La solución de lejía se empapará en la NGMA antes de que los embriones eclosionen.
- Lleve los LSCPs a RT durante varias horas antes de detectar gusanos blanqueadores.
- Preparar una relación 7:2:1 de ddH2O: lejía: 5 M NaOH. Haga que esta solución de hipoclorito alcalino esté fresca justo antes de su uso.
NOTA: Utilice el mismo stock de lejía y NaOH durante toda la duración de un experimento dado para evitar que el lote de lejía afecte. El blanqueo usado en este protocolo era hipoclorito del sodio 5-10%. - Encienda un quemador Bunsen y llame un pico de gusano antes de continuar. Saque la cucharada fresca de E. coli en una púa estéril del borde del césped bacteriano en el LSCP.
- Elija un solo adulto grávido de la4ª placa de trozo para el blanqueo puntual.
- Pipetee 5 μL de la solución de hipoclorito alcalino en una esquina del LSCP lejos del césped de E. coli.
- Coloque el adulto grávido recogido en la solución de hipoclorito alcalino de 5 μL. Toque el nematodo para ayudar a interrumpir la cutícula y liberar los huevos.
- Repita los pasos 6.4 – 6.6 para un total de 4x y coloque 5 adultos grávidos uniformemente alrededor del césped de E. coli. Elija los 5 adultos grávidos de la misma placa de4º trozo para asegurarse de que se agreguen individuos casi genéticamente isogénicos a una muestra dada.
- Coloque la tapa de nuevo en el LSCP.
- Repita los pasos para todos los LSCPs.
7. Crecimiento de gusanos en ambientes de temperatura controlada (TC)
- Después del blanqueamiento puntual, coloque la tapa firmemente sobre el LSCP y colótela en la sala de TC ajustada a 20 °C con flujo de aire constante y un fotoperiodo de 12L:12D (12 h de luz y 12 h de oscuridad).
- Tenga en cuenta la hora y la posición donde se colocó la muestra en la sala de TC.
NOTA: La posición dentro de la habitación siempre debe documentarse para registrar cualquier diferencia ambiental que las muestras puedan encontrar potencialmente durante el crecimiento. Una vez que la muestra está en la sala de TC, debe permanecer en su lugar asignado sin ser molestada. No abra la tapa del LSCP en la sala de TC para disminuir la posibilidad de contaminación. - Lleve el LSCP a un microscopio, fuera de la sala de TC, para observar el crecimiento y la densidad de la población.
NOTA: Cada cepa y muestra de C. elegans variará en su crecimiento, por lo que las muestras se vigilarán de cerca. Si bien se recomienda no perturbar el crecimiento del LSCP mientras estaba en la sala de TC, los LSCP se transportaron fuera de la sala de TC y las tapas se abrieron cada 2 días para monitorear el crecimiento de la muestra. Quitar las tapas selladas de los LSCP cada 2 días también permite que O2 fluya hacia el LSCP. - Antes de la cosecha asegúrese de que el LSCP se ha convertido en lleno de una gran población de gusanos. Utilice los siguientes criterios para decidir si el LSCP está listo para ser recopilado.
- Asegúrese de que el LSCP esté lleno de gusanos adultos grávidos.
- Asegúrese de que la placa contenga un tamaño de población grande (es decir, los gusanos cubren toda la superficie del agar).
- Asegúrese de que la placa no tenga muchos huevos en la superficie del agar(es decir,el número máximo de gusanos debería haber eclosionado).
- Asegúrese de que la placa tenga un mínimo o ningún E. coli a la izquierda, lo que indica que los gusanos morirían de hambre y generarían larvas de dauer si se dejan en la placa durante dos días adicionales.
NOTA: Aunque la mayoría de los LSCP están listos para cosechar entre 10 a 20 días, dependiendo de la cepa y la muestra, revise cada LSCP con frecuencia al establecer este protocolo para determinar los tiempos de cosecha normales.
- Limpie los guantes y el área con etanol al 70% entre la manipulación de LSCPs para evitar la contaminación cruzada entre cepas.
8. Cosecha de la muestra de LSCP
- Encienda y deje que la centrífuga se enfríe a 4 °C antes de cosechar las muestras.
- Preparar tres tubos cónicos de 50 mL con 50 mL de solución M9 por LSCP a cosechar.
- Etiquete un tubo cónico de 15 mL por LSCP.
NOTA: Todos los pasos de centrifugación se realizan en el tubo cónico de 15 mL, porque los gusanos tienden a peletizar bien en estos tubos. - Vierta 50 mL de solución M9 (de un tubo cónico de 50 mL en el paso 8.2) sobre la superficie LSCP y gire alrededor para asegurarse de que M9 cubre toda la superficie NGMA.
- Mientras M9 se asienta en la superficie de LSCP, prepara una pipeta serológica estéril con M9.
NOTA: Al cebar la pipeta serológica estéril con M9, esto asegura que menos gusanos se peguen al interior de la pipeta de plástico, evitando la pérdida de muestras. - Incline el LSCP para que M9 y la población de gusanos se reúnan en una esquina del LSCP.
NOTA: La mezcla de solución M9 y gusanos del LSCP se denominará "suspensión de gusanos" en los pasos posteriores. - Utilizando una pipeta serológica preparada con un pipettor automático, suspensión de gusano de pipeta y colocar en el tubo cónico original de 50 mL. Una vez que se recogen 50 mL de suspensión de gusanos, coloque el tubo cónico en un balancín para interrumpir los grupos de bacterias y los desechos.
- Repita los pasos 8.4 - 8.7 recogiendo 150 mL de suspensión de gusano por LSCP.
- Transferir 15 mL de suspensión de gusanos, de uno de los tres tubos cónicos de 50 mL, vertiendo en un tubo cónico de 15 mL marcado reservado en el paso 8.3. Centrifugar el tubo cónico de 15 mL a 884 x g durante 1 min a 4 °C. La mayoría de los gusanos se gránulos en la parte inferior del tubo.
- Aspirar el sobrenadante asegurando no molestar el pellet de gusano.
- Continúe añadiendo aproximadamente 13 mL de suspensión de gusanos a los mismos 15 mL de tubo cónico repitiendo los pasos 8.9 y 8.10 hasta que se consuman los 150 mL de suspensión de gusanos. Invierta el tubo y perturbe el pellet entre centrifugaciones para lavar y aspirar tantas bacterias y desechos como sea posible.
NOTA: En este paso, el contenido de los tres tubos cónicos de 50 mL se condensa en un solo tubo de 15 mL. - Añadir 10 mL de M9 limpio al tubo cónico de 15 mL y agitar el pellet de gusano invirtiendo. Centrifugar el tubo cónico de 15 mL a 884 x g durante 1 min a 4 °C. Aspirar el sobrenadante asegurando no molestar el pellet de gusano. Repetir dos veces.
NOTA: Si hay una gran cantidad de desechos o bacterias en la muestra, repita el paso 8.12 hasta que la muestra esté limpia. - Una vez que la muestra esté limpia, añadir ddH2O al pellet de gusano para un total de 10 mL de ddH2O y gusanos. Agitar el pellet de gusano invirtiendo. Muévase rápidamente en el paso 9.1, ya que los gusanos deben permanecer en ddH2O durante 5 minutos o menos para evitar el estrés osmótico.
NOTA: La suspensión de pellets de gusano en ddH2O es el disolvente preferido para los pasos ómicos aguas abajo. Los gusanos pueden suspenderse en otros disolventes o tampones si son compatibles con un flujo de trabajo experimental determinado.
9. Estimar el tamaño de la población
NOTA: Moverse a través de los pasos 9.1 – 9.7 rápidamente. La mezcla de ddH2O y gusanos del paso 8.13 se conoce como la "muestra de gusano" en los pasos posteriores.
- Antes de pipetear la muestra de gusano, la punta de la pipeta principal se utilizará con M9 para evitar que los gusanos se peguen al interior de la pipeta de plástico, evitando la pérdida de la muestra y reduciendo la variación del recuento.
- Tome una alícuota de 100 μL de muestra de gusano y diluya en 900 μL de M9. Mezclar bien y hacer una dilución en serie (1:10, 1:100, 1:1000). Repita este paso dos veces para lograr un total de tres conjuntos de réplicas alícuotas.
NOTA: Los gusanos de pipeteo pueden causar una gran variabilidad en los recuentos de población de muestras. Asegúrese de que la muestra de gusano sea homogénea antes de pipetear la alícuota deseada. - Fije el tubo cónico de 15 mL en un balancín para continuar moviendo la cultura mientras se cuentan las alícuotas.
- Asegúrese de que la muestra de gusano esté bien mezclada y homogénea. Pipetee 5 μL de la muestra de gusano 1:10, dispense en un portaobjetos de microscopía y cuente el número de gusanos. Si este número es menor que aproximadamente 50 gusanos, entonces también cuente las diluciones 1:100 y 1:1000. Si es más de 50, pase a la siguiente dilución en serie.
Nota : si no se pueden contar con precisión demasiados gusanos, utilice la siguiente dilución en serie para contar en su lugar. - Cuente cada réplica alícuota de cada dilución 3x. Al final del recuento, para la mayoría de los cultivos, se documentarán 9 recuentos totales(es decir,3 recuentos totales para cada réplica alícuota).
- Promediar los recuentos de dilución para determinar el tamaño estimado de la población de la muestra de gusano. Estos recuentos de dilución determinarán el volumen de muestra de gusano necesario para crear el tamaño de alícuota deseado para los pasos -omics.
NOTA: En este experimento, se generaron alícuotas de aproximadamente 200.000 gusanos de etapa mixta. Además, una alícuota de aproximadamente 50.000 gusanos de etapa mixta se apartó para su clasificación en un citómetro de flujo de partículas grandes (descrito en el paso 10). - Una vez que la muestra de gusano se ha dividido en alícuotas apropiadas, congele el nitrógeno líquido y almacene la muestra a -80 °C.
NOTA: No congele la alícuota destinada a la citometría de flujo de partículas grandes.
10. (Opcional) Preparación de la muestra para citometría de flujo de partículas grandes
NOTA: Los pasos 10, 11 y 12 son el método preferido por los autores para registrar el crecimiento de la muestra(es decir,el tamaño de la población y la distribución de la población de las etapas del ciclo de vida de C. elegans) y determinar el éxito de un cultivo. Los usuarios de este protocolo pueden sustituir los pasos opcionales 10, 11 y 12 por sus propias métricas de éxito de crecimiento. Los pasos 10, 11 y 12 se describen aquí por dos razones; en primer lugar, para que los usuarios que tienen equipos utilizados en los pasos 10, 11 y 12 puedan replicar estos pasos y, en segundo lugar, para mostrar la validación de este método de crecimiento. El paso 9 anterior proporciona una buena estimación del número total de gusanos para determinar los tamaños de las alícuotas, y el paso 10 es una métrica más cuantitativa para estimar el número y la distribución de la población de gusanos en una muestra dada.
- Lleve la alícuota de aproximadamente 50.000 gusanos de etapa mixta (reservados en el paso 9.6) hasta 10 mL de volumen total en solución M9.
- Realizar una solución compuesta por 1 mg/mL de E. coli y una dilución 1:50 de microesferas fluorescentes rojas de 0,5 μM19.
- Añadir 200 μL de esta solución a los 10 mL de gusanos de etapa mixta en M9 e incubar mientras se balancean durante 20 min.
- Después de 20 min, centrifugar el tubo cónico de 15 mL a 884 x g durante 1 min a 4 °C.
- Aspirar el sobrenadante asegurando no molestar el pellet de gusano.
- Lave el pellet de gusano dos veces con la solución M9 para eliminar el exceso de bacterias y las microesferas fluorescentes rojas.
- Agregue 5 mL de M9 al pellet de gusano y asegúrese de que el pellet se vea limpio. Si el pellet está limpio, añadir 5 mL de M9 con azida de sodio de 50 mM para enderezar y matar los gusanos para un conteo y dimensionamientoprecisos 21.
- Documente la hora y la fecha en que se agrega azida de sodio a la muestra.
- Deje la muestra a un lado en el balancín hasta que sea necesario para la citometría de flujo de partículas grandes.
NOTA: Se sabe que la azida de sodio afecta la fisiología de los nematodos (esdecir,la longitud corporal, el metabolismo y la termotolólerancia). Por lo tanto, es fundamental tener en cuenta el tiempo que los gusanos están expuestos a la azida de sodio, ya que muchos de estos efectos fisiológicos ocurren en cuestión de minutos22. Debido a los efectos fisiológicos sabidos del azide del sodio sobre gusanos, este tratamiento afectará a calidad de imagen rio abajo y debe ser considerado.
11. (Opcional) Documentar la distribución de la población y preparar la placa de 384 pozos para obtener imágenes
NOTA: Paso 11 utiliza un citómetro de flujo de partículas grandes (LPFC). El conocimiento básico de un LPFC se asume en este protocolo. Se pueden sustituir otros métodos para documentar el crecimiento y la distribución de la población de las muestras. Los pasos documentados aquí son para los usuarios que planean usar un LPFC en su canalización23.
- Encienda, limpie y ceda el LPFC, y permita que los láseres se calienten durante 1 h antes de clasificar las muestras.
- Después de que el láser se haya calentado, abra el perfil "Histograma" y escale a un Tiempo de Vuelo (TOF) de 2050.
- Agregue una región de barra al "Histograma" que abarque un rango TOF de 100. La primera región de la barra cubre un TOF de 50-150.
- Continúe creando veinte regiones de barras cada una que abarque un rango TOF de 100. Estas regiones de barras abarcarán todo el rango de TOF de 50 a 2050. Consulte la Tabla suplementaria 1 para las regiones cerradas exactas que se utilizaron en toda la distribución TOF.
- Guarde este histograma configurado como un "experimento" para usarlo en futuras ejecuciones de LPFC.
- Seleccione la placa calibrada de 384 pozos o calibre el instrumento a una placa de 384 pozos para dispensar objetos.
- Una vez en la plantilla de placa calibrada de 384 pozos, establezca la plantilla para dispensar 20 objetos bloqueados en cuatro pozos (cuatro réplicas técnicas de cada región cerrada) para cada una de las 20 regiones de barra creadas durante los pasos 11.3-4. Consulte la Tabla suplementaria 2 para obtener un diseño de ejemplo de cómo dispensar gusanos en la placa de 384 pozos.
- Transfiera la muestra del paso 10.9 a un tubo cónico de 50 mL y agregue una solución M9 adicional para lograr aproximadamente 40 mL de volumen total.
- Comience a clasificar automáticamente la muestra según los parámetros establecidos en el paso 11.7 mientras agita continuamente la muestra para evitar la sedimentación y la dispensación simultánea de objetos de la muestra en la placa calibrada de 384 pozos.
Nota : asegúrese de que el caudal del LPFC está funcionando entre 15-20 objetos por segundo y no especifique ningún doble que se va a ordenar. - Una vez que se haya clasificado toda la muestra y se haya dispensado el número máximo de regiones cerradas en la placa de 384 pozos, tome la muestra de LPFC y limpie el instrumento.
NOTA: Cuando se alcanzan regiones TOF más grandes, puede llegar a ser difícil continuar llenando la placa de 384 pocillos debido a los bajos recuentos de eventos en esa región TOF. Llene tantas de las regiones cerradas como sea posible para tener la mejor idea de dónde se encuentran las etapas de vida de C. elegans dentro de la distribución LPFC antes de quedarse sin muestra. - Coloque una película de sellado en la parte superior de la placa de 384 pozos hasta que se le ecree la imagen.
NOTA: Placa de imagen lo más rápido posible después de la clasificación porque las muestras se tratan con azidade sodio 22. Las microesferas fluorescentes rojas se pueden ver en los archivos de datos LPFC recopilados(es decir, datos rojos PH en el archivo de texto de salida) basados en el nivel de fluorescencia roja emitida en cada objeto ordenado para ayudar a identificar qué objetos son gusanos vivos, gusanos muertos, dauers o basura24.
12. (Opcional) Placa de 384 pozos de imágenes
NOTA: El paso 12 utiliza un microscopio microconfocal de lectura de placas. El conocimiento básico de un microscopio confocal micro se asume en este protocolo. Se pueden sustituir otros métodos para documentar el crecimiento y la distribución de la población de las muestras.
- Usando un microscopio micro confocal de lectura de placas con una lente 20x.
- Abra la pestaña "Objetivo y Cámara" y establezca el modo "10x Plan ApoLambda".
- Abra la pestaña "Camera Binning" y esta opción en "2".
- Abra la pestaña "Sitios para visitar en placa" y establezca "4" sitios por pozo y "sitios superpuestas 10%" para luego unir imágenes.
- Abra la pestaña "Longitud de onda" y esta estadá en "Brightfield 1".
- Abra la pestaña "Iluminación" y estadá en "Luz transmitida, muestra brillante".
- Coloque la placa de 384 pozos en el microscopio y establezca la "Pila Z" en "Calcular desplazamiento" y encontrar el plano focal adecuado para las muestras en la placa de 384 pozos.
- Ejecute la placa de 384 pozos en el microscopio microconfocal recogiendo cuatro imágenes por pozo.
- Montaje de las cuatro imágenes juntas para crear una imagen por pozo.
Resultados
El crecimiento de C. elegans utilizando el método LSCP produce un promedio de aproximadamente 2,4 millones de gusanos de etapa mixta por muestra durante 12,2 días. El crecimiento de C. elegans utilizando el método LSCP permite a los usuarios generar grandes poblaciones de etapa mixta de C. elegans con poco manejo y manipulación de los animales, lo que es ideal para estudios ómicos a gran escala(Figura 1). Una vez que un LSCP se ha lleno de gusanos adultos, ha alcanzado un gran tamaño de población y le quedan bacterias mínimas, los usuarios pueden cosechar y estimar el tamaño de la población. Este punto también puede servir como un control de calidad mediante la evaluación de si la población es suficiente para su uso en una tubería -ómica (Figura 2). La dinámica de la población depende de la cepa en sí, el comportamiento de la cepa(es decir,las cepas de madriguera tienden a tener una menor recuperación del gusano) y el éxito del crecimiento(es decir,la contaminación). El método LSCP se probó en 15 cepas de C. elegans que contenían una mezcla de mutantes del Caenorhabditis Genetics Center (CGC) y cepas silvestres de Caenorhabditis elegans Natural Diversity Resource (CeNDR)25. Los genotipos de cepa se describen en la Tabla suplementaria 3.
El método LSCP produjo tamaños de población de aproximadamente 94.500 a 9.290.000. El tamaño medio de la población dentro de la cepa de referencia, PD1074, y a través de las cepas fue de aproximadamente 2,4 millones de gusanos (Figura 3). No se encontraron diferencias significativas en los tamaños de población estimados entre las cepas de C. elegans en el transcurso de un promedio de 12,2 días de crecimiento de LSCP(Figura 4). Pd1074 LSCPs tomó entre 10 – 14 días para crecer a una población completa de etapa mixta. El tiempo medio de crecimiento en pd1074 fue de 10 días. La cepa de crecimiento más lento creció durante un máximo de 20 días, y la cepa de crecimiento más rápido creció durante un mínimo de 10 días (Figura 4).
Por lo tanto, utilizando este método LSCP, los usuarios pueden integrar fácilmente nuevas cepas de interés en un estudio con poco conocimiento de la sincronización del desarrollo y la experiencia de fondo. Tenga en cuenta que las cepas y fenotipos que tienen que ser mantenidos por picking, tienen defectos de fecundidad, son heterocigotos, o tienen defectos de crecimiento pueden no funcionar bien en esta tubería.
La citometría de flujo de partículas grandes y las imágenes de muestras permiten a los usuarios documentar la distribución de la población. Se puede utilizar una amplia variedad de plataformas para medir el crecimiento exitoso de la población.
Para mediciones -ómicas reproducibles, es importante cultivar cultivos consistentes. Las métricas de reproducibilidad del cultivo son el número de gusanos y una distribución de tamaño consistente para una cepa dada. Mostramos la distribución de la muestra para la cepa de referencia, PD1074 , una variante de la cepa original N2 Bristol, utilizando el LPFC23,26 y las imágenes de microscopio micro confocal como proxies para el éxito del crecimiento. Como los gusanos se midieron desde el estadio L1 hasta el adulto grávido en la distribución lpfc(Figura 5),las imágenes posteriores(Figura 6),y la variación en la distribución de la población a través de las muestras(Figura 7),podemos ver que esta tubería generó una población en etapa mixta de C. elegans.
Para echar un vistazo más de cerca a la distribución de la población de nuestras muestras de etapa mixta, observamos la distribución de 35 PD1074 LSCPs observando el porcentaje de gusanos que caen dentro de cada región a lo largo de toda la distribución de Tiempo de Vuelo (TOF)(es decir,longitud del cuerpo)(Figura 7A,B).
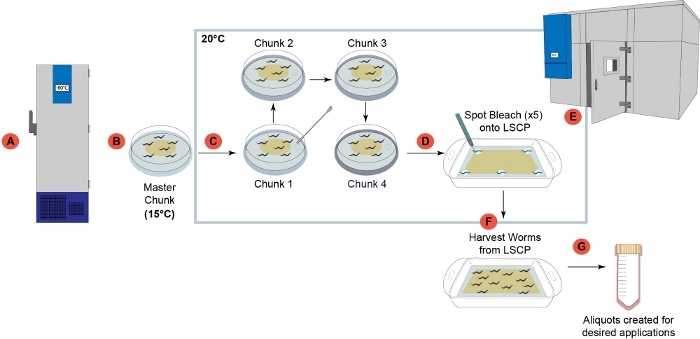
Figura 1: Descripción general de la canalización de crecimiento de gusanos LSCP. (A) Una vez recibidas en el laboratorio , todas las cepas se prepararon y congelaron para su almacenamiento a largo plazo a -80 °C2. B) Se preparó una placa "master chunk" a partir de una culata de gusanos congelados y se almacenó a 15 °C para ser utilizada durante un mes como mayor. (C) Cada muestra pasó por cuatro pasos sucesivos de fragmentación para reducir el estrés generacional antes de crecer en el LSCP. (D)seleccionaron a 5 adultos grávidos individuales del "pedazo 4" placa de 6 cm en el paso (d) y el punto blanqueado en cinco áreas dadas del LSCP. (E)El LSCP se colocó en una sala de temperatura controlada y creció a 20 °C hasta que el LSCP estaba lleno de gusanos adultos, alcanzó un gran tamaño de población y le quedaban bacterias mínimas. (F) La población de gusanos se cosechó y se recogió para los pasos aguas abajo. (G) Las alícuotas se crearon a partir del LSCP y se congelaron flash para las aplicaciones deseadas aguas abajo. Haga clic aquí para ver una versión más amplia de esta figura.
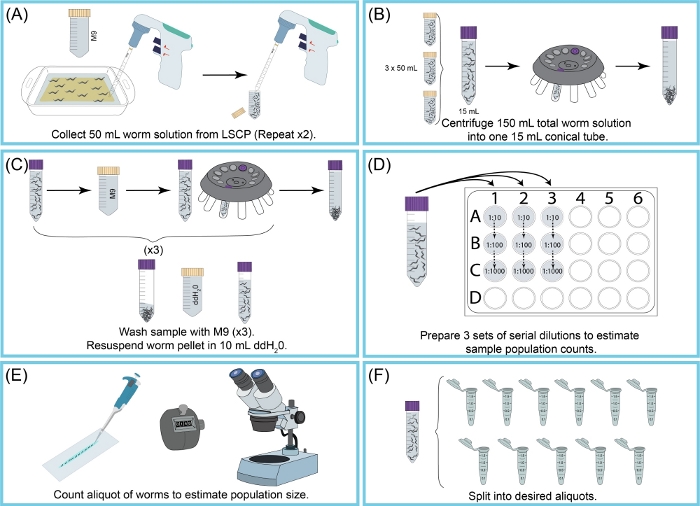
Figura 2: Visión general de la cosecha de LSCP y la estimación del tamaño de la población. (A)se utilizaron 50 mL de M9 para lavar gusanos de la superficie ngma. La suspensión del gusano fue pipeteada en un tubo cónico de 50 mL. El paso (A) se repitió dos veces. (B)15 mL de suspensión de gusanos se vertieron en un nuevo tubo cónico de 15 mL. Los gusanos fueron peleteados por centrifugado. M9 + la ruina fue aspirada apagado sin la pelotilla del gusano que disturba. El paso (b) fue repetido hasta que los 150 mL de la suspensión del gusano fueran recogidos. (C) El pellet de gusano fue lavado y centrifugado tres veces con M9 para eliminar los restos restantes. Una vez que la muestra estaba limpia, el pellet de gusano se resuspendió en 10 mL de ddH2O.(D)Se creó una dilución en serie de la muestra para estimar el tamaño de la población de gusanos. Se utilizaron los factores de dilución que permitieron contar con precisión los gusanos. Los factores de dilución utilizados cambiaron dependiendo del tamaño de la población del LSCP. (E) Una vez que se eligieron los factores de dilución, todos los gusanos de las tres réplicas alícuotas de esa dilución se pipetearon en un portaobjetos limpio y los gusanos se contaron bajo un microscopio de disección. (F) La muestra se dividió en alícuotas de tamaño apropiado. Haga clic aquí para ver una versión más amplia de esta figura.
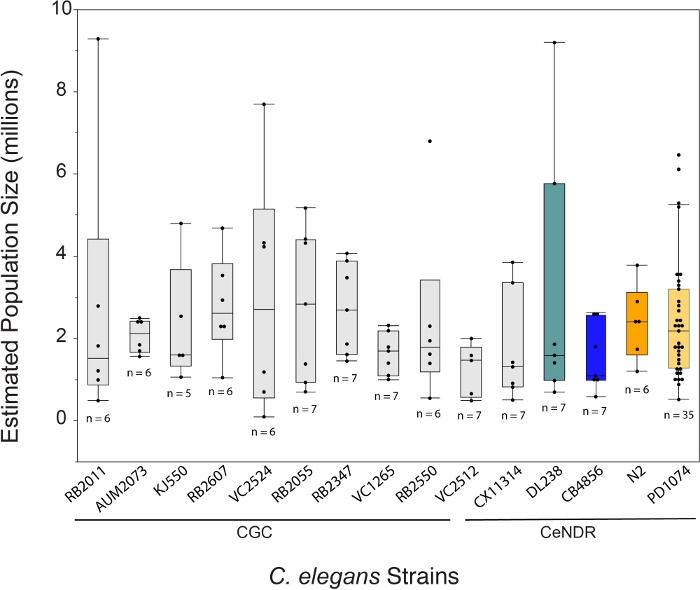
Figura 3: El método LSCP generó en promedio una población de 2,4 millones de gusanos de etapa mixta. El LSCP produce tamaños de población en los crecimientos de población más pequeños en torno a 94.500 y en los mayores crecimientos de población en torno a 9.290.000. El tamaño medio de la población en todas las cepas fue de 2,4 millones de gusanos. Las barras debajo de los nombres de cepas de C. elegans indican si una cepa es un mutante CGC o un aislado natural de CeNDR. El tamaño de la muestra de LSCP se muestra para cada cepa. Se realizaron comparaciones para todos los pares utilizando la prueba HSD de Tukey. No se observaron diferencias significativas entre los tamaños de población estimados a través de las cepas de C. elegans (F (14,108) = 0,7, p = 0,77). Las barras de colores indican las pantallas de color estándar para la respectiva representación de la cepa de C. elegans. Haga clic aquí para ver una versión más amplia de esta figura.

Figura 4: El método LSCP generó grandes poblaciones de gusanos en etapas mixtas en 10 a 20 días. Un LSCP dado de C. elegans creció hasta que la muestra estaba llena de gusanos adultos, alcanzó un tamaño de población grande, y tenía césped bacteriano mínimo a la izquierda. Los LSCPs tardaron entre 10 y 20 días en crecer a una población completa en etapas mixtas, dependiendo de la cepa. El tiempo medio de crecimiento a través de las cepas fue de 12,2 días. El tamaño de la muestra de LSCP se muestra para cada cepa. Cada barra de error se construyó utilizando 1 desviación estándar de la media. Los niveles no conectados por la misma letra son significativamente diferentes. Comparaciones para todos los pares usando la prueba HSD de Tukey. Una diferencia significativa fue encontrada en la cantidad de tiempo de crecimiento en LSCP necesario a través de las tensiones de los elegans de la C. (F (14.108) = 8,8, p < 0,0001*). Las barras de colores indican las pantallas de color estándar para la respectiva representación de la cepa de C. elegans. Haga clic aquí para ver una versión más amplia de esta figura.
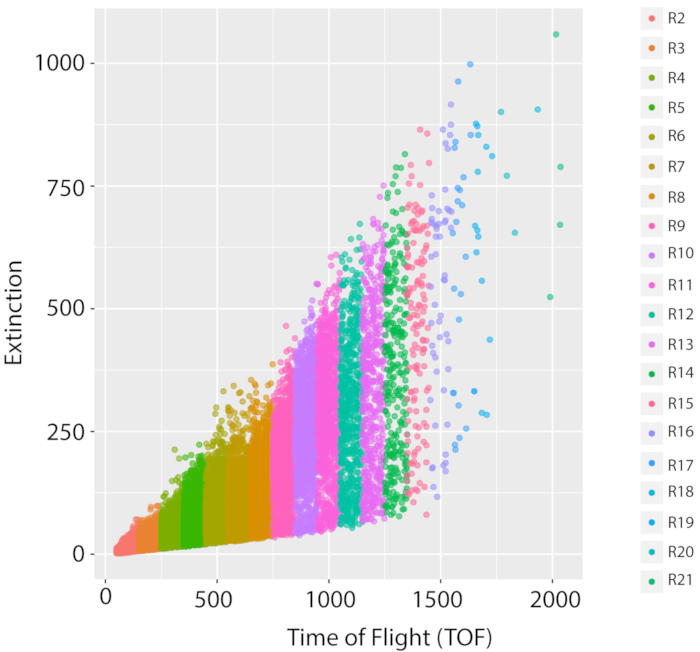
Figura 5: Medición mixta de la población y el crecimiento de la cepa de referencia de tipo salvaje, PD1074. Una distribución lpfc representativa de un crecimiento LSCP de la cepa de referencia de tipo salvaje, una variante de la cepa original N2 Bristol, (PD1074) documenta la distribución de tamaño y los recuentos de eventos de una población de etapa mixta. El eje X muestra la longitud (Tiempo de vuelo, TOF) de los gusanos ordenados. El eje y muestra la densidad óptica (extinción óptica, EXT) de los gusanos clasificados. Cada punto de datos es un gusano que se documentó en el ejemplo. Cada región TOF que se utilizó para el análisis de imágenes se muestra en un color diferente. Se crearon veinte regiones TOF (R2 – R21) que van desde un TOF de 50 a 2050. Los detalles sobre cada región tof se pueden encontrar en la tabla suplementaria 1. Haga clic aquí para ver una versión más amplia de esta figura.
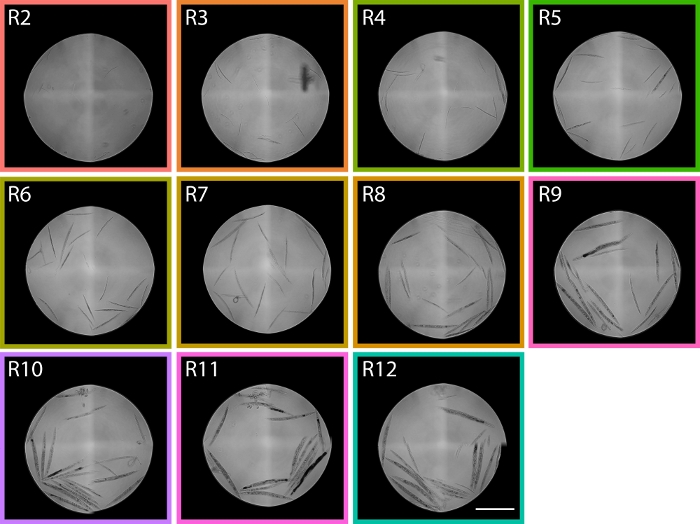
Figura 6: Las imágenes de gusanos clasificados de regiones TOF que van desde R2 – R12 muestran la distribución LPFC PD1074. En la región R2, se pueden identificar gusanos L1 y en la región R9 se identifican predominantemente adultos grávidos, que abarcan los dos extremos larvales del desarrollo que nos dan regiones aproximadas dentro de la distribución del citómetro de flujo de donde se esperan etapas en la distribución. La barra de escala representa 1 mm. Las imágenes representativas se tomaron de la distribución LPFC que se muestra en la Figura 5,y las cajas de colores corresponden a regiones de la Figura 5. Haga clic aquí para ver una versión más amplia de esta figura.
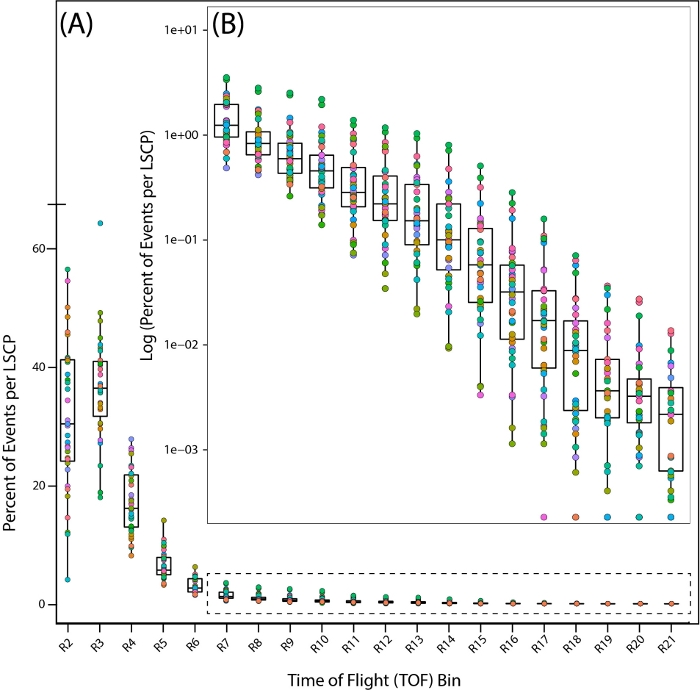
Figura 7: Distribución de la población a través de las regiones de tiempo de vuelo (TOF) en la cepa de referencia de tipo salvaje, PD1074. Distribución de gusanos en toda la región TOF que muestra las regiones donde se encontraron los gusanos. Cada PD1074 LSCP se representa como un color individual. (A)El eje x muestra las veinte regiones TOF (R2 – R21) observadas y contadas para el LSCP, mostrando toda la distribución de tamaño. El eje y muestra el porcentaje de gusanos de un LSCP dado que tenían un tamaño corporal que caía en una región TOF determinada. (B) Como una fracción más pequeña de la población de gusanos cae entre las regiones R7-R21, el registro del porcentaje de gusanos que cayeron dentro de cada región se tomó para mostrar la distribución de la población. El eje X muestra las regiones TOF R7-R21. El eje Y muestra el registro del porcentaje de gusanos de un LSCP determinado que tenía un tamaño de cuerpo que caía en una región TOF determinada. Haga clic aquí para ver una versión más amplia de esta figura.
Figura suplementaria 1: Temperatura media diaria (°C) de las condiciones de crecimiento en las que se cultivó y manipuló el LSCP. Las temperaturas reportadas de la sala de Temperatura Controlada (TC) se documentaron y recolectaron a lo largo del lapso de seis meses de crecimiento y recolección de muestras. La temperatura media diaria se informa aquí. No se observaron diferencias significativas entre la temperatura en la que creció el LCSP durante la duración del proyecto (F(5,24) = 2,59, p = 0,0524). La diferencia de temperatura total no abarcó más de 0,003 °C a lo largo de los seis meses de duración del crecimiento y la generación de la muestra. Haga clic aquí para descargar esta figura.
Tabla suplementaria 1: Regiones cerradas por TOF utilizadas para clasificar gusanos en placas de 384 pozos para obtener imágenes. Las regiones agrupadas se crearon para abarcar un TOF de 100 en toda la distribución de TOF de 50 a 2050. Las regiones cerradas se pueden cambiar y optimizar para satisfacer sus necesidades. Cada región TOF que se utilizó para el análisis de imágenes se muestra en un color diferente. Haga clic aquí para descargar esta tabla.
Tabla suplementaria 2: Plantilla de placa de 384 pozos de regiones TOF y diseño de réplica. Cada muestra se clasificó en una placa de 384 pozos para obtener imágenes. Se crearon cuatro réplicas para cada región seleccionada para la clasificación. Las regiones cerradas se pueden cambiar y optimizar para satisfacer sus necesidades. Vea la tabla suplementaria 1 para las regiones cercadas específicas creadas y utilizadas en este protocolo. Cada región TOF que se utilizó para el análisis de imágenes se muestra en un color diferente. Haga clic aquí para descargar esta tabla.
Tabla suplementaria 3: Las cepas de C. elegans utilizadas en este protocolo contienen una mezcla de cepas CGC y CeNDR. La cepa, el genotipo, la fuente de la cepa y los detalles se describen en esta tabla. Haga clic aquí para descargar esta tabla.
Discusión
Una variedad de recipientes se pueden utilizar como LSCP. En este protocolo, un plato de la hornada de cristal estándar fue utilizado. Los LSPCs en uso tenían dimensiones exteriores de 35,56 x 20,32 cm, dimensiones interiores de 27,94 x 17,78 cm, y aproximadamente 4,45 cm de profundidad y venían con una tapa ajustada. Por lo tanto, la cantidad de bacterias utilizadas aquí se ha optimizado para un LSCP con las dimensiones anteriores para producir una gran población de gusanos de etapa mixta. El volumen bacteriano y la concentración se pueden ajustar para adaptarse a las necesidades experimentales.
La contaminación por moho, hongos u otras fuentes bacterianas puede ocurrir en cualquier paso del método LSCP, así que maneje las muestras con cuidado. Antes de comenzar cualquier paso en el protocolo, asegúrese de que el espacio de trabajo se limpie con 70% de etanol y 10% de lejía. Si está disponible, trate las áreas usadas con luz UV durante 30 minutos y encienda un filtro de aire HEPA 30 minutos antes de comenzar cada paso.
Al cultivar el LSCP en un entorno controlado(es decir,en una sala de TC establecida a 20 °C), el usuario puede rastrear más fácilmente el crecimiento de la muestra y documentar la contaminación potencial. Si la superficie del LSCP se contamina, corte la contaminación cuando sea posible y deje que la muestra continúe creciendo o deseche la muestra si la contaminación no es posible controlar. Es imperativo abordar la contaminación rápidamente para reducir el crecimiento no deseado y para asegurarse de que no está superando a los gusanos en cuanto a recursos.
Este método está destinado a aquellos que quieren cultivar cultivos de poblaciones mixtas a gran escala de C. elegans. Aunque puede ser posible cultivar poblaciones sincronizadas de gusanos en el LSCP como se hace en placas de Petri disponibles en el mercado y en cultivo líquido, los autores no han probado esta opción. Además, si los usuarios desean cultivar más de aproximadamente 2,4 millones de gusanos en promedio en una muestra dada, se recomienda un método diferente4. El éxito del crecimiento depende de la cepa que se está procesando en la tubería. Los autores fueron capaces de cultivar con éxito poblaciones de aproximadamente 2,4 millones de gusanos en al menos cinco réplicas biológicas de 15 cepas de C. elegans, lo que indica que el método es robusto.
Antes de comenzar el experimento, tenga en cuenta que la edad y la salud de un gusano determinado pueden influir en la fecundidad y el tiempo de crecimiento de la población posterior. Asegúrese de que los gusanos se mantienen en condiciones saludables con un estrés mínimo antes de ser utilizados en esta canalización. Se supone que las muestras de stock se han creado, congelado y mantenido a -80 °C para reducir la deriva genética con el tiempo.
Dependiendo de las necesidades de un experimento dado, el número de adultos grávidos iniciales en un LSCP puede ser cambiado. Alterar el número de adultos grávidos iniciales en el LSCP cambiará la tasa de crecimiento y, por lo tanto, el tiempo para cosechar. Cinco adultos grávidos se utilizan para sembrar cada LSCP por las siguientes razones: (1) Se necesitaba una forma simple, rápida y eficiente de sembrar muchas cepas de C. elegans en LSCP a la vez y (2) reducir las diferencias de edad entre los adultos grávidos recogidos que podrían conducir a la heterogeneidad del crecimiento.
Este método permite al usuario cosechar grandes poblaciones de gusanos con todas las etapas del ciclo de vida presentes. Con los métodos actuales disponibles, la recolección de muestras a gran escala de C. elegans requiere la sincronización de la lejía para obtener el número de gusanos deseados para el trabajo aguas abajo. Dado este enfoque, ahora se pueden cultivar tantos gusanos como antes fuera posible en fermentadores o cultivos de líquidos a gran escala sin las dificultades asociadas con la sincronización de la lejía y múltiples pasos de manejo. Nuestro protocolo permite apuntar a las cepas de interés de manera eficiente, utilizar un tiempo de manipulación mínimo en el cultivo de la muestra en sí, y aislar las etapas de los gusanos o la población según sea necesario en las tuberías aguas abajo.
Un LPFC fue utilizado como herramienta para documentar la distribución y el tamaño de la población en un LSCP dado. El LPFC utilizado es un sistema de flujo continuo que analiza, clasifica y dispensa gusanos en función de su tamaño (TOF) y densidad óptica. A medida que un gusano dado pasa a través de la celda de flujo, el detector de pérdida de luz axial captura la cantidad de luz de señal bloqueada por un láser de estado sólido de 488 nm durante el tiempo que tarda un gusano en pasar, dando al usuario el TOF y la densidad óptica del gusano. La óptica y los detectores de recolección de fluorescencia también se pueden utilizar para maximizar la sensibilidad a la fluorescencia y la recolección en cada muestra. Los parámetros de recolección de LPFC variarán según el instrumento. Los usuarios pueden emplear una variedad de plataformas para capturar el tamaño del gusano y no están limitados a utilizar este protocolo si un LPFC no está disponible.
Los autores están utilizando muestras cultivadas en el método descrito aquí para identificar metabolitos desconocidos en varias cepas de C. elegans a través de cromatografía líquida – espectrometría de masas, espectroscopia de RMN, y la secuenciación de ARN. Los autores planean continuar utilizando este método para el crecimiento de muestras en esta tubería con una variedad de cepas de C. elegans, ya que las nuevas cepas de interés se pueden procesar fácilmente utilizando esta tubería.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a los miembros del Laboratorio Edison por sus útiles discusiones y comentarios sobre este manuscrito; en particular, B.M. García. Algunas cepas fueron proporcionadas por el CGC, que es financiado por la Oficina de Programas de Infraestructura de Investigación de los NIH (P40 OD010440), y CeNDR, que es financiado por NSF Living Collections CSBR 1930382. Este trabajo fue apoyado por una subvención de los NIH (U2CES030167).
Materiales
| Name | Company | Catalog Number | Comments |
| 10 mL Sterile Serological Pipettes | VWR | 89130-898 | |
| 10 ul pipette tips | VWR | 89079-438 | |
| 100 ul pipette tips | VWR | 89079-442 | |
| 1000 mL Graduated Cylinder | VWR | 10124-380 | |
| 1000 ul pipette tips | VWR | 89079-488 | |
| 15 mL conical tubes | VWR | 89039-668 | |
| 190 Proof Ethanol | VWR | 89125-166 | |
| 2 L Wide Neck Erlenmeyer Flask | VWR | 75804-654 | |
| 50 mL conical tubes | VWR | 75874-294 | |
| Agar | Sigma | 05040-100G | |
| Agarose | Sigma | A9539-500G | |
| BVC Control G Fluid Aspiration System | Vacuubrand | ||
| Calcium Chloride | Sigma | 449709-10G | |
| Cholesterol | Sigma | C3045-25G | |
| Clorox Bleach | VWR | 89414-502 | |
| Conviron Control Temperature Room | Conviron | https://www.conviron.com/environmental-rooms | |
| Corning Low Volume 384 Well Black with Clear Flat Bottom Polystyrene TC-Treated Microplate | VWR | 89089-866 | |
| Fisher Scientific Accuspin 3R | Fisher | ||
| Flat-Bottom 24-Well Plate | VWR | 29443-952 | |
| Honeywell True HEPA Purifier 465 sq ft. | Home Depot | 204390560 | |
| HT115 E. coli (DE3) | CGC | HT115(DE3) | https://cgc.umn.edu/strain/HT115(DE3) |
| Kimwipes | VWR | 470224-038 | |
| Large Scale Culture Plate (LSCP) | Pyrex | 1090948 | Pyrex 2-quart Glass Baking Dish with Red Lid |
| Magnesium Sulfate | Sigma | C86677-25G | |
| MgSO4 | VWR | 97062-998 | |
| Microscope Plain Slides | VWR | 16004-422 | |
| Millipore Filter | Millipore | 1.11727.2500 | |
| Molecular Devices ImageXpress | Molecular Devices | Model Number:IXMConfocal | https://www.moleculardevices.com/products/cellular-imaging-systems/high-content-imaging/imagexpress-micro-confocal#gref , Authors used MetaXpress Software Version 6.5.4.532 |
| Nystatin (10mg/mL) | Sigma | N6261-25MU | |
| Peptone | Sigma | P7750-100G | |
| Petri Dishes (6 cm) | VWR | 25384-092 | |
| Pipette Controller | VWR | 613-4180 | |
| Potassium Chloride | Fisher | P217-3 | |
| Potassium Phosphate Monobasic | VWR | 0781-500G | |
| Potasssium Hydroxide | Fisher | P250-500 | |
| Red Fluroscent Microspheres | Polysciences | 19507-5 | |
| Sodium Chloride | Sigma | 746398-500G | |
| Sodium Hydroxide | Fisher | 111357 | |
| Sodium Phosphate Dibasic Anhydrous | Fisher | BP332-500 | |
| Standard Gilson Pipette Set | Gilson | FA10002M, FA10004M, FA10006M | |
| Streptomycin (100mg/mL) | Sigma | S6501-25G | |
| Union Biometrica COPAS BioSorter | Union Biometrica | https://www.unionbio.com/biosorter/ , authors used: Flow Pilot software version 1.6.1.3. |
Referencias
- Félix, M. A., Braendle, C. The natural history of Caenorhabditis elegans. Current Biology. 20 (22), 965-969 (2010).
- Corsi, A. K. A Transparent window into biology: A primer on Caenorhabditis elegans. WormBook. , 1-31 (2015).
- Brenner, S. The genetics of behaviour. British Medical Bulletin. 29 (3), 269-271 (1973).
- Stiernagle, T. Maintenance of C. elegans. WormBook: The Online Review of C. elegans Biology. , https://www.ncbi.nlm.nih.gov/books/NBK19649/ (2006).
- Xiong, H., Pears, C., Woollard, A. An enhanced C. elegans based platform for toxicity assessment. Scientific Reports. 7 (1), 9839(2017).
- Loer, C. M., et al. Cuticle integrity and biogenic amine synthesis in Caenorhabditis elegans require the cofactor tetrahydrobiopterin (BH4). Genetics. 200 (1), 237-253 (2015).
- Li, Y., Paik, Y. K. A potential role for fatty acid biosynthesis genes during molting and cuticle formation in Caenorhabditis elegans. BMB Reports. 44 (4), 285-290 (2011).
- Meli, V. S., Osuna, B., Ruvkun, G., Frand, A. R. MLT-10 Defines a Family of DUF644 and Proline-rich Repeat Proteins Involved in the Molting Cycle of Caenorhabditis elegans. Molecular Biology of the Cell. 21 (10), 1648-1661 (2010).
- Fritz, J. A., Behm, C. A. CUTI-1: A novel tetraspan protein involved in C. elegans CUTicle formation and epithelial integrity. PloS One. 4 (4), 5117(2009).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Jeong, P. Y., et al. Chemical structure and biological activity of the Caenorhabditis elegans dauer-inducing pheromone. Nature. 433 (7025), 541-545 (2005).
- Srinivasan, J., et al. A blend of small molecules regulates both mating and development in Caenorhabditis elegans. Nature. 454 (7208), 1115-1118 (2008).
- Kaplan, F., et al. Ascaroside Expression in Caenorhabditis elegans Is Strongly Dependent on Diet and Developmental Stage. PLoS One. 6 (3), 17804(2011).
- Golden, J., Riddle, D. A pheromone influences larval development in the nematode Caenorhabditis elegans. Science. 218 (4572), 578-580 (1982).
- Çelen, İ, Doh, J. H., Sabanayagam, C. R. Effects of liquid cultivation on gene expression and phenotype of C. elegans. BMC Genomics. 19 (1), 562(2018).
- Andersen, E. C., Bloom, J. S., Gerke, J. P., Kruglyak, L. A Variant in the Neuropeptide Receptor npr-1 is a Major Determinant of Caenorhabditis elegans Growth and Physiology. PLoS Genetics. 10 (2), 1004156(2014).
- Rosenblatt, M. A central limit theorem and a strong mixing condition. Proceedings of the National Academy of Sciences. 42 (1), 43-47 (1956).
- Boyd, W. A., Smith, M. V., Freedman, J. H. Caenorhabditis elegans as a model in developmental toxicology. Methods in Molecular Biology. 889, 15-24 (2012).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
- Stiernagle, T. Maintenance of C. elegans. , Available from: http://www.wormbook.org/chapters/www_strainmaintain/strainmaintain.html (2020).
- Denver, D. R., Morris, K., Streelman, J. T., Kim, S. K., Lynch, M., Thomas, W. K. The transcriptional consequences of mutation and natural selection in Caenorhabditis elegans. Nature Genetics. 37 (5), 544-548 (2005).
- Massie, M. R., Lapoczka, E. M., Boggs, K. D., Stine, K. E., White, G. E. Exposure to the metabolic inhibitor sodium azide induces stress protein expression and thermotolerance in the nematode Caenorhabditis elegans. Cell Stress & Chaperones. 8 (1), 1-7 (2003).
- Kevin, S., Pulak, R. Techniques for Analysis, Sorting, and Dispensing of C. elegans on the COPAS Flow-Sorting System. C. elegans. Methods in Molecular Biology. Strange, K. 351, Humana Press. 275-286 (2006).
- Lee, D., et al. Selection and gene flow shape niche-associated variation in pheromone response. Nature Ecology & Evolution. 3 (10), 1455-1463 (2019).
- Cook, D. E., Zdraljevic, S., Roberts, J. P., Andersen, E. C. CeNDR, the Caenorhabditis elegans natural diversity resource. Nucleic Acids Research. 45, 650-657 (2016).
- Nika, L., Gibson, T., Konkus, R., Karp, X. Fluorescent Beads Are a Versatile Tool for Staging Caenorhabditis elegans in Different Life Histories. Genes, Genomes, Genetics. 6 (7), 1923-1933 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados