Method Article
在生理腔内压下对小肺静脉中的 Ca2+ 信号进行成像
摘要
在该协议中,我们提出了一种新技术,用于在生理腔内压下记录和分析肺内静脉(小肺静脉或 PV)中的 Ca2 + 信号。该技术包括分离小 PV、用 Ca2+ 指示剂孵育、插管和加压、Ca2+ 信号的共聚焦成像和数据分析。
摘要
肺静脉 (PV) 将富氧血液从肺部输送回左心,从而在将富氧血液输送到重要器官方面发挥着重要作用。然而,大多数肺血管系统研究都集中在正常和疾病条件下的肺动脉和毛细血管上。Ca2+ 信号是血管功能的关键调节因子。尽管 PV 具有关键的生理作用,但在生理条件下尚未记录小肺内 PV 中的 Ca2+ 信号。在这里,我们描述了一种在 5 mmHg 下分离、插管和加压的小鼠 PV 中记录 Ca2 + 信号活性的技术。通过掺入 Ca2+ 指示剂,我们可以在生理条件下使用高速转盘共聚焦成像研究小 PV 肌细胞层中的 Ca2+ 信号。我们的代表性数据表明,小 PV 肌细胞中的 Ca2+ 信号是由兰尼碱受体离子通道的开放介导的。这种方法将引起肺血管生理学和疾病领域的研究人员的极大兴趣。
引言
肺血管系统在交换气体、增加氧气和去除血液中的二氧化碳方面起着重要作用 1,2。肺动脉 (PA) 接收来自右心的贫氧血液。气体交换发生在毛细血管(肺泡毛细血管)水平,富氧血液通过肺静脉 (PV) 输送到左心。与其他输送贫氧血液的静脉不同,PV 具有将富氧血液输送到左心的重要功能,从而输送到身体的重要器官。然而,在正常和疾病条件下调节 PV 功能的信号转导机制知之甚少。
肺血管系统的研究主要集中在 PA 和肺毛细血管上。最近的研究表明,内皮细胞层和平滑肌细胞层中的 Ca2+ 信号对于调节 PA 的功能至关重要 3,4,5。此外,异常的 Ca2+ 信号转导机制是导致疾病条件下 PA 和肺毛细血管功能受损的原因 6,7,8,9,10。然而,关于肺内静脉 (小 PVs) 的研究仍然很少。与左心相邻的大型 PV(心脏 PV)中的异位活动已被提议作为人类心房颤动的来源11,12,自发搏动13 和 Ca2+ 信号12,14,15 也显示在大型 PV 中。小型 PV 将富氧血液输送到大型 PV。然而,尚未在生理腔内压下研究小 PV 中的 Ca2 + 信号转导机制。
在本手稿中,我们介绍了一种使用高速转盘共聚焦显微镜在 PV 肌细胞中分离、插管和加压小 PV 和 Ca2+ 信号成像的新方法。该方法的总体目标是在生理腔内压力下记录小 PV 肌细胞中的自发和诱导的 Ca2 + 信号。腔内压在调节心肌细胞中的 Ca2+ 信号中起关键作用16。通常,PV 承受 4 至 10 毫米汞柱的生理腔内压力17,18。整个心动周期中腔内压的变化会影响 PV 肌细胞中的 Ca2+ 信号。因此,必须采用一种技术,使我们能够在生理条件下研究这些信号,并检查不同的腔内压如何影响它们。此外,大多数先前关于 PV 的研究都集中在较大的心脏 PV 上。目前的技术侧重于位于肺深处的小 PV,这可能与理解健康和疾病中肺功能的调节更相关。
研究方案
所有动物方案均已获得弗吉尼亚大学动物护理和使用委员会的批准(方案 4100 和 4120)。C57BL6 / J小鼠,10-12周龄,用戊巴比妥(90mg / kg;腹膜内)安乐死,然后颈椎脱位以收获肺组织3,4,19,20。
1. 小型 PV 的隔离
- 用 100% 乙醇清洁解剖工具和餐具,然后用去离子水清洗。
- 用剪刀打开胸腔。使用镊子小心地从胸腔中取出心脏和肺,尽量减少对肺部的接触。
- 将组织放在含有冷 (4-10 °C) HEPES 缓冲生理盐溶液(HEPES-PSS,以 mM、10 HEPES、134 NaCl、6 KCl、1 MgCl2 六水合物、2 CaCl2 二水合物和 7 葡萄糖,使用 1 M NaOH 将 pH 值调节至 7.4)的 Sylgard 涂层板上3,4,19。使用解剖针固定心脏和肺,以便清楚地看到较大的 PV 和 PA,并且肺的左叶略微拉伸,如图 1 所示。
- 使用大肺静脉 (PV) 作为参考点,用细剪刀小心地去除小肺内静脉(小 PV,直径约 50-100 μm,由 图 1 中的虚线表示)周围的组织。确保避免直接接触小 PV。轻轻地将小 PV 与周围组织隔离。
- 分离大约 1-2 mm 长的小 PV 段。将小 PV 置于 4-10 °C HEPES-PSS 中。
2. 使用 Ca2+ 指示剂加载小 PV
注意:应小心处理小 PV,确保镊子仅接触 PV 的尖端。该方法是对前面描述的技术 3,7,20,21 的修改。
- 制备含 DMSO 3.4 的 2.5 mM Fluo-4 AM 储备液浓度。使用上述储备溶液,用 HEPES-PSS 制备 10 μM fluo-4 AM 和 0.04% 普洛膦酸。
- 将小 PV 放入装有上样溶液(10 μM fluo-4 AM 和 0.04% 普洛糖酸的 HEPES-PSS 溶液)的 1.5 mL 试管中3,4。用铝箔盖住试管,置于水浴中,在 37 °C 下孵育 1 小时。
- 孵育后,小心地用 4-10 °C HEPES-PSS 替换加载溶液,并在冰上保持 30 分钟作为洗涤步骤。
3. 小型 PV 的插管
注意:此方法是对前面描述 3,20,21 的技术的修改。
- 用两个玻璃套管准备压力肌成像室,每侧一个。用 PSS(119 mM NaCl、4.7 mM KCl、1.2 mM KH2PO4、1.2 mM MgCl2 160 六水合物、2.5 mM CaCl2 二水合物3、4、21、22、7 mM 葡萄糖和 24 mM NaHCO3)填充套管,通过用 21% O2 和 5% CO2 鼓泡溶液保持 pH 7.4)使用 10 mL 注射器。
- 从洗涤液中取出一个小 PV 并将其放入压力肌层成像室中。使用细尖镊子,小心地将小 PV 的一端插管到其中一个插管上。然后,使用由尼龙线制成的微丝,在小 PV 的空心端和套管尖端打一个结以固定它。
- 轻轻地将 PSS 推过套管以去除 PV 内的血液。使用尼龙线使用微丝用玻璃套管系住另一端,如图 1 所示。
4. 小型 PV 的加压和 Ca2+ 成像
注意:此方法是对前面描述 3,21 的技术的修改。
- 使用连接到含有 PSS 的管道上的伺服压力控制器,以 5 mm Hg 的一端对小 PV 加压。使用连接到入口和出口的蠕动泵对 PSS 进行超熔。将超级熔岩的温度保持在 37 °C。
- 平衡期后,使用 40 倍水浸物镜 (NA 0.8) 和转盘共聚焦成像系统采集 1000 帧(帧速率:每秒 30 帧)的 Ca2+ 图像。使用 488 nm 固态激光器激发 Fluo-4,并使用 525/36 nm 带通滤光片捕获发射的荧光。
- 将兰尼碱受体 (RyR) 拮抗剂兰尼碱 (5 μM)21,23 应用于超级融合物中。等待 5 分钟。如上所述重新拍摄 Ca2+ 图像,以 30 帧/秒的速率再拍摄 1000 帧。
5. Ca2+ 图像分析
注意:该方法是对前面描述的技术 21,22,24 的修改。PV 心肌细胞中 Ca2+ 信号活性的变化可以为抑制或增强 PV 中兴奋-收缩耦合提供重要见解。
- 使用定制设计的软件(由 https://github.com/vesselman/SparkAn 的 Adrian Bonev 博士开发)分析 Ca2+ 图像。
- 使用 5 x 5 Boxcar 滤镜和 5 x 5 中间滤镜平滑图像。使用一个框架勾勒出具有多个像元的 PV 的平坦区域,以便进行事件自动检测。
- 单击 View and Event Autodetection。使用以下设置:振幅为 1.3 F/F0 的事件阈值、20% 的容差、7 x 7 像素的扫描框和 7 张图像的运行平均值。从第一张图像开始,每 10 张图像自动生成平均图像。
- 单击 Start Search (开始搜索 ) (眼睛图标)。在 File 菜单下找到另存为 Mark File 的事件表。要计算每 μm² 的事件数,请将检测到的 Ca2+ 信号数除以所选帧的面积。
结果
图 2A 显示了 5 mm Hg 腔内压下小 PV 的视野。+ 符号表示在选定帧(视频 1)内自动检测到的 Ca2+ 信号,由绿色轮廓表示。从每个 PV 记录一个视野,从每只小鼠使用一个 PV。一个小 PV 被认为是 n=1。在配对实验中,比较在加入 RyR 抑制剂兰尼碱 (5 μM)23 之前和之后 5 分钟每分钟每 μm2 的 Ca2+ 信号数。采用配对 t 检验进行统计比较,以检测显著差异。在上述条件下,自发发生的 Ca2+ 信号的数量为每分钟 0.73 ± 0.2 个事件/μm2(图 2B,C)。兰尼碱处理几乎完全抑制了小 PV 中的 Ca2 + 信号(图 2C,视频 2),如每 μm2 每分钟事件数的急剧减少所示。这些数据表明,来自加压小 PV 的肌细胞层中 Ca2+ 信号的自发活动代表了 RyR 的开放。这些结果提供了证据,表明可以在生理腔内压力下的小 PV 中研究 Ca2+ 信号的活性。该方法将有助于未来研究腔内压力和神经体液介质对小 PV 肌细胞中 Ca2+ 信号传导的影响,从而可能为 PV 功能的调节提供有价值的见解。虽然目前的研究侧重于 RyR Ca2+ 信号的数量,但也可以分析这些信号的动力学特性,包括持续时间、振幅、空间传播和上升时间。了解生理和病理刺激如何影响 RyR Ca2+ 信号的动力学特性可能提供有关健康和疾病状态下 PV 功能调节的重要信息。
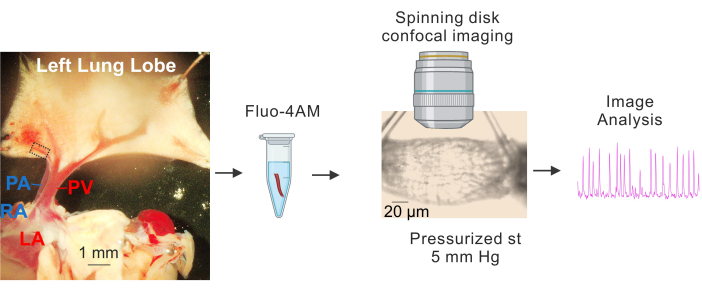
图 1:PV 的制备和 Ca2+ 成像。 显示小 PV 的识别和分离、fluo4-AM 的孵育、插管和加压 (5 mm Hg)、转盘高速共聚焦成像和图像分析的序列图像。左图中的虚线矩形表示用于研究的 PV。缩写: PA = 肺动脉;RA = 右心房;PV = 肺静脉;LA = 左心房。 请单击此处查看此图的较大版本。

图 2:Ca2+ 成像分析。 (A) 在不存在(左)或存在兰尼碱 (5 μM;RyR 抑制剂,右)。绿色矩形表示选择用于自动检测 Ca2+ 信号的区域。+ 号表示帧内自动检测到的事件。红色符号表示面积小于 3000 μm2 的信号,而蓝色符号表示面积大于 3000 μm2 的信号。每个 + 符号表示一个 Ca2+ 事件或信号。(B) 从 A 中所示的选定区域检测到的事件的 F/F0 痕迹,显示了在基础条件(左)和兰尼碱存在下(右)来自加压小 PV 的 Ca2+ 信号在心肌细胞层中的活性。(C) 在加入兰尼碱前后,每分钟每μm2 Ca2 + 信号中小 PV 的事件定量(每只小鼠 1 个 PV;n=6 只小鼠;**p < 0.01 vs 基础;配对 t 检验)。 请单击此处查看此图的较大版本。
视频 1: 在用兰尼碱处理之前,在 5 mm Hg 加压的小 PV 中的 Ca2+ 信号。视野代表选定的帧,如图 2 中以绿色显示。 请点击此处下载此视频。
视频 2: 用兰尼碱 (5 μM) 处理后,在 5 mm Hg 加压的小 PV 中的 Ca2+ 信号。视野代表选定的帧,如图 2 中以绿色显示。 请点击此处下载此视频。
讨论
平滑肌细胞中的 Ca2+ 信号在调节血管功能中起着至关重要的作用25。PV 是一种重要但相对研究不足的血管床,负责将富氧血液输送到左心26。然而,小 PV 中的 Ca2+ 信号转导机制及其对生理功能的影响尚不清楚。本手稿的目标是描述一种分离、插管和加压小 PV 以记录肌细胞层中的 Ca2+ 信号并分析这些 Ca2+ 信号的新方法。在小型 PV 中可视化 Ca2+ 信号的能力有助于促进我们对这些信号在正常和疾病条件下如何工作的理解。虽然研究完整肺内 PV 中的 Ca2+ 信号将提供更相关的生理数据,但在完整肺中并不清晰可见小的 PV,这可能会给加载 Ca2+ 染料和共聚焦成像带来技术挑战。分离和加压小 PV 提供了一种在生理腔内压力、温度和离子溶液下观察 Ca2+ 信号的替代方法。
本手稿中描述的 PV 的 Ca2+ 成像基于我们在体动脉中 Ca2+ 成像的成熟程序 21,22,27。数据表明,小 PV 肌细胞中的大多数 Ca2+ 信号是由于 RyR 离子通道的开放。因此,本手稿中概述的协议将有助于未来研究 RyR 调节及其在正常条件下和疾病中对 PV 功能的影响。RyR2 活性对于心肌细胞的收缩至关重要28,而在动脉平滑肌细胞中,它与松弛有关29。RyR 活性对小 PV 收缩的确切影响仍然未知。压力肌层图是监测小血管收缩变化的常用技术。因此,加压 PV 制备也可能用于监测小的 PV 收缩。
Ryanodine 对 RyR 活性表现出浓度依赖性影响,在亚微摩尔浓度时增加 RyR 活性,在微摩尔浓度时降低RyR 活性 23。兰尼碱也可能对小 PV 中的其他 Ca2+ 信号具有间接抑制作用,这种可能性尚未得到测试。在使用的浓度下,我们没有观察到 PV 中 Ca2+ 信号的代偿性增加。离体和加压 PV 中 Ca2+ 信号的调节可能与完整肺内 PV 中的调节不同,这种可能性尚未探索。然而,在麻醉小鼠完整肺中的小 PV 中记录 Ca2 + 信号存在重大挑战,这是由于肺在胸腔中的位置以及在麻醉小鼠的 PV 中选择性加载 Ca2 + 指示剂的困难。
众所周知,血流剪切应力会改变血管的功能。尽管目前的方法允许隔离腔内压力对小型 PV 中 Ca2+ 信号的影响,但缺乏流动或剪切应力是一个潜在的限制。然而,使用前面描述的设置,可以很容易地结合流动应力或剪切应力并与 Ca2+ 成像相结合21.流动/剪切应力可能会改变小 PV 中 Ca2+ 信号的活性,这将是未来研究的一个有趣话题。
我们使用 fluo-4-AM 作为 Ca2+ 指示剂来记录小 PV 中的 Ca2+ 信号。根据实验需要,应该可以使用其他可以在 488 nm (Calbryte 520 AM)7 或 560 nm (Calbryte 590 AM)30 激发的 Ca2+ 指示剂。使用转盘式共聚焦成像系统可以对 Ca2+ 信号进行成像,特别是在 PV 肌细胞中。虽然在目前的研究中没有研究,但专注于内皮细胞层将允许在小 PV 中记录内皮 Ca2+ 信号。PA 和 PV 在功能上不同,并且暴露在不同的微环境中。因此,比较小 PA 和小 PV 之间的心肌细胞和内皮 Ca2+ 信号可能为了解它们的功能差异提供重要见解。
小 PV 中的 Ca2+ 信号调节富氧血液通过 PV 的流动是合理的。在每个心动周期中,左心房内的压力从 4 mmHg 变为 12 mmHg17,18。由于 PV 为左心房供血,因此 PV 内部的压力很可能在心动周期期间也会发生变化。先前的研究表明,RyRs 可以通过小动脉中的腔内压激活16。因此,测量腔内压力对 PV Ca2+ 信号的影响可能会为从 PV 输送富氧血液到左心提供新的见解。血液中的神经刺激和体液介质也可以激活平滑肌 Ca2+ 信号。目前的方法将有助于未来研究神经体液介质对 PV Ca2+ 信号和 PV 功能的影响。
协议中有几个关键步骤应该注意。仔细解剖肺静脉 (PV) 非常重要。避免使用解剖工具触摸 PV 的成像区域至关重要,因为这会对它们的健康产生负面影响。只应触摸 PV 的末端。减少解剖时间可以提高成功率。染料负载不足会导致信噪比降低,并增加事件自动检测期间出现假阳性的可能性。遵循此处概述的方案应确保 PV 肌细胞中有足够的染料负载。
总之,我们提出了一种在小 PV 中记录 Ca2 + 信号的方法,该方法允许研究这个重要但经常被忽视的血管床中的 Ca2 + 信号传导机制。重要的是,在正常条件下记录小 PV 中 Ca2+ 信号的能力可以为了解肺部疾病的病理机制提供有价值的理解,包括肺动脉高压、肺损伤和心力衰竭引起的肺水肿。
披露声明
作者没有什么可披露的。
致谢
这项研究由从 NHLBI (HL167208、HL157407 和 HL146914) 到 SKS 和 NIDDK (DK138271) 到 YLC 的奖项资助。
材料
| Name | Company | Catalog Number | Comments |
| Custom-Designed SparkAn Software | University of Vermont | https://github.com/vesselman/SparkAn | |
| Fluo-4, AM | Thermo Fisher Scientific | F14201 | |
| FN1 Upright Microscope | Nikon | ||
| Heater/Temperature Controller | Warner Instruments | ||
| Imaging System | Andor | ||
| iQ 3.x acquisition Software | Andor | ||
| iXon EMCCD Cameras | Andor | ||
| Nylon Thread for Tying Blood Vessels | Living Systems Instrumentation | THR-G | |
| Pressure Myography Chamber | Instrumentation and Model Facility, University of Vermont, Burlington, VT, USA | ||
| Revolution WD (with Borealis) High Speed Spinning Disk Confocal Imaging System | Andor | ||
| Ryanodine | Bio-Techne | 1329 | |
| Servo Pressure Controller | Living Systems Instrumentation | ||
| SS Dissection Pins, 0.2mm dia | Living Systems Instrumentation | PIN-0.2mm | |
| Tubing Pump REGLO | ISMATEC | ISM4212 |
参考文献
- Suresh, K., Shimoda, L. A. Lung circulation. Compr Physiol. 6 (2), 897-943 (2016).
- Sundjaja, J. H., Bordoni, B. . Thorax, heart pulmonic valve. , (2024).
- Daneva, Z., et al. Caveolar peroxynitrite formation impairs endothelial TRPV4 channels and elevates pulmonary arterial pressure in pulmonary hypertension. Proc Natl Acad Sci U S A. 118 (17), e2023130118 (2021).
- Daneva, Z., et al. Endothelial pannexin 1-TRPV4 channel signaling lowers pulmonary arterial pressure in mice. Elife. 10, e67777 (2021).
- Kuhr, F. K., Smith, K. A., Song, M. Y., Levitan, I., Yuan, J. X. New mechanisms of pulmonary arterial hypertension: role of Ca2+ signaling. Am J Physiol Heart Circ Physiol. 302 (8), H1546-H1562 (2012).
- Sonkusare, S. K., Laubach, V. E. Endothelial TRPV4 channels in lung edema and injury. Curr Top Membr. 89, 43-62 (2022).
- Kuppusamy, M., et al. Purinergic P2Y2 receptor-induced activation of endothelial TRPV4 channels mediates lung ischemia-reperfusion injury. Sci Signal. 16 (808), eadg1553 (2023).
- Alvarez, D. F., et al. Transient receptor potential vanilloid 4-mediated disruption of the alveolar septal barrier: a novel mechanism of acute lung injury. Circ Res. 99 (9), 988-995 (2006).
- Balakrishna, S., et al. TRPV4 inhibition counteracts edema and inflammation and improves pulmonary function and oxygen saturation in chemically induced acute lung injury. Am J Physiol Lung Cell Mol Physiol. 307 (2), L158-L172 (2014).
- Suresh, K., et al. Reactive oxygen species induced Ca2+ influx via TRPV4 and microvascular endothelial dysfunction in the SU5416/hypoxia model of pulmonary arterial hypertension. Am J Physiol Lung Cell Mol Physiol. 314 (5), L893-L907 (2018).
- Haissaguerre, M., et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med. 339 (10), 659-666 (1998).
- Heijman, J., Voigt, N., Nattel, S., Dobrev, D. Cellular and molecular electrophysiology of atrial fibrillation initiation, maintenance, and progression. Circ Res. 114 (9), 1483-1499 (2014).
- Brunton, T. L., Fayrer, J. Note on independent pulsation of the pulmonary veins and vena cava. Proc R Soc Lond. 25, 174-176 (1877).
- Namekata, I., et al. Involvement of the Na(+)/Ca(2+) exchanger in the automaticity of guinea-pig pulmonary vein myocardium as revealed by SEA0400. J Pharmacol Sci. 110 (1), 111-116 (2009).
- Cros, C., et al. Regional differences in Ca2+ signaling and transverse-tubules across left atrium from adult sheep. Int J Mol Sci. 24 (3), 2347 (2023).
- Dabertrand, F., Nelson, M. T., Brayden, J. E. Ryanodine receptors, calcium signaling, and regulation of vascular tone in the cerebral parenchymal microcirculation. Microcirculation. 20 (4), 307-316 (2013).
- Nair, R., Lamaa, N. . Pulmonary capillary wedge pressure. , (2024).
- Fukuta, H., Little, W. C. The cardiac cycle and the physiologic basis of left ventricular contraction, ejection, relaxation, and filling. Heart Fail Clin. 4 (1), 1-11 (2008).
- Daneva, Z., et al. Endothelial IK and SK channel activation decreases pulmonary arterial pressure and vascular remodeling in pulmonary hypertension. Pulm Circ. 13 (1), e12186 (2023).
- Marziano, C., et al. Nitric oxide-dependent feedback loop regulates transient receptor potential vanilloid 4 (TRPV4) channel cooperativity and endothelial function in small pulmonary arteries. J Am Heart Assoc. 6 (12), e007157 (2017).
- Chen, Y. L., et al. Novel smooth muscle Ca2+-signaling nanodomains in blood pressure regulation. Circulation. 146 (7), 548-564 (2022).
- Sonkusare, S. K., et al. Elementary Ca2+ signals through endothelial TRPV4 channels regulate vascular function. Science. 336, 597-601 (2012).
- Arias-Cavieres, A., et al. Ryanodine receptor-mediated calcium release has a key role in hippocampal LTD induction. Front Cell Neurosci. 12, 403 (2018).
- Chen, Y. L., et al. Calcium signal profiles in vascular endothelium from Cdh5-GCaMP8 and Cx40-GCaMP2 mice. J Vasc Res. 58 (3), 159-171 (2021).
- Ottolini, M., Sonkusare, S. K. The calcium signaling mechanisms in arterial smooth muscle and endothelial cells. Compr Physiol. 11 (2), 1831-1869 (2021).
- Boyette, L. C., Burns, B. . Physiology, pulmonary circulation. , (2024).
- Ottolini, M., et al. Local peroxynitrite impairs endothelial transient receptor potential vanilloid 4 channels and elevates blood pressure in obesity. Circulation. 141 (16), 1318-1333 (2020).
- Shan, J., et al. Phosphorylation of the ryanodine receptor mediates the cardiac fight or flight response in mice. J Clin Invest. 120 (12), 4388-4398 (2010).
- Knot, H. J., Standen, N. B., Nelson, M. T. Ryanodine receptors regulate arterial diameter and wall [Ca2+] in cerebral arteries of rat via Ca2+-dependent K+ channels. J Physiol. 1 (Pt 1), 211-221 (1998).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proc Natl Acad Sci U S A. 112 (36), 11377-11382 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。