المواد الصلبة التي يتم فيها ترتيب الذرات أو الأيونات أو الجزيئات في نمط متكرر محدد تُعرف بالمواد الصلبة المتبلورة. وتشكل المعادن والمركبات الأيونية عادةً مواد صلبة بلورية مرتبة. المادة الصلبة المتبلورة لها درجة حرارة انصهار دقيقة لأن كل ذرة أو جزيء من نفس النوع مثبت في مكانه بنفس القوى أو الطاقة. المواد الصلبة غير المتبلورة أو المواد الصلبة غير البلورية (أو ، في بعض الأحيان ، الزجاج) التي تفتقر إلى بنية داخلية مرتبة ويتم ترتيبها عشوائيًا. المواد التي تتكون من جزيئات كبيرة ، أو خليط من الجزيئات التي تكون حركاتها أكثر تقييدًا ، غالبًا ما تشكل مواد صلبة غير متبلورة. تخضع المادة غير المتبلورة لتليين تدريجي ، على مدى درجات حرارة ، بسبب عدم التكافؤ الهيكلي للجزيئات. عندما يتم تسخين مادة غير متبلورة ، تنكسر أضعف عوامل الجذب بين الجزيئات أولاً كلما زادت درجة الحرارة بشكل أكبر ، تنكسر عوامل الجذب الأقوى.
خلية الوحدة
أفضل وصف لبنية المادة الصلبة المتبلورة هو أبسط وحدة مكررة لها ، والتي يشار إليها باسم خلية الوحدة . تتكون خلية الوحدة من نقاط شعرية تمثل مواقع الذرات أو الأيونات. يتكون الهيكل بأكمله من خلية الوحدة هذه التي تتكرر في ثلاثة أبعاد ، كما هو موضح في الشكل 1.
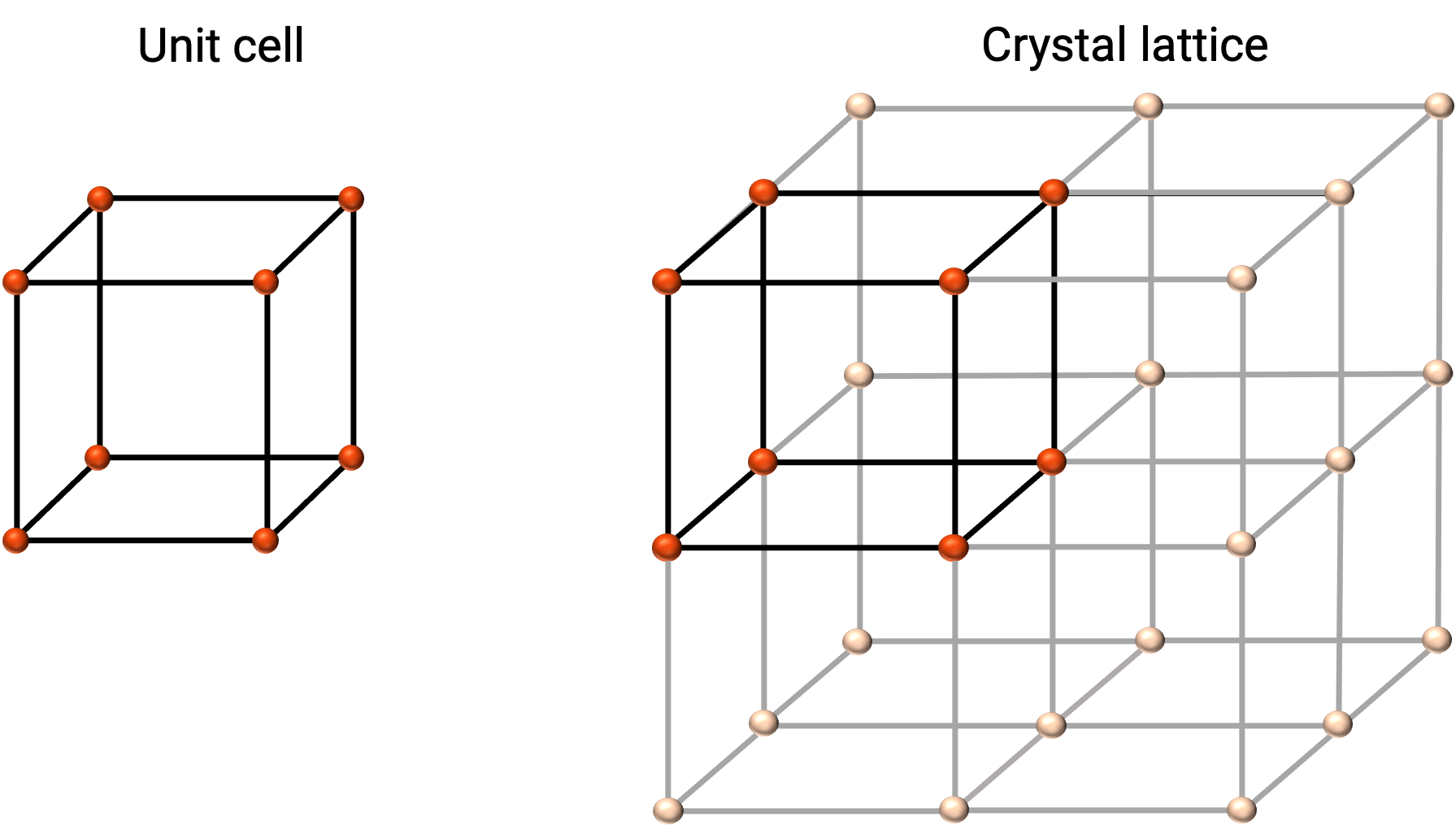
Figure 1. 1. خلية الوحدة والشبكة البلورية مع نقاط شعرية موضحة باللون الأحمر.
بشكل عام، يتم تعريف خلية الوحدة بأطوال ثلاثة محاور (a, b, و c) والزوايا (α, β, و γ) بينهما كما هو موضح في الشكل 2. يتم تحديد المحاور على أنها كونها الأطوال بين النقاط في شبكة الفضاء.
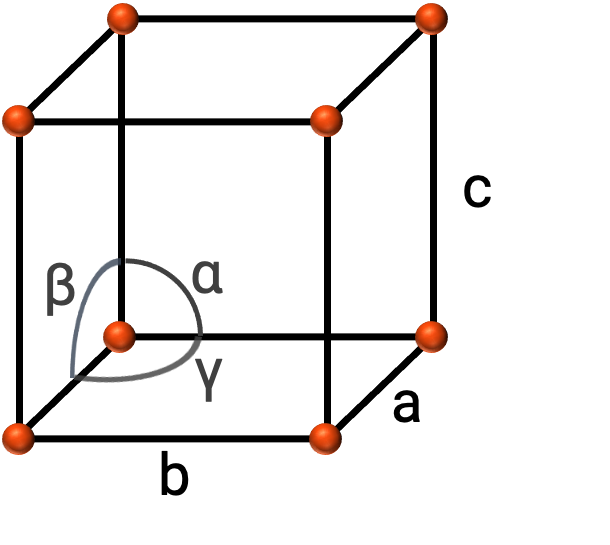
Figure 2. يتم تحديد خلية الوحدة من خلال محاورها (a, b, و c) والزوايا (α, β, و γ)
هناك سبعة أنظمة شبكية مختلفة، بعضها يحتوي على أكثر من نوع واحد من الشبكات، ليصبح المجموع أربعة عشر خلية مختلفة.
| Systems | Angles | Axes |
| Cubic | α = β = γ = 90° | a = b = c |
| Tetragonal | α = β = γ = 90° | a = b ≠ c |
| Orthorhombic | α= β = γ = 90° | a ≠ b ≠ c |
| Monoclinic | α = γ = 90°; β ≠ 90° | a ≠ b ≠ c |
| Triclinic | α ≠ β ≠ γ ≠ 90° | a ≠ b ≠ c |
هذا النص مقتبس من Openstax, Chemistry 2e, Section 10.6: Lattice Structures in Crystalline Solids.
From Chapter 11:

Now Playing
11.14 : تراكيب المواد الصلبة
Liquids, Solids, and Intermolecular Forces
13.6K Views

11.1 : مقارنة جزيئية بين الغازات والسوائل والمواد الصلبة
Liquids, Solids, and Intermolecular Forces
40.1K Views

11.2 : القوى بين الجزيئية مقابل القوى الجزيئية
Liquids, Solids, and Intermolecular Forces
84.8K Views

11.3 : القوى بين الجزيئات
Liquids, Solids, and Intermolecular Forces
56.1K Views

11.4 : مقارنة القوى بين الجزيئيات
Liquids, Solids, and Intermolecular Forces
43.5K Views

11.5 : التوتر السطحي والعمل الشعري واللزوجة
Liquids, Solids, and Intermolecular Forces
27.3K Views

11.6 : انتقالات المرحلة
Liquids, Solids, and Intermolecular Forces
18.6K Views

11.7 : انتقالات المرحلة: التبخير والتكثيف
Liquids, Solids, and Intermolecular Forces
17.0K Views

11.8 : ضغط البخار
Liquids, Solids, and Intermolecular Forces
33.9K Views

11.9 : معادلة كلاوزيوس-كلايبرون
Liquids, Solids, and Intermolecular Forces
55.1K Views

11.10 : انتقالات المرحلة: الذوبان والتجميد
Liquids, Solids, and Intermolecular Forces
12.2K Views

11.11 : انتقالات المرحلة: التصاعد والترسب
Liquids, Solids, and Intermolecular Forces
16.5K Views

11.12 : منحنيات التسخين والتبريد
Liquids, Solids, and Intermolecular Forces
22.2K Views

11.13 : مخطّطات المرحلة
Liquids, Solids, and Intermolecular Forces
38.8K Views

11.15 : المواد الصلبة الجزيئية والأيونية
Liquids, Solids, and Intermolecular Forces
16.5K Views
See More
Copyright © 2025 MyJoVE Corporation. All rights reserved