11.12 : منحنيات التسخين والتبريد
عندما تتعرض مادة— معزولة عن بيئتها— لتغيرات الحرارة، يتم ملاحظة التغيرات المقابلة في درجة الحرارة وطور المادة؛ يتم تمثيل ذلك بيانياً بواسطة منحنيات التسخين والتبريد.
على سبيل المثال، تؤدي إضافة الحرارة إلى زيادة درجة حرارة مادة صلبة؛ تعتمد كمية الحرارة الممتصة على السعة الحرارية للمادة الصلبة (q=mcصلبΔ؛T). وفقاً للكيمياء الحرارية، فإن العلاقة بين كمية الحرارة التي تمتصها أو تطلقها مادة ما، q، وتغير درجة الحرارة المصاحب لها، ΔT، هي:
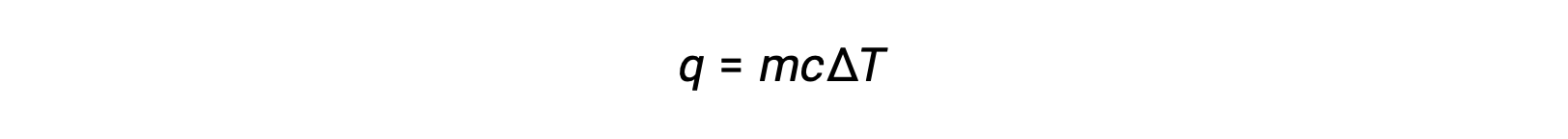
حيث m كتلة المادة و c هي الحرارة النوعية لها. العلاقة تنطبق على المادة التي يتم تسخينها أو تبريدها، ولكن لا تنطبق على تغيير حالتها.
عندما تكون درجة الحرارة عالية بما يكفي، تبدأ المادة الصلبة في الذوبان (الشكل 1 ، النقطة أ). تعتمد الحرارة الممتصة على السعة الحرارية الصلبة’ (q = mcصلبΔT)، ويلاحظ وجود هضبة عند نقطة انصهارها. تشير الهضبة إلى تغير الحالة من صلب إلى سائل، حيث لا ترتفع درجة الحرارة بسبب حرارة الانصهار (q = mΔHfusion). بعبارة أخرى ، يكون اكتساب المزيد من الحرارة نتيجة لتناقص عوامل الجذب بين الجزيئات، بدلاً من زيادة الطاقات الحركية الجزيئية. وبالتالي، بينما تتغير حالة المادة، تظل درجة حرارتها ثابتة.
بمجرد ذوبان المادة الصلبة تمامًا (الشكل 1 ، النقطة ب)، يبدأ السائل في الاحترار ويتعرض لارتفاع في درجة الحرارة. تعتمد الحرارة الممتصة على السعة الحرارية للسائل (q = mcسائلΔT). عندما يصل السائل إلى نقطة الغليان، يبدأ السائل في التبخر (الشكل 1 ، النقطة C) وتظل درجة الحرارة ثابتة على الرغم من استمرار إدخال الحرارة. لوحظ وجود هضبة أخرى (درجة حرارة ثابتة) عند نقطة غليان السائل أثناء انتقال السائل إلى الغاز بسبب حرارة التبخر (q = mΔHبخار). يتم الحفاظ على درجة الحرارة نفسها بواسطة السائل طالما أنه يغلي. إذا تم توفير الحرارة بمعدل أكبر، فإن درجة حرارة السائل لا ترتفع، ولكن بدلاً من ذلك، يصبح الغليان أكثر قوة (سريعاً). بعد تبخر كل السائل (الشكل 1 ، النقطة D) ، تزداد درجة حرارة الغاز.
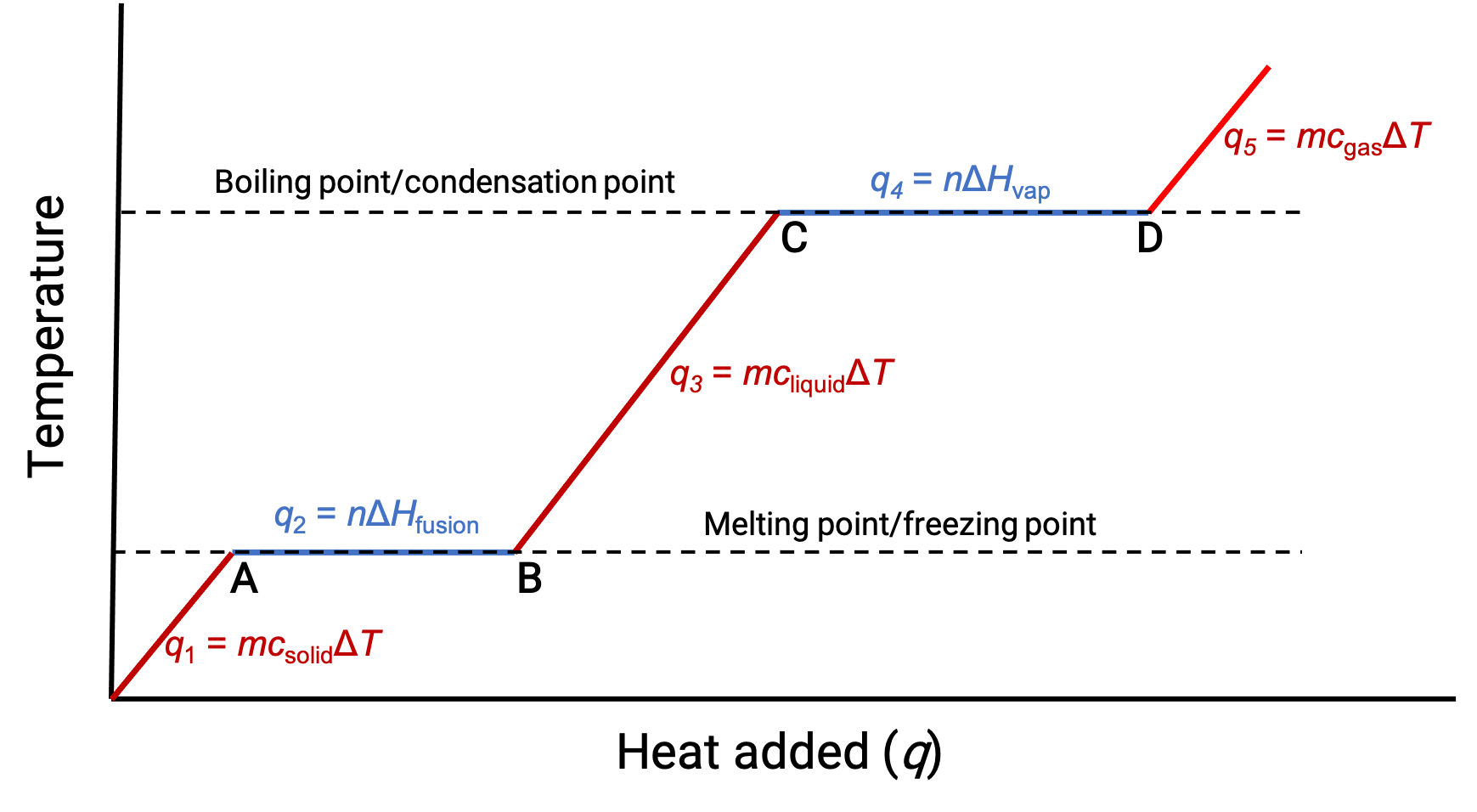
الشكل 1. يصور منحنى التسخين التمثيلي لمادة ما التغيرات في درجة الحرارة التي تنتج عندما تمتص المادة كميات متزايدة من الحرارة. تظهر الهضاب في المنحنى (مناطق درجة حرارة ثابتة) عندما تخضع المادة لتحولات طورية.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 10.3: Phase Transitions.
From Chapter 11:

Now Playing
11.12 : منحنيات التسخين والتبريد
Liquids, Solids, and Intermolecular Forces
22.4K Views

11.1 : مقارنة جزيئية بين الغازات والسوائل والمواد الصلبة
Liquids, Solids, and Intermolecular Forces
40.4K Views

11.2 : القوى بين الجزيئية مقابل القوى الجزيئية
Liquids, Solids, and Intermolecular Forces
86.4K Views

11.3 : القوى بين الجزيئات
Liquids, Solids, and Intermolecular Forces
57.5K Views

11.4 : مقارنة القوى بين الجزيئيات
Liquids, Solids, and Intermolecular Forces
43.8K Views

11.5 : التوتر السطحي والعمل الشعري واللزوجة
Liquids, Solids, and Intermolecular Forces
27.4K Views

11.6 : انتقالات المرحلة
Liquids, Solids, and Intermolecular Forces
18.7K Views

11.7 : انتقالات المرحلة: التبخير والتكثيف
Liquids, Solids, and Intermolecular Forces
17.2K Views

11.8 : ضغط البخار
Liquids, Solids, and Intermolecular Forces
34.2K Views

11.9 : معادلة كلاوزيوس-كلايبرون
Liquids, Solids, and Intermolecular Forces
55.7K Views

11.10 : انتقالات المرحلة: الذوبان والتجميد
Liquids, Solids, and Intermolecular Forces
12.3K Views

11.11 : انتقالات المرحلة: التصاعد والترسب
Liquids, Solids, and Intermolecular Forces
16.7K Views

11.13 : مخطّطات المرحلة
Liquids, Solids, and Intermolecular Forces
39.5K Views

11.14 : تراكيب المواد الصلبة
Liquids, Solids, and Intermolecular Forces
14.0K Views

11.15 : المواد الصلبة الجزيئية والأيونية
Liquids, Solids, and Intermolecular Forces
16.9K Views
See More
Copyright © 2025 MyJoVE Corporation. All rights reserved