Uso del pH-metro
Panoramica
Fonte: Laboratorio del Dr. Zhongqi He - Dipartimento dell'Agricoltura degli Stati Uniti
Acidi e basi sono sostanze in grado di donare protoni (H+) e ioni idrossido (OH-), rispettivamente. Sono due estremi che descrivono le sostanze chimiche. Mescolare acidi e basi può annullare o neutralizzare i loro effetti estremi. Una sostanza che non è né acida né basica è neutra. I valori di concentrazione di protoni ([H+]) per la maggior parte delle soluzioni sono scomodamente piccoli e difficili da confrontare in modo che sia stata introdotta una quantità più pratica, il pH. Il pH era originariamente definito come il logaritmo decimale del reciproco della concentrazione molare dei  protoni, ma è stato aggiornato al logaritmo decimale del reciproco dell'attività degli ioni
protoni, ma è stato aggiornato al logaritmo decimale del reciproco dell'attività degli ioni 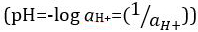 idrogeno. La prima definizione è ora occasionalmente espressa come p[H]. La differenza tra p[H] e pH è piuttosto piccola. È stato affermato che pH = p[H] + 0,04. È pratica comune utilizzare il termine "pH" per entrambi i tipi di misurazioni.
idrogeno. La prima definizione è ora occasionalmente espressa come p[H]. La differenza tra p[H] e pH è piuttosto piccola. È stato affermato che pH = p[H] + 0,04. È pratica comune utilizzare il termine "pH" per entrambi i tipi di misurazioni.
La scala del pH varia tipicamente da 0 a 14. Per una soluzione 1 M di un acido forte, pH=0 e per una soluzione 1 M di una base forte, pH=14. Pertanto, i valori di pH misurati si troveranno per lo più nell'intervallo da 0 a 14, sebbene i valori al di fuori di tale intervallo siano del tutto possibili. L'acqua pura è neutra con pH=7. Un pH inferiore a 7 è acido e un pH superiore a 7 è basico. Poiché la scala del pH è logaritmica, il pH è una quantità adimensionale. Ogni valore di pH intero inferiore a 7 è 10 volte più acido del numero intero successivo. Ad esempio, un pH di 4 è 10 volte più acido di un pH di 5 e 100x (10 x 10) più acido di un pH di 6. Lo stesso vale per i valori di pH superiori a 7, ognuno dei quali è 10 volte più basico (o alcalino) rispetto al successivo valore intero inferiore. Ad esempio, un pH di 10 è 10 volte più semplice di un pH di 9.
Procedura
1. Calibrazione del pH
- Accendere il contatore premendo il pulsante "power".
- Collegare la sonda di compensazione automatica della temperatura (ATC) se è disponibile e/o non è con l'elettrodo.
- Verificare che la modalità di misurazione sia pH. In caso contrario, premere il pulsante "MODE" fino a quando non viene visualizzata la modalità "pH" sul display LCD.
- Consultare la guida di riferimento rapido nella parte inferiore del misuratore o nelle vicinanze per assistenza, se necessario.<
Risultati
La figura 1 mostra il pH dei terreni agricoli influenzati dalla gestione delle colture e dall'irrigazione delle acque sotterranee. Questi campioni di terreno sono stati raccolti da 5 campi di patate sotto diverse pratiche di rotazione delle colture con o senza irrigazione delle acque sotterranee. Il pH più basso si osserva nei terreni del campo 4 sia nelle serie irrigate a pioggia che in quella sotterranea. L'irrigazione delle acque sotterranee ha costantemente aumentato il pH del suolo in tutti e 5 i campi. Le informazioni.
Applicazione e Riepilogo
Il pH è uno dei parametri chimici più comunemente misurati delle soluzioni acquose. È un parametro critico nel trattamento delle acque e delle acque reflue per applicazioni municipali e industriali, produzione chimica, ricerca agricola e produzione. È anche fondamentale nel monitoraggio ambientale, nella ricerca chimica e nelle scienze della vita, nella ricerca biochimica e farmaceutica, nella produzione elettronica e in molte altre applicazioni. La Figura 2 elenca i valori di pH di alcune sostanze c...
Vai a...
Video da questa raccolta:

Now Playing
Uso del pH-metro
General Chemistry
344.8K Visualizzazioni

Un'introduzione alla centrifuga
General Chemistry
487.9K Visualizzazioni

Introduzione al lettore di micropiastre
General Chemistry
126.5K Visualizzazioni

Comprendere la concentrazione e misurare i volumi
General Chemistry
215.8K Visualizzazioni

Realizzare soluzioni in laboratorio
General Chemistry
211.3K Visualizzazioni

Introduzione al micropipettor
General Chemistry
583.4K Visualizzazioni

Introduzione alle pipette sierologiche e ai pipettatori
General Chemistry
219.0K Visualizzazioni

Introduzione al Bunsen Burner
General Chemistry
207.2K Visualizzazioni

Un'introduzione al lavoro sotto cappa
General Chemistry
151.2K Visualizzazioni

Misurazione della massa in laboratorio
General Chemistry
170.8K Visualizzazioni

Introduzione allo spettrofotometro
General Chemistry
517.8K Visualizzazioni

Introduzione alla microscopia ottica
General Chemistry
814.9K Visualizzazioni

Vetreria di laboratorio e relativi usi
General Chemistry
654.9K Visualizzazioni

Uso del pH-metro
General Chemistry
344.8K Visualizzazioni